创面修复大致分为炎症期、增殖期和重塑期,各期有序进行且彼此重叠。适度的炎症刺激能够快速启动创面修复,此观点已得到广泛认可,但是炎症启动创面修复的机理还远未阐明[1]。肿瘤坏死因子α(TNF-α)、白细胞介素1(IL-1)和IL-6等是重要的炎症因子,对皮肤创面组织的修复具有重要的作用[2]。成纤维细胞是参与创面修复过程的重要成员[3],它既可以通过活化促进细胞外基质的形成,又可以分泌生长因子和细胞因子,还能够参与免疫调节,成纤维细胞功能的异常会显著延迟创面愈合的速度[4]。同时炎症是启动人真皮成纤维细胞迁移的关键因素,但炎症如何调节成纤维细胞迁移尚不十分清楚。近年来,细胞骨架,尤其是微丝被认为是调节细胞迁移的重要环节,细胞松弛素B作为经典研究微丝骨架的常用药物,可以抑制各种依赖于微丝的运动[5-6]。同时, 作为细胞骨架蛋白的重要成员的stathmin广泛表达于多种组织和细胞中。细胞骨架及其蛋白的动态变化控制着细胞迁移,微管与微丝在这一过程中具有相互协调的作用[7]。不仅如此,stathmin还参与调节肿瘤细胞、表皮细胞或内皮细胞迁移。但stathmin参与调节人真皮成纤维细胞的研究鲜有报道[8-9]。本研究旨在丰富炎症促进创面修复新机理,阐明stathmin在炎症介导人真皮成纤维细胞迁移中的作用和初步机制,为临床干预创面治疗提供新靶点和策略。
1 材料与方法 1.1 材料人真皮成纤维细胞(human dermal fibroblast, HDF)购自ATCC;胎牛血清(FBS)、DMEM高糖培养基购自Gibco公司;PBS缓冲液干粉购自Solarbio公司;青霉素-链霉素双抗、0.25%胰酶(含EDTA)、电转液、TBST、BCA蛋白测定试剂盒、4%多聚甲醛、免疫染色封闭液、免疫染色一抗稀释液和抗荧光淬灭封片剂购自碧云天公司;TNF-α重组蛋白、Stathmin抗体购自Proteintech公司;丝裂霉素购自Selleck公司;细胞松弛素B购自MACKLIN公司;SDS-PAGE凝胶配制试剂盒购自上海生工公司;PVDF膜购自美国Millipore公司;电泳缓冲液粉剂购自赛维尔公司;细胞裂解液购自北京鼎国公司;ECL超敏发光液购自硕华公司;小干扰RNA购自吉玛基因公司;GAPDH抗体Anti-rabbit IgG、HRP-linked抗体购自CST公司;共聚焦培养皿购自NEST公司;罗丹明标记的鬼笔环肽染料购自ABclonal公司。
1.2 方法 1.2.1 细胞培养及体外炎症模拟配制含10%胎牛血清的双抗DMEM高糖培养基用于培养人真皮成纤维细胞。于37 ℃、5%CO2的培养箱中培养2 d,细胞融合到80%时进行传代,选择对数生长期细胞用于后续实验。TNF-α重组蛋白20 ng/mL处理细胞24 h,模拟体外早期炎症。实验均重复3次。
1.2.2 细胞划痕实验用丝裂霉素-c(终浓度: 5 μg/mL)在37 ℃孵育2 h抑制细胞增殖,对照组不做任何处理,TNF-α组使用TNF-α处理24 h,细胞松弛素组使用细胞松弛素B(10 μmol/L)处理30 min; 小干扰相关组别同小干扰RNA转染部分。用1 mL的枪头在3.5 cm平板上对培养及处理的成纤维细胞进行划痕,然后用PBS缓冲液清洗2~3遍冲掉细胞碎片。采用倒置光学显微镜(IX73, Olympus)拍照记录。将细胞迁移定义为创面愈合率,创面愈合率=划痕距离(0 h) -划痕距离(24 h)/划痕距离(0 h),使用Image J软件对其进行分析。
1.2.3 Western blot检测人真皮成纤维细胞培养至对数生长期,对照组不做任何处理,TNF-α组使用TNF-α处理24 h。处理好的细胞用RIPA裂解液裂解后,在4 ℃以13 700 ×g离心15 min,获取上清液。然后使用BCA蛋白测定试剂盒进行蛋白定量分析。蛋白样品通过SDS-PAGE加载和分离,然后转移到PVDF膜上。转膜完毕后封闭1 h,膜与特异性的一抗(anti-stathmin,GAPDH)在4 ℃下孵育过夜。TBST洗3遍后,二抗共孵1 h,TBST再洗3遍,并使用ChemiDoc XRS系统(ChemiDoc, Bio-Rad Laboratories)曝光显影。
1.2.4 小干扰RNA转染用stathmin(siSTMN)特异性的siRNA或相应的对照siRNA(siNC)与转染试剂转染细胞,并按照使用说明操作。根据处理条件分为siNC组(只转染siNC 24 h)、siSTMN组(只转染siSTMN 24 h)、siNC+TNF-α组(转染siNC 24 h后再加TNF-α处理24 h)、siSTMN+TNF-α组(转染siSTMN 24 h后再加TNF-α处理24 h)。
1.2.5 免疫荧光检测Stathmin抗体染色:细胞培养于共聚焦培养皿上培养过夜,培养至对数生长期,对照组不做任何处理,TNF-α组使用TNF-α处理24 h。使用免疫染色洗涤液洗3遍后,4%多聚甲醛固定20 min,使用免疫染色封闭液封闭1 h。与配好的anti-stathmin抗体在4 ℃孵育过夜,继续使用免疫染色洗涤液洗3遍,然后与Alexa Fluor 488荧光二抗室温避光孵育1 h,免疫染色洗涤液洗3遍,与DAPI染料室温避光孵育5 min,免疫染色洗涤液洗3遍, 使用抗荧光淬灭封闭液进行封片,荧光显微镜观察拍照并采集图像。
微丝染色:细胞培养于共聚焦培养皿上培养过夜,培养至对数生长期,对照组不做任何处理,TNF-α组使用TNF-α处理24 h;细胞松弛素组使用细胞松弛素B(10 μmol/L)处理30 min;小干扰相关组别同小干扰RNA转染部分。处理后,使用免疫染色洗涤液洗3遍后,4%多聚甲醛固定20 min,与配好的罗丹明标记的鬼笔环肽染料室温避光孵育1 h,继续使用免疫染色洗涤液洗3遍,与DAPI染料室温避光孵育5 min,再使用免疫染色洗涤液洗3遍后,加抗荧光淬灭封闭液进行封片,激光共聚焦显微镜观察拍照并采集图像。
1.3 统计学分析使用GraphPad Prism 8进行统计分析。结果均表示为x±s。两组间比较采用独立样本t检验。多组间比较采用单因素方差分析,多重比较采用Tukey's检验。当P < 0.05时认为差异有统计学意义。
2 结果 2.1 炎症刺激对人真皮成纤维细胞伪足的影响罗丹明标记的鬼笔环肽染色观察伪足,结果显示:当TNF-α处理细胞24 h后,通过免疫荧光检测发现,TNF-α处理组细胞伪足较对照组增多。提示早期炎症刺激促进人真皮成纤维细胞伪足的形成(图 1)。
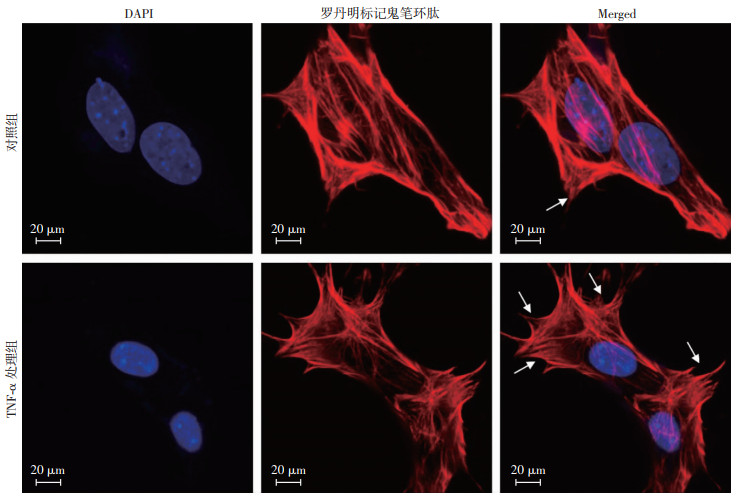
|
| 箭头示典型的伪足 图 1 免疫荧光检测TNF-α对人真皮成纤维细胞伪足的影响 |
2.2 TNF-α对人真皮成纤维细胞迁移的影响
细胞划痕实验观察细胞迁移,结果显示:当TNF-α(20 ng/mL)处理细胞24 h后,细胞迁移较对照组明显增加(P < 0.05)。提示早期适当的炎症刺激可以促进人真皮成纤维细胞迁移(图 2)。

|
| A:TNF-α 20 ng/mL处理前后人真皮成纤维细胞的迁移情况; B:划痕实验的定量分析 a: P < 0.05 图 2 细胞划痕实验观察TNF-α对人真皮成纤维细胞迁移的影响 |
2.3 伪足对人真皮成纤维细胞迁移的影响
细胞松弛素B(10 μmol/L)处理30 min后,免疫荧光检测细胞伪足, 细胞划痕实验观察细胞迁移, 结果显示:细胞松弛素B处理组伪足较对照组减少(图 3),细胞迁移较对照组显著减慢(P < 0.05,图 4),提示伪足增加促进人真皮成纤维细胞迁移。
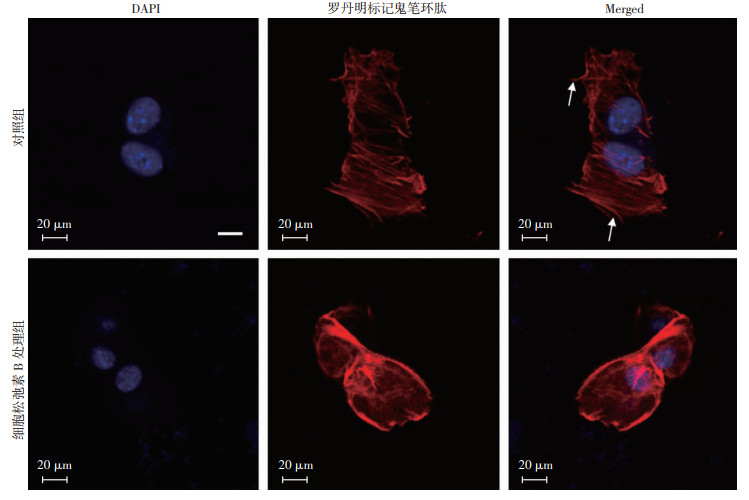
|
| 箭头示典型的伪足 图 3 免疫荧光检测细胞松弛素B对人真皮成纤维细胞伪足的影响 |
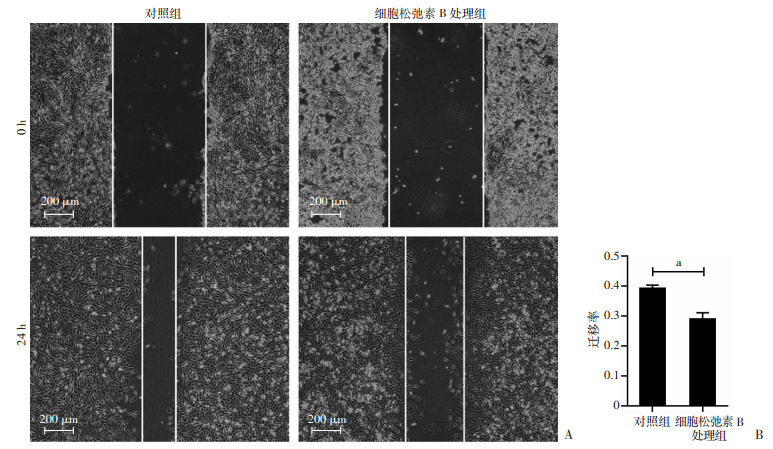
|
| A:细胞松弛素B(10 μmol/L)处理后,人真皮成纤维细胞的迁移情况;B:划痕实验的定量分析 a:P < 0.05 图 4 细胞划痕实验观察细胞松弛素B对人真皮成纤维细胞迁移的影响 |
2.4 TNF-α对人真皮成纤维细胞stathmin表达的影响
Western blot(图 5A、B)及免疫荧光(图 5C)检测人真皮成纤维细胞stathmin表达,结果显示:TNF-α处理细胞24 h后,TNF-α处理组stathmin表达均较对照组显著增加(P < 0.05)。提示早期炎症刺激促进人真皮成纤维细胞stathmin表达。
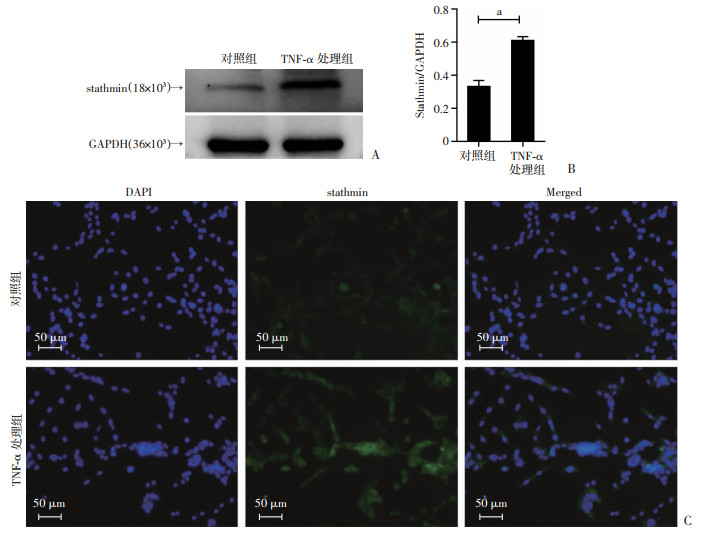
|
| A:Western blot检测TNF-α 20 ng/mL处理前后人真皮成纤维细胞stathmin的表达;B:Western blot实验的定量分析 a:P < 0.05;C:免疫荧光检测人真皮成纤维细胞stathmin表达情况 图 5 TNF-α对人真皮成纤维细胞stathmin表达的影响 |
2.5 伪足增加可能是炎症微环境下stathmin介导人真皮成纤维细胞迁移的机制
免疫荧光检测细胞伪足,结果显示:TNF-α处理人真皮成纤维细胞24 h后,细胞伪足较对照组增加,当使用小干扰RNA干扰stathmin表达后,小干扰RNA(siSTMN)组和小干扰RNA(siSTMN)+TNF-α组细胞伪足明显减少。提示伪足增加可能是炎症微环境下stathmin介导人真皮成纤维细胞迁移的机制(图 6)。
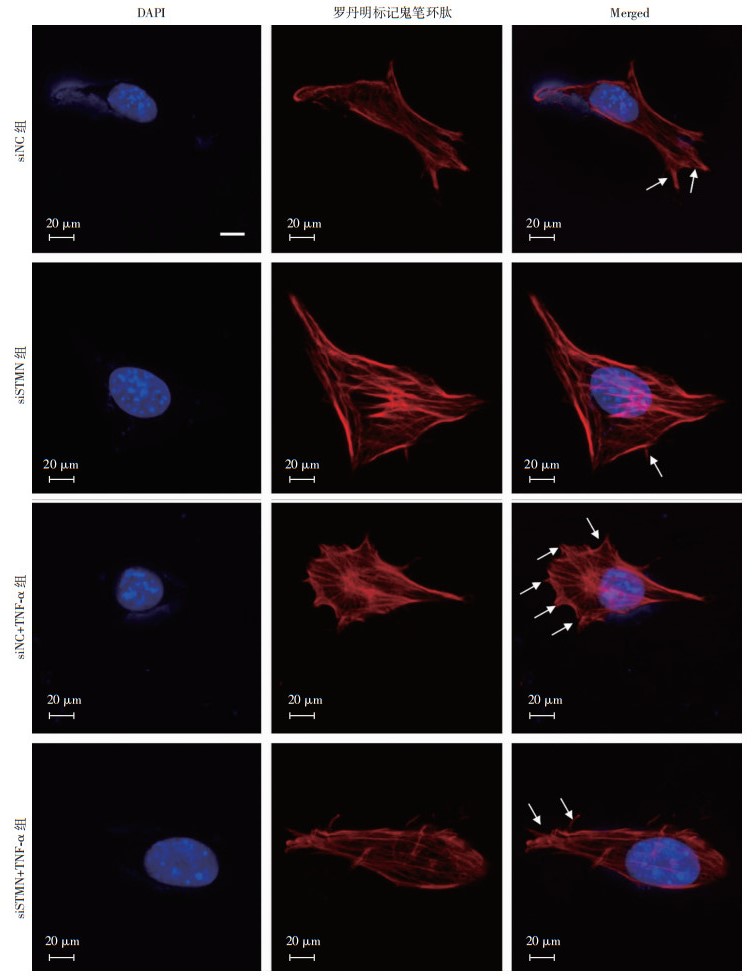
|
| 箭头示典型的伪足 图 6 伪足增加在炎症微环境下stathmin介导人真皮成纤维细胞迁移中的作用 |
2.6 stathmin对炎症介导人真皮成纤维细胞迁移的影响
细胞划痕实验观察细胞迁移,结果显示:TNF-α处理人真皮成纤维细胞24 h后,细胞迁移较对照组显著增加(P < 0.05), 当使用小干扰RNA干扰stathmin表达后,小干扰RNA(siSTMN)组和小干扰RNA(siSTMN)+TNF-α组细胞迁移被显著抑制(P < 0.05)。提示TNF-α可能通过上调stathmin表达促进人真皮成纤维细胞迁移(图 7)。
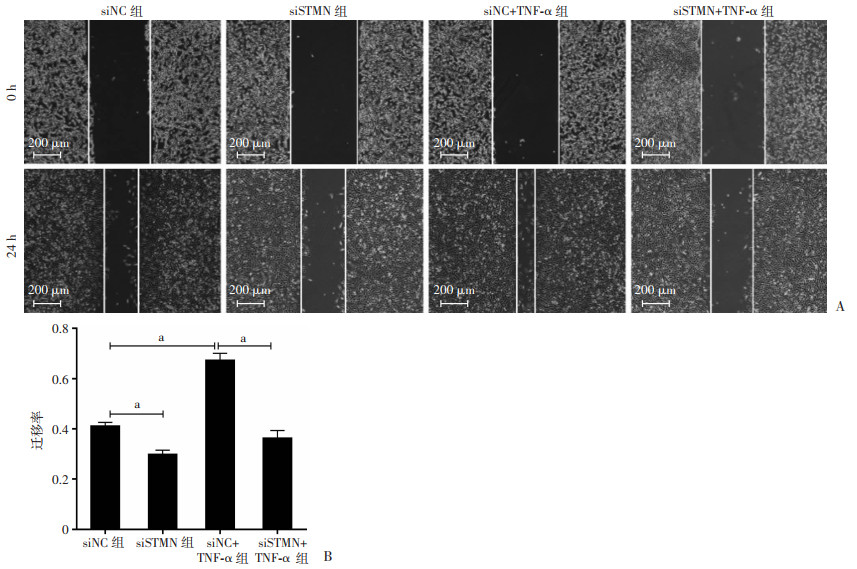
|
| A:细胞划痕实验观察siSTMN转染前后TNF-α对人真皮成纤维细胞迁移的影响; B:细胞划痕实验的定量分析 a: P < 0.05 图 7 stathmin对炎症介导人真皮成纤维细胞细胞迁移的影响 |
3 讨论
创面愈合是人体复杂却能精确调节的生物过程[10]。机体受伤时,炎症因子可通过激活和趋化众多的免疫细胞、补体和抗体等向局部破损创面聚集,抑制或清除细菌,激活机体对创伤的免疫应答,促进皮肤创面组织的愈合,是创面修复不可或缺的关键环节[1, 11-13]。TNF-α、IL-1和IL-6等是重要的炎症因子,对皮肤创面组织的修复具有重要的作用[2]。并且有临床研究发现激活血清TNF-α、IL-6等炎症因子的表达,可加速糖尿病足患者皮肤创面的愈合[14]。虽然炎症环境被认为是创面愈合的关键启动因素[15-16],并且成纤维细胞在这一过程中发挥了重要作用[16-17],但两者之间潜在的机制尚不十分清楚。本研究选取创面形成后机体释放的内源性TNF-α刺激人真皮成纤维细胞,从而模拟体外炎症微环境。研究结果发现:早期的炎症刺激会促进人真皮成纤维细胞stathmin的表达并且促进细胞迁移。Stathmin是一种经典的细胞骨架蛋白,参与广泛的生理和细胞功能(如细胞周期、增殖和迁移等)[18]。然而,stathmin是否参与早期炎症诱导的人真皮成纤维细胞迁移作用仍然不清楚。为了阐明这一假设,本研究构建了stathmin小干扰RNA并将其转染到人真皮成纤维细胞中,结果显示:在炎症微环境下,stathmin小干扰RNA对人真皮成纤维细胞的迁移具有显著的抑制作用,提示stathmin参与炎症介导的人真皮成纤维细胞在创面愈合过程中的迁移运动。
细胞迁移在创面愈合过程中起着关键作用。微丝在细胞前方通过肌动蛋白形成伸长的伪足,在细胞后方由肌球蛋白介导而收缩是细胞迁移驱动力的主要来源[19-20]。细胞松弛素B通过作用于微丝可以抑制各种依赖于微丝的运动[5],本研究使用细胞松弛素B作用于真皮成纤维细胞,通过观察伪足及细胞迁移的改变,判断伪足与细胞迁移之间的关系。Stathmin是一种微管解聚蛋白,已有的研究大多说明stathmin通过调控微管解聚来影响肿瘤细胞的转移[21-22]。但在正常细胞中,迁移这一复杂的过程需要细胞骨架蛋白微管与微丝的动态变化来提供主要动力,并且通过肌动蛋白、微管和中间丝之间的持续串扰来确保动力学的稳定[23]。其中微管的前缘通过携带调节肌动蛋白骨架的mRNA,影响肌动蛋白的聚合以及细胞的突起[24]进而对细胞迁移产生影响。而本研究证明了伪足增多会促进成纤维细胞迁移并且可能是stathmin促进早期炎症微环境下人真皮成纤维细胞迁移的初步机制,但其中是否涉及微管与微丝之间的相互调节作用还需进一步研究。
综上所述,本研究发现TNF-α促进人真皮成纤维细胞迁移的作用可能与stathmin表达增加继而促进伪足增多有关。这一发现有望为将来临床干预创面愈合提供新的潜在靶点和治疗策略。
| [1] |
RODRIGUES M, KOSARIC N, BONHAM C A, et al. Wound healing: a cellular perspective[J]. Physiol Rev, 2019, 99(1): 665-706. |
| [2] |
王科, 晁生武. 创面愈合相关机制的研究进展[J]. 中华损伤与修复杂志(电子版), 2021, 16(1): 81-84. WANG K, CHAO S W. Research progress on related mechanisms of wound healing[J]. Chin J Inj Repair Wound Heal Electron Ed, 2021, 16(1): 81-84. |
| [3] |
何秀娟, 林燕, 刘青武, 等. 皮肤成纤维细胞在创面愈合中的研究进展[J]. 中华损伤与修复杂志(电子版), 2021, 16(1): 74-77. HE X J, LIN Y, LIU Q W, et al. Research progress of skin fibroblasts in wound healing[J]. Chin J Inj Repair Wound Heal Electron Ed, 2021, 16(1): 74-77. |
| [4] |
MAHMOUDI S, MANCINI E, XU L, et al. Heterogeneity in old fibroblasts is linked to variability in reprogramming and wound healing[J]. Nature, 2019, 574(7779): 553-558. |
| [5] |
李奇志, 杨业秋, 夏姝, 等. 动物细胞骨架微丝标记与观察综合性实验的探索[J]. 生物学通报, 2021, 56(2): 53-57. LI Q Z, YANG Y Q, XIA S, et al. Exploration of comprehensive experiment for labelling and observation of actin cytoskeleton in animal cells[J]. Bull Biol, 2021, 56(2): 53-57. |
| [6] |
TAKAISHI K, KINOSHITA H, FENG G G, et al. Cytoskeleton-disrupting agent cytochalasin B reduces oxidative stress caused by high glucose in the human arterial smooth muscle[J]. J Pharmacol Sci, 2020, 144(4): 197-203. |
| [7] |
邢艳丽, 李静, 耿美玉. 细胞迁移中微丝微管的变化及其信号转导通路研究进展[J]. 现代生物医学进展, 2007, 7(6): 919-922. XING Y L, LI J, GENG M Y. Changes of microtubules and actin filaments in cell migration and the signal transduction in this process[J]. Prog Mod Biomed, 2007, 7(6): 919-922. |
| [8] |
YU D, GERNAPUDI R, DRUCKER C, et al. The myristoylated alanine-rich C kinase substrate differentially regulates kinase interacting with stathmin in vascular smooth muscle and endothelial cells and potentiates intimal hyperplasia formation[J]. J Vasc Surg, 2019, 70(6): 2021-2031. e1. |
| [9] |
BICHSEL K J, HAMMILLER B, TREMPUS C S, et al. The epidermal growth factor receptor decreases Stathmin 1 and triggers catagen entry in the mouse[J]. Exp Dermatol, 2016, 25(4): 275-281. |
| [10] |
陆树良. 把握创面修复的规律和特征促进创面愈合[J]. 中华烧伤杂志, 2021, 37(5): 401-403. LU S L. To master the rules and characteristics of wound repair for wound healing promotion[J]. Chin J Burns, 2021, 37(5): 401-403. |
| [11] |
CAÑEDO-DORANTES L, CAÑEDO-AYALA M. Skin acute wound healing: a comprehensive review[J]. Int J Inflam, 2019, 2019: 3706315. |
| [12] |
SINGAMPALLI K L, BALAJI S, WANG X Y, et al. The role of an IL-10/hyaluronan axis in dermal wound healing[J]. Front Cell Dev Biol, 2020, 8: 636. |
| [13] |
LI H L, LIU X T, HUANG S M, et al. Repair function of essential oil from Crocodylus Siamensis(Schneider, 1801) on the burn wound healing via up-regulated growth factor expression and anti-inflammatory effect[J]. J Ethnopharmacol, 2021, 264: 113286. |
| [14] |
孙好杰, 窦连军, 龚莹, 等. 糖尿病足创面预后与炎性因子的相关性[J]. 医学研究杂志, 2016, 45(11): 162-164. SUN H J, DOU L J, GONG Y, et al. Correlation between the prognosis of diabetic foot wounds and inflammation factor[J]. J Med Res, 2016, 45(11): 162-164. |
| [15] |
LANDÉN N X, LI D Q, STÅHLE M. Transition from inflammation to proliferation: a critical step during wound healing[J]. Cell Mol Life Sci, 2016, 73(20): 3861-3885. |
| [16] |
BROUGHTON G 2nd, JANIS J E, ATTINGER C E. Wound healing: an overview[J]. Plast Reconstr Surg, 2006, 117: 1e-S-32e-S. |
| [17] |
DESJARDINS-PARK H E, FOSTER D S, LONGAKER M T. Fibroblasts and wound healing: an update[J]. Regen Med, 2018, 13(5): 491-495. |
| [18] |
SHU F, ZOU X Q, TUO H, et al. Stathmin gene silencing suppresses proliferation, migration and invasion of gastric cancer cells via AKT/sCLU and STAT3 signaling[J]. Int J Oncol, 2019, 54(3): 1086-1098. |
| [19] |
邱鸿, 于荣. 微管和微丝的相互作用[J]. 细胞生物学杂志, 2009, 31(4): 476-480. QIU H, YU R. The interactions of microtubules and microfilaments[J]. Chin J Cell Biol, 2009, 31(4): 476-480. |
| [20] |
MATTILA P K, LAPPALAINEN P. Filopodia: molecular architecture and cellular functions[J]. Nat Rev Mol Cell Biol, 2008, 9(6): 446-454. |
| [21] |
ALESI G N, JIN L, LI D, et al. RSK2 signals through stathmin to promote microtubule dynamics and tumor metastasis[J]. Oncogene, 2016, 35(41): 5412-5421. |
| [22] |
ZHAO L, ZHANG D J, SHEN Q, et al. KIAA1199 promotes metastasis of colorectal cancer cells via microtubule destabilization regulated by a PP2A/stathmin pathway[J]. Oncogene, 2019, 38(7): 935-949. |
| [23] |
SEETHARAMAN S, ETIENNE-MANNEVILLE S. Cytoskeletal crosstalk in cell migration[J]. Trends Cell Biol, 2020, 30(9): 720-735. |
| [24] |
MARDAKHEH F K, PAUL A, KVMPER S, et al. Global analysis of mRNA, translation, and protein localization: local translation is a key regulator of cell protrusions[J]. Dev Cell, 2015, 35(3): 344-357. |




