胃癌(gastric cancer,GC)是常见的恶性肿瘤之一,其发病率和死亡率在全球癌症中均位列第5位[1]。全球范围内,以东亚地区的发病率和死亡率最高,其累积风险分别为2.64%和1.84%[2]。我国的恶性肿瘤流调数据显示,胃癌的发病率和死亡率分别位列第二和第三[3]。尽管近年来胃癌的诊疗技术已取得明显进步,但大多数患者在确诊时已发生转移[4],故胃癌患者的预后仍然很差[5-6]。因此,深入研究胃癌侵袭转移的具体机制对于发展新的针对转移的治疗策略、改善患者预后具有重要意义[5]。
PLXDC2(plexin domain containing 2)由Plxdc2基因所编码,蛋白结构包含Nidogen/plexin结构域,为单次跨膜蛋白。该基因于小鼠大脑转接方式的基因捕获过筛研究中被发现,后因其蛋白结构与肿瘤内皮细胞标志物7(tumor endothelial marker 7,TEM7)相关,故又被称为TEM7R(TEM7-related)[7-8]。后续研究发现,PLXDC2在神经母细胞的增殖和分化过程中发挥着重要作用[9];该分子还充当色素上皮衍生因子(pigment epithelial-derived factor,PEDF)的膜受体而发挥生物学功能[10]。近年来,PLXDC2在肿瘤中的异常表达已引起人们的关注。在乳腺癌中,PLXDC2在mRNA水平上的高表达与淋巴结转移和疾病进展相关[11];在肝癌中,PLXDC2在蛋白水平也异常高表达[12]。亦有报道发现PLXDC2的异常表达具有判断外阴鳞状细胞癌患者不良预后的潜能[13],也可被用作区分上皮性卵巢癌对紫杉醇是否耐药的指标[14]。新近,有报道表明PLXDC2在胃癌间质细胞相关M2巨噬细胞内高表达,可能与胃癌上皮间质转化(epithelial-mesenchymal transition, EMT)表型和进展相关[15]。因此,本研究进一步探讨PLXDC2在胃癌中的表达、临床病理学意义及其分子机制,以期为寻找胃癌潜在的预后标志物和治疗靶点提供依据。
1 材料与方法 1.1 公开数据库数据的应用胃癌免疫组织化学染色(immunohistochemical, IHC)图片获取自The Human Protein Atlas在线数据库(https://www.proteinatlas.org/)。采用在线工具cBioPortal (https://www.cbioportal.org)下载公共数据库Stomach Adenocarcinoma TCGA Pan Cancer(TCGA-STAD,http://Cancer Genome.nih.gov/)中胃癌患者资料,共收集患者440例,其中具有完整临床资料的356例。借助在线工具GEPIA (http://gepia.cancer-pku.cn)分析TCGA-STAD数据库中PLXDC2在胃癌和癌旁组织中表达量的差异。并从NCBI GEO database (http://www.ncbi.nlm.nih.gov/geo/)中检索到3个含有胃癌与癌旁资料的数据集:GSE54129(n=132)、GSE63089(n=90)和GSE65801 (n=64),使用GEO2R(https://www.ncbi.nlm.nih.gov/geo/geo2r/)在线工具进行分析。设置阈值条件:|log2FC|>2,adjust P value <0.05[16]。此外,采用Kaplan-Meier Plotter在线工具(http://kmplot.com/analysis/index.php)分析PLXDC2表达量与患者总生存率、无病生存率和进展后生存率之间的关系(227995_at)。
1.2 细胞培养胃癌SCG7901细胞系购自中科院上海细胞库。培养基:完全培养基RPMI1640(Gibco)+10%FBS(Gibco)。培养条件:相对湿度95%、5%CO2、37 ℃恒温培养箱。
1.3 稳定敲低/过表达PLXDC2胃癌细胞系的构建PLXDC2敲低和过表达慢病毒载体的构建、测序、质粒抽提以及慢病毒包装分别委托吉玛公司和上海生博公司完成。sh-PLXDC2序列和对照序列见表 1。PLXDC2过表达序列为NM_032812.9。慢病毒转染细胞后,以3 μg/mL嘌呤霉素(上海生工)筛选稳定细胞株。
| 名称 | 序列 | |
| sh-PLXDC2-1 | 正向 | 5′-GATCCGCAGGAGTTATGTTACTTTGCTTCAAGAGAGCAAAGTAACATAACTCCTGCTTTTTTG-3′ |
| 反向 | 5′-AATTCAAAAAAGCAGGAGTTATGTTACTTTGCTCTCTTGAAGCAAAGTAACATAACTCCTGCG-3′ | |
| sh-PLXDC2-2 | 正向 | 5′-GATCCGGAGAAGTCGTACATCGAATGTTCAAGAGACATTCGATGTACGACTTCTCCTTTTTTG-3′ |
| 反向 | 5′-AATTCAAAAAAGGAGAAGTCGTACATCGAATGTCTCTTGAACATTCGATGTACGACTTCTCCG-3′ | |
| Mock | 正向 | 5′-GATCCGTTCTCCGAACGTGTCACGTTTCAAGAGAACGTGACACGTTCGGAGAACTTTTTTG-3′ |
| 反向 | 5′-AATTCAAAAAAGTTCTCCGAACGTGTCACGTTCTCTTGAAACGTGACACGTTCGGAGAACG-3′ |
1.4 qRT-PCR检测
细胞经TRIzol裂解液(碧云天)裂解后,按照说明书提取总RNA。测定浓度后,使用逆转录试剂盒(TaKaRa,RR036Q)和qRT-PCR试剂盒(TaKaRa,RR066A)进行qRT-PCR反应。以2-ΔΔCt法计算各基因相对表达量。引物序列见表 2。
| 基因 | 序列 | |
| PLXDC2 | 正向 | 5′-CCAGTTTCAGTTCGCCGATG-3′ |
| 反向 | 5′-TGTCTACCGCCTTGAGAAAGT-3′ | |
| β-actin | 正向 | 5′-TTGCGTTACACCCTTTCTTG-3′ |
| 反向 | 5′-CACCTTCACCGTTCCAGTTT-3′ |
1.5 Western blot检测
收集细胞后加入含有1 mmol/L蛋白酶抑制剂RIPA蛋白裂解液(碧云天,P0013K),冰上裂解30 min,4 ℃离心后BCA法测定上清液中蛋白浓度。10%的SDS-PAGE凝胶分离蛋白后经湿转法转至PVDF膜上。5%脱脂奶粉于室温封闭1 h,然后滴加一抗溶液[PLXDC2 (1 ∶2 000,Abcam,ab67226);Cortactin (1 ∶1 000,CST,3503S);肌动蛋白成核和聚合抗体试剂盒(1 ∶1 000,CST,8606T);β-actin(1 ∶5 000,Abcam,ab8226)],4 ℃孵育过夜后室温孵育二抗溶液1 h,经ECL显影液显色后观察。β-actin为内参照。
1.6 Matrigel-transwell侵袭实验24孔板内安置Transwell小室(8 μm,Millipore,美国),微孔膜预先用Matrigel胶(BD,美国)包被(RPMI1640 ∶Matrigel胶=2 ∶1,10 μL/孔)。培养细胞经Accutase消化后,以无血清RPMI1640培养基制成单细胞悬液,并调整细胞数为5×105/mL。吸取200 μL于Transwell小室中,下室中添加600 μL完全培养基,于细胞培养箱中培养24 h。取出小室,4%多聚甲醛溶液固定30 min,结晶紫染色30 min。棉拭子擦掉微孔膜上层未侵袭细胞,显微镜下计数侵袭细胞并采图。
1.7 小鼠腹膜转移模型实验所用NOD-SCID小鼠购自重庆恩斯维尔生物科技有限公司,雌性,4~6周龄,体质量(20±2)g,通过完全随机分组法分为敲低/Mock以及过表达/对照4组,每组6只。Accutase酶消化培养细胞,以PBS制成单细胞悬液,调整细胞数为1×106/mL,按200 μL/只(2×105/只)接种于小鼠腹腔内。5周后断颈处死小鼠,检查腹膜转移灶形成情况,计数和采图,并进行转移灶的HE染色,以确定其胃癌细胞来源。
1.8 免疫荧光染色(IF)铺置盖玻片于24孔板中,滴加0.5 mL细胞悬液(1×105细胞),于细胞培养箱内培养6~8 h后,用4%多聚甲醛溶液固定,制成细胞爬片。细胞爬片经0.3% Triton溶液破膜15 min,山羊血清封闭30 min,润洗后滴加新鲜配置的鬼笔环肽(1 ∶20,CST,8953S)溶液,37 ℃孵育1 h,再以DAPI(碧云天,C1005)染核10 min后封片,激光共聚焦显微镜下观察并采图。
1.9 统计学分析所有实验至少重复3次。采用SPSS或GraphPad Prism软件,数据以x±s表示。两组间的比较采用Student’s t检验。Kaplan-Meier方法用于生存分析,并以对数秩检验比较生存率。使用风险比(HR)和95%置信区间(CI)评估PLXDC2表达与总生存率、无病生存率和进展后生存率之间的相关性。Pearson χ2检验用于评估胃癌患者PLXDC2表达与临床病理参数之间的关系。Cox回归用于单因素和多因素生存分析,以确定显著相关变量中的独立危险因素。P < 0.05表示差异具有统计学意义。
2 结果 2.1 PLXDC2在胃癌组织中高表达从The Human Protein Atlas数据库中获取胃癌免疫组织化学染色(IHC)结果显示,PLXDC2在胃癌细胞内染色明显,主要存在于细胞的胞浆和胞膜(图 1A)。利用GEPIA在线工具分析TCGA数据库中PLXDC2在胃癌组织和癌旁组织中mRNA表达情况,结果显示PLXDC2在胃癌组织中的表达量显著高于癌旁组织(P < 0.05,图 1B)。进一步对NCBI GEO数据库中的3个独立数据集进行分析,结果与TCGA数据库资料分析结果相一致,包括GSE54129(P < 0.01)、GSE63089(P < 0.01)和GSE65801(P < 0.01),见图 1C。
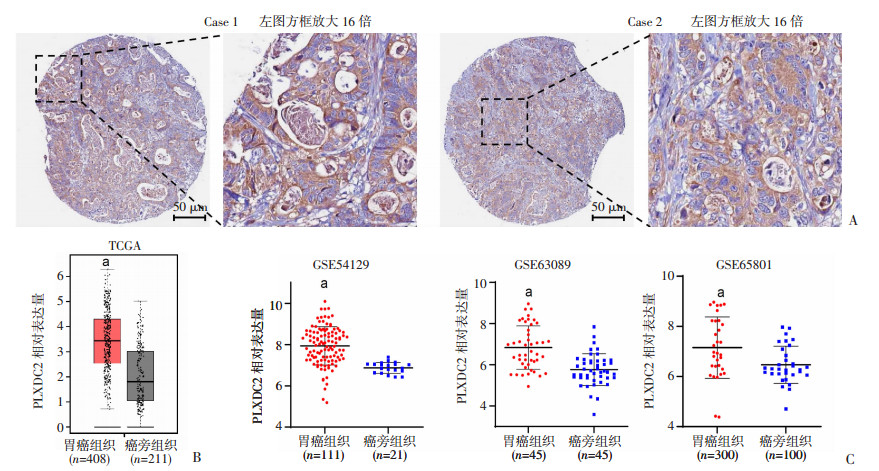
|
| A:The Human Protein Atlas数据库中2例患者胃癌组织IHC代表性图片;B:TCGA数据库中胃癌组织和癌旁组织PLXDC2 mRNA的表达;C:GSE54129、GSE63089和GSE65801数据集中胃癌组织和癌旁组织PLXDC2 mRNA的表达a:P < 0.01,与癌旁组织比较 图 1 PLXDC2在胃癌组织及癌旁组织中的表达 |
2.2 胃癌组织中PLXDC2的表达与临床资料的关系
从Stomach Adenocarcinoma TCGA Pan Cancer数据库中获取356例具有完整临床资料和PLXDC2 mRNA表达水平的胃癌患者。采用SPSS绘制ROC曲线确定PLXDC2相对表达量的cut-off值为239.079 6,将相对表达量≥239.079 6的患者定义为PLXDC2高表达(PLXDC2high),其余患者被定义为PLXDC2低表达(PLXDC2low)。卡方检验结果显示,PLXDC2表达量与组织学分级(P < 0.01)、TNM分期(P < 0.05)和T分期(P < 0.05)呈正相关关系,而与患者年龄、性别和肿瘤部位无显著相关性(表 3)。
| 临床病理特征 | n | PLXDC2 | χ2值 | P值 | 临床病理特征 | n | PLXDC2 | χ2值 | P值 | |||
| 低表达 | 高表达 | 低表达 | 高表达 | |||||||||
| 诊断年龄a/岁 | 1.115 | 0.291 | T分期 | 6.021 | 0.049 | |||||||
| <68 | 187 | 88(47.1) | 99(52.9) | T1+T2 | 92 | 51(55.4) | 41(44.6) | |||||
| ≥68 | 169 | 89(52.7) | 80(47.3) | T3 | 165 | 87(52.7) | 78(47.3) | |||||
| 性别 | 0.146 | 0.703 | T4 | 99 | 39(39.4) | 60(60.6) | ||||||
| 男 | 225 | 112(49.8) | 113(50.2) | N分期 | 0.857 | 0.836 | ||||||
| 女 | 131 | 65(49.6) | 66(50.4) | N0 | 110 | 58(52.7) | 52(47.3) | |||||
| 组织学分级 | 22.407 | 0.000 | N1 | 98 | 49(50.0) | 49(50.0) | ||||||
| G1+2 | 126 | 84(66.7) | 42(33.3) | N2 | 74 | 36(48.6) | 38(51.4) | |||||
| G3 | 230 | 93(40.4) | 137(59.6) | N3 | 74 | 34(45.9) | 40(54.1) | |||||
| TMN分期 | 8.152 | 0.043 | 肿瘤部位 | 7.177 | 0.066 | |||||||
| Ⅰ | 46 | 31(67.4) | 15(32.6) | 贲门 | 87 | 54(62.1) | 33(37.9) | |||||
| Ⅱ | 113 | 56(49.6) | 57(50.4) | 胃底 | 46 | 19(41.3) | 27(58.7) | |||||
| Ⅲ | 160 | 76(47.5) | 84(52.5) | 胃体 | 81 | 37(45.7) | 44(54.3) | |||||
| Ⅳ | 37 | 14(37.8) | 23(62.2) | 幽门窦 | 130 | 63(48.5) | 67(51.5) | |||||
| a:胃癌好发于65~74岁的人群,中位数为68岁 | ||||||||||||
进一步以Kaplan-Meier生存分析评估PLXDC2表达水平与胃癌患者预后之间的关系,结果表明PLXDC2high胃癌患者的总生存率、无病生存率和进展后生存率均显著低于PLXDC2low患者(P < 0.05,图 2A~C)。Kaplan-Meier Plotter在线工具的分析结果与TCGA-STAD数据库资料生存分析结果相一致(图 2D~E)。
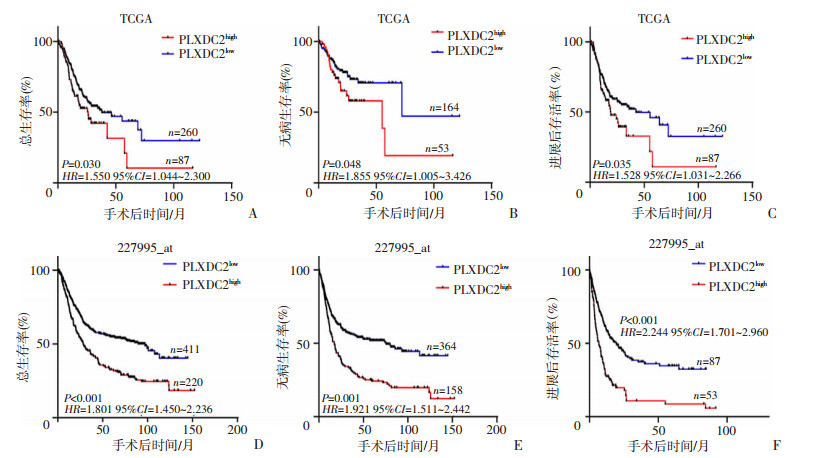
|
| A~C:Kaplan-Meier分析TCGA数据库结果;D~F:Kaplan-Meier Plotter在线工具分析结果;PLXDC2基因探针代号为“227995_at” 图 2 PLXDC2在胃癌组织的表达量与患者预后呈负相关 |
单因素和多因素Cox回归分析TCGA-STAD数据库数据,结果显示PLXDC2表达量是影响胃癌患者总生存率的独立危险因素(P < 0.05,表 4)。
| 预测变量 | 单因素分析 | 多因素分析 | |||
| P值 | HR(95% CI) | P值 | HR(95% CI) | ||
| PLXDC2表达量 | 0.003 | 1.001(1.000~1.001) | 0.001 | 1.001(1.000~1.002) | |
| 年龄(年) | 0.031 | 1.443(1.034~2.014) | 0.000 | 1.862(1.317~2.632) | |
| 性别 | 0.103 | 0.740(0.515~1.063) | - | - | |
| 组织学分级 | 0.059 | 1.378(0.988~1.921) | - | - | |
| TMN分期 | 0.000 | 1.597(1.295~1.971) | 0.000 | 1.755(1.400~2.199) | |
| T分期 | 0.008 | 1.332(1.079~1.644) | - | - | |
| N分期 | 0.000 | 1.349(1.161~1.576) | - | - | |
| 肿瘤部位 | 0.003 | 1.001(1.000~1.001) | 0.001 | 1.001(1.000~1.002) | |
2.3 PLXDC2促进胃癌细胞体外侵袭和体内转移
采用慢病毒方法,以胃癌细胞系SCG7901建立稳定敲低/过表达PLXDC2的细胞模型(图 3A、B)。Matrigel-transwell侵袭实验结果发现,与对照组比较,敲低PLXDC2显著降低SCG7901细胞的体外侵袭能力(P < 0.01),而过表达PLXDC2则显著增强其体外侵袭能力(P < 0.01,图 4A、B)。为进一步检测PLXDC2对胃癌细胞体内转移能力的影响,构建了小鼠腹膜转移模型。结果显示,沉默PLXDC2的SCG7901细胞所致小鼠腹膜转移灶的数目明显少于对照组(P < 0.01),而过表达PLXDC2则得到相反的结果(P < 0.01,图 4C、D)。HE染色证实了小鼠腹膜转移灶的胃癌细胞来源(图 4E)。以上结果表明,PLXDC2是调控胃癌细胞体外侵袭和体内转移能力的重要分子。
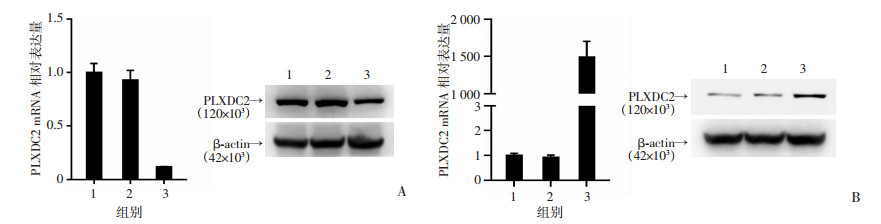
|
| A:验证PLXDC2在胃癌SCG7901细胞中的敲低效率1: WT; 2: Mock; 3: sh-PLXDC2;B:验证PLXDC2在胃癌SCG7901细胞中的过表达效率1: WT; 2: Ctrl; 3: OE-PLXDC2 图 3 qRT-PCR和Western blot检测PLXDC2敲低/过表达效率 |
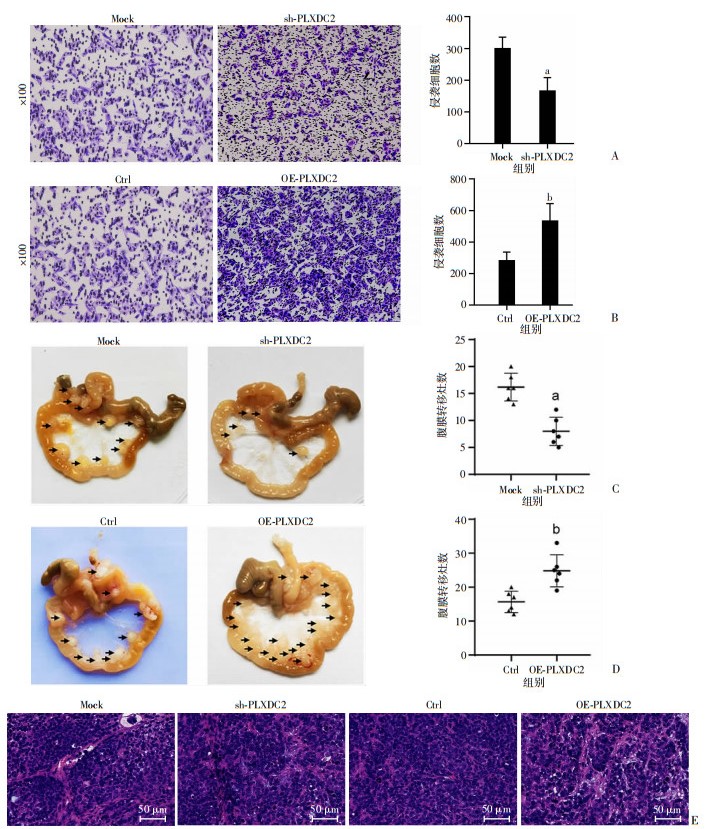
|
|
a:P < 0.01,与Mock组比较;b:P < 0.01,与Ctrl组比较 A:Transwell侵袭实验检测敲低PLXDC2抑制胃癌细胞SCG7901的侵袭能力;B:Transwell侵袭实验检测过表达PLXDC2增加胃癌细胞SCG7901的侵袭能力;C:PLXDC2敲低小鼠腹膜转移模型图像及统计分析;D:PLXDC2过表达小鼠腹膜转移模型图像及统计分析;E:HE染色观察小鼠腹膜转移瘤胃癌细胞形态 图 4 PLXDC2促进胃癌细胞侵袭转移 |
2.4 PLXDC2促进胃癌细胞丝状伪足形成
为探究PLXDC2促进胃癌细胞侵袭和转移是否与影响细胞伪足形成有关,使用肌动蛋白成核和聚合抗体试剂盒进行Western blot实验,结果显示,敲低PLXDC2的胃癌细胞中WAVE-2、N-WASp、Arp2/3、Cdc42和Profilin蛋白水平均降低,而过表达PLXDC2的胃癌细胞中这些蛋白表达增高(图 5A)。进一步在激光共聚焦显微镜下观察PLXDC2对胃癌细胞SCG7901丝状伪足形成的影响,发现敲低PLXDC2的胃癌细胞中丝状伪足显著减少,而过表达的胃癌细胞内丝状伪足显著增多(图 5B)。表明PLXDC2可能通过调控Cdc42的表达而促进胃癌细胞丝状伪足形成,进而促进胃癌细胞侵袭和转移。
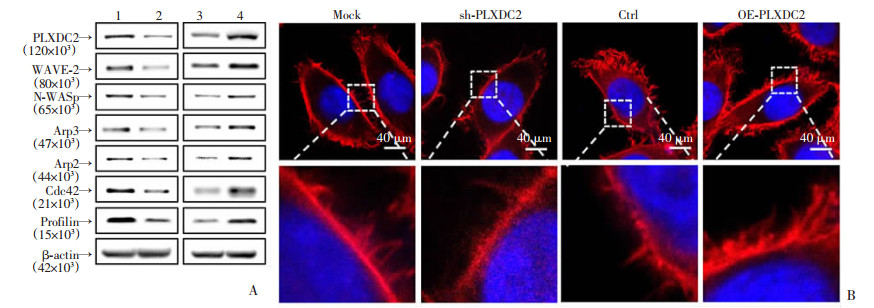
|
| A:肌动蛋白成核和聚合抗体试剂盒Western blot检测结果1:Mock; 2: sh-PLXDC2; 3: Ctrl; 4: OE-PLXDC2;B:免疫荧光染色观察;下排图为上排图方框放大16倍 图 5 PLXDC2促进胃癌细胞丝状伪足形成 |
3 讨论
侵袭和转移是胃癌的重要恶性生物学行为,其潜在机制仍有待阐明。虽然PLXDC2在肿瘤中的作用尚未完全明了,但一些研究已将PLXDC2与肿瘤的转移和进展联系起来,例如乳腺癌[11]和外阴鳞状细胞癌[13]。本研究证明PLXDC2是促进胃癌侵袭转移的重要分子,其表达水平与胃癌患者临床病理参数呈正相关,包括组织学分级、TNM分期和T分期,但不包括N分期。虽然结果显示PLXDC2表达量与N分期的相关性没有统计学意义,但观察N分期中各亚组内PLXDC2high的百分比可以发现,随着转移淋巴结数量的增多,PLXDC2的表达量也逐步升高。产生这一结果的原因可能是数据库中病例数不足,或者术后清数淋巴结操作欠完善。生存分析结果显示PLXDC2的表达与患者总生存率、无病生存率和进展后生存率呈负相关,而且是影响患者预后的独立危险因素。
肿瘤细胞转移时要调控其运动相关结构,向前拓展胞膜,形成突起结构[17]。现已知的该结构主要包含板状伪足、丝状伪足和侵袭性伪足[18-19]。在板状伪足和丝状伪足内,肌动蛋白聚合物推动胞膜向前移动;而在侵袭性伪足内,肌动蛋白聚合物与胞外基质金属蛋白酶结合,降解胞外基质,为细胞穿透基质建立通路[20]。这些结构都是由特殊的肌动蛋白成核因子调节肌动蛋白组装而成[18]。本研究采用Actin Nucleation and Polymerization Antibody Sampler试剂盒评估PLXDC2对肌动蛋白成核和聚合的影响,结果表明PLXDC2敲低会降低WAVE-2、N-WASp、Arp2/3、Cdc42和Profilin蛋白水平,而过表达PLXDC2会提高这些分子蛋白水平。Cdc42是第一个发现可诱导丝状伪足形成的Rho GTPase,是启动丝状伪足形成的重要调控分子[21]。Cdc42能募集IRSp53(I-BAR蛋白)、mDia2和N-WASp,通过激活WASP和N-WASp诱导Arp2/3复合物依赖性肌动蛋白丝成核。在肿瘤细胞内,丝状伪足密度的增加被视为侵袭性癌细胞的特征之一[22]。比如在骨肉瘤中,抑制丝状伪足的形成可减弱细胞转移[23];在乳腺癌内,增加丝状伪足形成会增强乳腺癌细胞迁移[24]。本研究发现,PLXDC2是调控胃癌细胞丝状伪足形成的重要分子,敲低PLXDC2会减弱丝状伪足的形成,进而导致胃癌细胞转移能力降低;过表达PLXDC2则结果相反。
综上所述,本研究证明PLXDC2在胃癌组织中高表达,其表达水平与组织学分级、TNM分期和T分期呈正相关,与患者预后呈负相关,其表达量是影响患者预后的独立危险因素。敲低PLXDC2可显著抑制胃癌细胞体外侵袭和体内转移能力,过表达PLXDC2则导致相反的结果,其机制可能为PLXDC2通过调控Cdc42的表达促进丝状伪足的形成,进而促进了胃癌细胞的侵袭和转移。本研究揭示了PLXDC2在胃癌中高表达的临床病理学意义,探讨了其调控丝状伪足形成而促进胃癌细胞侵袭转移的可能分子机制,提示PLXDC2可用作胃癌的潜在预后标志物和治疗靶点。
志谢 感谢陆军军医大学第一附属医院病理学研究所崔有宏教授的支持和指导,感谢王艳霞、向东方、颜泽萱等老师在实验中给予的支持和帮助| [1] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics[J]. CA Cancer J Clin, 2020, 70(1): 7-30. |
| [2] |
WONG M C S, HUANG J J, CHAN P S F, et al. Global incidence and mortality of gastric cancer, 1980-2018[J]. JAMA Netw Open, 2021, 4(7): e2118457. |
| [3] |
郑荣寿, 孙可欣, 张思维, 等. 2015年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2019, 41(1): 19-28. ZHENG R S, SUN K X, ZHANG S W, et al. Report of cancer epidemiology in China, 2015[J]. Chin J Oncol, 2019, 41(1): 19-28. |
| [4] |
RAWLA P, BARSOUK A. Epidemiology of gastric cancer: global trends, risk factors and prevention[J]. Prz Gastroenterol, 2019, 14(1): 26-38. |
| [5] |
HARADA K, LOPEZ A, SHANBHAG N, et al. Recent advances in the management of gastric adenocarcinoma patients[J]. F1000Research, 2018, 7: 1365. |
| [6] |
SMYTH E C, NILSSON M, GRABSCH H I, et al. Gastric cancer[J]. Lancet, 2020, 396(10251): 635-648. |
| [7] |
CARSON-WALTER E B, WATKINS D N, NANDA A, et al. Cell surface tumor endothelial markers are conserved in mice and humans[J]. Cancer Res, 2001, 61(18): 6649-6655. |
| [8] |
ST CROIX B, RAGO C, VELCULESCU V, et al. Genes expressed in human tumor endothelium[J]. Science, 2000, 289(5482): 1197-1202. |
| [9] |
ATTOFF K, GLIGA A, LUNDQVIST J, et al. Whole genome microarray analysis of neural progenitor C17.2 cells during differentiation and validation of 30 neural mRNA biomarkers for estimation of developmental neurotoxicity[J]. PLoS One, 2017, 12(12): e0190066. |
| [10] |
SHANG Z Y, LI C X, LIU X M, et al. PEDF gene deletion disrupts corneal innervation and ocular surface function[J]. Invest Ophthalmol Vis Sci, 2021, 62(7): 18. |
| [11] |
DAVIES G, CUNNICK G H, MANSEL R E, et al. Levels of expression of endothelial markers specific to tumour-associated endothelial cells and their correlation with prognosis in patients with breast cancer[J]. Clin Exp Metastasis, 2004, 21(1): 31-37. |
| [12] |
YAMAMOTO N, EGUCHI A, HIROKAWA Y, et al. Expression pattern of plexin domain containing 2 in human hepatocellular carcinoma[J]. Monoclon Antib Immunodiagn Immunother, 2020, 39(2): 57-60. |
| [13] |
LAVORATO-ROCHA A M, AKAGI E M, DE MELO MAIA B, et al. An integrative approach uncovers biomarkers that associate with clinically relevant disease outcomes in vulvar carcinoma[J]. Mol Cancer Res, 2016, 14(8): 720-729. |
| [14] |
WANG Y J, LI H X. Identification of proteins associated with paclitaxel resistance of epithelial ovarian cancer using iTRAQ-based proteomics[J]. Oncol Lett, 2018, 15(6): 9793-9801. |
| [15] |
GUAN Y M, DU Y Z, WANG G Z, et al. Overexpression of PLXDC2 in stromal cell-associated M2 macrophages is related to EMT and the progression of gastric cancer[J]. Front Cell Dev Biol, 2021, 9: 673295. |
| [16] |
DAVIS S, MELTZER P S. GEOquery: a bridge between the gene expression omnibus (GEO) and BioConductor[J]. Bioinformatics, 2007, 23(14): 1846-1847. |
| [17] |
GIBIEŽA P, PETRIKAITĚ V. The regulation of actin dynamics during cell division and malignancy[J]. Am J Cancer Res, 2021, 11(9): 4050-4069. |
| [18] |
CASWELL P T, ZECH T. Actin-based cell protrusion in a 3D matrix[J]. Trends Cell Biol, 2018, 28(10): 823-834. |
| [19] |
FERRARI R, INFANTE E, CHAVRIER P. Nucleus-invadopodia Duo during cancer invasion[J]. Trends Cell Biol, 2019, 29(2): 93-96. |
| [20] |
EDDY R J, WEIDMANN M D, SHARMA V P, et al. Tumor cell invadopodia: invasive protrusions that orchestrate metastasis[J]. Trends Cell Biol, 2017, 27(8): 595-607. |
| [21] |
MALDONADO M, MEDINA J I, VELAZQUEZ L, et al. Targeting rac and Cdc42 GEFs in metastatic cancer[J]. Front Cell Dev Biol, 2020, 8: 201. |
| [22] |
ZHANG Q L, LIANG H, ZHAO X Y, et al. PTENε suppresses tumor metastasis through regulation of filopodia formation[J]. EMBO J, 2021, 40(10): e105806. |
| [23] |
KIDANI T, YASUDA R, MIYAWAKI J, et al. Bis phenol A inhibits cell proliferation and reduces the motile potential of murine LM8 osteosarcoma cells[J]. Anticancer Res, 2017, 37(4): 1711-1722. |
| [24] |
JACQUEMET G, PAATERO I, CARISEY A F, et al. FiloQuant reveals increased filopodia density during breast cancer progression[J]. J Cell Biol, 2017, 216(10): 3387-3403. |




