2. 518111 广东 深圳,深圳大学附属华南医院血管外科
2. Department of Vascular Surgery, South China Affiliated Hospital, Shenzhen University, Shenzhen, Guangdong Province, 518111, China
内膜增生是导致多种血管疾病的病理基础。原因为多种刺激因素导致内皮细胞损伤并发生凋亡坏死,同时肌成纤维细胞向损伤处迁移并增殖[1]。内皮细胞损伤不仅是内膜增生的始动因素,更在整个病理过程中具有重要作用[2],而氧化应激是作为内皮细胞损伤的重要因素[3],主要通过升高细胞内活性氧(reactive oxygen species,ROS)水平产生病理的损伤。过量ROS可经NADPH氧化酶(NOX)等多种途径调控蛋白表达及造成细胞器的损伤[4]。其中氧化低密度脂蛋白(oxidation low lipoprotein,OX-LDL)不仅是ROS作用细胞的产物,同时还对细胞内的ROS水平有反向调控作用。
自噬是一种广泛存在于真核生物体内的生命活动,是细胞在饥饿、应激、毒物损伤等条件下加速代谢和获得能量的重要方式[5],既可维持正常的细胞生理状态,也可在病理状态下发挥作用[6]。细胞自噬目前分为3种:巨自噬、分子伴侣介导的自噬(chaperone-mediated autophagy, CMA)和微自噬。其中巨自噬标志蛋白包括Beclin-1、LC3蛋白[7-8],而3-MA是靶向阻断Ⅲ型P13K路径的特异性巨自噬抑制剂[9]。CMA是分子伴侣介导识别具备特定氨基酸序列的底物蛋白转运入自噬溶酶体降解的自噬方式,热休克蛋白家族Hsc70及Lamp-2a蛋白参与识别过程[10-11]。微自噬由溶酶体膜杯状凹陷内表面包裹吞噬物后形成小泡进入溶酶体降解。在哺乳动物中主要发生的是巨自噬和CMA。有研究发现自噬参与内皮细胞损伤导致的内膜增生过程[12],然而,关于两种自噬方式在氧化应激导致内皮细胞损伤中的作用特点尚不清楚。因此,本研究通过观测氧化应激条件下抑制巨自噬途径前后在时间层面内皮细胞巨自噬和分子伴侣介导自噬与细胞增殖凋亡水平,探究两种自噬途径在内皮细胞氧化应激损伤中的作用特点,阐明巨自噬和分子伴侣介导自噬对氧化应激内皮细胞损伤具有保护作用。
1 材料与方法 1.1 主要材料及分组 1.1.1 试剂与设备活性氧检测试剂盒(碧云天生物技术研究所),3-MA(MCE)、BCA快速蛋白定量试剂盒(贝博生物),各种兔源性一抗均来至于美国CST公司。全自动细胞计数仪、酶标仪(Bio-Rad),超净工作台(苏州净化),CCK-8检测试剂盒(碧云天),Annexin-V/PI凋亡双染试剂盒(贝博生物),氧化性低密度脂蛋白(奕源生物),HRP标记山羊抗兔二抗(碧云天)。
1.1.2 细胞分组及处理人脐静脉内皮细胞(human umbilical vein endothelialcells, HUVECs)原代细胞株购自深圳豪地华拓生物。HUVECs细胞株传代培养,取对数生长期细胞分为4组,空白对照组(Ctl):不做其他处理;单纯抑制巨自噬组(3-MA):10 mmol/L 3-MA处理细胞;氧化应激组(OX-LDL):50 μg/mL OX-LDL处理细胞;抑制巨自噬-氧化应激组(3-MA+OX-LDL):10 mmol/L 3-MA和50 μg/mL OX-LDL处理细胞。各组均处理6 h;另外,氧化应激组和抑制巨自噬-氧化应激组每组各处理1、3、6、12、48 h。
1.2 方法 1.2.1 细胞培养及不同浓度OX-LDL对ROS水平影响的测定HUVECs细胞用含10%胎牛血清的HDMEM培养基在恒温37 ℃、含5%二氧化碳细胞孵箱中培养。将不同浓度(0、20、50、100、200 μg/mL)OX-LDL加入HUVECs作用6 h后,行ROS检测。带DCFH-DA探针的ROS检测剂与细胞共培养2 h后,进行流式细胞仪检测。
1.2.2 流式细胞仪检测细胞凋亡HUVECs细胞在含10%血清的完全培养基培养,根据分组分别加入PBS、10 mmol/L 3-MA及50 μg/mL OX-LDL继续培养1、3、6、12、48 h。胰酶消化获取细胞悬液,采用Annexin-V/PI双染法,进行流式细胞仪凋亡检测。
1.2.3 CCK-8检测细胞增殖和细胞毒性取对数生长期细胞按照5 000/孔种入96孔板,根据分组分别加入10 mmol/L 3-MA及50 μg/mL OX-LDL继续培养1、3、6、12、48 h。细胞去除培养液使用PBS缓冲液清洗后加入10 μL/孔CCK-8溶液孵育,使用酶标仪在450 nm
检测波长下检测光密度值[D(450)]。计算细胞增殖抑制率=1-{[实验组D(450)-空白对照组D(450)]/[对照组D(450)-空白对照组D(450)]}×100%。
1.2.4 Western blot检测蛋白表达RIPA裂解液裂解细胞提取蛋白,BCA蛋白定量后,酶标仪在562 nm波长下测定,根据标准曲线得出目的蛋白浓度。采用SDS-PAGE电泳分离蛋白后转至PVDF膜。采用250 mA恒流转膜。将各个PVDF膜条带分别对应浸入beclin-1(1 ∶1 000)、Hsc70(1 ∶1 000)、Lamp-2a(1 ∶1 000)、PCNA(1 ∶1 000)、Caspase-3(1 ∶1 000)的一抗孵育。HRP标记二抗处理后,ECL显影及采集图形和数据分析。
1.3 统计学分析每组实验均重复至少3次,计量数据以x±s表示。流式检测结果使用FlowJo v10软件编辑分析,Western blot条带使用Image J软件进行量化分析。采用GraphPad Prism 8进行统计分析及制图。两组间比较采用独立样本t检验,多组间比较采用单因素方差分析Dunnet-t检验。P < 0.05表示差异有统计学意义。
2 结果 2.1 OX-LDL诱导HUVECs细胞ROS水平变化不同浓度OX-LDL作用后均引起HUVECs细胞内ROS水平上调,并且上调水平随OX-LDL浓度升高而升高,浓度在20~100 μg/mL上升趋势明显,提示此区间浓度诱导最为灵敏(图 1)。取趋势明显区间的中间值为诱导最佳浓度,后续实验采取50 μg/mL为适宜浓度。
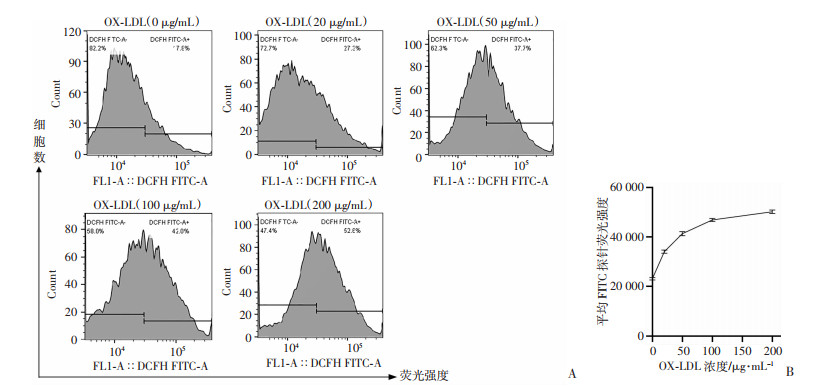
|
| A:不同浓度OX-LDL作用HUVECs 6 h ROS荧光强度细胞分布;B:不同浓度OX-LDL作用HUVECs 6 h平均ROS荧光强度 图 1 不同浓度OX-LDL作用HUVECs 6 h ROS水平的变化 (n=3) |
2.2 使用3-MA抑制巨自噬前后OX_LDL诱导氧化应激HUVECs不同时间内细胞增殖和凋亡情况
氧化应激组及抑制巨自噬-氧化应激组分别作用不同时间(1、3、6、12、48 h)后行CCK-8细胞增殖及流式凋亡检测。结果显示(图 2):不同时间对HUVECs细胞增殖抑制率和凋亡率均有显著影响(P < 0.05),随时间延长,增殖抑制率上升,凋亡率上升。与氧化应激组比较,同时段抑制巨自噬-氧化应激组增殖抑制率水平更高(P < 0.05),凋亡率更高(P < 0.05)。表明HUVEVCs细胞在OX_LDL诱导氧化应激48 h内随时间延长细胞增殖率下降,凋亡率上升,抑制巨自噬可以进一步抑制细胞的增殖并促进凋亡。
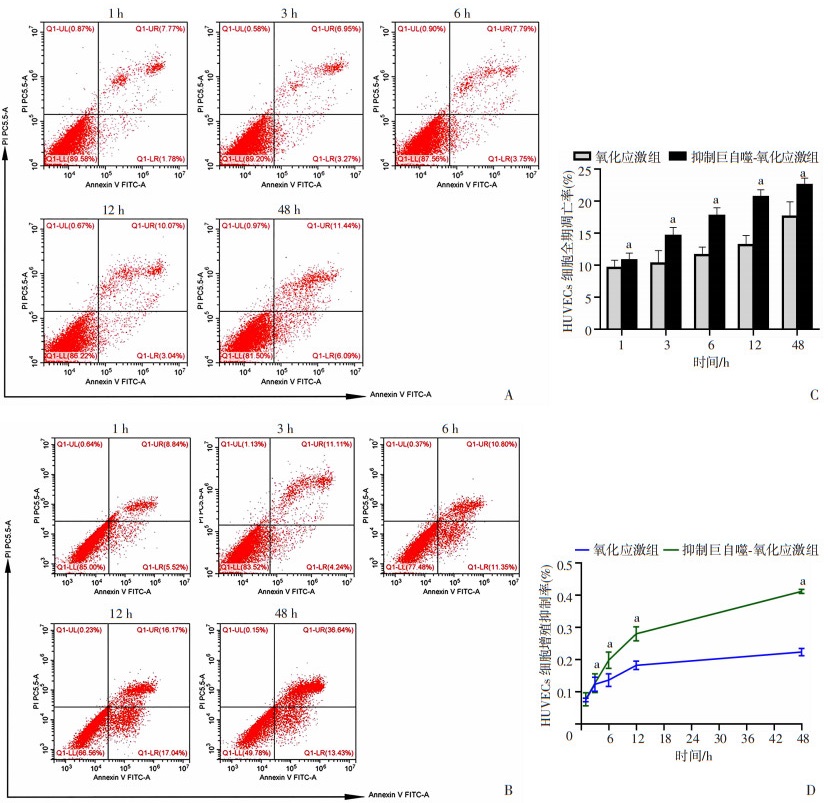
|
| A:氧化应激组不同时间HUVECs凋亡流式图;B:抑制巨自噬-氧化应激组不同时间HUVECs凋亡流式图;C:氧化应激组及抑制巨自噬-氧化应激组不同时间HUVECs全期凋亡率比较 a:P < 0.05,与同时间点氧化应激组比较;D:氧化应激组及抑制巨自噬-氧化应激组不同时间HUVECs增殖抑制率比较 a:P < 0.05,与同时间点氧化应激组比较 图 2 氧化应激组及抑制巨自噬-氧化应激组HUVECs凋亡率和增殖抑制率 (n=3) |
2.3 不同处理下HUVECs两种自噬、增殖及凋亡相关蛋白的表达
将4组细胞作用6 h后,行Western blot检测增殖、凋亡和两种自噬相关蛋白表达。结果显示(图 3):与空白对照组比较,OX-LDL诱导氧化应激可以提高HUVECs细胞Caspase-3、Beclin-1、Hsc70、Lamp-2水平(P < 0.05),同时降低PCNA水平(P < 0.05);与氧化应激组比较,抑制巨自噬-氧化应激组HUVECs Caspase-3、Hsc70、Lamp-2水平上升,同时PCNA下降(P < 0.05),3-MA可以显著抑制OX-LDL对HUVECs细胞巨自噬的升高作用(P < 0.05)。表明氧化应激本身可促进内皮细胞凋亡和自噬并抑制增殖,氧化应激下抑制巨自噬进一步增加内皮细胞凋亡,减少增殖活性,并伴随有CMA途径的强化激活。

|
|
1:空白对照组;2:单纯巨自噬抑制组;3:氧化应激组;4:抑制巨自噬-氧化应激组; a:P < 0.05,与氧化应激组比较;b:P < 0.05,与空白对照组比较 A:Western blot检测各组HUVECs PCNA、Hsc70、Lamp-2、Beclin-1、Caspase-3蛋白表达;B:各组PCNA蛋白相对表达量;C:各组Hsc70蛋白相对表达量;D:各组Lamp-2蛋白相对表达量;E:各组Beclin-1蛋白相对表达量;F:各组Caspase-3蛋白相对表达量 图 3 各组HUVECs PCNA、Caspase-3、Hsc70、Lamp-2、Beclin-1蛋白表达分析 (n=3) |
2.4 OX_LDL诱导HUVECs氧化应激下细胞两种自噬途径蛋白的时间表达特点
Western blot检测氧化应激组和抑制巨自噬-氧化应激组在不同时间点(1、3、6、12、48 h)巨自噬途径标志蛋白Beclin-1及分子伴侣介导自噬途径重要参与蛋白Hsc70和Lamp-2的表达。结果显示(图 4):OX_LDL诱导氧化应激HUVECs细胞时间在12 h内Beclin-1水平升高(P < 0.05),12 h后有所下降,巨自噬抑制剂3-MA可以全时段抑制Beclin-1蛋白表达。48 h内氧化应激组Lamp-2蛋白表达水平上升(P < 0.05),且同时段抑制巨自噬-氧化应激组Lamp-2蛋白水平更高(P < 0.05)。氧化应激组Hsc70蛋白1 h和3 h内表达无明显差异,在6 h后开始升高(P < 0.05),抑制巨自噬后Hsc70蛋白表达在3 h后开始升高(P < 0.05)。表明内皮细胞巨自噬在氧化应激早期即开始激活,随时间延长降低,分子伴侣介导自噬两种标志蛋白略有差异,其中Hsc70在氧化应激中后期开始升高,Lamp-2则随时间缓慢增加,氧化应激下抑制巨自噬后均可见两种标志蛋白水平上升,同时有Hsc70蛋白激活时间的提前。
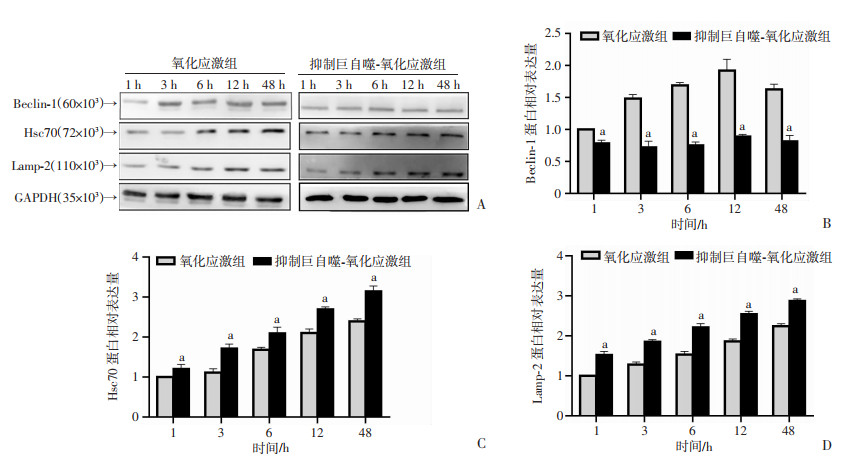
|
| A: Western blot检测氧化应激组和抑制巨自噬-氧化应激组HUVECs不同时间Beclin-1、Lamp-2、Hsc70蛋白表达;B~D:分别为Beclin-1、Hsc70、Lamp-2蛋白相对表达量 a:P < 0.05,与同时间点氧化应激组比较 图 4 氧化应激组和抑制巨自噬-氧化应激组不同时间HUVECs Beclin-1、Lamp-2、Hsc70表达分析 (n=3) |
3 讨论
氧化应激所致的内皮细胞损伤是引起多种血管疾病内膜增生的重要因素之一[13],其对内皮细胞的损伤以ROS的产生活化对胞内蛋白核酸等大分子的氧化以及特定通路的激活为主要途径[14]。OX-LDL可通过内皮细胞表面的OX-LDL依赖的类凝集素受体(LOX-1) 进入细胞内[15],激活细胞内NADPH氧化酶升高进而引起HUVECs细胞内ROS升高,本研究即利用OX-LDL可调控内皮细胞ROS模拟氧化应激,流式检测结果显示OX-LDL可以在实验浓度下诱导内皮细胞ROS水平的升高,并且不同浓度OX-LDL诱导相同时间ROS水平呈现低浓度高敏感、高浓度低敏感的特点,实验采取中间浓度诱导构建出内皮细胞氧化应激模型,可很好模拟内皮细胞氧化应激的特点。
自噬是真核细胞内广泛存在的一种重要的生命活动,经典自噬即巨自噬主要特征为自噬小体形成,最终形成自噬溶酶体并在溶酶体内完成对小体内包裹底物的消化和降解,涉及多个ATG基因调控不同蛋白结合形成自噬前体,其中ATG基因调控的Ⅲ型P13K路径与ATG14L形成的复合体参与自噬前体形成[16],Ⅲ型P13K路径与ATG14L形成的复合体再结合被ULK1磷酸化的Beclin-1参与到自噬前体的延伸及定位[17],自噬前体延伸结合磷脂双分子膜包裹底物形成经典大自噬特征结构自噬小体[18],其中3-MA可特异性靶向阻断Ⅲ型P13K路径从而抑制自噬前体形成使细胞应对刺激维持生理功能出现障碍,同时,自噬小体通过微丝蛋白、小体膜蛋白和溶酶体膜蛋白的引导与溶酶体结合形成自噬溶酶体,从而完成底物蛋白的降解。分子伴侣介导自噬主要特征为分子伴侣蛋白Hsc70识别特定氨基酸基序KFERQ介导底物蛋白转运进入溶酶体,其过程涉及Lamp蛋白。Lamp-2蛋白定位于溶酶体膜,是一种单次跨膜蛋白,识别Hsc70-底物复合体蛋白并转运底物进入溶酶体内降解同时释放Hsc70[19],CMA途径没有自噬小体形成,底物以细胞内长寿蛋白质为主[20]。作为两种不同的细胞自噬方式,尽管在底物选择、调控机制等多方面存在不同,在细胞面对各种外在刺激情况时,二者共同参与维持细胞内微环境的稳定。目前关于巨自噬的研究较多,但CMA相关功能及两种自噬途径间关系的研究则相对较少。有研究发现:在饥饿诱导的肿瘤细胞中,巨自噬活性下降后,分子伴侣介导自噬会开始活化增强细胞的自噬功能从而为细胞的生存提供必需的能源物质[21],这说明在肿瘤细胞中两种自噬途径间相互关联。然而,在内皮细胞尤其氧化应激引起内皮细胞的损伤中,这两种自噬途径的表现特点目前尚不清楚,因此,本研究探究了氧化应激两种自噬途径在内皮细胞损伤中特点。本研究采用抑制巨自噬观测分子伴侣介导自噬方式试图阐明二者表现特点。基于巨自噬早期激活的Ⅲ型P13K路径涉及Beclin-1的复合体形成,本研究使用3-MA作为巨自噬早期激活的特异性抑制剂,Beclin-1作为巨自噬特异性标志蛋白分子。CMA途径以涉及底物蛋白识别及转运的Hsc70及Lamp-2蛋白作为分子伴侣介导自噬的标志蛋白。
氧化应激可通过多种方式引起内皮细胞的损伤,其中最直接可引起内皮细胞形态及功能变化的指标包括细胞的增殖和凋亡水平。本研究采用经典CCK-8细胞增殖毒性实验检测内皮细胞增殖以及Annexin-V/PI双染法检测凋亡,同时配合免疫印迹检测增殖相关蛋白PCNA及凋亡蛋白Caspase-3评估细胞损伤水平。发现诱导氧化应激后内皮细胞巨自噬和分子伴侣介导自噬相关蛋白表达均增加,同时伴随细胞增殖抑制率及凋亡增加,在抑制巨自噬后Beclin-1水平明显抑制,细胞凋亡率及增殖抑制率进一步上升,同时观察到抑制巨自噬后分子伴侣介导自噬水平升高。CMA途径重要参与蛋白Hsc70和Lamp-2水平提高,提示巨自噬和分子伴侣介导自噬间存在关联,当巨自噬途径受阻后,分子伴侣介导自噬水平会有明显提高,以增强细胞自噬水平减轻细胞氧化应激损伤。
进一步在时间层面上阻断巨自噬途径研究两种自噬水平变化发现:巨自噬在细胞氧化应激状态的1、3、6、12 h内水平随时间推迟升高,作用12 h开始下降。其在12 h内水平持续升高与OX-LDL依赖LOX-1受体缓慢进入细胞以及细胞内ATP能量供应有关,12 h后Beclin-1水平有所下降,提示细胞内巨自噬水平开始降低,可能与细胞内能量耗竭及ROS对内皮细胞线粒体损伤有所关联,巨自噬涉及细胞内吞转运、细胞器膜流动重利用等需要大量耗能运动因而不能持久发生。Hsc70属于热休克同源蛋白,介导识别含特定氨基酸基序(KFERQ)的底物蛋白并转运进入自噬溶酶体,完成包括部分长寿蛋白质在内的蛋白降解[22]。Lamp-2蛋白定位于溶酶体膜,是一种单次跨膜蛋白,参与Hsc70结合的底物蛋白形成的复合体蛋白结合,从而转运底物蛋白进入溶酶体内降解,因此,Lamp-2也可以作为一种重要的溶酶体膜蛋白。作为分子伴侣介导自噬途径重要的两种参与蛋白,本研究中发现两者的作用方式仍有所不同。在HUVECs细胞氧化应激状态下,Hsc70蛋白在作用时间1、3 h内未见明显升高,在6 h后蛋白表达量开始上升,且在作用48 h仍有提高,可能与细胞内长寿蛋白质不易发生损伤有关。长寿蛋白质性质较稳定,而细胞内ROS水平依赖OX-LDL转运进入细胞内。Lamp-2蛋白则在作用时间内其水平与作用时间呈正比,没有类似Hsc70蛋白的窗口反应期,可能与Lamp-2蛋白本身是溶酶体膜蛋白,随着巨自噬的激活,自噬小体形成,自噬溶酶体活化水平增高伴随溶酶体蛋白增加有关联[23]。在巨自噬抑制后,两种CMA标志蛋白均呈现时间相关性水平增加,说明在抑制巨自噬后分子伴侣介导自噬可以激活某些特定的途径从而增加CMA途径自噬水平,其中Hsc70蛋白可以在巨自噬抑制后早期就开始激活,时间由6 h提前到3 h,具体方式有待继续探究。
本研究在分子层面上抑制了巨自噬的表达,如果同时抑制CMA途径,观测氧化应激下内皮细胞相关增殖凋亡以及两种自噬水平与时间的关系,可以从另一方面阐明自噬在内皮氧化应激损伤中的特点。有学者研究发现,使用SB203580(吡啶异咪哒化合物)抑制内皮祖细胞(EPCs)CMA途径后可以观测到EPCs巨自噬的增强及凋亡增加、增殖抑制[24]。提示两种自噬途径在细胞内相互关联,均可通过减轻内皮细胞损伤发挥保护作用。
综上所述,本研究结果显示:巨自噬和分子伴侣介导自噬在内皮细胞氧化应激中先后激活,巨自噬抑制后可提高分子伴侣介导自噬水平,提前激活时间以减轻氧化应激对内皮细胞的损伤。
作者贡献声明 王正力负责内容构思和实验方法设计、实验数据分析和撰写初稿;訾亚飞负责内容整理,参与实验研究及数据采集,参与文章内容撰写指导及提供实验技术材料支持;刘杨东参与酝酿和设计实验,核对实验进展及指导实验进行,并给予研究经费支持;傅麒宁参与选题方向确定及指导实验方案的设计;王学虎负责实验工作支持,全程参与论文内容修改指导并审核全文
| [1] |
靖永胜, 王小平, 刘芳, 等. 动静脉内瘘功能障碍病理及发病机制的研究进展[J]. 中华肾脏病杂志, 2017, 33(4): 318-320. JING Y S, WANG X P, LIU F, et al. Research progress on dysfunction and pathogenesis of arteriovenous fistula[J]. Chin J Nephrol, 2017, 33(4): 318-320. |
| [2] |
OWENS C D, WAKE N, KIM J M, et al. Endothelial function predicts positive arterial-venous fistula remodeling in subjects with stage Ⅳ and Ⅴ chronic kidney disease[J]. J Vasc Access, 2010, 11(4): 329-334. |
| [3] |
EGOROVA A D, VAN DER HEIDEN K, POELMANN R E, et al. Primary Cilia as biomechanical sensors in regulating endothelial function[J]. Differentiation, 2012, 83(2): S56-S61. |
| [4] |
DUNN S, VOHRA R S, MURPHY J E, et al. Thelectin-like oxidized low-density-lipoprotein receptor: a pro-inflammatory factor in vascular disease[J]. Biochem J, 2008, 409(2): 349-355. |
| [5] |
FURLONG K, HWANG S. Autophagy and noroviruses[J]. Viruses, 2019, 11(3): 244. |
| [6] |
MIALET-PEREZ J, VINDIS C. Autophagy in health and disease: focus on the cardiovascular system[J]. Essays Biochem, 2017, 61(6): 721-732. |
| [7] |
蒋琦炜, 张德宇, 石烟祝, 等. 细胞自噬与肿瘤发生发展[J]. 军事医学, 2021, 45(3): 234-241. JIANG Q W, ZHANG D Y, SHI Y Z, et al. Autophagy and tumor development and progression[J]. Mil Med Sci, 2021, 45(3): 234-241. |
| [8] |
DANCOURT J, MELIA T J. Lipidation of the autophagy proteins LC3 and GABARAP is a membrane-curvature dependent process[J]. Autophagy, 2014, 10(8): 1470-1471. |
| [9] |
MIZUSHIMA N, YOSHIMORI T, LEVINE B. Methods in mammalian autophagy research[J]. Cell, 2010, 140(3): 313-326. |
| [10] |
李钰. 分子伴侣介导自噬[J]. 临床医药文献电子杂志, 2017, 4(A3): 20364-20365. LI Y. Molecular chaperone mediated autophagy[J]. J Clin Med Lit, 2017, 4(A3): 20364-20365. |
| [11] |
ARIAS E, CUERVO A M. Chaperone-mediated autophagy in protein quality control[J]. Curr Opin Cell Biol, 2011, 23(2): 184-189. |
| [12] |
杨雄. 兔自体动静脉瘘术后内膜增生中的自噬现象[D]. 南宁: 广西医科大学, 2019. YANG X. Autophagy in endometrial hyperplasia after auto genous arteriovenous fistula surgery in rabbits[D]. Nanning: Guangxi Medical University, 2019. |
| [13] |
孔淑君, 陈卫东. 慢性肾脏病氧化应激的研究进展[J]. 国际泌尿系统杂志, 2020, 40(4): 759-762. KONG S J, CHEN W D. Research progress of oxidative stress in chronic kidney disease[J]. Int J Urol Nephrol, 2020, 40(4): 759-762. |
| [14] |
KIHARA A, KABEYA Y, OHSUMI Y, et al. Beclin-phosphatidylinositol 3-kinase complex functions at the trans-Golgi network[J]. EMBO Rep, 2001, 2(4): 330-335. |
| [15] |
和晓莹, 秦智琦, 段琦, 等. 氧化低密度脂蛋白激活PYHIN1/Caspase 1炎症复合体信号通路增强主动脉内皮细胞黏附的机制研究[J]. 中国分子心脏病学杂志, 2021, 21(5): 4248-4252. HE X Y, QIN Z Q, DUAN Q, et al. Mechanism of oxidized low density lipoprotein promotes PYHIN1/caspase 1 inflammatory complex signaling pathway and enhances aortic endothelial cell adhesion[J]. Mol Cardiol China, 2021, 21(5): 4248-4252. |
| [16] |
ZABIRNYK O, LIU W, KHALIL S, et al. Oxidized low-density lipoproteins upregulate proline oxidase to initiate ROS-dependent autophagy[J]. Carcinogenesis, 2010, 31(3): 446-454. |
| [17] |
ZHANG Y L, CAO Y J, ZHANG X, et al. The autophagy-lysosome pathway: a novel mechanism involved in the processing of oxidized LDL in human vascular endothelial cells[J]. Biochem Biophys Res Commun, 2010, 394(2): 377-382. |
| [18] |
朱琪, 林芳. 自噬的分子标志物[J]. 药学学报, 2016, 51(1): 33-38. ZHU Q, LIN F. Molecular markers of autophagy[J]. Acta Pharm Sin, 2016, 51(1): 33-38. |
| [19] |
NAZIO F, BORDI M, CIANFANELLI V, et al. Autophagy and cancer stem cells: molecular mechanisms and therapeutic applications[J]. Cell Death Differ, 2019, 26(4): 690-702. |
| [20] |
王海杰, 谭玉珍. 细胞自噬的形态学特征和功能意义[J]. 解剖学报, 2009, 40(5): 844-849. WANG H J, TAN Y Z. Morphological features and functional implications of autophagy[J]. Acta Anat Sin, 2009, 40(5): 844-849. |
| [21] |
李彩丽, 辛英, 魏虎来, 等. 巨自噬与分子伴侣介导的自噬在饥饿诱导的Raji细胞中相继顺序被激活[J]. 中国药理学通报, 2019, 35(7): 958-961. LI C L, XIN Y, WEI H L, et al. The sequential switch from macroautophagy to chaperone-mediated autophagy in Raji cells induced by starvation[J]. Chin Pharmacol Bull, 2019, 35(7): 958-961. |
| [22] |
曾欣程. 二甲双胍诱导分子伴侣介导自噬的功能研究[D]. 杭州: 浙江大学, 2018. ZENG X C. Study of metformin induced chaperone mediated autophagy[D]. Hangzhou: Zhejiang University, 2018. |
| [23] |
孙乐平. 分子伴侣介导自噬在甲基苯丙胺诱导的α-突触核蛋白相关神经毒性中的作用[D]. 广州: 南方医科大学, 2019. SUN L P. The role of chaperone-mediated autophagy in neurotoxicity induced by alpha-synuclein after METH exposure[D]. Guangzhou: Southern Medical University, 2019. |
| [24] |
赵彬. 通过激活和抑制EPCs的CMA探讨CMA和大自噬相互关系的实验研究[D]. 苏州: 苏州大学, 2012. ZHAO B. Research interaction of CMA and macroautophagy through inhibition and activation CMA in EPCs[D]. Suzhou: Soochow University, 2012. |




