肠道菌群可通过调节机体能量获取、脂代谢、肝脏功能等影响肥胖的发生发展[1-3]。在动物实验中,BÄCKHED等[1]报道将正常小鼠的粪便移植到无菌小鼠肠道后,菌群促进了肠腔对单糖的吸收,受体小鼠的机体脂肪含量增加。在人群调查中有研究报道,益生菌能降低超重与肥胖儿童的血清TG水平、脂肪沉积水平及体质量[4];提示肠道菌群可能成为预防肥胖的新策略。然而肠道菌群结构受民族与地区的影响,韩国人群的硒粪杆菌属(faeclibacterium)丰度最高,欧美人群的拟杆菌属(bacteroides)丰度最高[5],表明不同民族与地区人群的肠道菌群差异较大。而藏汉人群的肠道菌群差异与肥胖的关系报道较少。
血液生化指标可直观体现人体健康的基本状况,而肠道菌群结构与人体代谢表型有关,LE等[6]报道肠道菌群表型特征不同的个体具有不同的代谢表型,如全身性肥胖和血脂异常,提示肠道菌群对宿主的脂代谢状态具有重要的调节作用。而藏、汉两族的生化指标、肠道菌群以及肥胖的关系未见报道,因此本研究调查了居住于高原地区的四川红原藏族(海拔3 500 m以上)与居住于平原地区(海拔500 m)的成都汉族不同BMI人群的基本信息、粪便与血液样本,对粪便与血液样本进行16S rRNA基因测序及生化指标测定,对比分析藏汉不同BMI人群肠道菌群的结构及生化指标的差异,探讨肠道菌群、生化指标、肥胖之间的联合关系,为通过调节肠道菌群、预防不同民族人群的肥胖积累资料。
1 资料与方法 1.1 研究对象与标本采集本研究基于课题组2018年5月至2019年9月开展的西南区域自然人群队列研究(the China multi-ethnic cohort,CMEC)[7],通过电子问卷获得被试者信息。根据队列标准操作程序(standard operation procedure, SOP)对被试者进行体格检查,采集成都青白江、阿坝红原地区居民粪便样本。该研究获四川大学医学伦理审查委员会审查批准(IRB编号:K2016038、K2020022)。所有被试者在数据收集前知情同意[7]。
1.2 研究人群及分组对收集到粪便样品的调查对象排除:年龄<30岁、>79岁者;自报患有精神疾患或其他相关疾病如恶性肿瘤、混合性慢性高原病、高原红细胞增多症、高原心脏病、风心病、冠心病、肺源性心脏病、糖尿病、慢性肝炎、肝硬化、风湿性关节炎、胆结石、胆囊炎、慢性支气管炎、肺气肿、消化道溃疡、胃肠炎者。
根据研究对象的身高与体质量,计算体质指数(BMI),依照中国成年人肥胖症标准[8]区分是否肥胖:BMI≥28 kg/m为肥胖人群;BMI<28 kg/m为非肥胖人群。按BMI与民族属性,将被试者分为汉族肥胖组、汉族非肥胖组、藏族肥胖组与藏族非肥胖组等4组。
1.3 16SrRNA的扩增与测序使用Omega M5635-02基因组DNA抽提试剂盒提取粪便样本DNA。使用前引物338F(5′-ACTCCTAC-GGGAGGCAGCA-3′),后引物806R(5′-GGACTACHVGGGTWTCTAAT-3′),对细菌16S rDNA基因V3-V4区进行扩增。在如下条件进行PCR扩增:98 ℃预变性30 s,98 ℃变性15 s,50 ℃退火30 s,72 ℃延伸30 s,循环25次。扩增产物纯化后由上海派森诺生物科技有限公司采用Novaseq测序仪进行双端测序。采用Biostack工作站对粪便测序数据进行过滤、匹配与聚类[9],采用RDP数据库进行物种注释。
1.4 血液生化指标测定取被试者5 mL清晨空腹静脉血,凝固后以3 000 r/min离心10 min,分离后的血清于-20 ℃保存。使用自动生化分析仪(AU5800,Beckman,America)进行指标测定,测定指标包括:丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、谷氨酰转移酶(GGT)、碱性磷酸酶(ALP)、总胆红素(TBIL)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)。
1.5 生物信息学分析基于usearch(Version 11.64-bit)将测序结果转化为可分析的OTU表,使用RStudio(Version 1.4.1106)进行生物信息学分析。利用Vegan包(Version2.5-7)构建稀释曲线、物种累积曲线以及分析α多样性[10-12]。使用ape包计算β多样性[13],使用ggplot2包(Version 3.3.4)绘制物种组成图,使用ALDEx2包(1.24.0)进行物种差异性分析[14],使用cor.test函数进行Spearman关联性分析。
1.6 统计学分析使用RStudio(Version 1.4.1106)进行统计学分析。正态分布的计量资料采用x±s表示,偏态分布的计量资料采用M(P25,P75)表示,计数资料以例表示,正态定量资料采用独立样本t检验,两组间非正态定量资料的比较采用Wilcoxon检验。在物种差异分析部分采用FDR矫正P值,检验水准为α=0.05。
2 结果 2.1 纳入研究对象的基本信息研究共获取1 825人的粪便菌群信息,经排除后为1 120人。人群按BMI分组情况如表 1所示,藏族肥胖组与非肥胖组在性别构成上具有统计学差异(P < 0.05);4组间年龄构成比均有统计学差异(P < 0.05),见表 1。
| 组别 | n | 年龄/岁 | 男性/例 | 女性/例 |
| 汉族肥胖组 | 84 | 50.84±9.88 | 48 | 36 |
| 汉族非肥胖组 | 624 | 46.76(38.89, 52.91) | 303 | 321 |
| 藏族肥胖组 | 141 | 48.05±8.57 | 83 | 58 |
| 藏族非肥胖组 | 271 | 43.15(34.91, 50.45) | 126 | 145 |
| 统计值 | H=40.529 | χ2=7.998 | ||
| P | P < 0.001 | P=0.046 | ||
2.2 藏、汉族不同BMI人群肠道菌群α多样性比较
如图 1所示,藏族人群肠道菌群的ACE、Chao1、Simpson、Shannon指数均大于汉族人群(P < 0.01),同民族肥胖与非肥胖人群4个指数比较差异无统计学意义。提示藏族人群的菌群多样性与丰富度均大于汉族人群。

|
|
a:P < 0.01 A:Simpson指数;B:Shannon指数;C:Chao1指数;D:ACE指数 图 1 藏、汉族不同BMI人群肠道菌群α多样性比较 |
2.3 藏、汉族不同BMI人群肠道菌群的β多样性比较
如图 2所示,同民族肥胖与非肥胖人群间肠道菌群的β多样性未明显分离;而藏族与汉族肥胖人群、藏族与汉族非肥胖人群之间距离较远,差异具有统计学意义(P=0.001)。提示藏族与汉族人群的肠道菌群的构成不同。
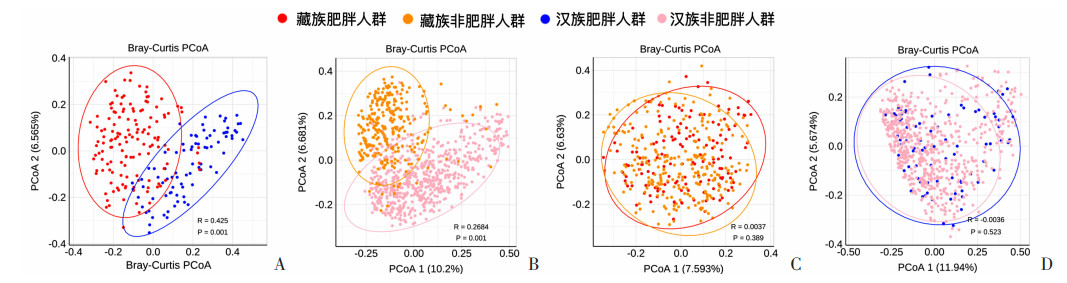
|
| A:汉族肥胖组vs.藏族肥胖组;B:汉族非肥胖组vs.藏族非肥胖组;C:藏族肥胖组vs. 藏族非肥胖组;D:汉族肥胖组vs. 汉族非肥胖组 图 2 藏、汉组不同BMI人群肠道菌群β多样性比较 |
2.4 藏、汉族不同BMI人群门水平肠道菌群物种组成分析
在门水平上,如图 3A所示,藏族人群放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)的丰度均高于汉族人群;而变形菌门(Proteobacteria)、梭杆菌门(Fusobacteria)的丰度均低于汉族人群。藏族肥胖人群的疣微菌门(Verrucomicrobia)丰度低于藏族非肥胖人群;汉族肥胖人群厚壁菌门(Firmicutes)的丰度低于汉族非肥胖人群,而梭杆菌门的丰度高于汉族非肥胖人群(P < 0.05)。

|
| A:门水平的物种组成;B:属水平的物种组成 图 3 藏、汉族不同BMI人群肠道菌群物种组成 |
2.5 藏、汉族不同BMI人群肠道菌群属水平差异
如图 4A、B所示,在不同民族相同BMI水平的组间比较中:藏族人群罗斯氏菌(roseburia)、普雷沃氏菌属(prevotella)、乳杆菌属(lactobacillus)、霍尔德曼氏菌(holdemanella)、小类杆菌属(dialister)、柯林斯氏菌属(collinsella)、clostridium_sensu_stricto、链型杆菌属(catenibacterium)、厚壁菌门某未分类属(unclassified genus of firmicutes)、梭菌目某未分类属(unclassified genus of clostridiales)、瘤胃球菌科某未分类属(unclassified genus of ruminococcaceae)与紫单胞菌科某未分类属(unclassified genus of porphyromonadaceae)的丰度高于汉族人群;而在这些菌属中,藏族肥胖人群柯林斯氏菌属的丰度高于非肥胖人群,藏族非肥胖人群的紫单胞菌科某未分类属、小类杆菌属的丰度高于肥胖人群。藏族非肥胖人群阿卡曼菌属的丰度不仅高于汉族非肥胖人群,还高于藏族肥胖人群;藏族肥胖人群毛螺菌科某未分类属的水平高于汉族肥胖人群。汉族人群肠杆菌科某未分类属(unclassified genus of enterobacteriaceae)、拟杆菌属、厌氧棒杆菌(anaerostipes)、布劳特氏菌属(blautia)、lachnospiracea_incertae_sedis、大肠杆菌属(escherichia/shigella)的丰度高于藏族人群。汉族肥胖人群吉米菌属、梭杆菌属的丰度高于藏族肥胖人群;汉族非肥胖人群链球菌属、瘤胃球菌属-2、罗姆布茨菌属、巨单胞菌属、多尔氏菌属的丰度高于藏族非肥胖人群。

|
| A:汉族肥胖组vs.藏族肥胖组;B:汉族非肥胖组vs.藏族非肥胖组;C:汉族肥胖组vs. 汉族非肥胖组;D:藏族肥胖组vs. 藏族非肥胖组 图 4 藏、汉族不同BMI人群肠道菌群差异菌属对比 |
如图 4C,D所示,在同民族不同BMI水平的组间比较中:不论是藏族还是汉族,瘤胃球菌科某未分类属均在非肥胖人群的丰度较高。在藏族人群中,链球菌属(streptococcus)、瘤胃球菌属(ruminococcus)、罗姆布茨菌(romboutsia)、多尔氏菌属(dorea)、柯林斯氏菌属和布劳特氏菌属为藏族肥胖人群的优势菌属。大肠杆菌属、拟杆菌属为藏族非肥胖人群优势菌属。
2.6 藏、汉族不同BMI人群静脉血生化指标分析如图 5所示,在同BMI不同民族人群的比较中:汉族人群TG的水平高于藏族人群(P < 0.01);汉族肥胖人群AST的水平高于藏族肥胖人群,而LDL-C的水平低于藏族肥胖人群(P < 0.01);汉族非肥胖人群ALT、ALP的水平低于藏族非肥胖人群(P < 0.01)。
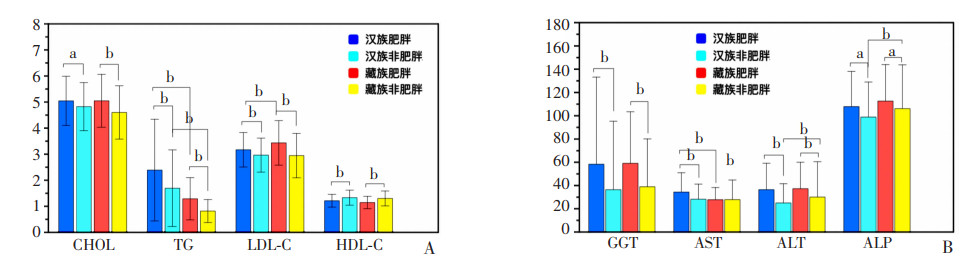
|
|
a:P < 0.05;b:P < 0.01 A:CHOL、TG、LDL-C、HDL-C的测定结果;B:GGT、AST、ALT、ALP的测定结果 图 5 藏、汉组不同BMI人群静脉血生化指标测定结果 |
在同民族不同BMI人群的比较中:两个民族的肥胖人群CHOL、TG、LDL-C、GGT、ALT、ALP的水平均高于非肥胖人群(P < 0.05),而藏汉两组肥胖人群HDL-C的水平均低于非肥胖人群(P < 0.01);AST汉族肥胖人群高于汉族非肥胖人群(P < 0.01)。
2.7 藏、汉族不同BMI人群肠道菌群、生化指标、BMI的相关性分析如图 6所示(均P < 0.05),除HDL-C与BMI呈负相关外,其余指标与BMI均呈正相关。藏族人群的柯林斯氏菌属与TG、LDL-C、GGT、ALT、AST呈正相关,与HDL-C呈负相关。阿卡曼菌属、紫单胞菌科某未分类属与AST、ALP、ALT、GGT、LDL-C、TG、CHOL呈负相关,与HDL-C呈正相关;小类杆菌属与CHOL呈负相关。链球菌属与GGT、ALP、LDL-C、TG、CHOL呈正相关,而瘤胃球菌属、拟杆菌属与这些指标呈负相关。多尔氏菌属与LDL-C、TG、CHOL、GGT、ALT呈正相关。汉族人群的吉米菌属与TG、GGT、AST呈负相关;梭杆菌属于TG、GGT呈正相关,与HDL-C呈负相关。链球菌属、罗姆布茨菌与TG、GGT、ALT、AST呈正相关;多尔氏菌属与TG呈正相关,与HDL-C呈负相关。两个人群的瘤胃球菌科某未分类属与CHOL、TG、GGT、ALT、AST呈负相关。
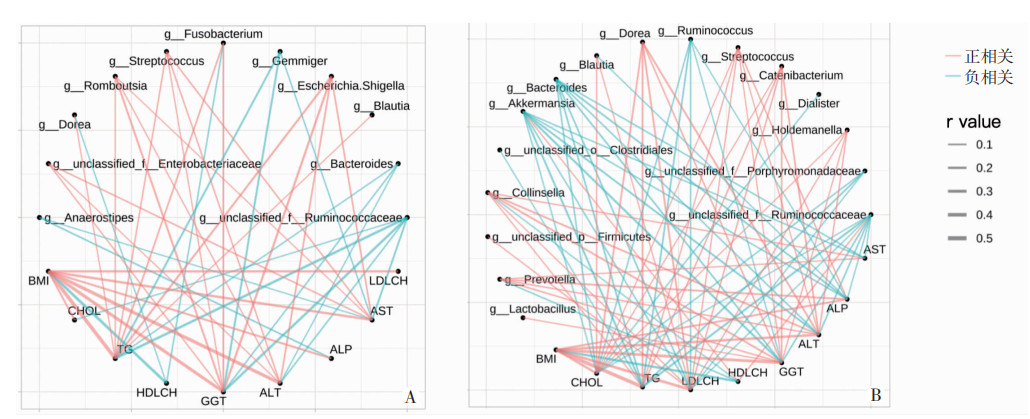
|
|
A:汉族人群;B:藏族人群 线条粗细代表|r|值的大小;图中所示相关性均P < 0.05 图 6 藏、汉族不同BMI人群肠道菌群、生化指标与BMI的相关性分析 |
3 讨论
尽管肠道菌群与肥胖的关系已有部分研究[15-16],但不同民族人群肠道菌群、生化指标的差异与肥胖的关系报道较少。因此,本研究对藏族与汉族不同体质指数人群的肠道菌群结构、生化指标进行差异性研究,并对这两种测量指标与体质指数进行了联合分析。
有研究结果表明,藏汉两族肠道菌群结构不同[17],藏族人群肠道菌群多样性与丰富度高于汉族人群[18]。本研究α多样性分析显示,藏族人群肠道菌群丰富度与多样性均高于汉族人群,β多样性分析结果提示,藏族人群与汉族人群的肠道菌群结构不同。有研究提示,汉族人群的饮食结构中碳水化合物与果蔬摄入较多[19],而藏族人群的饮食结构以肉类为主,对蔬菜和水果的摄入较少[20],藏族人群肠道菌群的物种丰富度高于汉族人群[18-19]。因此,两族人群饮食习惯的不同,可能是造成人群肠道菌群结构差异的原因之一。
在门水平上,两个民族的菌门构成不同,其中藏族肥胖人群疣微菌门的丰度低于非肥胖人群;汉族肥胖人群厚壁菌门的丰度低于汉族非肥胖人群,而梭杆菌门相对丰度高于汉族非肥胖人群(P < 0.05)。ZHANG等[21]发现肥胖人群中疣微菌门的相对丰度较低,VAZQUEZ-MORENO等[22]报道疣微菌门与儿童体质指数呈负相关,因此藏族人群中疣微菌门与肥胖的关系值得进一步探讨。
在属水平上,藏汉两族在菌群构成上具有较大差异,藏族人群共有12个菌属的丰度高于汉族人群,而汉族人群有6个菌属的丰度高于汉族人群。在藏族人群中丰度较高的柯林斯氏菌属与TG、LDL-C、GGT、ALT、AST呈正相关,与HDL-C呈负相关;这些生化指标中除HDL-C与BMI呈负相关外,其余指标与BMI呈正相关,提示柯林斯氏菌属可能导致人群肥胖。LAHTI等[23]发现该菌属与HDL-C呈负相关,与TG呈正相关,而有研究表明该属可增加肠道通透性、减少上皮细胞紧密连接蛋白的表达、增加IL-17的表达[24]。当肠道通透性增加,细菌和内毒素可从肠腔渗漏至肠系膜淋巴结和门静脉循环系统,进而刺激腹膜、肠道和肝脏巨噬细胞释放大量细胞因子,引发机体胰岛素抵抗[25]。因此柯林斯氏菌属可能通过调节机体胰岛素抵抗水平影响肥胖的发生与发展,其有关机制有待进一步探讨。本研究还发现,藏族人群中丰度较高的小类杆菌属与CHOL呈负相关,阿卡曼菌属、紫单胞菌科某未分类属与AST、ALP、ALT、GGT、LDL-C、TG、CHOL呈负相关,与HDL-C呈正相关,而除HDL-C外,其余指标均与BMI呈正相关。因此,在藏族人群中丰度较高的小类杆菌属、阿卡曼菌属和紫单胞菌科某未分类属可能使人群BMI降低。有研究提示,小类杆菌属与阿卡曼菌属在体质量正常人群中的水平较高[26],小类杆菌属的丰度与人体胰岛素水平呈正相关[27],阿卡曼菌属与人群肥胖发生的风险呈负相关[28],与本研究结果相符,所以这3个菌属对肥胖可能具有缓解作用。
有研究表明,梭杆菌属具有促炎作用,与肠道炎症密切相关[29],而CROVESY等与GAO等[30-31]发现该杆菌属在肥胖人群中的丰度较高。在本研究中,汉族人群的梭杆菌属丰度较高,并与TG、GGT呈正相关,与HDL-C呈负相关。提示梭菌杆属可能通过改变肠道炎症水平影响人群肥胖的发生与发展。
综上,本研究发现藏汉不同BMI人群的肠道菌群、生化指标具有差异,在门水平和属水平上发现了一些可能与不同民族人群肥胖有关的菌门和菌属。其中,柯林斯氏菌属与藏族人群肥胖有关,小类杆菌属、阿卡曼菌属、紫单胞菌科某未分类属可能使藏族人群体质指数降低;梭杆菌属可能与汉族人群肥胖有关。本研究对通过肠道菌群预防不同民族人群肥胖的后续研究提供了重要参考资料。然而,西南地区藏汉人群的数量庞大,由于本研究的采样点数较少可能使研究结论的推广性偏低。因此,在后续研究中可考虑采用增大样本量、多点采样等方式进一步增加样本的代表性,使研究结论更有普适性。
| [1] |
BÄCKHED F, DING H, WANG T, et al. The gut microbiota as an environmental factor that regulates fat storage[J]. Proc Natl Acad Sci USA, 2004, 101(44): 15718-15723. |
| [2] |
CAESAR R, FÅK F, BÄCKHED F. Effects of gut microbiota on obesity and atherosclerosis via modulation of inflammation and lipid metabolism[J]. J Intern Med, 2010, 268(4): 320-328. |
| [3] |
BOULANGÉ C L, NEVES A L, CHILLOUX J, et al. Impact of the gut microbiota on inflammation, obesity, and metabolic disease[J]. Genome Med, 2016, 8(1): 42. |
| [4] |
NICOLUCCI A C, HUME M P, MARTÍNEZ I, et al. Prebiotics reduce body fat and alter intestinal microbiota in children who are overweight or with obesity[J]. Gastroenterology, 2017, 153(3): 711-722. |
| [5] |
LIU W J, ZHANG J C, WU C Y, et al. Unique features of ethnic Mongolian gut microbiome revealed by metagenomic analysis[J]. Sci Rep, 2016, 6: 34826. |
| [6] |
LE CHATELIER E, NIELSEN T, QIN JJ, et al. Richness of human gut microbiome correlates with metabolic markers[J]. Nature, 2013, 500(7464): 541-546. |
| [7] |
ZHAO X, HONG F, YIN J Z, et al. Cohort profile: the China multi-ethnic cohort (CMEC)study[J]. Int J Epidemiol, 2021, 50(3): 721-721l. |
| [8] |
中华人民共和国卫生部疾病控制司. 中国成人超重和肥胖症预防控制指南[M]. 北京: 人民卫生出版社, 2006. Department of Disease Control, Ministry of Health of P. R, China. Guidelines for prevention and control of overweight and obesity in Chinese adults[M]. Beijing: People's Medical Publishing House, 2006. |
| [9] |
WEI Y J, REN T Q, ZHANG L. Dix-seq: an integrated pipeline for fast amplicon data analysis[J]. bioRxiv, 2020. |
| [10] |
SIMPSON G, SOLYMOS P, STEVENS M, et al. Vegan: community ecologypackage[J]. Time International, 2010. |
| [11] |
DONG K, WU K P, ZHENG T L, et al. Comparative study of oral bacteria and fungimicrobiota in Tibetan and Chinese Han living at different altitude[J]. Tohoku J Exp Med, 2021, 254(2): 129-139. |
| [12] |
ZUO H J, FU M R, ZHAO H L, et al. Study on the salivary microbial alteration of men with head and neck cancer and its relationship with symptoms in southwest China[J]. Front Cell Infect Microbiol, 2020, 10: 514943. |
| [13] |
PARADIS E, CLAUDE J, STRIMMER K. APE: analyses of phylogenetics and evolution in R language[J]. Bioinformatics, 2004, 20(2): 289-290. |
| [14] |
FERNANDES A D, MACKLAIM J M, LINN T G, et al. ANOVA-like differential expression (ALDEx) analysis for mixed population RNA-Seq[J]. PLoS One, 2013, 8(7): e67019. |
| [15] |
GOMES A C, HOFFMANN C, MOTA J F. The human gutmicrobiota: metabolism and perspective in obesity[J]. Gut Microbes, 2018, 9(4): 308-325. |
| [16] |
GÉRARD P. Gut microbiota and obesity[J]. Cell Mol Life Sci, 2016, 73(1): 147-162. |
| [17] |
LI K, DAN Z, GESANG L B, et al. Comparative analysis of gut microbiota of native Tibetan and Han populations living at different altitudes[J]. PLoS One, 2016, 11(5): e0155863. |
| [18] |
武雅婷, 肖颖, 范紫玮, 等. 藏汉不同骨密度人群肠道菌群及粪便短链脂肪酸差异研究[J]. 现代预防医学, 2021, 48(22): 9. WU Y T, XIAO Y, FAN Z W, et al. Differences of intestinal microflora and fecal short-chain fatty acids between Tibetan and Han populations with different bone densities[J]. Modern Preventive Med, 2021, 48(22): 9. |
| [19] |
刘怡萱, 曹鹏熙, 马红梅, 等. 健康藏族与汉族大学生肠道细菌多样性研究[J]. 微生物学报, 2019, 59(9): 11. LIU Y X, CAO P X, MA H M, et al. Diversity of intestinal bacteria in healthy Tibetan and Han college students[J]. Acta Microbiologica Sinica, 2019, 59(9): 11. |
| [20] |
梁田, 马利锋, 张致英, 等. 海拔高度与藏族人群肠道菌群的宏基因组学关联分析[J]. 天津师范大学学报: 自然科学版, 2021. DOI: 0.19638/j.issn1671-1114.20210207. LIANG T, MA L F, ZHANG Z Y, et al. Metagenomic association analysis between altitude and intestinal microflora in Tibetan population[J]. J Tianjin Normal Univ: Natural Sci, 2021. DOI: 0.19638/j.issn1671-1114.20210207. |
| [21] |
ZHANG H S, DIBAISE J K, ZUCCOLO A, et al. Human gut microbiota in obesity and after gastric bypass[J]. Proc Natl Acad Sci USA, 2009, 106(7): 2365-2370. |
| [22] |
VAZQUEZ-MORENO M, PEREZ-HERRERA A, LOCIA-MORALES D, et al. Association of gut microbiome with fasting triglycerides, fasting insulin and obesity status in Mexican children[J]. Pediatr Obes, 2021, 16(5): e12748. |
| [23] |
LAHTI L, SALONEN A, KEKKONEN R A, et al. Associations between the human intestinalmicrobiota, Lactobacillus rhamnosus GG and serum lipids indicated by integrated analysis of high-throughput profiling data[J]. PeerJ, 2013, 1: e32. |
| [24] |
CHEN J, WRIGHT K, DAVIS J M, et al. An expansion of rare lineage intestinal microbes characterizes rheumatoidarthritis[J]. Genome Med, 2016, 8(1): 43. |
| [25] |
DERRIEN M, ADAWI D, AHRNÉ S, et al. The intestinal mucosa as a habitat of the gut microbiota and a rational target for probiotic functionality and safety[J]. Microb Ecol Heal Dis, 2004, 16(2/3): 137-144. |
| [26] |
DE LA CUESTA-ZULUAGA J, CORRALES-AGUDELO V, CARMONA J A, et al. Body size phenotypes comprehensively assess cardiometabolic risk and refine the association between obesity and gut microbiota[J]. Int J Obes (Lond), 2018, 42(3): 424-432. |
| [27] |
NADERPOOR N, MOUSA A Y, GOMEZ-ARANGO L F, et al. Faecal microbiota are related to insulin sensitivity and secretion in overweight or obese adults[J]. J Clin Med, 2019, 8(4): 452. |
| [28] |
ZHOU Q, ZHANG Y F, WANG X X, et al. Gut bacteria Akkermansia is associated with reduced risk of obesity: evidence from the American Gut Project[J]. Nutr Metab (Lond), 2020, 17: 90. |
| [29] |
BASHIR A, MISKEEN A Y, HAZARI Y M, et al. Fusobacterium nucleatum, inflammation, and immunity: the fire within human gut[J]. Tumour Biol, 2016, 37(3): 2805-2810. |
| [30] |
CROVESY L, MASTERSON D, ROSADO E L. Profile of the gut microbiota of adults with obesity: a systematic review[J]. Eur J Clin Nutr, 2020, 74(9): 1251-1262. |
| [31] |
GAO X F, ZHANG M R, XUE J M, et al. Body mass index differences in the gut microbiota are gender specific[J]. Front Microbiol, 2018, 9: 1250. |




