2. 400038 重庆,陆军军医大学(第三军医大学)药学与检验医学系: 分析化学教研室;
3. 154007 黑龙江 佳木斯,佳木斯大学临床医学院
2. Department of Analytical Chemistry, Faculty of Pharmacy and Medical Laboratory, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. Clinical School of Medicine, Jiamusi University, Jiamusi, Heilongjiang Province, 154007, China
金黄色葡萄球菌是一种可以导致皮肤或软组织感染、心内膜炎、肺炎、慢性骨髓炎和菌血症的革兰阳性球菌[1]。耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus, MRSA)是最为常见的耐药株系,于1961年在英国首次报告[2],并不断发展出对氨基糖苷类、大环内酯类、氯霉素、磺胺类、链霉素和四环素等经典抗生素以及万古霉素、利奈唑胺等常用一、二线抗生素的多重耐药性(multi-drug resistance, MDR)[3-7],导致MRSA感染的药物治疗受到严峻挑战。除了抗生素耐药之外,细菌生物膜作为一种具有复杂3D结构的胞外聚合物,进一步阻碍了抗生素的治疗[8]。生物膜是指细菌黏附于接触表面后,为适应生存环境,自身分泌多糖基质、脂质蛋白、纤维蛋白等并将其自身包裹而产生的细菌聚集膜样物[9]。形成完整细菌生物膜的细菌能抵抗宿主免疫系统的清除,对抗生素的敏感性也远远低于同种的浮游菌,使其耐药性相对于浮游菌提高10~1 000倍[10]。目前研究发现:80%以上的人类细菌感染疾病都与细菌生物膜的形成有关[11]。
大黄素(emodin),化学名为1, 3, 8-三羟基-6甲基蒽醌(1, 3, 8-trihydroxy-6-methyl-anthraquinone),属于羟基蒽醌类化合物,主要提取自中药大黄的根茎,也存在于芦荟、虎杖等蓼科药用植物中[12]。大黄素具有抗菌、抗病毒、抗肿瘤、抗炎、保肝、心血管保护、免疫调节、皮肤调理及泻下等多种药理作用[13]。临床上可用于改善人体胃肠功能、辅助治疗急性胰腺炎、治疗肝胆湿热等[14]。大黄素具有广谱抑菌作用,对厌氧菌有很强的抑制作用,能显著抑制金黄色葡萄球菌的生长,且不易产生耐药[15]。虽然已有少量研究表明大黄素可以抑制金黄色葡萄球菌生物膜的形成[16],但大黄素对MRSA生物膜的抑制作用目前还未被系统考察过,其作用机制也不明确。我们在前期研究中初步观察到大黄素对MRSA生物膜也具有抑制作用,本研究系统评价大黄素对MRSA生物膜形态的影响,并初步探究其抑制生物膜形成的机制,为新型抗生物膜化合物研发提供思路。
1 材料与方法 1.1 材料MHB培养基(索莱宝),氯化钠(索莱宝),琼脂粉(BBI),DMSO(Sigma Aldrich), 大黄素(纯度≥98%)购于上海诗丹德生物技术有限公司,细菌死活检测试剂盒(L7012 live/dead Baclight Bacterial Viability Kit, invitrogen), 无核酶TE buffer(天恩泽),细菌总RNA提取试剂盒(天根),DEPC水(碧云天),溶菌酶(索莱宝),溶葡球菌素(Sigma Aldrich),β-巯基乙醇(罗恩试剂),无水乙醇(川东化工),冰醋酸(川东化工),PrimeScript RT reagent kit(RR037A, Takara), SYBR Green Realtime PCR Master Mix(TOYOBO)。MRSA 252标准株购于美国ATCC(编号Taxon identifier282458),MRSA临床分离株(北京BJ005、广州GZ024、济南JN075、昆明KM033、重庆SA077)由陆军军医大学药学与检验医学系微生物与生化药学教研室提供。所有引物由武汉金开瑞生物工程有限公司合成。所用仪器由陆军军医大学药学与检验医学系微生物与生化药学教研室及中心实验室提供。
1.2 方法 1.2.1 培养基配制取24 g MHB培养基粉末和20 g NaCl粉末加入1 L超纯水中,混合均匀后121 ℃、20 min高压灭菌制得液体培养基,密封4 ℃保存备用。取24 g MHB培养基粉末、20 g NaCl粉末和15 g琼脂粉末加入1 L超纯水中,混合均匀后121 ℃、20 min高压灭菌,趁热在超净台倒入细菌培养皿中制得固体培养基,冷却凝固后密封4 ℃保存备用。
1.2.2 细菌培养取保种菌液,三线法画于2% NaCl MHB固体培养基上,置于37 ℃培养箱中培养24 h,放入4 ℃冰箱保存备用。使用时取出平板挑取单菌落,接种于2% NaCl MHB培养基中,37 ℃、220 r/min振摇培养,过夜,吸取过夜菌液1 ∶100接种于2% NaCl MHB培养基中,37 ℃、220 r/min振摇培养6 h进行二次活化。
1.2.3 最低抑菌浓度(minimum inhibitory concentration,MIC)及最低杀菌浓度(minimum bactericidal concen-tration,MBC)测定D(600)[D(600)=1时,浓度为2.3×109 CFU/mL],调节菌液浓度为1×105 CFU/mL,采用微量肉汤稀释法测定MIC,静置培养24 h,读取MIC,以最后1个澄清孔药物浓度作为MIC。取所有澄清孔菌液涂板,再置于37 ℃培育箱培育24 h后,以细菌未生长的药物浓度作为MBC。
1.2.4 抑菌曲线取二次活化后菌液,1 ∶100接入空白培养基及两组含药培养基中(0.25×MIC和0.50×MIC),24 h内每隔2 h测定1次D(600),以时间为横坐标,D(600)值为纵坐标作图。
1.2.5 结晶紫染色法取二次活化后菌液,调节其浓度为1×107 CFU/mL,加入不同体积大黄素DMSO溶液得到处理后菌液(药物浓度为0.125×MIC、0.25×MIC、0.50×MIC), 放入37 ℃培养箱静置培养20 h,吸出菌液,用超纯水清洗96孔板各孔2次,自然风干4 h;各孔分别加入150 μL 0.1%结晶紫染色30 min;吸出结晶紫,用生理盐水彻底清洗至溶液无色(2~3次),吸出残水,过夜风干;各孔分别加入200 μL 33%醋酸,静置溶解,于酶标仪上振荡混匀,590 nm波长测定D(590)值。
1.2.6 激光共聚焦染色取二次活化后的菌液,调节其浓度为107CFU/mL,设置3组2副孔,分别移取2 mL、1 999.376 μL、1 998.75 μL稀释菌液(1.0×107 CFU/mL)于第1、2、3组玻底皿中;第1组作为空白对照组(Control),第2、3组分别加入3.2 mg/mL大黄素溶液0.625、1.25 μL,得到1、2 μg/mL大黄素(0.25×MIC、0.50×MIC)处理液。将玻底皿置于37 ℃恒温箱孵育48 h。而后吸出菌液,缓慢加入2 mL生理盐水清洗玻底皿,重复清洗2遍,吸干水分,按说明书使用L-7012 Live/Dead BacLight Bacterial Viability Kit试剂盒中PI和SYTO9两种荧光染液避光染色10 min;吸出荧光染液,缓慢加入1 mL生理盐水清洗玻底皿,重复清洗2遍,吸干水分;用锡箔纸包裹玻底皿以避光转移。激光共聚焦扫描显微镜观察:将上述标本分别置于40倍激光共聚焦扫描显微镜下观察。其中活菌为绿色,死菌为红色。
1.2.7 扫描电镜将爬片放入24孔板,细菌培养及给药处理同激光共聚焦,培养48 h吸出菌液,缓慢加入1 mL生理盐水清洗24孔板,重复清洗2遍,吸干水分;每孔加入1 mL 2.5%戊二醛固定样本,4 ℃过夜保存。随后吸尽戊二醛,0.9%生理盐水清洗2次,5 min/次;乙醇低浓度至高浓度(50%、70%、80%、90%)脱水各1次,100%乙醇脱水2次,7 min/次;叔丁醇低浓度至高浓度(50%、70%、90%、95%)置换各1次,100%叔丁醇置换2次,7 min/次。将上述处理后的聚苯乙烯塑料片粘至样品托上,CO2冷冻干燥5 h,载体表面在真空条件下喷金后扫描电镜观察。
1.2.8 实时荧光定量PCR检测取二次活化后菌液稀释至为1.0×107 CFU/mL,分别移取10 mL稀释菌液于15 mL EP管中,第1管作为空白对照组(Control),第2、3管分别为0.25×MIC、0.50×MIC大黄素处理液,220 r/min,37 ℃振荡培养6 h。根据天根细菌总RNA提取试剂盒说明书提取RNA,PrimeScript RT reagent kit(TaKaRa)说明书反转录为cDNA,最后根据SYBR Green Real-time PCR Master Mix试剂盒说明书加入相引物对其基因相对表达水平进行测定,引物类型及序列如表 1所示。
| 基因 | 引物序列 | 编号 | 退火温度/℃ | 扩增长度/bp |
| icaA | 5′-GAGGTAAAGCCAACGCACTC-3′ 5′-CCTGTAACCGCACCAAGTTT-3′ |
AF086783 | 60 | 151 |
| icaD | 5′-ACCCAACGCTAAAATCATCG-3′ 5′-GCGAAAATGCCCATAGTTTC-3′ |
AF086783 | 60 | 211 |
| icaB | 5′-ATACCGGCGACTGGGTTTAT-3′ 5′-TTGCAAATCGTGGGTATGTGT-3′ |
AF086783 | 60 | 140 |
| icaC | 5′-CTTGGGTATTTGCACGCATT-3′ 5′-GCAATATCATGCCGACACCT-3′ |
AF086783 | 60 | 209 |
| 16S rRNA | 5′-GGGACCCGCACAAGCGGTGG-3′ 5′-GGGTTGCGCTCGTTGCGGGA-3′ |
L37597.1 | 60 | 191 |
1.3 统计学分析
计量资料数据以x±s表示,采用GraphPad Prism 9.0作图,SPSS 16.0统计软件进行数据分析,两组比较采用独立样本t检验,P<0.05认为差异有统计学意义。
2 结果 2.1 大黄素对MRSA的体外抑菌作用采用微量肉汤稀释法,检测得大黄素对MRSA252标准株的MIC为4 μg/mL,MBC为8 μg/mL;来源于北京、广州、济南、昆明及重庆等地区的5个MRSA临床株的MIC范围为2~8 μg/mL,MBC范围为4~16 μg/mL(表 2)。结果表明:大黄素对包括青霉素高耐药临床株在内的MRSA菌株具有显著抑制作用。
| 株系 | 地区 | MIC青霉素 | MIC大黄素 | MBC大黄素 |
| MRSA252 | 512 | 4 | 8 | |
| BJ005 | 北京 | 128 | 4 | 16 |
| GZ024 | 广州 | 32 | 8 | 16 |
| JN075 | 济南 | 512 | 2 | 4 |
| KM033 | 昆明 | 1 024 | 8 | 16 |
| SA077 | 重庆 | 1 024 | 4 | 8 |
动态抑菌曲线显示(图 1):6~24 h增长速度趋于平缓;1 μg/mL(0.25×MIC)大黄素处理组MRSA生长曲线各时间点D(600)值均低于对照组,提示细菌生长被抑制,2 μg/mL(0.50×MIC)大黄素处理组MRSA生长速度被进一步抑制。结果表明:大黄素可持续抑制MRSA生长,并呈剂量依赖关系。
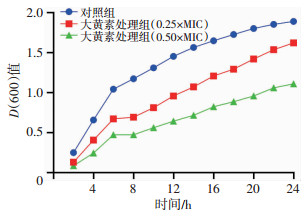
|
| 图 1 紫外分光光度法测定MRSA252生长曲线 |
2.2 大黄素对MRSA生物膜的体外抑制活性
通过结晶紫染色测定不同浓度大黄素对MRSA生物膜的体外抑制活性。如图 2所示:培养24 h后,0.25×MIC大黄素处理组结晶紫处理后D(590)值明显低于对照组(P<0.05),0.50×MIC大黄素处理组数据也明显低于对照组(P<0.05),表明大黄素对MRSA生物膜具有显著抑制作用且呈现剂量依赖关系。计算抑制率发现:0.25×MIC和0.50×MIC浓度下大黄素对生物膜的平均抑制率分别为27.12%和42.50%。
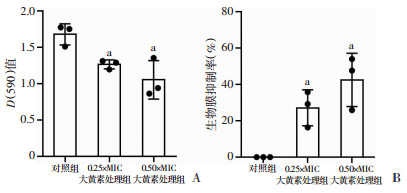
|
|
a:P<0.05,与对照组比较 A:结晶紫染色后各组D(590)值;B:各组生物膜抑制率 图 2 结晶紫染色测定不同浓度大黄素对MRSA生物膜的体外抑制活性(n=3) |
2.3 大黄素对MRSA生物膜结构的影响
扫描电镜观察大黄素对MRSA生物膜结构的影响,结果如图 3所示:对照组有明显的生物膜形成,生物膜结构致密,大量细菌成聚集状态,且被膜状聚合物包埋;0.25×MIC大黄素处理组生物膜被破坏,细菌分散,少数聚集成团块状,无膜状物包裹。随着给药浓度增加,0.50×MIC组生物膜被进一步破坏,细菌密度极低,成分散状排布。

|
| 图 3 扫描电镜观察大黄素对MRSA生物膜结构的影响 |
2.4 大黄素对MRSA生物膜内细菌活力的影响
激光共聚焦显微镜进一步观察大黄素对MRSA生物膜形态以及膜内细菌存活的影响,结果如图 4A所示:与对照组相比,大黄素处理组生物膜结构疏松弥散且厚度降低,细菌密度明显低于对照组;根据不同颜色荧光强度推算得知:0.25×MIC和0.50×MIC浓度下大黄素处理组生物膜内包埋的死细菌平均比例分别为52.41%和82.98%,均高于对照组(31.67%),0.50 MIC组表现出明显差异(P<0.05,图 4B)。
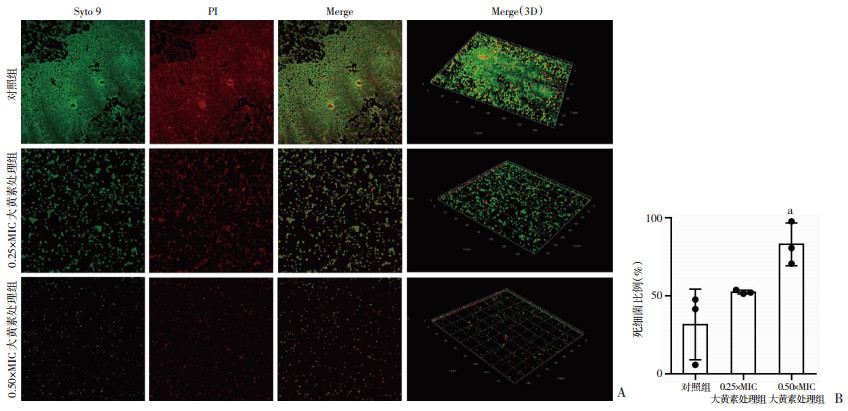
|
| A:激光共聚焦显微镜观察(×40) 绿色为活菌,红色为死菌;B:各组死菌所占比例 a: P<0.05,与对照组比较 图 4 激光共聚焦显微镜观察大黄素对MRSA生物膜内细菌活力的影响(n=3) |
2.5 大黄素可能通过下调ica系列基因表达来抑制生物膜形成
为了探究大黄素抑制MRSA生物膜形成的机制,采用RT-qPCR检测大黄素对细菌icaA、icaB、icaC、icaD 4个与生物膜形成相关基因表达的影响,如图 5所示:相对于对照组,大黄素处理组4个基因表达量均明显下降(P<0.05),且表现出剂量依赖性,提示大黄素对体外生物膜形成的抑制作用可能与下调ica系列操纵子基因相关。
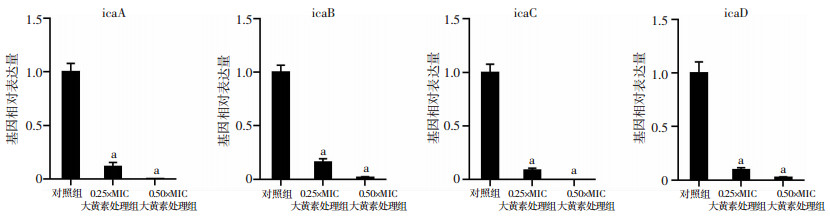
|
| a: P<0.05,与对照组比较 图 5 RT-qPCR检测大黄素对细菌ica系列基因表达的影响(n=3) |
3 讨论
由于MRSA感染在全球范围内的高发病率和病死率,2017年它已被列为世界卫生组织(WHO)发布的高度优先的多药耐药(MDR)病原体[17],在我国2021年上半年细菌耐药监测网报告中,MRSA检出率也高达30.3%[18]。在现有抗生素治疗陆续出现耐药菌株的情况下,生物膜的出现使得细菌能够有效躲避自体免疫系统和药物,增强了细菌黏附和毒力因子,严重阻碍了治疗[8],开发新型抗MRSA药物迫在眉睫。大黄素作为天然药效成分,具有较好的安全性,且已被证明不易诱导金黄色葡萄球菌产生耐药性[19],具有作为抗MRSA候选药效物质进一步研究的价值。
生物膜形态的改变,主要是表现在其结构变得疏松、膜厚度降低等方面[20]。本研究通过扫描电镜观测到:用大黄素处理后MRSA生物膜结构变得疏松、破碎,且随着给药浓度增加,结构破碎更为彻底,菌体更为分散。生物膜的破坏通常会导致膜通透性增加、膜内细菌死亡和死菌比例增高[21]。本研究扫描电镜结果也表明:经过大黄素处理后MRSA生物膜结构变得疏松,生物膜厚度降低,且生物膜内的活菌比例显著下降,证明大黄素在体外对于MRSA生物膜有较为显著的抑制作用并呈现浓度依赖性。
MRSA的生物膜的产生受一个复杂的信号网络调控,该网络作用于激活或抑制生物膜相关成分的表达。Agr调控系统、SarA蛋白家族、转录因子σB、信号转导系统LuxS/Al-2等调控因子参与了生物膜群体感应系统(quorumsensing,QS)、毒力因子分泌、生物膜分散解离等环节[22-27],atlE、bap、sasG、ica等基因则调控了表面附着、细胞积累等环节[20]。在对其可能存在的机制进行研究时,本研究重点考察了在生物膜调控中比较重要的调控元件之一——ica操纵子。ica操纵子基因包括icaA、icaB、icaC、icaD 4个功能基因和1个调节基因icaR,主要通过下调葡糖胺转氨酶诱导产生的多糖细胞间黏附素(PIA)合成来抑制生物膜的形成,当其功能基因表达上调时,PIA作为生物膜基质中的主要多糖成分,合成量增加,促进生物膜形成[28]。实时荧光定量PCR检测结果显示:ica系列相关调控基因相对表达水平都表现出了下调趋势,随着给药浓度升高,下调趋势更为明显,也呈现出浓度依赖性,初步推断大黄素对生物膜的抑制作用可能是通过下调ica系列基因表达,抑制PIA合成来实现的。
在今后的研究中,我们计划建立动物实验模型验证大黄素的体内安全性和有效性,通过急性毒性实验及血液生化指标测定并评估其安全性,通过建立局部皮肤感染模型及全身感染致死/亚致死模型评价其体内有效性;对其调控机制进一步研究,探究其是否可能存在其他作用靶点,并阐明其具体作用机制。
| [1] |
MCGUINNESS W A, MALACHOWA N, DELEO F R. Vancomycin resistance in Staphylococcus aureus[J]. Yale J Biol Med, 2017, 90(2): 269-281. |
| [2] |
CHAMBERS H F. Methicillin-resistant staphylococci[J]. Clin Microbiol Rev, 1988, 1(2): 173-186. |
| [3] |
SCHITO G C. The importance of the development of antibiotic resistance in Staphylococcus aureus[J]. Clin Microbiol Infect, 2006, 12(Suppl 1): 3-8. |
| [4] |
SCHAEFLER S, JONES D, PERRY W, et al. Emergence of gentamicin- and methicillin-resistant Staphylococcus aureus strains in New York City hospitals[J]. J Clin Microbiol, 1981, 13(4): 754-759. |
| [5] |
HAN L L, MCDOUGAL L K, GORWITZ R J, et al. High frequencies of clindamycin and tetracycline resistance in methicillin-resistant Staphylococcus aureus pulsed-field type USA300 isolates collected at a Boston ambulatory health center[J]. J Clin Microbiol, 2007, 45(4): 1350-1352. |
| [6] |
Controlprevention C F D. Staphylococcus aureus resistant to vancomycin—United States, 2002[J]. MMWR Morb Mortal Week Rep, 2002, 51(26): 565-567. |
| [7] |
KALI A. Antibiotics and bioactive natural products in treatment of methicillin resistant Staphylococcus aureus: a brief review[J]. Pharmacogn Rev, 2015, 9(17): 29-34. |
| [8] |
BRIDIER A, BRIANDET R, THOMAS V, et al. Resistance of bacterial biofilms to disinfectants: a review[J]. Biofouling, 2011, 27(9): 1017-1032. |
| [9] |
PERCIVAL S, KNOTTENBELT D, COCHRANE C. Biofilms and veterinary medicine[M]. Berlin: Springer Berlin Heidelberg, 2011.
|
| [10] |
EHRLICH G D, AHMED A, EARL J, et al. The distributed genome hypothesis as a rubric for understanding evolution in situ during chronic bacterial biofilm infectious processes[J]. FEMS Immunol Med Microbiol, 2010, 59(3): 269-279. |
| [11] |
邓曌曦, 音建华, 汪海峰. 乳酸菌群体感应与其肠道生物膜形成的研究进展[J]. 微生物学报, 2018, 58(11): 1970-1978. DENG Z X, YIN J H, WANG H F. Progress in research on quorum sensing and intestinal biofilm formation of Lactobacillus[J]. Acta Microbiol Sin, 2018, 58(11): 1970-1978. |
| [12] |
TIAN K, ZHANG H G, CHEN X G, et al. Determination of five anthraquinones in medicinal plants by capillary zone electrophoresis with β-cyclodextrin addition[J]. J Chromatogr A, 2006, 1123(1): 134-137. |
| [13] |
李牧, 杜智敏. 芦荟大黄素的药理作用研究进展[J]. 中国临床药理学杂志, 2015, 31(9): 765-768. LI M, DU Z M. Research progress on pharmacological effects of aloe-emodin[J]. Chin J Clin Pharmacol, 2015, 31(9): 765-768. |
| [14] |
陈艳琰, 唐于平, 陈嘉倩, 等. 大黄资源化学研究进展与利用策略[J]. 中草药, 2018, 49(21): 5170-5178. CHEN Y Y, TANG Y P, CHEN J Q, et al. Research progress and utilization strategy on resource chemistry of Rhei Radix et Rhizoma[J]. Chin Tradit Herb Drugs, 2018, 49(21): 5170-5178. |
| [15] |
刘静, 王丽. 大黄素的研究进展[J]. 中国药房, 2014, 25(35): 3351-3354. LIU J, WANG L. Research progress on emodin[J]. China Pharmacy, 2014, 25(35): 3351-3354. |
| [16] |
YAN X, GU S S, SHI Y J, et al. The effect of emodin on Staphylococcus aureus strains in planktonic form and biofilm formation in vitro[J]. Arch Microbiol, 2017, 199(9): 1267-1275. |
| [17] |
CASCIOFERRO S, CARBONE D, PARRINO B, et al. Therapeutic strategies to counteract antibiotic resistance in MRSA biofilm-associated infections[J]. ChemMedChem, 2021, 16(1): 65-80. |
| [18] |
CHINET中国细菌耐药监测网. "CHINET中国细菌耐药监测网年度报告"2021(上)[R/OL]. (2021-08-12)[2021-12-04]. http://www.chinets.com/Content/File/CHINET中国细菌耐药监测网年度报告(2021上).pdf.
|
| [19] |
LIU M, PENG W, QIN R X, et al. The direct anti-MRSA effect of emodin via damaging cell membrane[J]. Appl Microbiol Biotechnol, 2015, 99(18): 7699-7709. |
| [20] |
YANG Y, LI H B, SUN H W, et al. A novel nitro-dexamethasone inhibits agr system activity and improves therapeutic effects in MRSA sepsis models without antibiotics[J]. Sci Rep, 2016, 6: 20307. |
| [21] |
PARAI D, BANERJEE M, DEY P, et al. Reserpine attenuates biofilm formation and virulence of Staphylococcus aureus[J]. Microb Pathog, 2020, 138: 103790. |
| [22] |
MOOTZ J M, MALONE C L, SHAW L N, et al. Staphopains modulate Staphylococcus aureus biofilm integrity[J]. Infect Immun, 2013, 81(9): 3227-3238. |
| [23] |
BALAMURUGAN P, PRAVEEN KRISHNA V, BHARATH D, et al. Staphylococcus aureus quorum regulator SarA targeted compound, 2-[(methylamino)methyl]phenol inhibits biofilm and down-regulates virulence genes[J]. Front Microbiol, 2017, 8: 1290. |
| [24] |
BISCHOFF M, ENTENZA J M, GIACHINO P. Influence of a functional sigB operon on the global regulators sar and agr in Staphylococcus aureus[J]. J Bacteriol, 2001, 183(17): 5171-5179. |
| [25] |
SLATER R T, FROST L R, JOSSI S E, et al. Clostridioides difficile LuxS mediates inter-bacterial interactions within biofilms[J]. Sci Rep, 2019, 9(1): 9903. |
| [26] |
LE K Y, OTTO M. Quorum-sensing regulation in staphylococci-an overview[J]. Front Microbiol, 2015, 6: 1174. |
| [27] |
TURKEY A M, BARZANI K K, SULEIMAN A A J, et al. Molecular assessment of accessory gene regulator (agr) quorum sensing system in biofilm forming Staphylococcus aureus and study of the effect of silver nanoparticles on agr system[J]. Iran J Microbiol, 2018, 10(1): 14-21. |
| [28] |
MOORMEIER D E, BAYLES K W. Staphylococcus aureus biofilm: a complex developmental organism[J]. Mol Microbiol, 2017, 104(3): 365-376. |




