在哺乳动物骨骼系统中,骨是蛋白质和矿物质的复合组织,通过调节钙和磷的代谢,经历不断的重塑以及修复损伤。骨骼的完整性通过精细协调骨形成和骨吸收来维持,这一骨重塑过程由破骨细胞(osteoclasts,OCs)和成骨细胞的“交流”来调控完成[1]。破骨细胞是由单核细胞/巨噬细胞来源的前体细胞融合形成的大型多核骨吸收细胞,且是唯一明确可降解骨的细胞,是包括骨质疏松症在内的骨/关节疾病的始作俑者[2]。至此,破骨细胞作为“噬骨者(bone eaters)”被聚焦于探讨其在骨稳态和疾病中的角色。然而,越来越多的证据表明,破骨细胞除了“噬骨者”的角色外,还有一些更复杂的身份。破骨细胞与成骨细胞、造血和免疫系统细胞,甚至与肿瘤细胞之间密切联系,共同参与骨微环境稳态的调控机制[3-4]。随着单细胞标记和检测技术的快速发展及其在骨领域中的广泛应用,新的破骨细胞亚型概念及其新的功能不断得到鉴定和解析。
本述评结合文献与本研究团队近期工作,阐述对破骨细胞功能的新认识。“破而后立”——含意两层:第一,我们强调破骨细胞骨吸收之外的功能,探究破骨细胞和微环境中其他细胞之间的联系,深入阐释微环境中破骨细胞的功能,以期为深入理解骨/关节疾病本质提供新思路。第二,我们提出保护破骨细胞前体功能,特异靶向成熟破骨细胞的骨疾病防治新途径;同时,将“破骨细胞”概念引入骨/软骨疾病干预和组织工程修复,以丰富骨修复理论体系并寻求较佳的修复策略和技术。
1 破骨细胞生物学的最新进展在骨中,单核/巨噬细胞谱系融合形成破骨细胞,通过局部泌酸以及释放骨基质降解酶完成骨的吸收和降解。已有研究表明[5],破骨细胞多核化是其有效骨吸收所必需的。几十年来,与破骨细胞相关的研究已经破译了控制该细胞分化和骨吸收活性的细胞和分子机制,这些研究促进了抗骨吸收药物的发展和临床应用,这些药物的上市预防了无数骨质疏松性骨折,提高了骨癌患者的生活质量[6]。
破骨细胞一直被认为是骨吸收细胞,几乎没有其他功能。然而,新近研究表明其可分泌细胞因子和生长因子,参与成骨细胞形成的正负向调节、血管生成、神经支配、肿瘤转移以及免疫调控等[7]。近年来在多种骨/关节疾病中均发现了破骨细胞的活跃身影,并将其与病理生理学联系起来。与之相符,靶向破骨细胞的药物已在临床和动物疾病模型中被证明是骨质疏松症、骨折愈合、骨关节炎和原发性/转移性骨肿瘤的潜在治疗靶点[8-9]。本部分,我们将系统地阐述调节破骨细胞融合(osteoclast fusion)、形成和功能的分子机制及其在正常和病理状态下与其他细胞的相互作用,这也为解析骨/关节疾病发生、发展机制提供重要支撑。
1.1 经典破骨细胞的“命运”与功能 1.1.1 破骨细胞分化与激活破骨细胞由血液及骨髓中的单核/巨噬细胞系分化而来,其分化过程经历破骨细胞前体(osteoclast precursor cells,OPCs,或称preosteoclasts)、融合的多核破骨细胞(non-functional polykaryons)、成熟破骨细胞(mature osteoclasts,也称极化的多核破骨细胞)等几个阶段[10]。破骨细胞前体被趋化因子从骨髓吸引到血流中,经由循环直到被在骨重塑单位中释放的各种因子募集回骨,并在那里分化为破骨细胞。这些因子包括趋化因子和细胞因子,如巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF)和核因子κB受体激活剂(receptor activator of nuclear factor-kappa B ligand,RANKL)[11]。髓系祖细胞分化为OPCs的基本条件是转录因子PU.1和小眼畸形相关转录因子(microphthalmia-associated transcription factor,Mitf)的表达,二者可诱导M-CSFR的表达。M-CSF作用是促进髓系祖细胞表达RANK、M-CSF与M-CSFR的结合激活ERK/Grb-2和Akt/PI3K信号来调节其增殖、分化和存活[12]。
RANKL刺激表达RANK的OPCs进一步分化,期间多种转录因子的表达增加,包括核因子活化B细胞κ轻链增强子(nuclear factor kappa-light-chain-enhancer of activated B cells,NF-κB)、c-fos和活化T细胞核因子细胞质1型(nuclear factor of activated T-cells cytoplasmic 1,NFATc1)。它们诱导参与破骨细胞激活的基因编码蛋白的表达,包括抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)、组织蛋白酶K和降钙素受体,并介导H+和Cl―的产生,在破骨细胞的皱褶边界下形成HCl介导骨溶解[13]。此外,RANKL诱导c-myc的激活,进一步促进MKK6、p38、ERK、Mitf及Src表达,进而发挥激活破骨细胞功能和促进其存活的多重作用[14]。
1.1.2 破骨细胞识别与融合在破骨分化历程中,最具有标志性且不可或缺的一步便是破骨细胞前体细胞-细胞间的融合,融合后形成的成熟破骨细胞才具备更高效的骨吸收能力。破骨细胞融合过程包括细胞识别其融合伴侣细胞、细胞质膜中的磷脂双层相互接触形成融合中间结构、融合孔形成以及最后细胞内容物混合完成细胞融合[15]。有研究显示巨噬细胞融合受体(macrophage fusion receptor,MFR)与融合伴侣细胞CD47的配对结合是细胞与细胞相互识别的重要过程。树突细胞特异性跨膜蛋白(dendritic cell-specific transmembrane protein,DC-STAMP)、囊泡型ATP酶V0结构域d2亚单位(Atp6v0d2)、破骨细胞多次跨膜蛋白(osteoclast stimulatory transmembrane protein,OC-STAMP)、轻链钙调蛋白结合蛋白(light-chain caldesmon,L-CaD)、钙黏蛋白E(E-cadherin)、syncytin-1和CD9等在内的多种蛋白质参与了融合过程,它们的表达受PU.1、Mitf、c-fos和NFATc1的调节[16]。此外,细胞膜上脂筏的主要成分stomatin可通过共聚效应促进促融合蛋白之间的相互作用,促进融合孔的扩张,正向调控破骨细胞融合[17]。
在细胞融合方面,已经证实miRNA在调控破骨细胞的分化中具有重要的作用,而其中miR-7b是唯一被报道可直接负向调控DC-STAMP进而调控破骨细胞前体融合的miRNA。miR-7b在调控破骨细胞融合的同时,能够进而影响其关键转录因子NFATc1和c-fos的表达[18]。今后的研究重点应该重视明确破骨细胞前体如何相互识别、启动细胞融合的分子基础等基本问题,这将有助于理解破骨细胞参与的骨/关节疾病的深层机制。
1.2 骨与关节疾病:破骨细胞无处不在近年来,许多研究表明,在多种骨与关节疾病(如骨质疏松症、骨折愈合、骨关节炎和原发性/转移性骨肿瘤等)中发现了破骨细胞的变化,并将其与病理生理学联系起来。与之相符,靶向破骨细胞的药物已在临床和动物疾病模型中被证明是骨质疏松症、骨折愈合、骨关节炎和原发/转移性骨肿瘤的潜在治疗靶点。
骨质疏松症是一种常见的与年龄相关的疾病,其特征是骨量明显减少、骨的微小结构破坏,使患者容易发生脆性骨折。截至2020年,全球约有2亿人患有骨质疏松,且每年有900万人发生由骨质疏松导致的骨折[19]。骨质疏松症患者骨丢失的主要原因是破骨细胞活性增加和/或骨形成减少。其中,破骨细胞的功能失调是其重要的发病因素。成熟破骨细胞是骨吸收的主要细胞,导致骨微结构破坏,骨量和密度降低[20]。
骨折是临床上骨科疾病最为常见的类型。破骨细胞在骨折修复的两个阶段中发挥作用:一是在骨折的炎症阶段(骨折修复炎症期)之后,破骨细胞被募集到较小的骨碎片中进行骨碎片的部分吸收。二是在接近愈合过程结束时(骨折修复骨重塑期),破骨细胞再次被诱导重塑硬骨痂并使骨骼恢复到与损伤前相似的尺寸以遵从wolf定律[21]。通过瞬时受体电位香草酸亚型1(transient receptor potential vanilloid 1,TRPV1)抑制剂被证实能够阻止破骨细胞生成并已被用作绝经后骨质流失的治疗策略。有研究使用TRPV1基因敲除小鼠建立骨折模型,发现其破骨细胞数量减少导致畸形骨痂扩大和连续的骨折间隙,从而证实破骨细胞在软骨痂形成和重塑中发挥着重要作用[22]。
骨关节炎是成人常见的肌肉骨骼疾病,其特征是进行性关节软骨退变、关节面和软骨下骨血管侵犯以及异常软骨下骨重塑[23]。据估计,到2040年将有7 800万人因骨关节炎导致残疾和生活质量下降。近年来,软骨下骨重塑异常被证实在骨关节炎病理进程中至关重要:破骨细胞异常激活启动早期骨关节炎软骨下骨病理改变,晚期则以成骨异常及骨赘形成为主[24]。
多发性骨髓瘤是浆细胞异常增生的一种恶性肿瘤,其常见的临床表现之一为溶骨性病变,严重影响80%以上患者的生活质量。破骨细胞介导的溶解性骨破坏一直是多发性骨髓瘤的主要病因[25]。此外,晚期乳腺癌、肺癌、甲状腺癌、膀胱癌和其他癌症的骨转移均可形成溶骨性骨病变,引起病理性骨吸收,伴有剧烈疼痛、骨折、神经压迫和高钙血症等临床症状。溶骨性肿瘤病变的发展基于肿瘤细胞和破骨细胞在骨破坏和肿瘤扩张的恶性循环中的复杂相互作用[26]。
2 骨骼系统中破骨细胞新功能的解析破骨细胞的研究历经多年,新近学者们越来越清晰地认识到:破骨细胞除了“噬骨者”的角色外,还有一些更复杂的身份。近年来,随着单细胞标记和检测技术的快速发展及在骨领域中的广泛应用,对一些新的破骨细胞亚型概念的认识逐渐清楚。但如此众多的亚型如何协调一致地发挥其功能?又是如何在生理和病理条件下或不同骨骼部位与微环境中与其他细胞形成复杂且精细的功能细胞网络?这些复杂的细胞通讯仍处于初级探索阶段,尚有遥远的研究之路要走。对上述问题的解答不仅有助于骨/关节疾病病理机制的阐释,还可为未来的药物研发提供启发。
2.1 破骨细胞:不仅仅是“噬骨者”,而是兼具多功能角色 2.1.1 破骨细胞前体:是友是敌?单核破骨细胞前体的骨吸收能力很弱;发生融合后形成多核成熟破骨细胞,其骨吸收能力达到最强。那么破骨细胞前体毫无用处吗?恰恰相反——破骨细胞前体可以分泌多种促成骨因子。例如,研究发现前体破骨细胞分泌的血小板衍生生长因子-BB(platelet-derived growth factor-BB,PDGF-BB)在骨重塑过程中诱导H型血管形成,这种CD31和Emcn高表达的血管类型与成骨是相互耦联的[27]。该研究提示破骨细胞不完全是个“吃骨头”的细胞,破骨细胞前体可以募集间充质干细胞成骨,并促进血管化。
GAO等[28]的一项研究发现单核/巨噬细胞在骨重塑过程中可分化为定位于骨膜的TRAP+单核细胞,其分泌PDGF-BB,诱导骨膜来源细胞(periosteum-derived cells,PDCs)的骨膜蛋白(periostin)表达并被募集至骨膜表面,从而支持成骨和H型血管形成。这种通讯招募包括两种不同类型的PDCs:Nestin+ PDCs主要在骨发育过程中被发现,而LeptinR+ PDCs对成年小鼠的骨稳态至关重要。我们团队探究了TRAP+单核破骨细胞前体在骨折愈合进程中的新角色。其分泌的结缔组织生长因子(connective tissue growth factor,CTGF)通过激活骨膜干细胞促进其在骨修复微环境中参与维持骨膜干细胞池,并指导骨膜干细胞的谱系向软骨分化参与软骨内成骨过程。机制上,CTGF通过αVβ5整合素诱导Jun表达,Jun直接激活多能基因Nanog、Sox2和Oct4的转录。同时,CTGF还通过αVβ5整合素上调Smad3信号通路从而促进软骨标志基因Sox9和Col2a1的表达[29]。这些研究从破骨细胞前体的角度,探索不同谱系细胞之间的复杂相互作用关系,丰富了其新的细胞功能的内涵,为阐释骨修复的机制提供了新思路,对寻找解决骨修复失败的有效治疗靶点具有重要意义。
2.1.2 血管相关破骨细胞如前所述,破骨细胞前体即吸收性破骨细胞的未成熟前体,是骨髓中促血管PDGF-BB的主要来源。最近的一项研究确定了一种新的非骨吸收性破骨细胞亚型,该亚型破骨细胞定位于干骺端H型血管拱形结构内的突起附近,称之为血管相关破骨细胞(vessel-associated osteoclasts,VAOs)。VAOs能够调节H型血管末端的连接,协同H型血管侵入生长板软骨基质,维持骨发育过程中骨-软骨交界面的正常形态。这一研究呈现了长骨破骨细胞的空间和表型异质性,与骨小梁周围发挥骨吸收作用的经典骨相关破骨细胞(bone-associated osteoclasts,BAOs)相反,VAOs对于软骨吸收和调节H型血管吻合是不可或缺的[30]。除了骨发育,软骨基质吸收是骨折或损伤后修复过程中的一个重要机制。骨关节炎的病理状况也同样涉及软骨基质的代谢失调和骨形成[31-32]。骨/软骨界面的H型血管与VAOs提供了对诸如骨折愈合和骨关节炎等病理学新见解。
骨重塑是新骨替代旧骨的过程。人的一生中,骨不断被重塑,重塑的比例约为每年10%。骨重塑周期包括3个连续的阶段:骨吸收(由破骨细胞主导)、骨逆转(由破骨细胞与成骨细胞交接)和骨形成与矿化(由成骨细胞主导)。伴随骨重塑过程,破骨细胞周期性凋亡势必产生大量凋亡小体,破骨细胞来源凋亡小体是否具有生物学意义?传统观点将凋亡小体视为“垃圾袋”,将死细胞的残余碎片封装起来进行吞噬,以“净化环境”。新近证据表明,细胞的凋亡小体内含物包括核酸、蛋白质和脂质以及部分细胞器[33]。我们认为破骨细胞来源的凋亡小体中包含向周围细胞和外界传递的“信息”,从而参与调控骨重塑过程。在绘制了不同分化阶段破骨细胞来源凋亡小体的蛋白组图谱基础上,发现凋亡小体与母细胞具有高度的蛋白组标签的相似性,破骨细胞前体凋亡小体将PDGF-BB转运给内皮祖细胞受体促进血管生成,而成熟破骨细胞凋亡小体通过RANKL反向信号促进骨生成,在骨重塑中通过促进细胞间耦合作用桥接了骨吸收与骨形成的过渡[34-35]。
2.1.3 新亚型osteomorph与破骨细胞再循环地舒单抗(denosumab)作为一种阻断RANK/RANKL信号传导的单克隆抗体,是临床上一种骨质疏松经典药物,可使绝经后妇女增加骨密度和降低骨质破坏速度,也用于防治实体瘤骨转移患者发生骨骼相关事件[36]。但新近发现停止治疗后会出现骨丢失加速和自发性骨折。MCDONALD等[37]在Cell报道了破骨细胞新亚型osteomorph,可能解释这一临床现象。该研究通过小鼠胫骨中的细胞动力学进行纵向实时成像,发现RANKL刺激的破骨细胞有一种意想不到的细胞命运——通过分裂成更小、更活跃的细胞(称之为osteomorph),其可再循环到不同的位置再融合形成吸收骨的破骨细胞。单细胞测序显示osteomorph是一种转录上不同于破骨细胞和巨噬细胞的独特细胞类型。此外,osteomorph中开启的基因可能调控人类骨骼发育不良和骨密度下降。因此,该研究确定了新亚型osteomorph与破骨细胞再循环在骨稳态和相关疾病中的重要作用,沿此方向进行深入机制研究,有望为治疗骨质疏松症和其他骨骼疾病提供新靶标。
2.1.4 抗原呈递破骨细胞与骨免疫骨骼和免疫系统通过细胞和分子的相互作用而密切相关。因此,在基于诸如免疫功能障碍和骨代谢异常的类风湿关节炎和多发性骨髓瘤等疾病的背景下,“骨免疫”的概念被提出[38]。那么,破骨细胞在骨免疫微环境中扮演着什么样的角色?大部分的研究阐释了破骨细胞与多种免疫细胞之间通过细胞-细胞接触,以及多种细胞/趋化因子的双向相互作用创造了一个正反馈回路,以调节骨免疫微环境[39]。但是,学者们也逐步认识到破骨细胞不仅能介导骨破坏,还作为一种免疫细胞发挥效应。
骨吸收性破骨细胞和抗原呈递树突状细胞源自共同的造血前体。据报道,在关节炎小鼠模型和类风湿性关节炎患者的滑膜中发现了从树突状细胞(dendritic cells,DCs)转分化而来的新破骨细胞亚群(DC-OCs)。在体外M-CSF和RANKL或促炎细胞因子作用下,DC衍生的破骨细胞被证明是组织蛋白酶K和TRAP阳性的多核巨细胞,同时其显示出比单核细胞来源的破骨细胞(monocyte-derived OCs,Mo-OCs)更强的骨吸收能力。有趣的是,与Mo-OCs不同,DC-OCs依然保持了DCs吞噬活性的功能与高抗原呈递能力[40-41]。
破骨细胞可以类似于DCs作为抗原呈递细胞激活T细胞。在一项研究中,RANKL和M-SCF的刺激下,人单核细胞可产生破骨细胞。与DCs相似,破骨细胞表达主要组织相容性复合体(MHC-Ⅰ和MHC-Ⅱ)以及共刺激分子(CD80、CD86和CD40)。该破骨细胞能摄取可溶性抗原,依赖MHC呈递同种异体抗原并激活CD4+和CD8+同种反应性T细胞。这些发现表明,破骨细胞可以作为抗原提呈细胞并激活CD4+和CD8+ T细胞[42]。因此,抗原呈递破骨细胞与骨免疫的新概念,可能有助于开发治疗类风湿性关节炎和多发性骨髓瘤等免疫相关性疾病的新策略。
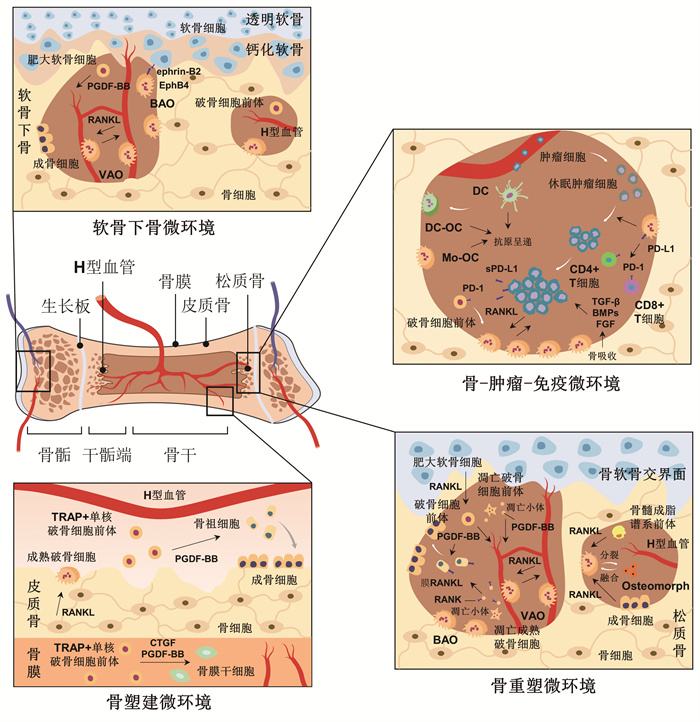
2.2 骨微环境稳态是破骨细胞及其主导的细胞网络共同活动的结果骨基础研究的学者们在不断思考,如此众多破骨细胞亚群如何在生理和病理条件下、在不同骨骼部位与微环境中与其他细胞形成复杂且精细的功能细胞网络?从破骨细胞及其主导的细胞网络共同营造骨微环境稳态的角度,将为深入理解骨/关节疾病本质做出新的阐释(图 1)。
|
| 图 1 破骨细胞及其主导的细胞网络调控骨微环境稳态 |
2.2.1 骨塑建与骨重建微环境
经典的“破骨-成骨细胞串话(osteoclast-osteoblast crosstalk)”参与了骨塑建(bone modeling)与骨重建(bone remodeling)微环境的维持。事实上,各类骨细胞以及H型血管内皮细胞的相互耦合也精细地调控着该微环境的稳态。破骨细胞前体分泌PDGF-BB,通过增加内皮祖细胞的募集和组装,导致H型血管形成增加。PDGF-BB还从H型血管招募骨祖细胞在骨重塑部位分化为成骨细胞。成熟破骨细胞和成骨细胞释放狭缝制导配体3(slit guidance ligand 3,SLIT3),增强内皮管腔形成和H型血管分支[43]。TRAP+单核细胞也将PDGF-BB分泌至骨膜以募集骨膜干/祖细胞;或者其来源的CTGF维持骨膜干细胞池,并调控骨膜干细胞向软骨分化来参与软骨内成骨过程[28-29]。H型血管嵌入在干骺端的骨小梁和骨膜里,并延伸到生长板。VAOs还促进H型血管的吻合,H型内皮细胞通过RANKL-RANK信号机制支持VAOs[30]。因此,在骨髓微环境构成了所谓的“破骨-成骨-血管”耦合。
对破骨细胞的调控需要RANKL的参与,经典的观点认为RANKL是由成骨细胞表达。然而,关于骨中RANKL的主要细胞来源,最新的两项研究描述了体内破骨细胞的分化及其在不同骨骼部位的调节。研究发现,在皮质骨的骨膜表面,骨细胞主要产生RANKL以促进破骨细胞生成;软骨-骨交界处则是肥大软骨细胞来源的RANKL刺激破骨细胞形成;骨小梁中,利用高通量单细胞测序技术对小鼠骨髓细胞检测发现一种特殊的脂肪前体细胞——骨髓成脂谱系前体(marrow adipogenic lineage precursors,MALPs),主要调节破骨细胞分化[44-45]。因此,围绕破骨细胞,各类细胞以及H型血管内皮细胞在骨髓腔内形成一个密集的3D网络,相互耦合、精细调控骨微环境稳态。
2.2.2 骨-肿瘤-免疫微环境骨是多种癌症类型最常见的发生和转移部位。肿瘤细胞向骨转移的过程涉及多个步骤:①肿瘤细胞从原发部位渗入淋巴或血管系统;②肿瘤细胞倾向转移至骨并定植于骨微环境;③肿瘤细胞存活与休眠;④肿瘤细胞再次被激活;⑤肿瘤细胞生长[46]。其中,破骨细胞的活动几乎涉及所有步骤。肿瘤衍生因子和细胞外囊泡为未来的骨转移准备了“肥沃的土壤”,被称为“转移前龛位(pre-metastatic niche,PMN)”,比如乳腺癌细胞的细胞外囊泡L-plastin[47-48]。而破骨细胞介导的PMN形成和原发灶转移的机制尚不清楚。此外,破骨细胞可以介导骨龛位重塑以释放休眠的肿瘤细胞,使它们能够增殖并形成微转移。然后,微转移增殖以建立经典的破骨细胞与肿瘤细胞之间的“恶性循环”,介导肿瘤生长和骨破坏[49]。
当然,破骨细胞调控的“骨微环境-肿瘤微环境”相互作用也离不开免疫微环境的参与。一方面,破骨细胞与免疫细胞串扰从而创造出兼有“骨溶解”和“免疫抑制”的肿瘤微环境。破骨细胞可以调控免疫细胞,甚至作为自身“免疫细胞”来“训练”肿瘤细胞的免疫逃逸。成熟破骨细胞表达程序性死亡配体1(programmed death-ligand 1,PD-L1)和半乳糖凝集素-9(galectin-9)以诱导T细胞凋亡[50]。程序性死亡受体-1(programmed death 1,PD-1) 在破骨细胞前体中高表达,却在成熟的破骨细胞中不表达;肿瘤细胞来源的sPD-L1与破骨细胞前体中的PD-1结合导致JNK激活和C-C基序趋化因子配体2(C-C motif chemokine ligand 2,CCL2)的释放。CCL2进一步促进破骨细胞的分化和作用于背根神经节神经元上表达的C-C趋化因子受体2(C-C chemokine receptor 2,CCR2)以引起癌痛[51]。成熟破骨细胞分泌的增殖诱导配体(a proliferation-inducing ligand,APRIL)通过B细胞成熟抗原(B-cell maturation antigen,BCMA)(一种特定的骨髓瘤抗原)刺激骨髓瘤细胞PD-L1的表达[52]。
2.2.3 软骨下骨微环境在软骨内成骨过程中,H型血管与破骨细胞前体和成骨细胞前体共同侵入软骨组织肥大区,与肥大软骨细胞共同重塑软骨基质形成初级骨化中心。其中,肥大软骨细胞分泌RANKL,调控破骨细胞分化和成熟,实现对软骨内成骨进程的调控。此外,软骨细胞ephrin-B2-破骨细胞EphB4轴在软骨内成骨过程中影响软骨细胞稳态、促进破骨细胞破坏软骨基质。我们前期发现破骨细胞外泌体来源let-7a-5p靶向Smad2,削弱转化生长因子-β(transforming growth factor-β,TGF-β)通路对软骨细胞肥大的抑制,促进软骨细胞肥大化[53],部分阐释了破骨细胞对软骨细胞的作用及分子机制,从细胞间通讯角度丰富了对软骨内成骨的认识。
类似地,骨关节炎病理进程“再现”了软骨内成骨过程,实验证实内侧半月板-胫骨韧带切除小鼠和老年小鼠软骨下骨中的H型血管增加[54]。基于此,我们提出了“破骨-软骨细胞耦合(osteoclast-chondrocyte coupling)”的概念,并认为细胞间存在多种沟通方式:①借由血管的远距离串话;②借由血管的近距离串话;③依赖降解的骨软骨通道串话;④依赖骨软骨力传导。因此,应关注软骨下骨微环境,聚焦软骨下骨微环境失衡致破骨细胞调控软骨细胞功能紊乱及软骨退变[55]。新近香港浸会大学LIU等[56]发现破骨细胞的miRNA向软骨细胞以细胞外囊泡的形式转移,削弱组织金属蛋白酶抑制剂(tissue inhibitor of metalloproteinases,TIMPs)-2和-3的表达,降低了骨关节炎进展过程中软骨对基质变性的抵抗力。因此,软骨下骨微环境中“破骨细胞-软骨细胞耦合”有望成为骨关节炎新治疗策略的干预靶点。
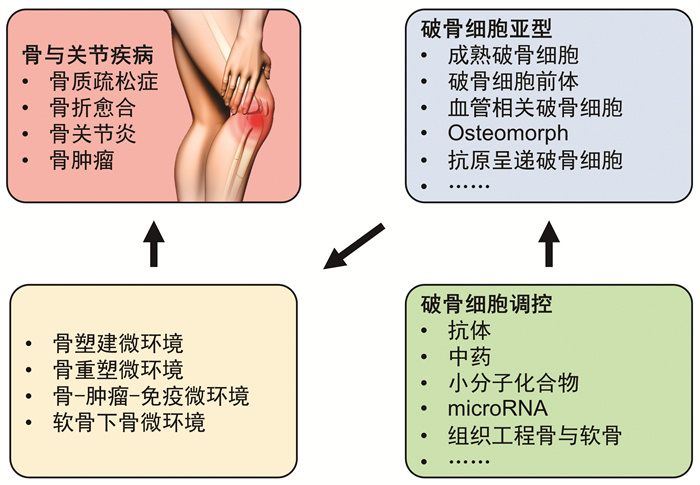
3 破而后立:基于破骨细胞调控的骨与关节疾病干预策略一直以来,破骨细胞被认为是一种负性功能的细胞,开发的多种药物均针对抑制破骨细胞的分化和活性。比如现在的一线药物大部分是含氮的二磷酸盐类,用于抑制破骨细胞活性。成骨细胞活性强于破骨细胞,由此出现的问题是虽然骨体积增大,但临床上由骨质疏松导致的骨折并没有减少。随着破骨细胞新功能以及破骨细胞与骨/关节疾病的内在关系不断得到解析,基于破骨细胞调控的骨与关节疾病干预策略亦逐步获得调整(图 2)。
|
| 图 2 破而后立:基于破骨细胞调控的骨与关节疾病干预策略 |
3.1 保护破骨细胞前体功能,特异性靶向成熟破骨细胞的骨疾病防治新途径
骨质疏松症患者骨质流失的主要原因是破骨细胞活性增加和/或骨形成减少,抗吸收和合成代谢药物各自针对其中的一种机制。针对这两种机制的双功能药物可能会在对抗骨质流失方面取得卓越的效果,但目前尚无此类药物上市。那么,能否仅抑制具有很强的骨吸收功能的成熟破骨细胞、而保留对促血管和成骨功能具有正向作用的破骨细胞前体呢?目前专门针对破骨细胞前体融合的研究甚少。ZHEN[57]在Siglec-15破骨细胞条件性敲除小鼠和接受Siglec-15中和抗体处理的小鼠中,发现破骨细胞的多核化受到抑制;相反,PDGF-BB的分泌、TRAP+单核细胞的数量和骨形成显著增加。转化应用上,Siglec-15中和抗体在雌激素缺乏性骨质疏松小鼠中有效地减少骨吸收并刺激骨形成,也在骨折愈合小鼠模型中促进了皮质骨受损区域的膜内成骨和软骨内成骨。我们通过微乳液法,将阿仑膦酸(alendronic acid,AL)锚定在裸的氧化铈纳米颗粒(cerium nanoparticles,CNP)上,使用PEG600原位进行配体交换,合成具有pH依赖的酶学活性生物材料CNPs-AL-PEG600。在治疗骨质疏松性去卵巢小鼠模型中,其增加了破骨细胞前体分泌的PDGF-BB,从而增加H型血管数量、增强骨矿物质密度和骨体积[58]。
3.2 将“破骨细胞”概念引入组织工程骨与软骨构筑技术传统理论认为,组织工程骨是通过种子细胞(如最常见的间充质干细胞)直接发挥成骨作用。随着组织工程的飞速发展,出现了新型功能性骨修复支架材料。那么,基于前面所述的破骨细胞前体的促血管和成骨功能,能否开发可调控“破骨细胞”功能的骨修复材料?随着构建技术的进步和完善,我们将间充质干细胞与破骨细胞前体共培养作为构建基质依赖性组织工程骨的种子系统,在大鼠股骨缺损模型显示其具有更好的骨修复潜力。相对和绝对定量同位素标记(iTRAQ)的质谱分析表明,伴随着破骨细胞前体的引入,募集类因子、成骨类因子、生长因子和血管化因子的分泌明显上调,其中从破骨细胞前体中释放的C-X-C趋化因子配体12(C-X-C chemokine ligand 12,CXCL12)和胰岛素样生长因子结合蛋白5(insulin-like growth factor binding protein 5,IGFBP5)蛋白分别促进间充质干细胞的成骨分化以及迁移能力[59]。骨软骨缺损包括软骨层和软骨下骨层缺损,二者具有不同的理化和生物学特性。为了实现软骨下骨和软骨的同时修复,支架需要具有多功能性且具有成骨和成软骨特性[60]。因此,是否可以将“破骨细胞”概念引入建立组织工程骨软骨仿生一体化支架制备技术?虽然现在还只是停留在理论和基础研究阶段,但随着各相关学科的不断发展及进一步的研究探索,相信这将给关节软骨缺损的临床治疗带来新突破。
综上所述,骨重建的动态平衡靠骨组织内各类细胞的相互协作来实现。其中破骨细胞的调控在其中发挥主导作用。骨骼系统中破骨细胞新功能的不断探索使得研究者重新审视这一个所谓的“噬骨者”,但众多的新破骨细胞亚型与微环境中其他细胞形成复杂功能细胞网络的细胞和分子机制仍处于初级探索阶段。通过对破骨细胞融合能够靶向性地调控破骨细胞分化的某一个阶段。当前基于破骨细胞调控的骨与关节疾病干预策略也仅是针对破骨细胞前体和成熟破骨细胞两个群体,而其他诸如VAO、osteomorph和抗原呈递破骨细胞的新亚型如何具体涉及骨/关节疾病的相关机制研究仍比较匮乏。厘清破骨细胞调控网络,尤其是对多种亚型的分化及功能调控机制的深入理解,争取精确地调控破骨细胞分化的各个阶段及细胞间相互作用,将为临床上治疗骨质疏松症等破骨细胞失调的骨相关疾病带来更好的干预靶标,进而推动新型骨再生策略的发展及应用。
| [1] |
KIM J M, LIN C J, STAVRE Z, et al. Osteoblast-osteoclast communication and bone homeostasis[J]. Cell, 2020, 9(9): E2073. |
| [2] |
TATEIWA D, YOSHIKAWA H, KAITO T. Cartilage and bone destruction in arthritis: pathogenesis and treatment strategy: a literature review[J]. Cell, 2019, 8(8): E818. |
| [3] |
OKAMOTO K, NAKASHIMA T, SHINOHARA M, et al. Osteoimmunology: the conceptual framework unifying the immune and skeletal systems[J]. Physiol Rev, 2017, 97(4): 1295-1349. |
| [4] |
BOYLE W J, SIMONET W S, LACEY D L. Osteoclast differentiation and activation[J]. Nature, 2003, 423(6937): 337-342. |
| [5] |
YAGI M, MIYAMOTO T, TOYAMA Y, et al. Role of DCSTAMP in cellular fusion of osteoclasts and macrophage giant cells[J]. J Bone Miner Metab, 2006, 24(5): 355-358. |
| [6] |
BROUNAIS B, RUIZ C, ROUSSEAU J, et al. Novel anticancer strategy in bone tumors by targeting molecular and cellular modulators of bone resorption[J]. Recent Pat Anticancer Drug Discov, 2008, 3(3): 178-186. |
| [7] |
CHARLES J F, ALIPRANTIS A O. Osteoclasts: more than 'bone eaters'[J]. Trends Mol Med, 2014, 20(8): 449-459. |
| [8] |
WANG T, LIU Q, TJHIOE W, et al. Therapeutic potential and outlook of alternative medicine for osteoporosis[J]. Curr Drug Targets, 2017, 18(9): 1051-1068. |
| [9] |
KARSDAL M A, BAYJENSEN A C, LORIES R J, et al. The coupling of bone and cartilage turnover in osteoarthritis: opportunities for bone antiresorptives and anabolics as potential treatments?[J]. Ann Rheum Dis, 2014, 73(2): 336-348. |
| [10] |
UDAGAWA N, KOIDE M, NAKAMURA M, et al. Osteoclast differentiation by RANKL and OPG signaling pathways[J]. J Bone Miner Metab, 2021, 39(1): 19-26. |
| [11] |
TAKAYANAGI H. RANKL as the master regulator of osteoclast differentiation[J]. J Bone Miner Metab, 2021, 39(1): 13-18. |
| [12] |
BOYCE B F. Advances in the regulation of osteoclasts and osteoclast functions[J]. J Dent Res, 2013, 92(10): 860-867. |
| [13] |
WADA T, NAKASHIMA T, HIROSHI N, et al. RANKLRANK signaling in osteoclastogenesis and bone disease[J]. Trends Mol Med, 2006, 12(1): 17-25. |
| [14] |
BATTAGLINO R, KIM D, FU J, et al. Cmyc is required for osteoclast differentiation[J]. J Bone Miner Res, 2002, 17(5): 763-773. |
| [15] |
MIYAMOTO T. Regulators of osteoclast differentiation and cellcell fusion[J]. Keio J Med, 2011, 60(4): 101-105. |
| [16] |
VIGNERY A. Osteoclasts and giant cells: macrophage-macrophage fusion mechanism[J]. Int J Exp Pathol, 2000, 81(5): 291-304. |
| [17] |
LEE J H, HSIEH C F, LIU H W, et al. Lipid raftassociated stomatin enhances cell fusion[J]. FASEB J, 2017, 31(1): 47-59. |
| [18] |
DOU C, ZHANG C C, KANG F, et al. MiR7b directly targets DCSTAMP causing suppression of NFATc1 and cFos signaling during osteoclast fusion and differentiation[J]. Biochim Biophys Acta Gene Regul Mech, 2014, 1839(11): 1084-1096. |
| [19] |
ELONHEIMO H, LANGE R, TOLONEN H, et al. Environmental substances associated with osteoporosis—A scoping review[J]. Int J Environ Res Public Heal, 2021, 18(2): 738. |
| [20] |
BLANGY A, BOMPARD G, GUERIT D, et al. The osteoclast cytoskeletoncurrent understanding and therapeutic perspectives for osteoporosis[J]. J Cell Sci, 2020, 133(13): jcs244798. |
| [21] |
TAKEYAMA K, CHATANI M, TAKANO Y, et al. In-vivo imaging of the fracture healing in medaka revealed two types of osteoclasts before and after the callus formation by osteoblasts[J]. Dev Biol, 2014, 394(2): 292-304. |
| [22] |
HE L H, LIU M, HE Y, et al. TRPV1 deletion impaired fracture healing and inhibited osteoclast and osteoblast differentiation[J]. Sci Rep, 2017, 7: 42385. |
| [23] |
HUNTER D J, BIERMAZEINSTRA S. Osteoarthritis[J]. Lancet, 2019, 393(10182): 1745-1759. |
| [24] |
FANG C, GUO J W, WANG Y J, et al. Diterbutyl phthalate attenuates osteoarthritis in ACLT mice via suppressing ERK/cfos/NFATc1 pathway, and subsequently inhibiting subchondral osteoclast fusion[J]. Acta Pharmacol Sin, 2021, 1-12. |
| [25] |
YILDIRIM M, BAYKARA M. Differentiation of multiple myeloma and lytic bone metastases: histogram analysis[J]. J Comput Assist Tomogr, 2020, 44(6): 953-955. |
| [26] |
MAURIZI A, RUCCI N. The osteoclast in bone metastasis: player and target[J]. Cancers (Basel), 2018, 10(7): 218. |
| [27] |
XIE H, CUI Z, WANG L, et al. PDGFBB secreted by preosteoclasts induces angiogenesis during coupling with osteogenesis[J]. Nat Med, 2014, 20(11): 1270-1278. |
| [28] |
GAO B, DENG R, CHAI Y, et al. Macrophagelineage TRAP+ cells recruit periosteumderived cells for periosteal osteogenesis and regeneration[J]. J Clin Invest, 2019, 129(6): 2578-2594. |
| [29] |
BAI Y, YU T, DENG J Z, et al. Connective tissue growth factor from periosteal tartrate acid phosphatasepositive monocytes direct skeletal stem cell renewal and fate during bone healing[J]. Front Cell Dev Biol, 2021, 9: 730095. |
| [30] |
ROMEO S G, ALAWI K M, RODRIGUES J, et al. Endothelial proteolytic activity and interaction with nonresorbing osteoclasts mediate bone elongation[J]. Nat Cell Biol, 2019, 21(4): 430-441. |
| [31] |
FERGUSON C, ALPERN E, MICLAU T, et al. Does adult fracture repair recapitulate embryonic skeletal formation?[J]. Mech Dev, 1999, 87(1/2): 57-66. |
| [32] |
GOLDRING S R. Pathogenesis of bone and cartilage destruction in rheumatoid arthritis[J]. Rheumatology (Oxford), 2003, 42: ii11-ii16. |
| [33] |
YUAN F L, WU Q Y, MIAO Z N, et al. Osteoclast-derived extracellular vesicles: novel regulators of osteoclastogenesis and osteoclast-osteoblasts communication in bone remodeling[J]. Front Physiol, 2018, 9: 628. |
| [34] |
MA Q Y, LIANG M M, LIMJUNYAWONG N, et al. Osteoclastderived apoptotic bodies show extended biological effects of parental cell in promoting bone defect healing[J]. Theranostics, 2020, 10(15): 6825-6838. |
| [35] |
MA Q Y, LIANG M M, WU Y T, et al. Osteoclastderived apoptotic bodies couple bone resorption and formation in bone remodeling[J]. Bone Res, 2021, 9(1): 5. |
| [36] |
TSOURDI E, LANGDAHL B, COHENSOLAL M, et al. Discontinuation of Denosumab therapy for osteoporosis: a systematic review and position statement by ECTS[J]. Bone, 2017, 105: 11-17. |
| [37] |
MCDONALD M M, KHOO W H, NG P Y, et al. Osteoclasts recycle via osteomorphs during RANKLstimulated bone resorption[J]. Cell, 2021, 184(7): 1940. |
| [38] |
OKAMOTO K, TAKAYANAGI H. Osteoimmunology[J]. Cold Spring Harb Perspect Med, 2019, 9(1): a031245. |
| [39] |
TSUKASAKI M, TAKAYANAGI H. Osteoimmunology: evolving concepts in boneimmune interactions in health and disease[J]. Nat Rev Immunol, 2019, 19(10): 626-642. |
| [40] |
NARISAWA M, KUBO S, OKADA Y, et al. Human dendritic cellderived osteoclasts with high bone resorption capacity and T cell stimulation ability[J]. Bone, 2021, 142: 115616. |
| [41] |
LAPÉRINE O, BLINWAKKACH C, GUICHEUX J, et al. Dendritic-cell-derived osteoclasts: a new game changer in bone-resorption-associated diseases[J]. Drug Discov Today, 2016, 21(9): 1345-1354. |
| [42] |
LI H Y, HONG S, QIAN J F, et al. Cross talk between the bone and immune systems: osteoclasts function as antigenpresenting cells and activate CD4+ and CD8+ T cells[J]. Blood, 2010, 116(2): 210-217. |
| [43] |
PENG Y, WU S, LI Y S, et al. Type H blood vessels in bone modeling and remodeling[J]. Theranostics, 2020, 10(1): 426-436. |
| [44] |
YU W, ZHONG L L, YAO L T, et al. Bone marrow adipogenic lineage precursors promote osteoclastogenesis in bone remodeling and pathologic bone loss[J]. J Clin Invest, 2021, 131(2): 140214. |
| [45] |
ZHONG L, YAO L, TOWER R J, et al. Single cell transcriptomics identifies a unique adipose lineage cell population that regulates bone marrow environment[J]. Elife, 2020, 9. |
| [46] |
BYRNE N M, SUMMERS M A, MCDONALD M M. Tumor cell dormancy and reactivation in bone: skeletal biology and therapeutic opportunities[J]. JBMR Plus, 2019, 3(3). |
| [47] |
HIGGINBOTHAM J N, DEMORY BECKLER M, GEPHART J D, et al. Amphiregulin exosomes increase cancer cell invasion[J]. Curr Biol, 2011, 21(9): 779-786. |
| [48] |
TIEDEMANN K, SADVAKASSOVA G, MIKOLAJEWICZ N, et al. Exosomal release of Lplastin by breast cancer cells facilitates metastatic bone osteolysis[J]. Transl Oncol, 2019, 12(3): 462-474. |
| [49] |
YANG Z F, YUE Z Y, MA X R, et al. Calcium homeostasis: a potential vicious cycle of bone metastasis in breast cancers[J]. Front Oncol, 2020, 10: 293. |
| [50] |
TAI Y T, CHO S F, ANDERSON K C. Osteoclast immunosuppressive effects in multiple myeloma: role of programmed cell death ligand 1[J]. Front Immunol, 2018, 9: 1822. |
| [51] |
WANG K Y, GU Y, LIAO Y H, et al. PD1 blockade inhibits osteoclast formation and murine bone cancer pain[J]. J Clin Invest, 2020, 130(7): 3603-3620. |
| [52] |
AN G, ACHARYA C, FENG X Y, et al. Osteoclasts promote immune suppressive microenvironment in multiple myeloma: therapeutic implication[J]. Blood, 2016, 128(12): 1590-1603. |
| [53] |
DAI J J, DONG R, HAN X Y, et al. Osteoclastderived exosomal let7a5p targets Smad2 to promote the hypertrophic differentiation of chondrocytes[J]. Am J Physiol Cell Physiol, 2020, 10.1152/ajpcell. 00039.2020. DOI: 10.1152/ajpcell.00039.2020.
|
| [54] |
LU J S, ZHANG H Y, CAI D Z, et al. Positivefeedback regulation of subchondral Htype vessel formation by chondrocyte promotes osteoarthritis development in mice[J]. J Bone Miner Res, 2018, 33(5): 909-920. |
| [55] |
HU W H, CHEN Y Q, DOU C, et al. Microenvironment in subchondral bone: predominant regulator for the treatment of osteoarthritis[J]. Ann Rheum Dis, 2020, 80(4): 413-422. |
| [56] |
LIU J, WU X H, LU J, et al. Exosomal transfer of osteoclastderived miRNAs to chondrocytes contributes to 〖JP2〗osteoarthritis progression[J]. Nat Aging, 2021, 1(4): 368-384. |
| [57] |
ZHEN G H, DAN Y, WANG R M, et al. An antibody against Siglec15 promotes bone formation and fracture healing by increasing TRAP+ mononuclear cells and PDGFBB secretion[J]. Bone Res, 2021, 9(1): 47. |
| [58] |
DOU C, LI J M, HE J, et al. Bonetargeted pHresponsive cerium nanoparticles for anabolic therapy in osteoporosis[J]. Bioact Mater, 2021, 6(12): 4697-4706. |
| [59] |
DONG R, BAI Y, DAI J J, et al. Engineered scaffolds based on mesenchymal stem cells/preosteoclasts extracellular matrix promote bone regeneration[J]. J Tissue Eng, 2020, 11: 2041731420926918. |
| [60] |
DENG C, ZHU H, LI J, et al. Bioactive scaffolds for regeneration of cartilage and subchondral bone interface[J]. Theranostics, 2018, 8(7): 1940-1955. |




