2. 635000 四川 达州,达州中医药职业学院:药学系
2. Faculty of Pharmacy, Dazhou Vocational College of Traditional Chinese Medicine, Dazhou, Sichuan Province, 635000, China
狼疮肾炎属于系统性自身免疫性疾病,系统性红斑狼疮是狼疮肾炎中较严重的表现之一,具有较高的发病率和死亡率[1]。狼疮肾炎极易复发且预后欠佳,目前西医主要以糖皮质激素联合免疫抑制剂治疗为主[2],然而,研究表明由于长时间使用免疫抑制药物,造成的感染、骨髓抑制、肝肾功能损害等副作用甚至可以威胁患者的生命[3]。因此,寻找有效且副作用低的治疗方法对治疗狼疮肾炎和改善狼疮肾炎患者生活质量具有重要的作用。香叶木素是从柑橘类植物中分离出来的类黄酮[4]。研究表明在肺炎链球菌细菌性脑膜炎大鼠模型中,香叶木素通过调节PI3K/AKT/NF-κB信号通路降低神经炎症和神经元凋亡[5]。同时也有研究表明香叶木素对顺铂诱导的肾小管上皮细胞损伤的保护作用[6]。本研究旨在观察香叶木素对MRL/lpr小鼠的影响,为临床治疗狼疮肾炎提供新的思路。
1 材料与方法 1.1 实验动物健康清洁级MRL/lpr狼疮性肾炎小鼠(实验组)50只及野生型C57BL/6小鼠(对照组)10只,雌性,8周龄,体质量18~21 g,均购于四川省医学科学院/四川省人民医院实验动物研究所[SCXK(川)2018-110]。小鼠饲养于达州中医药职业学院SPF环境独立通气笼,温度: (25 ± 2)℃; 相对湿度: 40%~70%,常规饲养1周。本研究经达州中医药职业学院动物伦理与福利委员会批准(20200421),动物实验严格遵循3R原则。
1.2 分组及给药MRL/lpr狼疮性肾炎小鼠50只按随机数字表法分成5组:MRL/lpr组,地塞米松(1.50 mg/kg[7])组,香叶木素低剂量(0.25 mg/kg[8])组,香叶木素中剂量(0.50 mg/kg)组和香叶木素高剂量(1.00 mg/kg)组,每组10只。正常对照组野生型C57BL/6小鼠10只。连续7 d腹腔注射给药,然后取所有小鼠血清及肾脏组织测定各项指标。
1.3 肾脏组织HE染色各组小鼠取血完成后,处死并取肾脏组织,置于4%多聚甲醛溶液中固定72 h后进行乙醇梯度脱水,二甲苯透明后石蜡包埋,切成2 μm厚的切片,然后进行HE染色,于光学显微镜下观察肾脏组织的形态学变化。
1.4 血清肌酐、血尿素氮、抗双链DNA抗体水平检测麻醉状态下断颈处死小鼠,眼球取血,离心,取血清,-80 ℃冻存。在最后1次给药2 h后,采用全三硝基苯酚比色法和脲酶法分别测定血清肌酐和血尿素氮水平。ELISA试剂盒检测血清中抗双链DNA抗体的含量,严格按照试剂盒操作进行。ELISA试剂盒购置于南京建成生物工程研究所。
1.5 ELISA检测血清和肾脏组织中细胞因子IL-6、TNF-α和IL-1β的表达根据制造商说明书测量血清和肾脏组织中细胞因子IL-6、TNF-α和IL-1β的表达水平。用Bio-Rad酶标仪(Hercules, USA)测定光密度。使用ELISA试剂盒提供的细胞因子标准品建立测量的标准曲线。ELISA试剂盒购置于南京建成生物工程研究所。
1.6 Western blot检测肾脏组织中蛋白表达肾脏组织加入液氮研磨成粉末,加入RIPA裂解液(上海碧云天生物有限公司)冰上裂解1 h,4 ℃下以14 000 r/min离心15 min取上清,形成浓缩蛋白质。用BCA蛋白定量检测盒(上海碧云天生物有限公司)测量蛋白质浓度。取20 μg蛋白样品上样,于12%聚丙烯酰胺凝胶电泳分离蛋白并转移至聚偏二氟乙烯膜,5%脱脂奶粉室温封闭1 h,加入一抗NLRP3(1 ∶1 000,ab263899,Abcam)、ASC(1 ∶1 000,#13833,Cell signaling)、Caspase-1(1 ∶1 000,ab207802,Abcam)、IL-1β(1 ∶1 000,ab234437,Abcam)、p-NF-κB(1 ∶1 000,#3033,Cell signaling)和p-IκBα(1 ∶1 000,#2859,Cell signaling)于4 ℃过夜,磷酸盐吐温缓冲液清洗3次,加入辣根过氧化物酶标记的山羊抗兔IgG(二抗)37 ℃反应1 h。洗膜后ECL曝光成像并应用Quantity one(Bio-Rad)软件分析蛋白条带的灰度值。
1.7 统计学分析采用SPSS 22.0软件进行统计分析,正态分布时计量资料以x±s表示,多组间均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 香叶木素对MRL/lpr狼疮性肾炎小鼠肾组织形态学变化的影响与对照组相比,MRL/lpr狼疮性肾炎小鼠肾组织中有大量炎性细胞浸润。与MRL/lpr组相比,地塞米松组中炎性细胞的浸润减少,同时在中剂量和高剂量香叶木素治疗组中炎性细胞的浸润也减少,见图 1。

|
| 图 1 香叶木素对MRL/lpr狼疮性肾炎小鼠肾组织形态学变化的影响 (HE ×400) |
2.2 香叶木素对MRL/lpr狼疮性肾炎小鼠血清肌酐、血尿素氮、抗双链DNA抗体变化量的影响
与对照组比较,MRL/lpr组小鼠血清肌酐、血尿素氮和血清抗双链DNA抗体的水平均显著升高(P < 0.01);与MRL/lpr组比较,地塞米松组小鼠血清肌酐、血尿素氮和血清抗双链DNA的水平均显著下调(P < 0.01),香叶木素中、高剂量组小鼠血清肌酐、血尿素氮和血清抗双链DNA抗体的水平均显著下调(P < 0.05,P < 0.01), 见表 1。
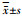
| 组别 | 血清肌酐/mg·dL-1 | 血尿素氮/mg·dL-1 | 抗双链DNA抗体/mg·L-1 |
| 对照组 | 0.31±0.10 | 13.37±2.66 | 31.37±3.85 |
| MRL/lpr组 | 0.95±0.28a | 45.56±4.81a | 352.58±30.81a |
| 地塞米松组 | 0.44±0.16c | 16.58±2.93c | 67.15±9.81c |
| 香叶木素低剂量组 | 0.86±0.22 | 39.11±4.08 | 304.37±27.63 |
| 香叶木素中剂量组 | 0.69±0.25b | 30.56±3.54b | 207.28±22.54b |
| 香叶木素高剂量组 | 0.53±0.17c | 25.37±3.08c | 158.33±20.08c |
| a:P < 0.01,与对照组比较;b:P < 0.05,c:P < 0.01,与MRL/lpr组比较 | |||
2.3 香叶木素对MRL/lpr狼疮性肾炎小鼠血清中IL-1β、IL-6及TNF-α水平的影响
与对照组比较,MRL/lpr组小鼠血清IL-1β、IL-6和TNF-α水平均显著升高(P < 0.01);与MRL/lpr组比较,地塞米松组小鼠血清IL-1β、IL-6和TNF-α水平均显著下调(P < 0.01),香叶木素中、高剂量组小鼠血清IL-1β、IL-6和TNF-α水平均显著下调(P < 0.05,P < 0.01),见表 2。
| 组别 | IL-1β | IL-6 | TNF-α |
| 对照组 | 10.08±1.58 | 22.69±2.34 | 40.10±4.66 |
| MRL/lpr组 | 41.53±3.60a | 128.61±17.02a | 345.69±23.18a |
| 地塞米松组 | 22.63±3.18c | 42.38±4.16c | 101.86±15.66c |
| 香叶木素低剂量组 | 36.11±3.08 | 118.59±13.81 | 307.33±21.75 |
| 香叶木素中剂量组 | 29.51±2.59b | 87.34±9.85b | 236.15±17.89b |
| 香叶木素高剂量组 | 23.18±2.51c | 74.73±6.97c | 158.49±17.11c |
| a:P < 0.01,与对照组比较;b:P < 0.05,c:P < 0.01,与MRL/lpr组比较 | |||
2.4 香叶木素对MRL/lpr狼疮性肾炎小鼠肾脏组织中IL-1β、IL-6及TNF-α水平的影响
与对照组比较,MRL/lpr组小鼠肾组织中IL-1β、IL-6和TNF-α水平均显著升高(P < 0.01);与MRL/lpr组比较,地塞米松组小鼠肾组织中IL-1β、IL-6和TNF-α水平均显著下调(P < 0.01),香叶木素中、高剂量组小鼠肾组织中IL-1β、IL-6和TNF-α水平均显著下调(P < 0.05,P < 0.01),见表 3。
| 组别 | IL-1β | IL-6 | TNF-α |
| 对照组 | 2.64±0.88 | 12.88±3.37 | 32.51±5.01 |
| MRL/lpr组 | 12.91±1.79a | 93.11±10.64a | 207.76±21.99a |
| 地塞米松组 | 5.69±1.93c | 31.85±5.91c | 93.83±10.17c |
| 香叶木素低剂量组 | 11.29±1.19 | 83.77±7.83 | 187.69±18.19 |
| 香叶木素中剂量组 | 8.53±2.07b | 59.89±5.50b | 153.22±13.77b |
| 香叶木素高剂量组 | 6.82±1.17c | 47.33±4.23c | 118.01±9.59c |
| a:P < 0.01,与对照组比较;b:P < 0.05,c:P < 0.01,与MRL/lpr组比较 | |||
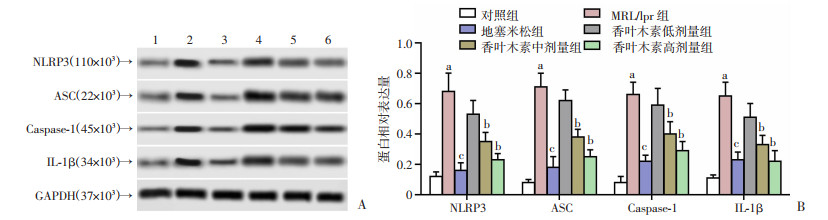
2.5 香叶木素对MRL/lpr狼疮性肾炎小鼠肾脏组织中NLRP3、ASC、Caspase-1、IL-1β蛋白表达的影响
与对照组比较,MRL/lpr组小鼠肾组织中NLRP3、ASC、Caspase-1和IL-1β的蛋白表达均显著升高(P < 0.01);与MRL/lpr组比较,地塞米松组小鼠肾组织中NLRP3、ASC、Caspase-1和IL-1β的蛋白表达均显著下调(P < 0.01),香叶木素中、高剂量组小鼠肾组织中NLRP3、ASC、Caspase-1和IL-1β的蛋白表达均显著下调(P < 0.05),见图 2。
|
|
1:对照组;2:MRL/lpr组;3:地塞米松组;4:香叶木素低剂量组;5:香叶木素中剂量组;6:香叶木素高剂量组;a:P < 0.01,与对照组比较;b:P < 0.05,c:P < 0.01,与MRL/lpr组比较 A:Western blot检测;B:半定量分析 图 2 各组小鼠肾脏组织中NLRP3、ASC、Caspase-1和IL-1β蛋白表达 |
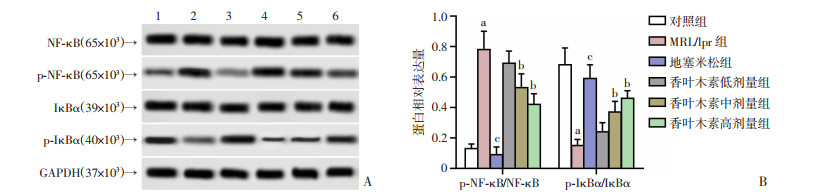
2.6 香叶木素对MRL/lpr狼疮性肾炎小鼠肾脏组织中p-NF-κB、p-IκBα蛋白表达的影响
与对照组比较,MRL/lpr组小鼠肾组织中p-NF-κB的蛋白表达显著升高(P < 0.01);与MRL/lpr组比较,地塞米松组小鼠肾组织中p-NF-κB的蛋白表达显著下调(P < 0.01),香叶木素中、高剂量组小鼠肾组织中p-NF-κB的蛋白表达均显著下调(P < 0.05);与对照组比较,MRL/lpr组小鼠肾组织中p-IκBα的蛋白表达显著下调(P < 0.01);与MRL/lpr组比较,地塞米松组小鼠肾组织中p-IκBα的蛋白表达显著上调(P < 0.01),香叶木素中、高剂量组小鼠肾组织中p-IκBα的蛋白表达均显著上调(P < 0.05),见图 3。
|
|
1:对照组;2:MRL/lpr组;3:地塞米松组;4:香叶木素低剂量组;5:香叶木素中剂量组;6:香叶木素高剂量组;a:P < 0.01,与对照组比较;b:P < 0.05,c:P < 0.01,与MRL/lpr组比较 A:Western blot检测;B:半定量分析 图 3 各组小鼠肾脏组织中p-NF-κB、p-IκBα蛋白表达 |
3 讨论
由于MRL/lpr小鼠病理表现与人类狼疮样特征相似,故常用作研究狼疮肾炎的动物模型[9-10]。本研究结果表明:与对照组相比,MRL/lpr狼疮性肾炎小鼠肾组织中有大量炎性细胞浸润,MRL/lpr组小鼠血清肌酐、血尿素氮和血清抗双链DNA抗体的水平均显著升高,MRL/lpr组小鼠血清和肾脏组织中IL-1β、IL-6和TNF-α的蛋白表达均显著升高。研究表明:香叶木素可有效缓解脂多糖诱导的急性肺损伤小鼠模型肺组织病理学改变,减轻炎症细胞浸润,能降低肺湿/干比,抑制支气管肺泡灌洗液中促炎细胞因子IL-1β、IL-6和TNF-α的释放,抑制MPO、MDA和ROS水平的升高[11];其可降低急性肝衰竭小鼠死亡率,抑制炎症介质和细胞因子的水平,并阻止IKK,IκBα和NF-κB p65的磷酸化水平,抑制肝细胞凋亡,发挥对内毒素诱导的小鼠急性肝衰竭的保护作用[12];还可减轻肾功能损伤和肾管结构损伤,缓解炎症反应和肾小管凋亡,促进抗氧化蛋白表达显著增加,从而缓解肾脏缺血再灌注造成的损伤[8]。本研究结果显示:香叶木素治疗后,肾脏炎性细胞的浸润也减少,且小鼠血清肌酐、血尿素氮和血清抗双链DNA抗体的水平均显著下调;同时,小鼠血清和肾脏组织中IL-1β、IL-6和TNF-α的蛋白表达均显著下调,提示香叶木素能够缓解MRL/lpr狼疮性肾炎小鼠炎症作用。
由于NLRP3炎症小体不受控制的激活是多种自身免疫性疾病和代谢紊乱的主要原因之一,必须防止NLRP3炎症小体在生理和病理条件下的异常激活[13]。在狼疮性肾炎中,过度的炎症反应会对机体造成损害。激活NLRP3/ASC/Caspase-1驱动狼疮性肾炎炎症小体,导致IL-1β产生增加,是导致MLR/lpr小鼠肾脏损伤的主要原因,NLRP3炎症小体激活促进狼疮性肾炎进展[14]。因此,NLRP3炎性小体可能是狼疮性肾炎的一个潜在治疗靶点。此外,最近的证据表明:姜黄素通过抑制NLRP3炎性小体的活化减轻MRL/lpr狼疮性肾炎小鼠病理损伤[15]。在MRL-lpr小鼠中,原花青素B2通过抑制NLRP3炎症小体的激活抑制狼疮性肾炎的发展[16]。胡椒碱通过靶向AMPK介导的NLRP3炎症小体的激活来改善狼疮性肾炎[17]。在本研究中,MRL/lpr组小鼠肾组织中NLRP3、ASC、Caspase-1和IL-1β的蛋白表达均显著升高,香叶木素治疗后,小鼠肾组织中NLRP3、ASC、Caspase-1和IL-1β的蛋白表达均显著下调。香叶木素显著提高Nrf2及其靶基因HO-1的表达,阻断肺组织中NLRP3炎症小体的激活,揭示了香叶木素通过激活Nrf2和抑制NLRP3炎性小体对脂多糖诱导的急性肺损伤的保护作用[11]。以上结果表明:香叶木素通过抑制NLRP3炎症小体的激活从而发挥对狼疮性肾炎的保护作用。
有研究表明髓系细胞中的NF-kB信号通路介导免疫介导性系统性红斑狼疮的发病机制[18]。在正常情况下,NF-κB以无活性复合物的形式存在于细胞质中。一旦配体抑制剂IκB被IκB激酶复合物磷酸化,NF-κB被分离并迅速转移到细胞核中参与炎症相关基因的转录[19]。淫羊藿苷通过抑制NF-κB激活和NLRP3炎性小体激活[20]缓解小鼠狼疮性肾炎。香叶木素通过抑制NF-kB的活化,改善了蛙皮素诱导的小鼠急性胰腺炎[21]。在本研究中,MRL/lpr组小鼠肾组织中p-NF-κB的蛋白表达显著升高,香叶木素治疗后,小鼠肾组织中p-NF-κB的蛋白表达均显著下调。然而,MRL/lpr组小鼠肾组织中p-IκBα的蛋白表达显著下调,香叶木素治疗后,小鼠肾组织中p-IκBα的蛋白表达均显著上调。以上结果表明:香叶木素通过抑制NF-kB信号通路的活化从而发挥对狼疮性肾炎的保护作用。
综上所述,香叶木素对MRL/lpr狼疮肾炎小鼠的肾脏具有显著保护作用,其作用机制可能与抑制NLRP3炎症小体的活化和抑制NF-κB信号通路有关。本研究初步揭示了香叶木素对狼疮性肾炎的作用机制,为狼疮肾炎的治疗提供了新的思路,也为香叶木素的临床应用提供了一定的理论依据。
| [1] |
AIRY M, EKNOYAN G. Lupus nephritis: a historical appraisal of how a skin lesion became a kidney disease[J]. Clin Nephrol, 2019, 91(6): 325-333. |
| [2] |
韦婷婷, 黄雪霞, 李丽容, 等. 中医药治疗狼疮性肾炎的研究进展[J]. 湖南中医杂志, 2021, 37(9): 194-196. WEI T T, HUANG X X, LI L R, et al. Research progress on treatment of lupus nephritis with traditional chinese medicine[J]. Hunan J Tradit Chin Med, 2021, 37(9): 194-196. |
| [3] |
JOLLY M, TOLOZA S, GOKER B, et al. Disease-specific quality of life in patients with lupus nephritis[J]. Lupus, 2018, 27(2): 257-264. |
| [4] |
MEIRINHOS J, SILVA B M, VALENTÃO P, et al. Analysis and quantification of flavonoidic compounds from Portuguese olive (Olea europaea L.) leaf cultivars[J]. Nat Prod Res, 2005, 19(2): 189-195. |
| [5] |
ZHANG Y, JIANG Y L, LU D J. Diosmetin suppresses neuronal apoptosis and inflammation by modulating the phosphoinositide 3-kinase (PI3K)/AKT/nuclear factor-κB (NF-κB) signaling pathway in a rat model of pneumococcal meningitis[J]. Med Sci Monit, 2019, 25: 2238-2245. |
| [6] |
陈新亮, 陈志宝. 香叶木素改善顺铂诱导的鼠肾小管上皮细胞的损伤[J]. 黑龙江八一农垦大学学报, 2021, 33(5): 93-99. CHEN X L, CHEN Z B. Diosmetin improvement cisplatin-induced damage to rat renal tubular epithelial cells[J]. J Heilongjiang August First Land Reclam Univ, 2021, 33(5): 93-99. |
| [7] |
王元元, 李洪涛, 陆杨, 等. 甘草酸对MRL/lpr小鼠狼疮性肾炎的治疗作用[J]. 南方医科大学学报, 2017, 37(7): 957-961. WANG Y Y, LI H T, LU Y, et al. Protective effects of glycyrrhizic acid against lupus nephritis in MRL/lpr mice[J]. J South Med Univ, 2017, 37(7): 957-961. |
| [8] |
YANG K, LI W F, YU J F, et al. Diosmetin protects against ischemia/reperfusion-induced acute kidney injury in mice[J]. J Surg Res, 2017, 214: 69-78. |
| [9] |
DANG W Z, LI H, JIANG B, et al. Therapeutic effects of artesunate on lupus-prone MRL/lpr mice are dependent on T follicular helper cell differentiation and activation of JAK2-STAT3 signaling pathway[J]. Phytomedicine, 2019, 62: 152965. |
| [10] |
LI Q R, TAN S R, XU K, et al. Curcumin attenuates lupus nephritis in MRL/lpr mice by suppressing macrophage-secreted B cell activating factor (BAFF)[J]. Int J Clin Exp Pathol, 2019, 12(6): 2075-2083. |
| [11] |
LIU Q M, CI X X, WEN Z M, et al. Diosmetin alleviates lipopolysaccharide-induced acute lung injury through activating the Nrf2 pathway and inhibiting the NLRP3 inflammasome[J]. Biomol Ther (Seoul), 2018, 26(2): 157-166. |
| [12] |
YANG Y, GONG X B, HUANG L G, et al. Diosmetin exerts anti-oxidative, anti-inflammatory and anti-apoptotic effects to protect against endotoxin-induced acute hepatic failure in mice[J]. Oncotarget, 2017, 8(19): 30723-30733. |
| [13] |
SONG N, LI T. Regulation of NLRP3 inflammasome by phosphorylation[J]. Front Immunol, 2018, 9: 2305. |
| [14] |
张清平, 陈永旺. 栀子苷通过抑制NLRP3炎症小体激活治疗MRL/lpr小鼠狼疮性肾炎[J]. 中国免疫学杂志, 2021, 37(17): 2082-2086. ZHANG Q P, CHEN Y W. Geniposide treats MRL/lpr mice lupus hephritis by inhibiting NLRP3 inflammasome activation[J]. Chin J Immunol, 2021, 37(17): 2082-2086. |
| [15] |
ZHAO J J, WANG J H, ZHOU M J, et al. Curcumin attenuates murine lupus via inhibiting NLRP3 inflammasome[J]. Int Immunopharmacol, 2019, 69: 213-216. |
| [16] |
HE J H, SUN M C, TIAN S J. Procyanidin B2 prevents lupus nephritis development in mice by inhibiting NLRP3 inflammasome activation[J]. Innate Immun, 2018, 24(5): 307-315. |
| [17] |
PENG X, YANG T, LIU G, et al. Piperine ameliorated lupus nephritis by targeting AMPK-mediated activation of NLRP3 inflammasome[J]. Int Immunopharmacol, 2018, 65: 448-457. |
| [18] |
CHALMERS S A, GARCIA S J, REYNOLDS J A, et al. NF-kB signaling in myeloid cells mediates the pathogenesis of immune-mediated nephritis[J]. J Autoimmun, 2019, 98: 33-43. |
| [19] |
BAEUERLE P A, BALTIMORE D. A 65-kappaD subunit of active NF-kappaB is required for inhibition of NF-kappaB by I kappaB[J]. Genes Dev, 1989, 3(11): 1689-1698. |
| [20] |
SU B F, YE H, YOU X H, et al. Icariin alleviates murine lupus nephritis via inhibiting NF-κB activation pathway and NLRP3 inflammasome[J]. Life Sci, 2018, 208: 26-32. |
| [21] |
YU G, WAN R, YIN G J, et al. Diosmetin ameliorates the severity of cerulein-induced acute pancreatitis in mice by inhibiting the activation of the nuclear factor-κB[J]. Int J Clin Exp Pathol, 2014, 7(5): 2133-2142. |




