2. 563000 贵州 遵义,遵义医科大学附属医院心血管内科
2. Department of Cardiovascular Diseases, Affiliated Hospital of Zunyi Medical University, Zunyi, Guizhou Province, 563000, China
饮酒会导致严重的心血管并发症,尤其是酒精性心肌病(alcoholic cardiomyopathy,ACM)。ACM主要表现为间质纤维化和心肌功能不全,最终演变为心力衰竭[1]。虽然ACM的确切机制尚不清楚,但目前认为氧化应激在ACM的发生发展中起着重要作用。大量研究指出,饮酒引起的氧化应激增加了心肌纤维化,加重了心功能损害[2]。在心肌纤维化期间,心肌胶原含量增加。研究发现,在病理条件下,心肌胶原在正常水平以上增加2~3倍会导致左室僵硬和功能障碍增加[3]。组织蛋白酶K(cathepsin K,CatK)是最有效的哺乳动物胶原酶之一[4],最近的证据表明,CatK参与介导细胞蛋白质周转、胶原降解和细胞外基质重塑[5]。此外,CatK在肥厚和衰竭心脏中的表达增加,而敲除CatK可以减轻肥胖和压力超负荷相关的心功能不全[6]。然而,CatK在ACM中的明确作用或潜在机制仍不清楚。因此,本研究探讨CatK抑制对ACM引起的心脏结构和功能改变的作用及机制。
1 材料与方法 1.1 ACM模型的建立48只8周龄C57BL/6J雄性小鼠购自北京维通利华实验动物技术有限公司[合格证编号:SCXK(京)2016-0006],置于温控室内、12 h/12 h的光/暗循环环境下饲养。将小鼠按随机数字表法分为对照组(n=12,等热量麦芽糖糊精对照液体饲料喂养,南通特洛菲饲料科技有限公司)和模型组(n=36,4%乙醇Lieber- DeCarli液体饲料喂养,南通特洛菲饲料科技有限公司)[7]。8周后,用VEVO3100超声系统(日本Fujifilm-visualonics公司)检测小鼠的心功能。以超声心动图心脏收缩功能下降的模型组小鼠为ACM,将ACM小鼠分为:ACM组、sh-NC组、sh-CatK组,每组12只。分别向sh-NC组和sh-CatK组小鼠鼠尾静脉注射1×109 vg(100 μL,生理盐水溶解)Scramble-shRNA和CatK-shRNA的重组腺病毒。表达CatK-shRNA的重组腺病毒载体以及Scramble-shRNA阴性对照由上海吉玛制药技术有限公司设计并合成。重组腺病毒注射后4周处死小鼠,收集被处死小鼠的左心室心肌作进一步实验。
1.2 超声心动图在第8周末和第12周末,小鼠用1.5%异氟醚麻醉后进行经胸超声心动图检查。采用M型超声心动图测量以下心脏参数:射血分数、短缩分数、收缩期左室后壁厚度(systole left ventricle posterior wall thickness,LVPWs)、舒张期左室后壁厚度(diastole left ventricle posterior wall thickness,LVPWd)。
1.3 组织病理学和免疫组织化学左心室心肌用4%多聚甲醛固定,乙醇梯度脱水,石蜡包埋。制备4.5 μm厚的组织切片。苏木精-伊红(HE)染色和Masson三色染色评价心肌细胞横截面积和心肌间质纤维化。将连续切片脱石蜡和再水化,然后与抗CatK(1∶250,英国Abcam公司)和Nox4(1∶200,上海Abways公司)一起孵育过夜。然后在室温下用二级抗体(美国Santa Cruz公司)染色1 h。使用CX31显微镜(日本Olympus公司)进行检查。
1.4 细胞培养H9c2小鼠心肌细胞系从上海生物化学与细胞生物学研究所获得,接种在含有4.5 mmol/L D-葡萄糖、10%胎牛血清、100 U/mL青霉素和100 mg/mL链霉素的高糖DMEM培养基(美国Gibco公司)中生长。为了评价乙醇对H9c2细胞中CatK蛋白表达的影响,将H9c2细胞暴露于不同时间(0、4、8、16、24和48 h)的乙醇中。为了评价CatK-shRNA介导的CatK沉默对酒精诱导的心肌细胞损伤的影响,将细胞接种于6孔板上,转染Scramble-shRNA或CatK-shRNA,将H9c2分为4组:对照组(不含乙醇),乙醇组(含乙醇,200 mmol/L[8]),乙醇+Scramble-shRNA(sh-NC,10 nmol/L)组和乙醇+CatK-shRNA(sh-CatK,10 nmol/L)组。24 h后收集细胞和培养基进行进一步实验。
1.5 蛋白质印迹分析将上述处理的H9c2细胞在含有磷酸酶和蛋白酶抑制剂(美国Merck Corporation公司)的细胞裂解缓冲液(美国Cell signaling technology公司)中裂解,并通过BCA Bradford蛋白分析试剂盒(上海Beyotime公司)测定蛋白含量,然后将蛋白质与负载缓冲液混合并煮沸10 min。用SDS-PAGE凝胶分离等量提取物(50 μg)并转移到硝化纤维素膜(美国Bio-rad公司)。用5%的脱脂奶粉封闭细胞膜2 h,然后在4 ℃下与抗CatK(1∶1 000,英国Abcam公司)、Ⅰ型胶原(COL-1,1∶1 000,武汉Boster公司)、转化生长因子-β(TGF-β,1∶1 000,武汉Boster公司)、AMPK(1∶1 000,上海Abways公司)、p-AMPK(1∶1 000,上海Abways公司)、Nox4(1∶1 000,上海Abways公司)和β-actin(1∶3 000,上海Abways公司)孵育过夜。第2天,用适当的辣根过氧化物酶结合二级抗体(1∶10 000,上海Abways公司)在室温下孵育1 h。通过Tanon 5200化学发光成像系统(上海天能科技有限公司)观察免疫复合物。
1.6 流式细胞仪分析应用Annexin V-FITC凋亡检测试剂盒(江苏凯基生物技术股份有限公司)进行流式细胞术检测H9c2细胞凋亡。取处理后细胞,用Annexin V和PI双重染色。然后用流式细胞仪(美国BD公司)对细胞进行分析。
1.7 MDA、SOD活性测定用荧光染料二氢乙胺(dihydroethidium,DHE)测定小鼠心肌组织和体外培养的H9c2细胞的活性氧(ROS)生成。将新鲜冷冻心肌切片和H9c2细胞在37 ℃下用DHE(10 μm)孵育30 min。在CX31显微镜下观察组织切片和细胞的荧光图像(激发520 nm和发射590 nm)。使用试剂盒(中国南京建城生物工程研究所)测定小鼠心肌组织中MDA水平和SOD活性。
1.8 统计学分析使用SPSS 21.0进行统计分析,数据以x±s表示。采用非配对t检验对两组数据进行分析。采用单因素方差分析(ANOVA)和Bonferroni事后检验来确定多组间的统计差异。P<0.05为差异具有统计学意义。
2 结果 2.1 CatK在ACM小鼠心功能不全中的作用乙醇喂养12周后,小鼠表现出明显的ACM症状,包括射血分数和缩短分数降低,并伴有左室后壁舒张内径的增加(表 1)。HE染色和Masson染色显示,ACM组心肌细胞表面积和心肌纤维化面积较对照组均显著增加(P<0.05),表明乙醇诱导心肌细胞肥大(图 1A~C)。通过免疫组化检测CatK在各组中的表达情况。与对照组相比,ACM组心肌组织中CatK蛋白显著增加(P<0.05),而sh-CatK治疗显著抑制了ACM小鼠心肌组织中CatK蛋白表达(P<0.05,图 1D),并且显著降低了ACM小鼠心肌细胞表面积和心肌纤维化面积(P<0.05)。表明sh-CatK治疗显著减轻了乙醇诱导的心功能不全,但对血液乙醇水平没有影响,提示sh-CatK对ACM小鼠心脏保护作用并非归因于血清乙醇的清除(表 1)。
| 指标 | 对照组 | ACM组 | sh-NC组 | sh-CatK组 |
| 心脏质量/体质量/mg·g-1 | 5.16±0.34 | 6.24±0.07a | 6.35±0.01a | 5.40±0.16b |
| 心率/次·min-1 | 456±4 | 438±3 | 431±2 | 450±6 |
| 射血分数(%) | 65.00±3.17 | 40.39±1.86a | 40.04±2.51a | 67.75±2.72b |
| 缩短分数(%) | 35.15±2.90 | 18.64±1.34a | 18.85±1.32a | 37.07±2.07b |
| 左室质量/mg | 59.90±2.82 | 88.76±2.94a | 87.80±3.57a | 69.95±2.76b |
| LVPWs/mm | 1.15±0.02 | 1.02±0.07 | 1.00±0.06 | 1.17±0.08 |
| LVPWd/mm | 0.65±0.02 | 0.78±0.02a | 0.78±0.03a | 0.66±0.03b |
| 血液酒精/mg·dL-1 | - | 3.30±0.17 | 3.36±0.18 | 3.27±0.15 |
| a: P<0.05,与对照组比较;b: P<0.05,与ACM组比较 | ||||

|
|
1:对照组;2:ACM组;3:sh-NC组;4:sh-CatK组; a: P<0.05,与对照组比较; b: P<0.05,与ACM组比较 A: 各组小鼠心脏组织的HE和Masson染色;B: 心肌细胞表面积的定量分析;C: 心肌纤维化面积的定量分析;D: 免疫组化分析各组心肌组织中CatK蛋白表达及定量分析 图 1 CatK在ACM小鼠心功能不全中的作用(n=6) |
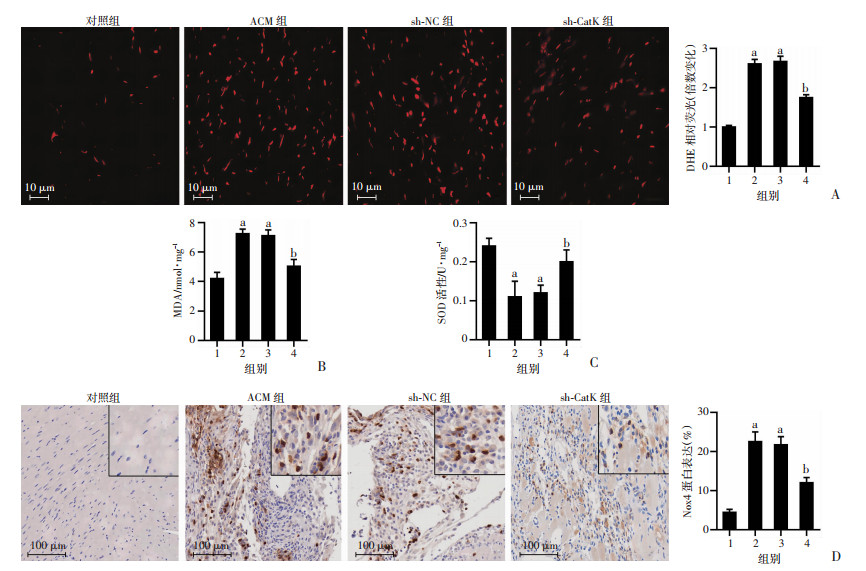
2.2 抑制CatK改善ACM小鼠氧化应激
通过DHE染色法测定小鼠心脏组织氧化应激水平。与对照组相比,ACM组小鼠心肌组织中超氧化物的产生、脂质过氧化标志物MDA水平以及Nox4蛋白表达明显增加(P<0.05),而抗氧化酶SOD活性明显降低(P<0.05)。CatK抑制减少了ACM小鼠心肌组织中超氧化物的产生、MDA水平和Nox4蛋白表达(P<0.05),同时增加了SOD活性(P<0.05)。见图 2。
|
|
1:对照组;2:ACM组;3:sh-NC组;4:sh-CatK组; a: P<0.05,与对照组比较; b: P<0.05,与ACM组比较 A: 各组小鼠心脏组织的DHE荧光染色;B、C: 各组小鼠心脏组织的MDA和SOD表达水平;D: 免疫组化分析各组心肌组织中Nox4蛋白表达及定量分析 图 2 CatK抑制改善ACM小鼠氧化应激水平(n=6) |
2.3 抑制CatK减轻乙醇诱导的心肌细胞凋亡及氧化应激
随着暴露于乙醇中的时间不断延长,H9c2细胞中CatK蛋白表达不断增加,并在24 h达到峰值(P<0.05,图 3A)。在乙醇存在下,H9c2细胞凋亡率和氧化应激水平明显增加(P<0.05),而CatK抑制处理显著降低了H9c2细胞凋亡和氧化应激水平(P<0.05,图 3B、C)。研究进一步检测AMPK/Nox4信号通路是否参与CatK对心肌细胞的作用。如图 3D所示,H9c2细胞暴露于乙醇后AMPK磷酸化表达减弱,Nox4蛋白、纤维细胞胶原COL-1和TGF-β表达增强,而CatK抑制处理逆转了这些变化(P<0.05)。

|
| A: 蛋白质印迹分析不同乙醇暴露对H9c2细胞中CatK蛋白表达影响及定量分析;a: P<0.05,与0 h比较;B: 流式细胞分析各组细胞凋亡及定量分析;C: 各组细胞的DHE荧光染色;D: 蛋白质印迹分析各组细胞的AMPK/Nox4信号通路表达及定量分析;1:对照组;2:乙醇组;3:乙醇+sh-NC组;4:乙醇+sh-CatK组; a: P<0.05,与对照组比较; b: P<0.05,与乙醇组比较 图 3 CatK抑制减轻乙醇诱导的心肌细胞凋亡及氧化应激(n=3) |
3 讨论
ACM是一种在长期饮酒人群中常见的心血管并发症,最终导致心力衰竭[9]。ACM与心脏的结构和功能改变有关,导致舒张和收缩功能障碍以及氧化损伤。因此,亟需确定ACM相关心功能不全的靶点。在目前的研究中,体内实验显示,ACM小鼠中CatK的过度表达引起细胞外基质的沉积和心功能的恶化。同样,体外实验结果表明,乙醇刺激了H9c2心肌细胞中CatK上调,并诱导细胞凋亡、氧化应激水平增加以及促纤维化因子的产生。此外,shRNA介导的CatK沉默可抑制乙醇的这些不良作用。这些数据表明CatK可以作为减轻ACM相关心脏功能障碍的治疗靶点。
先前研究证实,在人类动脉粥样硬化病变中,CatK的表达增加[10],与大多数其他胱氨酰组织蛋白酶不同,CatK具有强大的胶原蛋白溶解和弹性蛋白溶解活性[11]。在主动脉中,弹性蛋白溶解和胶原溶解削弱了动脉壁,有利于血管扩张,增加了血液中的白细胞浸润,最终导致破裂[10]。CatK敲除减少了动脉弹性蛋白溶解和胶原溶解,如在CatK-/-小鼠出现了较小的动脉粥样硬化和动脉瘤病变[12]。此外,有研究证明,CatK基因敲除可以防止高脂饮食和腹主动脉收缩引起的心肌肥大和功能障碍[5],与先前观察结果一致。在本研究中,饮酒导致小鼠心室扩大[13],而CatK基因抑制可减轻ACM相关的左室质量、LVPWd增加以及射血分数、缩短分数降低。心肌纤维化是导致心功能不全的主要诱因之一,无论病因如何,心脏纤维化都会增加终末期心力衰竭患者心脏病发病率和病死率的风险[14]。本研究结果表明,饮酒诱导小鼠心肌纤维化面积增加,CatK抑制降低ACM小鼠心肌纤维化面积,并减轻乙醇诱导的H9c2心肌细胞胶原和TGF-β的生成。这些数据表明,CatK活性降低可能对ACM引起的心脏改变有保护作用。
本研究数据表明,CatK在心肌损伤中起着一定作用,因为CatK抑制的ACM小鼠体内心肌氧化应激水平明显下降,氧化应激参与了ACM的病理过程。作为氧化应激NADPH氧化酶(Nox)的一个常见来源,Nox4在心脏中大量表达,其介导了心肌成纤维细胞向肌成纤维细胞的分化[15-16]。酒精摄入引起的乙醛累积可上调Nox4及其亚单位的蛋白表达,从而增加心肌细胞线粒体衍生的ROS[17]。本研究结果表明,CatK抑制减少了ACM小鼠心肌组织中超氧化物的产生和MDA水平,同时增加了SOD活性,这些作用可能与Nox4蛋白表达下调有关。氮氧化物衍生的活性氧参与多种心血管疾病。据报道,Nox4-ROS途径会加重衰竭心脏的促纤维化反应、重塑过程和心功能恶化[18]。PAN等[19]发现Nox4的敲除减弱了由AngⅡ刺激的心肌成纤维细胞中ROS的产生和心肌纤维化反应。最近的研究发现,AMPK作为一种抗氧化剂,其通过抑制Nox4信号表达减少主动脉内皮细胞中活性氧的产生,在血管平滑肌细胞重构中发挥作用[20]。本研究中,CatK抑制促进了H9c2细胞中AMPK磷酸化,进而减弱了Nox4蛋白、纤维细胞胶原COL-1和TGF-β表达。因此,CatK可能通过AMPK/Nox4信号通路参与ACM引起的心功能不全。
综上所述,饮酒导致心肌重塑,最终出现心功能不全。CatK通过促进AMPK/Nox4信号通路介导的氧化应激参与ACM小鼠心功能不全的病理过程,CatK可能作为减轻ACM相关心脏功能障碍的治疗靶点。
| [1] |
WANG S Y, REN J. Role of autophagy and regulatory mechanisms in alcoholic cardiomyopathy[J]. Biochim Biophys Acta Mol Basis Dis, 2018, 1864(6 Pt A): 2003-2009. |
| [2] |
WARE J S, AMOR-SALAMANCA A, TAYAL U, et al. Genetic etiology for alcohol-induced cardiac toxicity[J]. J Am Coll Cardiol, 2018, 71(20): 2293-2302. |
| [3] |
TALMAN V, RUSKOAHO H. Cardiac fibrosis in myocardial infarction-from repair and remodeling to regeneration[J]. Cell Tissue Res, 2016, 365(3): 563-581. |
| [4] |
HEO S C, KIM Y N, CHOI Y, et al. Elevated expression of cathepsin K in periodontal ligament fibroblast by inflammatory cytokines accelerates osteoclastogenesis via paracrine mechanism in periodontal disease[J]. Int J Mol Sci, 2021, 22(2): 695. |
| [5] |
FANG W Q, HE A N, XIANG M X, et al. Cathepsin K-deficiency impairs mouse cardiac function after myocardial infarction[J]. J Mol Cell Cardiol, 2019, 127: 44-56. |
| [6] |
GUO R, HUA Y N, ROGERS O, et al. Cathepsin K knockout protects against cardiac dysfunction in diabetic mice[J]. Sci Rep, 2017, 7(1): 8703. |
| [7] |
廉虹, 刘立会, 聂宇. 液质饲料喂养制备酒精性心肌病小鼠模型[J]. 中国比较医学杂志, 2020, 30(5): 40-46. LIAN H, LIU L H, NIE Y. Establishment of a mouse model of alcoholic cardiomyopathy with liquid feed[J]. Chin J Comp Med, 2020, 30(5): 40-46. |
| [8] |
GAO W Q, PAN B, LIU L J, et al. Alcohol exposure increases the expression of cardiac transcription factors through ERK1/2-mediated histone3 hyperacetylation in H9c2 cells[J]. Biochem Biophys Res Commun, 2015, 466(4): 670-675. |
| [9] |
卢薇, 王宁夫. 酒精性心肌损伤的临床分类及其临床特点分析[J]. 中华医学杂志, 2019, 99(41): 3237-3242. LU W, WANG N F. Clinical classification and characteristics of alcoholic myocardial injury[J]. Natl Med J China, 2019, 99(41): 3237-3242. |
| [10] |
LIU C L, GUO J L, ZHANG X, et al. Cysteine protease cathepsins in cardiovascular disease: from basic research to clinical trials[J]. Nat Rev Cardiol, 2018, 15(6): 351-370. |
| [11] |
MCGLINCHEY R P, LACY S M, WALKER R L 3rd, et al. Cathepsin K is a potent disaggregase of α-synuclein fibrils[J]. Biochem Biophys Res Commun, 2020, 529(4): 1106-1111. |
| [12] |
SUN J S, SUKHOVA G K, ZHANG J, et al. Cathepsin K deficiency reduces elastase perfusion-induced abdominal aortic aneurysms in mice[J]. Arterioscler Thromb Vasc Biol, 2012, 32(1): 15-23. |
| [13] |
路倩, 赵唯安, 刘玲娟, 等. 父代饮酒致子代小鼠心脏发育异常的组蛋白乙酰化修饰机制[J]. 中国病理生理杂志, 2019, 35(6): 975-980. LU Q, ZHAO W A, LIU L J, et al. Mechanisms of histone acetylation modification in paternal alcohol consumption-induced heart development abnormalities of offspring[J]. Chin J Pathophysiol, 2019, 35(6): 975-980. |
| [14] |
尹玉洁, 张倩, 旷湘楠, 等. 内皮间质转分化在心肌纤维化中的研究进展[J]. 中国药理学通报, 2019, 35(1): 12-16. YIN Y J, ZHANG Q, KUANG X N, et al. Research progress of endothelial mesenchymal transition in myocardial fibrosis[J]. Chin Pharmacol Bull, 2019, 35(1): 12-16. |
| [15] |
员小利, 井海云, 王丹. 丹参酮ⅡA通过抑制NADPH氧化酶保护心衰大鼠心肌纤维化的机制[J]. 安徽医科大学学报, 2019, 54(4): 600-604. YUAN X L, JING H Y, WANG D. Tanshinone ⅡA protects myocardial fibrosis in rats with heart failure by inhibiting NADPH oxidase[J]. Acta Univ Med Anhui, 2019, 54(4): 600-604. |
| [16] |
KAMIHARA T, BANDO Y K, MUROHARA T. Cardiac aging is regulated by autophagic disorder mediated by chronic inflammation via the Rubicon/Nox4 pathway[J]. Eur Heart J, 2020, 41(Supplement_2): ehaa946.0842. |
| [17] |
TAO Y L, ZHOU H, HUANG L L, et al. Schisandrin B protects against acute ethanol-induced cardiac injury by downregulating autophagy via the Nox4/ROS pathway[J]. Pharmacology, 2021, 106(3/4): 177-188. |
| [18] |
SONG H, REN J. Protocatechuic acid attenuates angiotensin Ⅱ-induced cardiac fibrosis in cardiac fibroblasts through inhibiting the Nox4/ROS/p38 signaling pathway[J]. Phytother Res, 2019, 33(9): 2440-2447. |
| [19] |
PAN L L, LIU X H, SHEN Y Q, et al. Inhibition of NADPH oxidase 4-related signaling by sodium hydrosulfide attenuates myocardial fibrotic response[J]. Int J Cardiol, 2013, 168(4): 3770-3778. |
| [20] |
MROUEH F M, NOURELDEIN M, ZEIDAN Y H, et al. Unmasking the interplay between mTOR and Nox4: novel insights into the mechanism connecting diabetes and cancer[J]. FASEB J, 2019, 33(12): 14051-14066. |




