血管瘤和血管畸形是常见的软组织病变,分类复杂,不易完整切除。婴儿毛细血管瘤和部分先天性血管瘤在增殖后期可自发消退,而血管畸形不可自行消退,需要医学干预以避免因血管过度增殖而出现的疼痛、功能障碍甚至面部受损等并发症[1],发现新的标记物鉴别血管瘤和血管畸形具有潜在临床应用价值。组蛋白修饰是表观遗传调控的机制之一,其中组蛋白H3 N-末端第27位氨基酸残基是主要的甲基化修饰位点,具有单甲基化、双甲基化和三甲基化3种形式,甲基化程度不同,对基因启动子区转录活性不同。H3K27me3的甲基化程度受多梳抑制复合物2(polycomb repressive complex 2, PRC2)的甲基转移酶Zeste的基因增强子人类同源物2(enhancer of zeste homolog 2, EZH2)调控,参与早期血管发育[2]。内皮细胞H3K27me3表达缺失与肺动脉高压肺血管重构有关,内皮细胞间质转化促进血管平滑增生是肺动脉高压的潜在分子机制之一[3]。本研究拟通过免疫组化检测27位氨基酸三甲基化的组蛋白3(the tri-methylation of lysine 27 on histone H3 protein, H3K27me3) 在血管瘤和血管畸形中的表达,评价其在血管瘤和血管畸形中的鉴别诊断价值,通过生物信息学数据库检索和在线分析探讨其在血管发育中的潜在作用。
1 资料与方法 1.1 病例选择收集来自福建医科大学附属第一医院病理科2010年1月至2021年6月库存169例血管瘤和75例血管畸形标本,其中89例为婴儿毛细血管瘤。标本使用经福建医科大学附属第一医院伦理委员会医学研究与临床技术应用分会批准(IEC-FOM-013-2.0)。手术时机为血管瘤外观稳定期,排除因溃疡出血等并发症施行手术的标本,术前均未使用类固醇激素治疗。血管瘤和血管畸形分类参照文献[4],由我院3位病理科医师分别独立完成,最后结合随访结果确定诊断。动静脉血管畸形与血管瘤鉴别的主要形态学依据有2个,一是镜下观察到明显的血管壁弹力纤维染色阳性的中、小动脉形态诊断为动静脉血管畸形;二是血管瘤生长较快,后期有消退趋势,血管畸形生长较慢,基本不消退。所有标本术后用4%福尔马林固定,常规石蜡包埋,经苏木精-伊红染色后筛选典型病变区域4 μm连续切片,行免疫组化染色。
1.2 免疫组化染色及评价应用全自动免疫组化染色仪(Leica BOND-MAX)对以下抗体行免疫组化染色,抗体信息如下:H3K27me3(Millipore Sigma,07-449,1∶2 000倍稀释)、平滑肌肌动蛋白(smooth muscle actin,SMA)、葡萄糖转运蛋白1抗体(glucose transporter 1,GLUT1)、分化簇34(cluster designation 34, CD34)均为福州迈新生物技术有限公司的即用型抗体。H3K27me3免疫组化评分参照半定量标准,每张切片选择H3K27me3染色最强的区域采集5个视野(×400)后,由尼康Cellsens图像分析软件计数阳性和阴性细胞数,根据公式:阳性表达率=阳性细胞/(阳性细胞+阴性细胞)的算术平均数,如表达出现显著异质性,则分别计算不同区域的阳性细胞数,再求平均值。用免疫组化双重染色技术显示H3K27me3和SMA在血管内皮和血管周细胞中的表达差异,参照试剂盒说明书进行(福州迈新生物有限公司,货号KIT-9998)。进行H3K27me3免疫组化染色,DAB染色后,蒸馏水漂洗后添加双重染色增强剂,37 ℃ 30 min进行SMA免疫组化染色,AEC显色,苏木精复染封片。GLUT-1免疫组化染色辅助婴儿血管瘤与其他血管瘤的鉴别。
1.3 H3K27me3在心血管系统发育的细胞类型及靶点基因筛选从高通量基因表达数据库(gene expression omnibus, GEO)下载HT U133芯片数据集GSE21212基因表达矩阵,利用R软件limma程序包对不同内皮细胞和非内皮细胞差异表达基因进行分析,结合文献选取前10个基因,在ENCODE网站(https://www.encodeproject.org/)对不同基因启动子区H3K27me3的富集情况进行分析,首先选择H3K27me3为靶点,再选择内皮细胞谱系,包括未分化和分化的细胞类型,点击进入相应的实验研究,在基因选框内输入需要查询的基因,获取H3K27me3在内皮细胞与不同差异表达基因交互作用的免疫共沉淀图谱。参考编号为ENCFF788LHJ、ENCFF646GYN、ENCFF612SMS、ENCFF504LAK、EENCFF452NQN、NCFF427QEV。完成富集分析及靶点基因筛选的链接网址(https://www.encodeproject.org/matrix/?type=Annotation&encyclopedia_version=current&award.project=ENCODE&targets.label=H3K27me3)。
1.4 统计学分析采用SPSS 21.0软件进行统计学分析,H3K27me3在不同血管瘤的表达水平用x±s表示,通过绘制受试者工作特征曲线(ROC),分析H3K27me3对血管瘤和血管畸形的鉴别诊断价值及最佳截点值、灵敏度和特异度。
2 结果 2.1 不同血管病变H3K27me3表达分析244例血管病变患者年龄范围为2个月~5岁,平均15.7岁,男女比例为5∶7,浅表皮肤血管瘤191例,深部软组织血管瘤53例,肿瘤最大径为(4.15±1.97) cm,H3K27me3在血管瘤内皮细胞呈中-强表达(阳性表达率在50%~90%),血管周细胞不表达或零星表达;而血管畸形内皮细胞几乎不表达或零星表达,个别肌周细胞少量表达(图 1)。不同血管病变H3K27me3的表达率如下:动静脉型血管畸形[(40.5± 17.5)%,n=34],海绵状血管畸形[(46.7±20.3)%,n=32],毛细血管畸形[(37.9±26.9)%,n=9],动静脉血管瘤[(74.2±8.7)%,n=9],毛细血管瘤[(51.7±13.8)%,n=129],海绵状血管瘤[(83.0±11.3)%,n=31],其中毛细血管瘤中有89例为婴儿血管瘤,H3K27me3在实性区和管腔形成区域的表达具有异质性(图 2)。
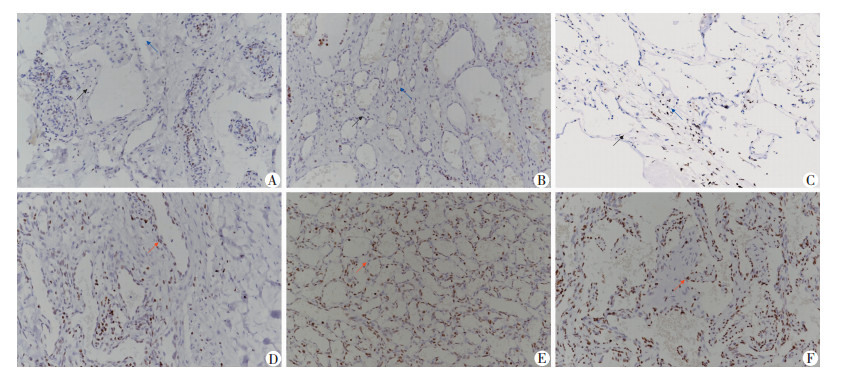
|
| A: 动静脉畸形;B: 毛细血管畸形;C: 海绵状畸形;D: 动静脉型血管瘤;E: 毛细血管瘤;F: 海绵状血管瘤;黑色箭头:示内皮细胞阴性表达;蓝色箭头:示少量阳性反应细胞;红色箭头:示内皮细胞阳性表达 图 1 H3K27me3在不同血管畸形和血管瘤中的表达 (×200) |

|
| A、B: HE染色和GLUT1染色;C、D: 富于细胞区HE染色和CD34内皮细胞染色;E、F: 管腔形成区HE染色和CD34内皮细胞染色;G、H: H3K27me3和SMA免疫组化双染红色为SMA阳性,在血管周细胞/平滑肌细胞表达;褐色为H3K27me3阳性,在内皮细胞核表达;黑色箭头:示缺失表达;蓝色箭头:示少量阳性反应细胞;红色箭头:示H3K27me3内皮细胞核阳性表达 图 2 H3K27me3/GLUT1/SMA/CD34在婴儿血管瘤中的表达(HE×100,IHC×400) |
2.2 H3K27me3/GLUT1/SMA/CD34在婴儿血管瘤表达分析
GLUT-1阳性易将婴儿血管瘤与其他血管肿瘤或血管畸形区分开,婴儿血管瘤临床特征是增殖后退化,且大多数婴儿血管瘤不需要治疗。H3K27me3在婴儿血管瘤的不同区域呈异质性表达,与其他血管瘤表达模式不同,实性区易表达丢失,管腔形成区域恢复表达。89例婴儿血管瘤实性区内皮细胞H3K27me3表达率为(26.5±5.6)%,管腔形成区H3K27me3表达率为(84.1±7.8)%,两者差异具有统计学意义(P<0.01)。见图 2。
2.3 H3K27me3在内皮细胞谱系相关基因的富集分析为了进一步探讨H3K27me3在血管内皮细胞表达的潜在调控靶点,本研究在ENCODE网站,选择不同的血管内皮细胞系,查看H3K27me3对前10个差异表达基因启动子区的富集程度,结果显示脐静脉内皮细胞(图 3A)、皮肤血管内皮细胞(图 3B)、脑微血管内皮细胞(图 3C)、肾毛细血管内皮细胞(图 3D)、肺动脉内皮细胞(图 3E)、肺微血管内皮细胞(图 3F)中SRY盒转录因子2(SRY-Box transcription factor 2, SOX2)的启动子区均有H3K27me3不同程度富集,SOX2与内皮细胞介导的血管新生及内皮细胞功能失调有关,其过表达不利于内皮细胞分化和血管腔形成,提示H3K27me3在内皮细胞谱系与SOX2相互作用可能与内皮细胞介导的血管发育和分化有关。

|
| A: 脐静脉内皮细胞; B: 皮肤血管内皮细胞; C: 脑微血管内皮细胞; D: 肾毛细血管内皮细胞; E: 肺动脉内皮细胞; F: 肺微血管内皮细胞 图 3 ECNODE网站血管内皮细胞SOX2启动子区H3K27me3富集分析结果 |
2.4 H3K27me3对血管瘤和血管畸形的鉴别诊断价值
前期免疫组化染色结果提示,H3K27me3在伴管腔形成的血管瘤内皮细胞中强表达,而在血管畸形内皮细胞中表达丢失,在婴儿血管瘤的不同区域呈异质性表达。为了进一步明确H3K27me3在血管瘤和血管畸形的鉴别诊断价值,为临床诊疗提供可靠的依据,本研究通过ROC曲线确立H3K27me3鉴别不同血管瘤和血管畸形的最佳表达界值,其中动静脉血管瘤和血管畸形的最佳临界值为46.5%,灵敏度为0.618,特异度为1.0,曲线下面积为0.894(图 4A),毛细血管瘤和血管畸形最佳临界值为23.5%,灵敏度为0.556,特异度为1.0,曲线下面积为0.676(图 4B);静脉型血管瘤和血管畸形的最佳临界值为74.5%,灵敏度为0.875,特异度为0.812,曲线下面积为0.867(图 4C)。

|
| A: 动静脉血管瘤vs动静脉畸形;B: 毛细血管瘤vs毛细血管畸形;C: 静脉型血管瘤vs静脉畸形 图 4 H3K27me3免疫组化染色鉴别不同血管瘤和血管畸形的ROC曲线分析 |
3 讨论
血管瘤和血管畸形是一组复杂异质性疾病,好发于婴幼儿,病理形态经常具有重叠性和多样性,二者的鉴别诊断是临床诊疗关键[4],鉴别二者的靶点基因筛选是血管肿瘤研究的热点。多梳家族蛋白(polycomb group,PcG)是一组通过染色质修饰介导基因沉默的转录抑制子, 包含2个核心蛋白复合体多梳抑制复合物1 (polycomb repressive complex 1,PRC1)和多梳抑制复合物2 (polycomb repressive complex 2,PRC2)。其中PRC1的核心成分Pc与组蛋白H3.3三甲基化修饰产物H3K27me3结合,维持基因沉默,而PRC2中的甲基转移酶EZH2催化H3K27发生三重甲基化,因此H3K27me3是PcG蛋白介导基因沉默的标记物[5]。
近年来研究表明,组蛋白甲基化修饰参与心血管系统疾病的发生发展。H3K27me3在具有晚期动脉粥样硬化斑块的血管中整体表达水平降低,这种低甲基化应激所致的炎症激活可能导致内皮功能障碍[6-7],提示内皮细胞H3K27me3表达缺失与血管内皮功能障碍有关。目前H3K27me3在血管发育异常的研究少见报道,本研究免疫组化染色结果显示:H3K27me3在不同类型的血管瘤中表达率为50%~90%,血管畸形内皮细胞表达率低于50%,甚至不表达;提示其缺失表达可能与血管异常发育和血管重塑有关。血管畸形的表现形态之一是血管周平滑肌细胞和血管周细胞的缺失,平滑肌22α蛋白(smooth muscle 22α,SM22α)是决定血管平滑肌细胞表型的关键分子。研究表明,EZH2介导的H3K27甲基化程度增加,后者与SM22α启动子区结合,抑制SM22α转录,不利于血管平滑肌分化[8-9],但我们的生物信息学分析仅发现一项有关H3K27me3在血管周平滑肌细胞调控的实验研究,而关于内皮细胞的调控研究则多达13项,涉及6种内皮细胞类型。也有研究发现,EZH2表达缺失,内皮细胞TGF-β1启动子的H3K27me3标记减少,触发内皮-间质分化(endothelial-to-mesenchymal transition, EndMT)过程,导致血管壁肌纤维母细胞增生伴纤维化,血管异常重塑[9]。据此我们推测,H3K27me3也可能通过EndMT过程,即内皮细胞在特殊情境下转分化获得肌成纤维细胞表型,间接参与血管壁的表观遗传学修饰,诱发血管畸变。
本研究还发现,婴儿毛细血管瘤实性区和管腔形成区域H3K27me3呈异质性表达。在实性区内皮细胞H3K27me3表达显著降低,而在血管腔形成良好的区域,H3K27me3在内皮细胞完整表达,伴管腔形成和血管周平滑肌细胞分化,提示H3K27me3在婴儿血管瘤呈动态表达。VASTENHOUW等[10]认为,H3K27me3和H3K4me3甲基化是二价染色质结构域最常见的拮抗表观遗传调节因子,H3K27me3标记使基因沉默,H3K4me3激活谱系分化特征基因表达。在胚胎发育早期,干细胞H3K27me3移除为H3K4me3激活和干细胞定向分化做准备;但在分化的细胞中H3K27me3再表达则有利于抑制分化谱系外发育基因表达,保持细胞分化和谱系特异性,二者的相互作用可促进血管生成信号激活和血管再生[11]。在胚胎发育过程中,原始成血管细胞可转化成微血管内皮细胞(microvascular endothelial cell, MVEC)和血管周平滑肌细胞(smooth muscle cell, SMC),其间通过表观遗传学调控控制分化相关基因的开放和关闭[12]。从数据集筛选和文献中获得内皮细胞特异性表达基因,经染色质免疫共沉淀富集分析发现:H3K27me3在不同内皮细胞SOX2启动子区不同程度富集,提示其在内皮细胞中与SOX2交互作用可能参与胚胎血管发育或缺氧微环境下血管重塑过程,但伴随内皮细胞的分化呈现动态表达过程。PRICKAERTS等[6]发现,注射血清来源的糖尿病外分泌囊泡ssEVs降低小鼠缺血后肢的血流灌注和毛细血管/小动脉密度,增强MVEC中EZH2和H3K27me3的表达,血管生成因子表达受抑,而EZH2特异性抑制剂则抑制H3K27me3促血管生成基因启动子的表达,促进血管生成。另有研究发现,实体瘤中的低氧条件下,缺氧肿瘤区域中组蛋白H3K27me3表达显著增加[5]。基于此, 我们假设内皮细胞H3K27me3在婴儿毛细血管瘤实性区和管腔形成期呈动态表达变化,可能与血管内皮细胞发育和分化有关,也可能与局部微环境改变有关。从二价染色质结构域表观遗传调控来看,婴儿血管瘤实性期H3K27me3缺失表达有利于血管瘤分化基因的激活,其在血管腔形成内皮细胞再表达则有助于维持血管分化状态。
ROC曲线分析提示,H3K27me3免疫组化染色在鉴别血管瘤和血管畸形时具有较高的敏感性和特异性。虽然H3K27me3在婴儿血管瘤呈异质性表达,但婴儿血管瘤是一种特殊类型的血管瘤,结合年龄和GLUT-1免疫组化染色与血管畸形鉴别并不困难,但其他血管瘤样本可能需要进一步扩大样本量来研究验证。
基于临床病理特征的免疫组化观察,本研究发现,H3K27me3在血管畸形的内皮细胞低表达或缺失表达,而在多数的血管瘤内皮细胞表达,对血管瘤和血管畸形具有一定的鉴别诊断价值。另一方面,H3K27me3在婴儿血管瘤的实性区与管腔分化区域呈异质性表达,实性区表达缺失,但在血管腔形成区内皮细胞表达伴完整血管周细胞形成,提示内皮细胞H3K27me3表达有助于维持血管腔分化状态,差异表达基因分析和免疫共沉淀分析提示内皮细胞中H3K27me3与SOX2交互作用可能介导血管发育和分化,是动态调控过程,可能与其在血管病变,特别是在婴儿型血管瘤中表达具有异质性。
| [1] |
何毅辉, 黄海建, 陈志忠, 等. 肝先天性血管瘤3例临床病理分析[J]. 临床与实验病理学杂志, 2021, 37(2): 224-226. HE Y H, HUANG H J, CHEN Z Z, et al. Clinicopathological analysis of 3 cases of hepatic congenital hemangiomas[J]. Chin J Clin Exp Pathol, 2021, 37(2): 224-226. |
| [2] |
CHENG Z J, NAGA SRIKANTH GARIKIPATI V, TRUONGCAO M M, et al. Serum-derived small extracellular vesicles from diabetic mice impair angiogenic property of microvascular endothelial cells: role of EZH2[J]. J Am Heart Assoc, 2021, 10(10): e019755. |
| [3] |
CHENG X Y, WANG Y, DU L Z. Epigenetic modulation in the initiation and progression of pulmonary hypertension[J]. Hypertension, 2019, 74(4): 733-739. |
| [4] |
中华医学会病理学分会儿科病理学组. 儿童脉管性病变诊断共识[J]. 中华病理学杂志, 2020, 49(3): 220-227. Subspecialty Group of Paediatrics of Society of Pathology of Chinese Medical Association. Expert consensus on the diagnosis of vasculitides in children[J]. Chin J Pathol, 2020, 49(3): 220-227. |
| [5] |
DI CROCE L, HELIN K. Transcriptional regulation by Polycomb group proteins[J]. Nat Struct Mol Biol, 2013, 20(10): 1147-1155. |
| [6] |
PRICKAERTS P, ADRIAENS M E, BEUCKEN T V D, et al. Hypoxia increases genome-wide bivalent epigenetic marking by specific gain of H3K27me3[J]. Epigenetics Chromatin, 2016, 9: 46. |
| [7] |
WIERDA R J, RIETVELD I M, VAN EGGERMOND M C, et al. Global histone H3 lysine 27 triple methylation levels are reduced in vessels with advanced atherosclerotic plaques[J]. Life Sci, 2015, 129: 3-9. |
| [8] |
LINO CARDENAS C L, KESSINGER C W, MACDONALD C, et al. Inhibition of the methyltranferase EZH2 improves aortic performance in experimental thoracic aortic aneurysm[J]. JCI Insight, 2018, 3(5): e97493. |
| [9] |
HULSHOFF M S, XU X B, KRENNING G, et al. Epigenetic regulation of endothelial-to-mesenchymal transition in chronic heart disease[J]. Arterioscler Thromb Vasc Biol, 2018, 38(9): 1986-1996. |
| [10] |
VASTENHOUW N L, SCHIER A F. Bivalent histone modifications in early embryogenesis[J]. Curr Opin Cell Biol, 2012, 24(3): 374-386. |
| [11] |
FRAINEAU S, PALII C G, MCNEILL B, et al. Epigenetic activation of pro-angiogenic signaling pathways in human endothelial progenitors increases vasculogenesis[J]. Stem Cell Rep, 2017, 9(5): 1573-1587. |
| [12] |
CHAI M M, GU C, SHEN Q H, et al. Hypoxia alleviates dexamethasone-induced inhibition of angiogenesis in cocultures of HUVECs and rBMSCs via HIF-1α[J]. Stem Cell Res Ther, 2020, 11: 343. |




