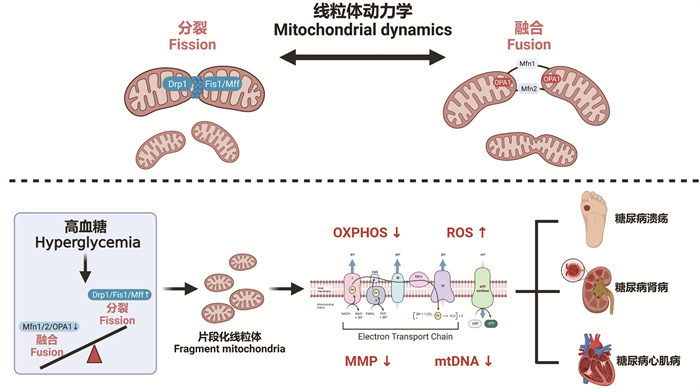
线粒体是一种高度动态变化的细胞器,其通过不断地融合与分裂以维持数量、形态与功能正常,而该动态平衡的过程称为线粒体动力学(mitochondrial dynamics)[1]。线粒体融合包括锚定、外膜融合、内膜融合与基质融合几个步骤,在哺乳动物体内主要受线粒体融合蛋白(mitofusin1,Mfn1和mitofusin2,Mfn2)及视神经萎缩蛋白1(opticatrophy1,OPA1)调控[1]。而线粒体分裂主要受线粒体动力蛋白1(dynaminrelated protein1,Drp1)及其受体蛋白Fis1(mitochondrial fission1 protein)和Mff(mitochondrial fission factor)调控,Drp1被其受体蛋白募集到线粒体后,在内质网和肌动蛋白相互协作下驱动Drp1蛋白收缩,直至线粒体分裂的发生[1]。
研究证实,线粒体融合/分裂蛋白功能增强或减弱均可打破线粒体动力学平衡,而后者是导致线粒体数量、形态及功能异常的关键。糖尿病时,高血糖及胰岛素信号通路障碍致使细胞能量生成与需求不匹配,造成能量缺口;同时,线粒体融合蛋白表达下调而分裂蛋白增加以代偿能量缺口,该过程虽增加线粒体数量,但却促进小的、片段化的和无功能的线粒体的产生[2-3]。随着糖尿病病程的进展,当线粒体动力学改变不能满足代偿过高的能量代谢需求时,则出现继发性功能障碍[4],如可导致糖尿病患者及动物模型中皮肤创缘、肾脏及心肌氧化磷酸化(oxidative phosphorylation, OXPHOS)功能受损、活性氧(reactive oxygen species,ROS)堆积、线粒体膜电位异常等,进而损伤上述组织[5]。因此,线粒体动力学紊乱与线粒体功能及糖尿病并发症的发生、发展密切相关(图 1)。
|
| 线粒体动力学是线粒体融合与分裂动态平衡的过程;线粒体融合主要受融合蛋白Mfn1、Mfn2及视神经萎缩蛋白OPA1的调控,而线粒体分裂主要由线粒体动力蛋白Drp1及其受体蛋白Fis1、Mff调控。高血糖促进分裂蛋白而抑制融合蛋白的表达,促使片段化线粒体形成,进而减弱线粒体呼吸链氧化磷酸化功能(OXPHOS),上调活性氧自由基(ROS)生成,致线粒体膜电位(MMP)去极化及线粒体DNA(mtDNA)异常,并最终参与糖尿病溃疡、肾病、心肌病的发生、发展 图 1 线粒体动力学在糖尿病溃疡、肾病及心肌病中的作用与机制 |
1 线粒体动力学与糖尿病溃疡
尽管已有包括降糖在内的多种方式应用于糖尿病溃疡的防治,糖尿病患者发生溃疡的终身风险仍高达25%[6]。既往研究表明,糖尿病时机体创口愈合能力减弱是导致溃疡迁延不愈的重要原因。创口愈合是一个高度协调的生理过程,可分为3个连续又相互重叠的阶段:①炎症反应期,止血、炎症细胞召集、细胞因子及生长因子的分泌;②增殖期,形成临时基质、新生血管以及上皮再生;③重塑期,肉芽组织重组以及成熟瘢痕的形成[7]。
研究发现,糖尿病时线粒体动力学失衡主要通过诱导线粒体氧化应激参与创口延迟愈合。糖尿病时,线粒体融合蛋白Mfn2在创缘表达降低,而分裂蛋白Fis1表达升高,提示糖尿病创口愈合与线粒体动力学失衡密切相关[8]。通过生物素标记的Cys-OH捕获探针及回复实验,KIM等[9]揭示了蛋白质二硫键异构酶A1(protein disulfide isomerase, PDIA1)为线粒体分裂蛋白Drp1的硫醇还原酶。内皮细胞PDIA1缺乏通过上调Drp1在Cys644上的磺基化水平及活性,在促进线粒体分裂及碎片化的同时增加ROS水平,进而加速内皮细胞衰老,延缓创口愈合过程;在糖尿病溃疡动物模型中,上调PDIA1表达或活性则可降低Drp1相关ROS堆积,并促进创口愈合。除Drp1以外,新近研究证实线粒体Rho-GTPase MIRO-1与细胞质Ca2+结合后,不依赖于Drp1促进线粒体分裂并增加线粒体碎片化,而通过上调线粒体ROS水平和细胞色素P450加速创口愈合[10]。目前,尚缺乏单独针对线粒体融合在糖尿病创口愈合中作用的研究;但也有证据提示融合蛋白Mfn2参与调控HeLa细胞的上皮-间质转化过程[11],而后者已被证实在创口愈合过程中发挥重要作用。本课题组新近研究发现,在糖尿病状态下,细胞质分裂因子5可影响线粒体动力学平衡,调控ROS水平并促进创口再上皮化、胶原沉积及创面愈合[12]。上述研究结果提示线粒体动力学平衡在糖尿病创口愈合过程中发挥重要作用,其机制可能与线粒体氧化应激有关。但仍需更多的研究全面描绘线粒体动力学失衡在糖尿病溃疡中的作用,并进一步阐释糖尿病相关线粒体动力学失衡致创口愈合延迟的分子机制。
2 线粒体动力学与糖尿病肾病糖尿病肾病是糖尿病常见微血管并发症之一,其在糖尿病患者中的患病率高达20%~40%,且呈逐年上升趋势[13]。尽管临床上已有多种针对糖尿病肾病的预防及早期干预手段,如:降糖、降压、降尿蛋白等,但其进展为终末期肾病(end stage renal disease,ESRD)的比例仍居高不下,造成严重的社会经济负担[14]。因此,深入理解糖尿病肾病发病机制是全面制定其干预策略的关键。肾脏是仅次于心肌的高代谢、高耗能且富含线粒体的器官,在糖尿病状态下,线粒体动力学失衡所致线粒体数量减少、产能减弱、ROS堆积亦被认为是糖尿病肾病发生、发展的重要环节[15]。
在糖尿病肾病患者及动物模型体内,均有证据表明肾皮质存在碎片状的线粒体聚集,提示存在线粒体动力学异常[16]。在急性肾病动物模型中,采用Mdivi-1抑制Drp1可降低血清肌酐和尿素氮水平,减轻缺血再灌注相关肾小管损伤[17]。在糖尿病肾病小鼠体内,研究发现高血糖可通过Rho关联含卷曲螺旋结合蛋白激酶1(ROCK1)磷酸化Drp1丝氨酸残基,从而促进Drp1募集于线粒体,诱导线粒体分裂;而敲除Rock1则可减少肾小球足细胞凋亡和线粒体ROS堆积,降低尿蛋白[18]。此外,SHEN等[19]在动物模型中发现,Mfn2泛素化降解促进缺血再灌注诱导的肾小管上皮细胞凋亡,提示线粒体融合减低与急性肾损伤密切相关。而在2型糖尿病db/db小鼠体内,有研究发现Mfn1表达降低,且与肾皮质呼吸链功能障碍、能量生成减低密切相关[20]。我们的研究发现,线粒体内膜蛋白mGPDH缺乏通过调控线粒体动力学,影响线粒体OXPHOS、ROS生成及膜电位水平,导致足细胞损伤、足突融合及肾小球球部病变;而在糖尿病小鼠体内上调GPDH表达则可显著改善线粒体动力学及功能,减轻肾小球足细胞损伤与球部病理改变[21]。我们的研究结果提示,线粒体融合、分裂失衡与急慢性肾损伤均密切相关,其可能通过影响线粒体功能导致组织损伤。但目前针对线粒体动力学在糖尿病肾病中的具体作用与致病机制尚需更多的研究予以证实。
3 线粒体动力学与糖尿病心肌病心血管并发症是糖尿病相关死亡的主要原因,占因糖尿病死亡人数的50%~80%[22]。糖尿病心肌病是由糖尿病相关代谢紊乱引起的非缺血性和非高血压性心肌病,是糖尿病常见并发症之一[23]。糖尿病心肌病早期以舒张功能障碍和左心室肥厚为主要特征,中晚期可见收缩功能障碍、心肌纤维化[24]。生理情况下,70%的心肌能量供给来自于线粒体脂肪酸β氧化;2型糖尿病时,胰岛素抵抗导致葡萄糖利用率降低,使心肌能量供给更加依赖于线粒体脂肪酸氧化供能,严重增加心肌线粒体负担。近期研究发现,线粒体动力学紊乱及其所导致的线粒体功能障碍在糖尿病心肌病的发生、发展中发挥关键作用[25]。
在糖尿病心肌病大鼠心肌组织中,有研究发现线粒体分裂蛋白Drp1表达较之非糖尿病组显著升高,而融合蛋白Mfn1/2降低,提示糖尿病心肌病时存在线粒体动力学紊乱,且分裂增加、融合减低。上调线粒体分裂蛋白Drp1表达促进心肌线粒体功能障碍及胰岛素抵抗,而下调Drp1表达可预防氧化氢诱导的心肌线粒体功能障碍,其机制与Drp1调控线粒体ROS生成、膜电位及ATP生成有关[26]。同样,采用Mdivi-1抑制Drp1可通过减少Drp1丝氨酸S616位点的磷酸化并增加S637处的磷酸化,从而预防高糖诱导的心肌细胞肥大[27]。有研究发现,在生理状态下调Drp1同样可导致小鼠心肌线粒体形态及功能异常,并诱发心力衰竭和早产。此外,有研究发现,糖尿病心肌病时,高血糖还可通过上调融合蛋白Mfn1/2泛素化水平降低两种蛋白的表达;亦通过降低线粒体膜电位、促线粒体通透性转运孔mPTP的开放、增加细胞内ATP渗漏,从而导致心肌线粒体功能障碍[28]。而本课题组前期研究发现:线粒体内膜蛋白mGPDH缺乏加重糖尿病所致线粒体动力学紊乱,进而影响线粒体脂肪酸氧化及能量生成,并导致心肌肥大及功能障碍。因此,维持心肌线粒体融合与分裂平衡是维持心肌线粒体功能的关键,而靶向线粒体动力学是糖尿病心肌病、肥胖性心肌病等代谢紊乱相关心肌疾病的潜在干预靶点。
4 展望线粒体是真核细胞内高度动态变化的、具有形态可塑性的细胞器,参与了细胞内能量代谢、自噬、凋亡等许多生理过程。线粒体融合与分裂间的动力学调控在糖尿病溃疡、肾病、心肌病等慢性并发症中的作用已被逐渐发掘,但尚缺乏整体性描绘,且其具体分子机制、作用通路还有待深入阐释。目前,虽已有一些小分子化合物被证实可调控线粒体融合或分裂过程,如Mdivi-1、Dynasore等,但其对疾病的干预效果仍处于临床前期研究阶段。在既往各类动态平衡研究中(如氧化与抗氧化平衡),平衡中心点的确定往往是该类问题的研究难点。因此,在线粒体融合与分裂的动态变化中,如何寻找与确定平衡态是今后研究工作的重心与难点,亦值得深入探寻。
| [1] |
WILLEMS P H, ROSSIGNOL R, DIETEREN C E, et al. Redox homeostasis and mitochondrial dynamics[J]. Cell Metab, 2015, 22(2): 207-218. |
| [2] |
KOU Z Z, LI C Y, HU J C, et al. Alterations in the neural circuits from peripheral afferents to the spinal cord: possible implications for diabetic polyneuropathy in streptozotocin-induced type 1 diabetic rats[J]. Front Neural Circuits, 2014, 8: 6. |
| [3] |
WENG T Y, TSAI S A, SU T P. Roles of sigma-1 receptors on mitochondrial functions relevant to neurodegenerative diseases[J]. J Biomed Sci, 2017, 24(1): 74. |
| [4] |
RUEGSEGGER G N, CREO A L, CORTES T M, et al. Altered mitochondrial function in insulin-deficient and insulin-resistant states[J]. J Clin Invest, 2018, 128(9): 3671-3681. |
| [5] |
PETERSEN K F, BEFROY D, DUFOUR S, et al. Mitochondrial dysfunction in the elderly: possible role in insulin resistance[J]. Science, 2003, 300(5622): 1140-1142. |
| [6] |
BOWLING F L, RASHID S T, BOULTON A J. Preventing and treating foot complications associated with diabetes mellitus[J]. Nat Rev Endocrinol, 2015, 11(10): 606-616. |
| [7] |
KUNKEMOELLER B, KYRIAKIDES T R. Redox signaling in diabetic wound healing regulates extracellular matrix deposition[J]. Antioxid Redox Signal, 2017, 27(12): 823-838. |
| [8] |
TATMATSU-ROCHA J C, TIM C R, AVO L, et al. Mitochondrial dynamics (fission and fusion) and collagen production in a rat model of diabetic wound healing treated by photobiomodulation: comparison of 904 nm laser and 850 nm light-emitting diode (LED)[J]. J Photochem Photobiol B, 2018, 187: 41-47. |
| [9] |
KIM Y M, YOUN S W, SUDHAHAR V, et al. Redox regulation of mitochondrial fission protein Drp1 by protein disulfide isomerase limits endothelial senescence[J]. Cell Rep, 2018, 23(12): 3565-3578. |
| [10] |
FU H Y, ZHOU H D, YU X H, et al. Wounding triggers MIRO-1 dependent mitochondrial fragmentation that accelerates epidermal wound closure through oxidative signaling[J]. Nat Commun, 2020, 11(1): 1050. |
| [11] |
SU L N, ZHANG Y R, HE K C, et al. Activation of transient receptor potential vanilloid 1 accelerates re-endothelialization and inhibits neointimal formation after vascular injury[J]. J Vasc Surg, 2017, 65(1): 197-205. |
| [12] |
QU H, MIAO T, WANG Y R, et al. Dedicator of cytokinesis 5 regulates keratinocyte function and promotes diabetic wound healing[J]. Diabetes, 2021, 70(5): 1170-1184. |
| [13] |
THOMAS M C, COOPER M E, ZIMMET P. Changing epidemiology of type 2 diabetes mellitus and associated chronic kidney disease[J]. Nat Rev Nephrol, 2016, 12(2): 73-81. |
| [14] |
GROSS J L, DE AZEVEDO M J, SILVEIRO S P, et al. Diabetic nephropathy: diagnosis, prevention, and treatment[J]. Diabetes Care, 2005, 28(1): 164-176. |
| [15] |
SUN L, XIE P, WADA J, et al. Rap1b GTPase ameliorates glucose-induced mitochondrial dysfunction[J]. J Am Soc Nephrol, 2008, 19(12): 2293-2301. |
| [16] |
ZHENG N, LIANG T, XU X H, et al. Polydatin impairs mitochondria fitness and ameliorates podocyte injury by suppressing Drp1 expression[J]. J Cell Physiol, 2017, 232(10): 2776-2787. |
| [17] |
HIGGINS G C, COUGHLAN M T. Mitochondrial dysfunction and mitophagy: the beginning and end to diabetic nephropathy?[J]. Br J Pharmacol, 2014, 171(8): 1917-1942. |
| [18] |
WANG W J, WANG Y, LONG J Y, et al. Mitochondrial fission triggered by hyperglycemia is mediated by ROCK1 activation in podocytes and endothelial cells[J]. Cell Metab, 2012, 15(2): 186-200. |
| [19] |
SHEN L, ZHANG Q F, TU S M, et al. SIRT3 mediates mitofusin 2 ubiquitination and degradation to suppress ischemia reperfusion-induced acute kidney injury[J]. Exp Cell Res, 2021, 408(2): 112861. |
| [20] |
CLEVELAND K H, BROSIUS F C 3rd, SCHNELLMANN R G. Regulation of mitochondrial dynamics and energetics in the diabetic renal proximal tubule by the β2-adrenergic receptor agonist formoterol[J]. Am J Physiol Renal Physiol, 2020, 319(5): F773-F779. |
| [21] |
QU H, GONG X L, LIU X F, et al. Deficiency of mitochondrial glycerol 3-phosphate dehydrogenase exacerbates podocyte injury and the progression of diabetic kidney disease[J]. Diabetes, 2021, 70(6): 1372-1387. |
| [22] |
HTAY T, SOE K, LOPEZ-PEREZ A, et al. Mortality and cardiovascular disease in type 1 and type 2 diabetes[J]. Curr Cardiol Rep, 2019, 21(6): 45. |
| [23] |
MAACK C, LEHRKE M, BACKS J, et al. Heart failure and diabetes: metabolic alterations and therapeutic interventions: a state-of-the-art review from the Translational Research Committee of the Heart Failure Association-European Society of Cardiology[J]. Eur Heart J, 2018, 39(48): 4243-4254. |
| [24] |
MARWICK T H, RITCHIE R, SHAW J E, et al. Implications of underlying mechanisms for the recognition and management of diabetic cardiomyopathy[J]. J Am Coll Cardiol, 2018, 71(3): 339-351. |
| [25] |
WU S N, LU Q L, DING Y, et al. Hyperglycemia-driven inhibition of AMP-activated protein kinase α2 induces diabetic cardiomyopathy by promoting mitochondria-associated endoplasmic reticulum membranes in vivo[J]. Circulation, 2019, 139(16): 1913-1936. |
| [26] |
WATANABE T, SAOTOME M, NOBUHARA M, et al. Roles of mitochondrial fragmentation and reactive oxygen species in mitochondrial dysfunction and myocardial insulin resistance[J]. Exp Cell Res, 2014, 323(2): 314-325. |
| [27] |
WU Q R, ZHENG D L, LIU P M, et al. High glucose induces Drp1-mediated mitochondrial fission via the Orai1 calcium channel to participate in diabetic cardiomyocyte hypertrophy[J]. Cell Death Dis, 2021, 12(2): 216. |
| [28] |
WANG Y, WANG Y, LI F, et al. Spermine protects cardiomyocytes from high glucose-induced energy disturbance by targeting the CaSR-gp78-ubiquitin proteasome system[J]. Cardiovasc Drugs Ther, 2021, 35(1): 73-85. |




