纤维化是肝脏对慢性损伤的反应。丙型肝炎病毒(hepatitis C virus,HCV)和乙型肝炎病毒(hepatitis B virus,HBV)都与肝纤维化有关,后者是我国肝纤维化的主要原因[1]。慢性HBV感染中持续的纤维化导致肝脏瘢痕组织形成,最终导致肝硬化[2]。抗纤维化治疗通常包括抑制上皮细胞向间充质细胞的转化、减轻肝脏炎症、再生肝细胞和促进基质金属蛋白酶的分泌[3]。虽然这些疗法是有效的,但它们并不一定能解决肝纤维化发生和发展的所有途径,因此需要继续努力寻找有效的治疗方法。改善纤维化的治疗可能在于控制宿主对慢性HBV感染的免疫反应[4]。常驻的肝巨噬细胞是肝脏中与细菌、细菌内毒素和肠道碎片接触的免疫细胞,虽然它们可促进肝损伤或感染后组织完整性的恢复,但也可促进肝脏疾病的进展,包括肝炎、纤维化和癌症[5]。在病理条件下,肝巨噬细胞被不同的组分激活,可分化为M1极化(促炎)或M2极化(抗炎)状态。因此,肝巨噬细胞的极化状态可能是决定其是否抑制或促进肝纤维化的关键[6]。Fractalkine受体CX3CR1是一种7-跨膜G蛋白偶联受体,已知在自然杀伤细胞、单核细胞和树突状细胞中表达,并在启动免疫反应方面起着关键作用。先前的研究表明,抑制CX3CR1表达可降低肾纤维化的作用[7]。另一项研究表明抑制CX3CR1介导的巨噬细胞自噬减轻高氧肺损伤肺纤维化[8]。由于CX3CR1在巨噬细胞中大量表达[9],因此课题组推测巨噬细胞、CX3CR1和肝纤维化之间存在重要联系。本研究探讨抑制CX3CR1表达能否通过调节巨噬细胞极化来抑制CCl4诱导的小鼠肝纤维化,旨在为抗肝纤维化的治疗策略提供新的见解。
1 材料与方法 1.1 小鼠模型及治疗从北京华阜康生物科技股份有限公司购买8周龄雄性C57BL/6小鼠[许可证号:SCXK(京)2019-0004]。动物在22~24 ℃和12 h光/暗循环的SPF级水平环境下饲养,可自由获取食物和水。通过腹腔注射用玉米油稀释1∶4的四氯化碳(CCl4,美国Sigma-Aldrich公司)诱导肝纤维化,剂量为0.5 mL/100 g体质量。每周注射2次,持续6周。
根据研究要求,将小鼠分为:正常组(n=24)、CCl4组(n=36)、CCl4+对照shRNA(sh-NC)组(n=36)、CCl4+CX3CR1 shRNA(sh-CX3CR1)组(n=36)。6周时处死小鼠。从CCl4诱导的肝纤维化4周开始,每周分别向CCl4+sh-NC组和CCl4+sh-CX3CR1组小鼠尾静脉注射sh-NC或sh-CX3CR1(将所有siRNA溶解于无RNase的水中,终浓度为2 μg/μL,每次注射12 μL)3次,持续2周。表达CX3CR1小发夹RNA(shRNA)的慢病毒基因转移载体由上海吉凯基因医学科技股份有限公司构建,目标序列为5′-GGACACATACACATGA-3′。
1.2 组织病理学分析收获的肝组织用4%多聚甲醛固定,脱水,包埋在石蜡中,然后切成薄片(3 μm)。接下来,进行苏木精和伊红(HE)染色以观察肝损伤,然后进行Masson三色染色观察胶原沉积。在BX-51显微镜(日本Olympus公司)下评估病理变化并拍照。
1.3 免疫组织化学将石蜡包埋的切片与抗CX3CR1抗体(1∶50,英国Abcam公司)在4 ℃孵育过夜,并在37 ℃与HRP聚合物偶联的二抗孵育1 h。细胞核用苏木精复染。观察切片并在显微镜下拍照。
1.4 免疫荧光染色对于免疫荧光染色,将4%多聚甲醛固定肝标本,蔗糖梯度脱水后进行冰冻切片。然后,将切片在室温下用含0.5%Triton X-100的10%山羊血清封闭30 min,用小鼠抗α平滑肌肌动蛋白抗体(α-SMA,1∶250,美国Thermo Fisher Scientific公司)、兔抗F4/80抗体(1∶250,美国Novus Biologicals公司)、兔抗甘露糖受体CD206抗体(1∶50,Abcam)或兔抗iNOS抗体(1∶250,Thermo Fisher Scientific)在4 ℃孵育过夜。切片用PBS洗涤3次,然后用Alexa-Fluor 488共轭山羊抗鼠IgG(上海Beyotime公司,1∶500)在室温下孵育1 h,再用DAPI染色5 min。使用lx71荧光显微镜(日本Olympus公司)采集图像。
1.5 肝星状细胞(hepatic stellate cells,HSC)和巨噬细胞的分离和培养 1.5.1 原代细胞分离采用两步胶原酶灌注法从小鼠肝脏分离HSC,然后在8.2% Nycodenz双层不连续密度梯度(美国Sigma-Aldrich公司)上离心。细胞在含有10%胎牛血清(FBS,美国Gibco公司)的DMEM中的无涂层组织培养皿上培养,允许粘附,然后传代。采用胶原酶链霉蛋白酶灌注,15%Nycodenz梯度离心,并使用超纯MACS试剂盒中的Anti-F4/80微球进行选择(德国Miltenyi Biotec GmbH公司),最终分离巨噬细胞。小鼠巨噬细胞在含有10%FBS的RPMI1640(Gibco)中培养,不传代。
1.5.2 共培养[10]从各组小鼠中分离原代巨噬细胞,然后立即与等量的原代HSC(2 ng/mL TGF-β1激活)共培养24 h。共培养物在双室6孔Transwell平板中培养,其中两个室用孔径为0.4 μm的半透膜隔开(美国Corning公司)。
1.6 流式细胞术分析巨噬细胞表型采用基于直接免疫荧光的流式细胞术分析小鼠肝巨噬细胞的表型。细胞在PBS中漂洗,通过刮擦回收。然后使用针对小鼠CD11b单克隆抗体(M1/70)(FITC-conjugated,美国eBioscience公司),F4/80单克隆抗体(PerCPCyanine5.5-conjugated,eBioscience),CD206单克隆抗体(PE-Cyanine7-conjugated,eBioscience)或iNOS单克隆抗体(PE-conjugated,eBioscience)对小鼠肝巨噬细胞进行免疫标记。用FACS Calibur流式细胞仪和FlowJo 7.6软件(BD Biosciences)分析标记的细胞。
1.7 试剂盒法测定炎症因子和肝功能指标通过ELISA法(英国Abcam公司)测定血清或培养上清液中细胞因子IL-1β、IL-6、TGF-β1、A1型胶原蛋白(Col-α1)和3A1型胶原蛋白(Col-3A1)的水平。一式两份分析样品和标准品,并使用平均光密度(校正空白对照的光密度)从标准曲线计算细胞因子浓度。用Reitman-Frankel法测定血清丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST),试剂盒购自南京建成生物工程研究所。
1.8 Western blot分析采用RIPA缓冲液(上海Beyotime公司)从靶组织中提取总蛋白,并使用BCA蛋白分析试剂盒(美国Pierce公司)测定蛋白含量。总蛋白用SDS-PAGE分离,然后转移到PVDF膜上(美国Invitrogen公司)。在TBST(TBS+0.1% Tween-20)中用5%脱脂牛奶封闭1 h后,用一级抗体α-SMA(1∶800)、E-cadherin(1∶800)、CX3CR1(1∶1 200)、N-cadherin(1∶1 000)、Vimentin(1∶1 000)或β-actin(1∶1 000,均购自英国Abcam公司)孵育印迹过夜,然后在TBST中洗涤3次。将PVDF膜与HRP结合的兔抗(美国MultiSciences公司,1∶5 000)在室温下孵育1 h。使用蛋白质印迹检测化学发光试剂盒(南京凯基生物科技发展有限公司)观察目标条带。用Image J软件对条带强度进行定量。
1.9 统计学分析数据均以x±s表示。使用SPSS 22.0统计学软件分析。采用Student’s t检验对两组之间的差异进行显著性评估,并使用单向方差分析(ANOVA)对两组以上的差异进行评估。P值小于0.05认为具有统计学差异。
2 结果 2.1 CCl4处理对小鼠肝脏中CX3CR1表达的影响在C57BL/6小鼠中,通过反复注射CCl4诱导小鼠肝纤维化模型。HE染色和Masson染色观察各组小鼠肝脏的组织病理学特征和胶原水平。结果显示,小鼠在CCl4处理第4周时整个肝实质中都有炎症细胞募集,肝组织中假小叶形成,且在肝小叶中央区向外周逐步发生纤维化。在CCl4处理第6周时炎症细胞募集增加,并可见更多蓝染的纤维素。免疫组织化学显示,在健康的非纤维化对照肝脏中几乎检测不到CX3CR1,在CCl4处理4周和6周后,肝实质中CX3CR1强烈上调(图 1)。这些结果提示CX3CR1可能在肝纤维化中起重要作用。

|
| 图 1 CCl4诱导的肝纤维化小鼠肝组织中CX3CR1的表达 |
2.2 CX3CR1沉默可减轻小鼠肝纤维化
通过免疫组织化学证实了CX3CR1沉默的体内效率。结果显示,CCl4组和CCl4+sh-NC组中CX3CR1蛋白含量显著增加,而CCl4+ sh-CX3CR1组的CX3CR1蛋白含量降低。HE和Masson染色显示CCl4组和CCl4+sh-NC组小鼠肝脏均有炎症细胞募集和纤维组织沉积,CCl4+sh-CX3CR1组肝炎症细胞募集和纤维组织沉积化的严重程度均较CCl4组和CCl4+sh-NC组明显减轻(图 2)。通过Western blot证实组织病理学分析结果,即CX3CR1沉默逆转了CCl4诱导的α-SMA、N-cadherin和Vimentin蛋白水平增加,同时增加了E-cadherin蛋白表达(图 3A)。此外,与CCl4组和CCl4+sh-NC组相比,CCl4+sh-CX3CR1组小鼠血清AST、ALT水平显著降低(P<0.01,图 3B、C)。结果表明,体内CX3CR1沉默可部分缓解CCl4相关的小鼠肝纤维化。

|
| 图 2 CX3CR1沉默对小鼠肝组织病理学的影响 |
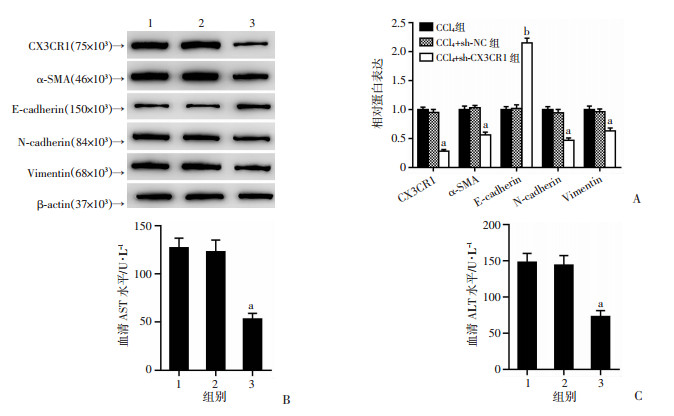
|
|
1:CCl4组;2:CCl4+sh-NC组;3:CCl4+sh-CX3CR1组;a:P<0.05,b:P<0.01,与CCl4+sh-NC组比较 A:Western blot分析小鼠肝脏组织中CX3CR1、α-SMA、E-cadherin、N-cadherin和Vimentin的蛋白水平;B、C:生化分析测定小鼠血清AST、ALT水平 图 3 CX3CR1沉默可减轻小鼠肝纤维化 |
2.3 CX3CR1沉默通过调节巨噬细胞M1/M2极化抑制肝纤维化中炎性细胞因子
根据血清实验,CCl4组和CCl4+sh-NC组小鼠中IL-1β、IL-6和TGF-β1水平均较正常组明显升高(P<0.01)。CCl4+sh-CX3CR1组小鼠血清IL-1β、IL-6和TGF-β1水平均下调4.6~8.1倍(P<0.01),恢复至正常水平(图 4)。免疫荧光染色显示,与正常组相比,CCl4组、CCl4+sh-NC组和CCl4+sh-CX3CR1组M1-和M2-巨噬细胞的百分率均显著增加(P<0.01)。CCl4+sh-CX3CR1组M2-巨噬细胞的百分率和M2/M1比值均显著高于CCl4+sh-NC组(P<0.01,图 5)。结果表明,CX3CR1沉默通过调节巨噬细胞M1/M2极化抑制肝纤维化中炎性细胞因子。
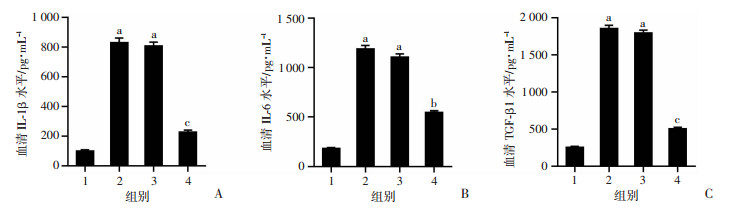
|
| 1:Normal组;2:CCl4组;3:CCl4+sh-NC组;4:CCl4+sh-CX3CR1组;a:P<0.01,与正常组比较;b:P<0.05,c:P<0.01,与CCl4+sh-NC组比较 图 4 ELISA试剂盒法检测小鼠血清IL-1β(A)、IL-6 (B)和TGF-β1(C)水平 |

|
|
a:P<0.01,b:P<0.01,与正常组比较;c:P<0.05,d:P<0.01,与CCl4+sh-NC组比较 A:免疫荧光染色分析小鼠肝脏组织中M1-巨噬细胞(F4/80+iNOS+)或M2-巨噬细胞(F4/80+CD206+)表达;B、C:M1-和M2-巨噬细胞定量分析及M2/M1比值1:Normal组;2:CCl4组;3:CCl4+sh-NC组;4:CCl4+sh-CX3CR1组 图 5 CX3CR1沉默通过调节巨噬细胞M1/M2极化抑制肝纤维化中炎性细胞因子 |
2.4 CX3CR1沉默通过调节巨噬细胞M1/M2极化减弱HSC的胶原生成
从不同组小鼠中分离原代肝脏巨噬细胞,然后立即与活化HSC 1∶1共培养24 h。免疫荧光染色分析显示,与CCl4+sh-NC组相比,CCl4+sh-CX3CR1组小鼠肝脏巨噬细胞与HSC的共培养物显示出明显较小的α-SMA免疫染色面积(图 6A、B),并且共培养的培养基中Col-α1和Col-3A1水平显著降低(P<0.01,图 6C、D)。使用流式细胞仪测定分析共培养后巨噬细胞的M1和M2表型,结果显示CCl4+sh-CX3CR1组小鼠肝脏巨噬细胞中M2/M1比值明显高于其他组(P<0.01,图 7)。结果表明,高的M2/M1-巨噬细胞比值抑制胶原的生成。
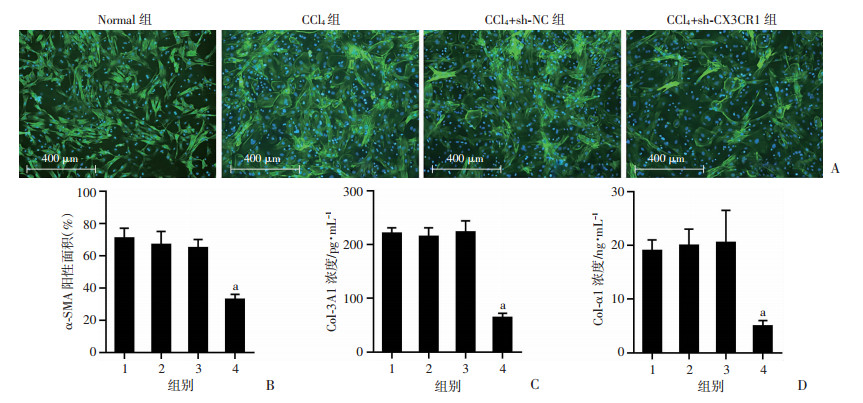
|
|
1:Normal组;2:CCl4组;3:CCl4+sh-NC组;4:CCl4+sh-CX3CR1组;a:P<0.01,与CCl4+sh-NC组比较 A、B:免疫荧光染色法检测HSC表达α-SMA(绿色)及定量分析;C、D:ELISA测定混合培养基中Col-α1和Col-3A1水平 图 6 CX3CR1沉默通过调节巨噬细胞M1/M2极化减弱HSC的胶原生成 |

|
| 1:Normal组;2:CCl4组;3:CCl4+sh-NC组;4:CCl4+sh-CX3CR1组;a:P<0.01,与CCl4+sh-NC组比较 图 7 流式细胞仪分析共培养后巨噬细胞的M1和M2表型(A)及二者比值(B) |
3 讨论
以往研究证实,巨噬细胞在组织修复和随后的纤维化改变中必不可少[5]。在实验性肝纤维化模型中,免疫细胞尤其是肝巨噬细胞发挥损伤诱导或修复促进作用[11],这些巨噬细胞可以根据其所处微环境变化占据从M1到M2激活和行为的连续体[12]。因此,调控巨噬细胞极化可能是多种疾病的有效治疗靶点。CX3CR1在巨噬细胞中的稳定表达促使多个科学小组研究其在各种器官纤维化中的作用[13]。研究表明,CX3CR1基因缺陷减轻了高血压和单侧输尿管梗阻引起的肾纤维化[7]。此外,CX3CR1沉默抑制了博莱霉素诱导的肺部纤维化[9]。本研究使用CCl4诱导的肝纤维化小鼠模型,观察到CX3CR1随着模型建立时间的延长逐渐上调。显然,增加的CX3CR1对应于增加的肺纤维化。为了进一步验证CX3CR1在CCl4诱导的肝纤维化中的作用,在小鼠模型中沉默CX3CR1,观察到CX3CR1沉默可以通过增加M2/M1-巨噬细胞比值来减弱肝纤维化。
M1/M2巨噬细胞的动态平衡可能是肝纤维化进展的关键[14]。本研究在小鼠纤维化模型中探讨了这种平衡,发现在这些动物的纤维形成过程中,M1-巨噬细胞明显多于M2-巨噬细胞。M1-巨噬细胞分泌高水平的IL-1β、IL-6和TGF-β1。这些结果表明,M1-巨噬细胞可以促进肝纤维化的进展,正如前期研究所报道的结果[15]。通过沉默纤维化动物CX3CR1可显著下调这些炎症因子并上调M2巨噬细胞标记物CD206。CX3CR1沉默也显著增加M2-巨噬细胞的数量,减少M1-巨噬细胞的数量,并增加了M2/M1比值。根据组织学结果,这些变化伴随着肝纤维化的改善,提示CX3CR1沉默可促进M2巨噬细胞极化,抑制M1-巨噬细胞极化,有助于减轻肝纤维化,延缓肝纤维化进程。M2-巨噬细胞的治疗作用已经在肝细胞脂肪变性和凋亡中得到证实[16],并且M2-巨噬细胞可诱导M1-巨噬细胞凋亡[17],本研究结果与其他临床研究一致。一项对慢性HBV感染和不同程度肝纤维化患者的肝活检分析显示,肝纤维化过程中,M1/M2-巨噬细胞的比例发生变化,M1-巨噬细胞的数量显著增加,M1/M2的比值在G2/S2期最高[18]。此外,一项关于非酒精性脂肪性肝炎纤维化进展和消退的决定因素的研究显示,在纤维化进展和消退的过程中伴随着巨噬细胞表型转化[19]。在这些研究中,肝纤维化的表型转化可能是由于趋化性和单核细胞浸润的抑制,导致M1的表型抑制[20]。因此,CX3CR1沉默能通过调节巨噬细胞极化来抑制肝纤维化的进展。
总之,目前的数据表明CX3CR1沉默通过促进M1向M2-巨噬细胞的极化发挥抗肝纤维化作用。这些对M1和M2-巨噬细胞之间的极化平衡的影响可能有助于解释CX3CR1的炎症和免疫调节功能,并为抗肝纤维化的治疗策略提供新的见解。然而,目前尚不清楚CX3CR1通过何种途径调节M1和M2-巨噬细胞之间的极化,有待于进一步研究。
| [1] |
孙鑫, 黄恺, 张满, 等. HBV-Tg复合四氯化碳模型小鼠肝内淋巴细胞亚群变化特点及其与HBV病毒学和肝纤维化的相关性分析[J]. 中华肝脏病杂志, 2020, 28(7): 580-585. SUN X, HUANG K, ZHANG M, et al. Correlational analysis of alternation of clinical features of intrahepatic lymphocyte subsets with HBV virology and liver fibrosis in HBV-Tg composite CCl4 mice model[J]. Chin J Hepatol, 2020, 28(7): 580-585. |
| [2] |
王煜, 马娟, 张旭, 等. 慢性乙型肝炎患者STING表达与病毒载量及肝组织病理的相关性[J]. 中华医院感染学杂志, 2020, 30(1): 82-85. WANG Y, MA J, ZHANG X, et al. Correlation between expression of STING and viral load and liver histopathology of patients with chronic hepatitis B[J]. Chin J Nosocomiol, 2020, 30(1): 82-85. |
| [3] |
XU X Y, DU Y, LIU X, et al. Targeting Follistatin like 1 ameliorates liver fibrosis induced by carbon tetrachloride through TGF-β1-miR29a in mice[J]. Cell Commun Signal, 2020, 18(1): 151. |
| [4] |
KISSELEVA T, BRENNER D. Molecular and cellular mechanisms of liver fibrosis and its regression[J]. Nat Rev Gastroenterol Hepatol, 2021, 18(3): 151-166. |
| [5] |
KRENKEL O, TACKE F. Liver macrophages in tissue homeostasis and disease[J]. Nat Rev Immunol, 2017, 17(5): 306-321. |
| [6] |
伊宏煜, 张津睿, 胡海峰, 等. 乙型肝炎病毒及其核心抗原对巨噬细胞极化的影响[J]. 中国免疫学杂志, 2020, 36(7): 769-773. YI H Y, ZHANG J R, HU H F, et al. Effect of hepatitis B virus and hepatitis B core antigen on macrophage polarization[J]. Chin J Immunol, 2020, 36(7): 769-773. |
| [7] |
ENGEL D R, KRAUSE T A, SNELGROVE S L, et al. CX3CR1 reduces kidney fibrosis by inhibiting local proliferation of profibrotic macrophages[J]. J Immunol, 2015, 194(4): 1628-1638. |
| [8] |
CHEN Y Q, ZHANG H, LI F, et al. Inhibition of CX3C receptor 1-mediated autophagy in macrophages alleviates pulmonary fibrosis in hyperoxic lung injury[J]. Life Sci, 2020, 259: 118286. |
| [9] |
ISHIDA Y, KIMURA A, NOSAKA M, et al. Essential involvement of the CX3CL1-CX3CR1 axis in bleomycin-induced pulmonary fibrosis via regulation of fibrocyte and M2 macrophage migration[J]. Sci Rep, 2017, 7(1): 16833. |
| [10] |
BEKKI Y, YOSHIZUMI T, SHIMODA S, et al. Hepatic stellate cells secreting WFA +-M2BP: its role in biological interactions with Kupffer cells[J]. J Gastroenterol Hepatol, 2017, 32(7): 1387-1393. |
| [11] |
刘新, 娄金丽, 白丽, 等. 小鼠肝纤维化形成过程中肝内巨噬细胞的表型转换[J]. 标记免疫分析与临床, 2019, 26(9): 1532-1536, 1564. LIU X, LOU J L, BAI L, et al. Phenotypes of macrophages conversion in liver during the development of liver fibrosis of mice[J]. Labeled Immunoass Clin Med, 2019, 26(9): 1532-1536, 1564. |
| [12] |
唐颖悦, 李静, 雷晓红, 等. CCl4诱导肝纤维化小鼠模型中肝脏巨噬细胞及淋巴细胞亚群变化的初步分析[J]. 肝脏, 2019, 24(4): 377-381. TANG Y Y, LI J, LEI X H, et al. Preliminary analysis of changes of hepatic macrophages and lymphocyte subsets in CCl4-induced hepatic fibrosis in mice[J]. Chin Hepatol, 2019, 24(4): 377-381. |
| [13] |
JULIA V, STAUMONT-SALLE D, DOMBROWICZ D. Role of fractalkine/CX3CL1 and its receptor CX3CR1 in allergic diseases[J]. Med Sci (Paris), 2016, 32(3): 260-266. |
| [14] |
刘莹, 刁波, 王刚, 等. 大鼠肝纤维化进程中原代Kupffer细胞吞噬能力及表型变化特征研究[J]. 免疫学杂志, 2019, 35(3): 213-218. LIU Y, DIAO B, WANG G, et al. The phagocytic ability and phenotypic changes of primary Kupffer cells in rat liver fibrosis[J]. Immunol J, 2019, 35(3): 213-218. |
| [15] |
MA P F, GAO C C, YI J, et al. Cytotherapy with M1-polarized macrophages ameliorates liver fibrosis by modulating immune microenvironment in mice[J]. J Hepatol, 2017, 67(4): 770-779. |
| [16] |
谭海鹏. 巨噬细胞对凋亡细胞的清除及炎症调控作用[J]. 复旦学报(医学版), 2020, 47(6): 911-916. TAN H P. Clearance of apoptotic cells by macrophages and resolution of inflammation[J]. Fudan Univ J Med Sci, 2020, 47(6): 911-916. |
| [17] |
WAN J H, BENKDANE M, TEIXEIRA-CLERC F, et al. M2 Kupffer cells promote M1 Kupffer cell apoptosis: a protective mechanism against alcoholic and nonalcoholic fatty liver disease[J]. Hepatology, 2014, 59(1): 130-142. |
| [18] |
LI L, WEI W, LI Z Z, et al. The spleen promotes the secretion of CCL2 and supports an M1 dominant phenotype in hepatic macrophages during liver fibrosis[J]. Cell Physiol Biochem, 2018, 51(2): 557-574. |
| [19] |
SCHUPPAN D, SURABATTULA R, WANG X Y. Determinants of fibrosis progression and regression in NASH[J]. J Hepatol, 2018, 68(2): 238-250. |
| [20] |
DOU Y, SHEN H T, FENG D X, et al. Tumor necrosis factor receptor-associated factor 6 participates in early brain injury after subarachnoid hemorrhage in rats through inhibiting autophagy and promoting oxidative stress[J]. J Neurochem, 2017, 142(3): 478-492. |




