2. 400016 重庆,重庆医科大学医学信息学院
2. College of Medical Informatics, Chongqing Medical University, Chongqing, 400016, China
关节软骨缺损可导致继发性骨关节炎,引起关节疼痛,严重影响患者生活质量[1-2]。由于缺乏血管、神经、淋巴的支配,关节软骨在破坏后的自我修复能力有限,现有的临床治疗策略均存在一定缺陷[3-5]。组织工程为关节软骨的修复提供了新的方向。水凝胶作为支架材料已经被广泛应用于软骨组织工程中,它不仅具有三维网络结构、含水率高、高渗透率等特点,而且力学性能、溶胀率以及良好的润滑性能等都与天然的关节软骨相类似[6-7]。
炎性因子,如白细胞介素1(IL-6)、肿瘤坏死因子α(TNF-α)、干扰素γ在关节软骨缺损后会迅速升高,进而会导致软骨细胞死亡,加速软骨基质降解[8-9]。在软骨再生过程中,炎性因子会抑制细胞成软骨分化并减缓软骨相关基质的合成速度,从而导致软骨再生失败[10-11]。因而,在水凝胶支架材料用于关节软骨缺损修复时应控制局部炎性微环境,以达到更好的修复效果。
抗炎肽(KAFAKLAARLYRKALARQLGVAA, KAFAK) 是一种细胞穿透肽,通过抑制丝裂原活化蛋白激酶活化蛋白激酶2(MK2),能减少炎性因子IL-6和TNF-α的分泌[12]。因此,将KAFAK引入水凝胶内部能改善炎性微环境。但KAFAK作为一种阳离子多肽,存在酶降解性、解离性和构象变化等缺陷,导致半衰期短,生物利用度低[13]。一系列研究采用纳米颗粒对KAFAK进行包裹,以延长KAFAK的抗炎周期[13-17]。本课题组前期也将KAFAK负载到乙二醇壳聚糖-岩藻多糖纳米凝胶内以达到延缓骨关节炎进展的目的[18],但这些材料对KAFAK的控释时间都偏短,而软骨再生的整个过程都要对炎症进行有效控制才能实现软骨再生,故需要找到更有效的控释手段。
金属-有机框架(metal-organic frameworks,MOFs)是由有机配体和金属离子或团簇通过配位键自组装形成的具有分子内孔隙的有机-无机杂化材料[19]。MOFs材料具有高的药物负载量、良好的生物相容性以及功能多样性,已经成为广泛应用的药物载体[20-21]。有研究将MOFs材料修饰的介孔聚多巴胺(mesoporous polydopamine, MPDA)为载体,将雷帕霉素负载于介孔内,胆红素负载于MOFs材料的壳层上,然后将Ⅱ型胶原靶向多肽(WYRGRL)偶联到载体表面,形成软骨靶向双药给药纳米平台并用于骨关节炎治疗[22]。研究表明pH响应和透明质酸功能化的MOFs将负载具有抗炎活性的儿茶酸用于骨关节炎的治疗[23]。另有研究证明MOFs在骨关节炎的治疗中具有潜在应用价值[24-26]。基于封装MOFs的支架材料也可用于促成骨形成[27-31],但在软骨再生应用方面鲜有报道。
本课题组前期研究显示:普鲁兰多糖-聚乙二醇复合水凝胶具有良好的力学性能和可调控降解速度,是适合的软骨再生支架材料[32]。因此,本研究拟将MOFs材料作为药物载体先对抗炎肽KAFAK进行负载,然后将其封装于普鲁兰多糖/聚乙二醇复合水凝胶内部。通过MOFs材料的含量变化调控水凝胶的理化性质,同时通过对KAFAK的持续释放控制组织修复区域的炎性微环境,从而达到更好的软骨再生效果。
1 材料与方法 1.1 材料与仪器 1.1.1 实验材料氯氧化锆(ZrOCl2)、内消旋-四(4-羧基苯基)卟吩(TCPP)、苯甲酸、无水N,N-二甲基甲酰胺(DMF)、聚乙二醇二丙烯酸酯(PEGDA)、乙醇均购自上海阿拉丁生化科技股份有限公司,抗炎肽KAFAK委托上海生工合成,苯基(2, 4, 6-三甲基苯甲酰基)磷酸锂盐(LAP,Sigma公司),普鲁兰多糖(Pullulan)购自西安瑞禧生物,DMEM/F12培养基和胎牛血清购自美国Gibco公司,成软骨诱导培养基(江苏赛业生物),活/死细胞染色试剂盒(Calcein-AM/PI双染,上海贝博),总糖胺聚糖测定试剂盒(Blyscan Sulfated Glycosaminoglycan Assay,英国Biocolor公司),DNA含量测定试剂盒(AccuGreen High Sensitivity dsDNA Quantitation Kits,美国Biotium公司)。
1.1.2 实验仪器超声清洗器(洁盟公司),磁力搅拌仪(IKA公司),高速离心机(Thermo Fisher公司),IS-RDD3台式恒温振荡器(Crystal公司),扫描电镜(日本Hitachi公司),透射电镜(Thermo Fisher公司),粒径分析仪(Malvern公司),红外光谱仪(PerkinElmer公司),冷冻干燥机(Labconco公司),DHR-1流变仪(TA Instruments公司),荧光显微镜(Olympus公司),多功能酶标仪(Thermo Fisher公司)。
1.2 方法 1.2.1 纳米锆-金属有机框架(Zr MOF)材料的制备纳米Zr MOF材料的制备方法参考文献[33]。称取ZrOCl2 150 mg、TCPP 50 mg和苯甲酸1.4 g分别置于50 mL离心管中,对应加入20、20 mL和10 mL无水DMF,超声5 min进行溶解,然后分别将溶液倒入100 mL圆底烧瓶中,置于事先预热到90 ℃的油浴锅中,调整磁力搅拌的转速为1 200 r/min,安装上回流装置,反应持续搅拌5 h,关闭反应,待反应液冷却至常温后,将反应液清液转移至50 mL的圆底高速离心管中,常温,15 000×g、10 min条件离心,并用DMF和乙醇溶液分别洗3次(常温,15 000×g、10 min),最后将沉淀分散于乙醇溶液中备用。
1.2.2 纳米Zr MOF材料对抗炎肽KAFAK的负载取1 mg/mL的纳米Zr MOF材料溶液3 mL,离心(常温,15 000×g、5 min),加入3 mL去离子水分散。称取15 mg抗炎肽KAFAK,加入到纳米Zr MOF材料水溶液中,置于摇床中,4 ℃条件震摇24 h,然后离心(4 ℃,15 000×g、5 min),去离子水洗3次(4 ℃,15 000×g、5 min),最后将沉淀分散于去离子溶液中并置于4 ℃冰箱备用。
1.2.3 纳米Zr MOF材料的表征将制备好的纳米Zr MOF材料溶液滴加到薄的铜网碳支持膜上,待样品自然干燥后,于透射电镜下观察结构形貌。将制备好的纳米Zr MOF材料溶液滴加到硅片上,待干燥后喷金,于扫描电镜下观察结构形貌。取1 mL的纳米Zr MOF材料溶液加入到样品池中,用马尔文粒径分析仪进行粒径分析和Zeta点位测试。
1.2.4 普鲁兰多糖/聚乙二醇复合水凝胶对纳米Zr MOF材料的封装水凝胶制备方法参照课题组已发表的研究[32]。称取100 mg甲基丙烯酸普鲁兰多糖加入到10 mL浓度为15%(w/v)的聚乙二醇二丙烯酸酯溶液中,取2 mL上述溶液加入200 mg的纳米Zr MOF材料混匀,加入2 μL浓度为100 mg/mL的光交联剂苯基(2, 4, 6-三甲基苯甲酰基)磷酸锂盐,将溶液置于圆柱形模具中,紫外光(365 nm、5 W)照射1 min得到复合水凝胶。调整纳米Zr MOF材料的浓度分别得到Gel、Gel-10 Zr MOF、Gel-100 Zr MOF和Gel-500 Zr MOF水凝胶。将被封装物换为Zr MOF@KAFAK时得Gel-100 Zr MOF@KAFAK水凝胶。
1.2.5 水凝胶的形貌观察制备好的水凝胶用液氮进行快速冷冻,置于冷冻干燥机中进行冷冻干燥,待样品干燥后取出,用刀片切开,将样品粘于样品台上,喷金,扫描电镜下对凝胶的切面进行观察拍照。
1.2.6 水凝胶的溶胀平衡制备好的水凝胶用液氮进行快速冷冻,置于冷冻干燥机中进行冷冻干燥,待样品干燥后取出,称取质量记为M0,将样品置于24孔板中,加入2 mL的PBS溶液,置于37 ℃孵箱中,于1、3、7、12、24 h取出样品,快速用滤纸吸干水凝胶表面水分,再次称取质量记为M1,水凝胶的吸水能力=(M1-M0)/M0×100%。
1.2.7 水凝胶的降解制备好的水凝胶称取质量记为Ma,将样品置于24孔板中,加入2 mL的PBS溶液,置于37 ℃孵箱中,于1、5、9、14、28 d取出样品,快速用滤纸吸干水凝胶表面水分,再次称取质量记为Mb,水凝胶降解率=(Ma-Mb)/Ma×100%。
1.2.8 水凝胶的流变测试用DHR-1型流变仪对水凝胶的流变性能进行表征。在测试过程中,选用20 mm的平板,板间距保持在500 nm。振荡模式下进行测试,设定扫描频率为0.1~10.0 Hz,应力应变恒定为1%。
1.2.9 抗炎肽KAFAK释放曲线将含有抗炎肽KAFAK的水凝胶和含有Zr MOF@KAFAK材料的水凝胶分别置于PBS溶液中,然后分别在1、3、7、14、21 d对溶液的KAFAK含量采用fluoraldehydeo-phthalaldehyde(OPA)法测定[13]。在不透明的96孔板中加入样品和fluoraldehyde OPA(体积比为1 ∶10)的混合液,在荧光酶标仪上进行读数,设置激发波长为360 nm,吸收波长为455 nm,通过KAFAK的标准曲线计算含量。
1.2.10 兔骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)提取新西兰大白兔(约2.5 kg)用耳缘静脉注射1%的戊巴比妥溶液全身麻醉,于右胫骨上端内侧用锐性穿刺椎于骨皮质上开出直径2~3 mm的孔,使通达髓腔。用18号硬膜穿刺针接含有肝素的5 mL注射器,抽出骨髓约2 mL。抽出的骨髓液用平衡液洗涤2次后,离心1 000×g、5 min。去除上清液后,加入红细胞裂解缓冲液,破坏骨髓组织中的红细胞,离心1 000×g、5 min。将沉淀物培养在37 ℃孵箱中,1 d后更换培养液,去除未贴壁细胞。每3天更换1次培养基,本实验中使用细胞为第3代。
1.2.11 BMSCs的三维培养及细胞活/死细胞染色采用紫外光交联法制备含BMSCs的水凝胶。将BMSCs以1×106/mL的密度悬浮于含有Zr MOF@KAFAK的成水凝胶前混合液中(见复合水凝胶制备部分),加入光交联剂苯基(2, 4, 6-三甲基苯甲酰基)磷酸锂盐(1 mg/mL,体积比1 ∶100)。取混合溶液(200 μL)加入48孔板,紫外光照射(365 nm、5 W)1 min形成水凝胶每孔加入1 mL培养基,置于37 ℃孵箱中培养。用活/死细胞染色检测BMSCs在水凝胶中的活性。将含有MSCs的水凝胶培养至3 d时,用PBS洗涤3次,用2 mmol/L钙黄绿素(Calcein-AM)在37 ℃孵育30 min,然后用1.5 mmol/L碘丙烷(PI)在37℃孵育5 min,用荧光显微镜观察、标记细胞。用Image J图像分析软件计数细胞数,计算活细胞比例。
1.2.12 总糖胺聚糖含量测定用BlyscanTM硫酸化糖胺多糖测定法测定水凝胶中BMSCs的总糖胺聚糖产生量。水凝胶用含有IL-1β(10 ng/mL)培养基处理1 d,然后换成成软骨诱导培养基培养7 d和14 d后,取出含BMSCs的水凝胶,液氮研磨,60 ℃条件下用木瓜蛋白酶溶液消化6 h,将200 μL染料溶液转移到96孔板上,用酶标仪于656 nm处测量光密度值。采用AccuGreen高灵敏度dsDNA定量试剂盒检测各样品的DNA含量。将总糖胺聚糖含量用DNA含量进行均化处理。
1.2.13 基因表达含量测定水凝胶用含有IL-1β(10 ng/mL)培养基处理1 d,然后换成成软骨诱导培养基培养7 d和14 d后,取出含BMSCs的水凝胶,液氮研磨,加入TRIzol进行裂解,紫外可见分光光度计测定RNA浓度。然后将RNA逆转录为cDNA,进行逆转录聚合酶链反应(RT-PCR)。对软骨标志物Ⅱ型胶原(COL2A1)、聚蛋白多糖(ACAN)、肥大标志物X型胶原(COL10A1)基因进行定量测定。所得结果根据2-△△Ct公式进行计算,GAPDH基因作为内参。引物序列:COL2A1上游引物:5′-CAACAACCAGATCGAGA-GCA-3′,下游引物:5′-CCAGTAGTCACCGCTCTTCC-3′;ACAN上游引物:5′-CGACATCAGTGGAGACCTCA-3′,下游引物:5′-AGACTGCCAGAGTCCAGCTC-3′;COL10A1上游引物:5′-GAATGGCACGCCTGTAATGT-3′,下游引物:5′-CCATTGGACTCAGCGTTAGG-3′;GAPDH上游引物:5′-CGACATCAAGAAGGTGGTGA-3′,下游引物:5′-ATCGAAGGTGGAGGAGTGG-3′。
1.3 统计学分析采用SPSS 23.0软件进行统计学分析,数据均以x±s表示。多组间采用单因素方差分析,两组间用Student-t检验,P<0.05认为差异有统计学意义。
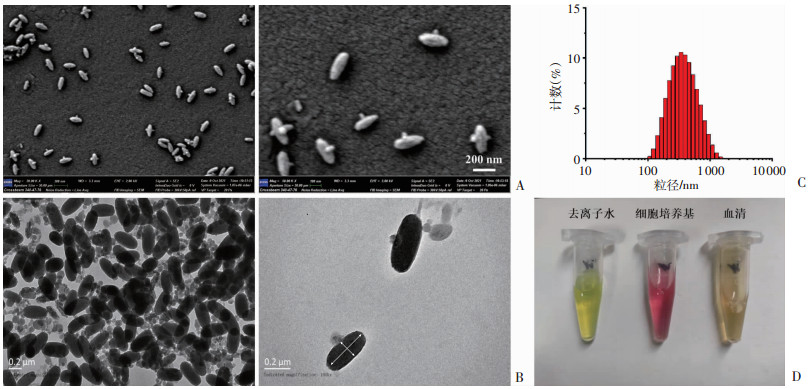
2 结果 2.1 纳米Zr MOF材料的形态结构表征通过热溶法成功制备出纳米Zr MOF材料,通过扫描电镜及透射电镜观察材料为长梭形,结构规整,大小均一,宽处约150 nm,长处约350 nm(图 1A、B)。通过粒径分析仪测出纳米Zr MOF材料的水合粒径为328.8 nm,粒径分布(PDI)为0.20,Zeta电位为(-23.77±3.33) mV(图 1C),同扫描电镜及透射电镜观察结果一致。纳米Zr MOF材料在去离子水、细胞培养基和血清中都显示出良好的分散性(图 1D)。
|
| A:扫描电镜下的纳米Zr MOF材料;B:透射电镜下的纳米Zr MOF材料;C:纳米Zr MOF材料的粒径分析和Zeta电位;D:纳米Zr MOF材料在去离子水、细胞培养基和血清中的分散性 图 1 纳米Zr MOF材料的基本理化性质表征结果 |
2.2 水凝胶对纳米Zr MOF材料的封装及红外表征
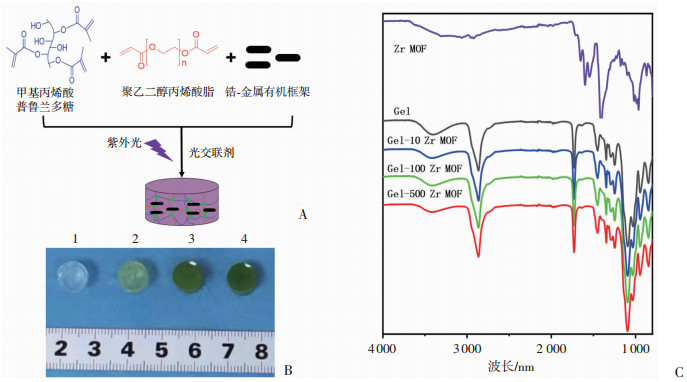
水凝胶对纳米Zr MOF材料封装的制备路线图如图 2A所示,在课题组已经发表的普鲁兰多糖/聚乙二醇复合水凝胶基础之上引入纳米Zr MOF材料到水凝胶内部,在紫外光照射1 min就能得到水凝胶,制备方法简单。通过调整纳米Zr MOF材料的含量可以得到一系列水凝胶,如图 2B所示:随着纳米Zr MOF材料含量提高,水凝胶的颜色逐渐变深。红外图谱结果表明纳米Zr MOF材料的引入对水凝胶原有的结构没有明显改变(图 2C),由此推测水凝胶对纳米Zr MOF材料只是简单的物理封装,没有新的化学键的形成。
|
| A:水凝胶对纳米Zr MOF材料封装的制备路线图;B:不同纳米Zr MOF材料含量(0、10、100、500 μg/mL)的水凝胶实物图 1:Gel;2:Gel-10 Zr MOF;3:Gel-100 Zr MOF;4:Gel-500 Zr MOF;C:不同纳米Zr MOF材料含量水凝胶的红外图谱 图 2 纳米Zr MOF材料封装于普鲁兰多糖/聚乙二醇复合水凝胶内部的制备过程及红外图谱表征 |
2.3 水凝胶的内部结构观察
通过扫描电镜对水凝胶的内部结构进行观察(图 3A),可以看出随着纳米Zr MOF材料的引入,水凝胶的内部孔径分布更均匀。通过局部放大图可以看到随着纳米Zr MOF材料含量的增加,孔壁粗糙度增加且具有更多的小孔(图 3B)。这是因为纳米Zr MOF材料作为填充物引入,使得水凝胶的孔壁致密性降低,从而导致孔壁粗糙度增加,同时会让孔壁出现明显的小孔。作为组织工程支架材料,这有利于种子细胞的粘附,以及水分和营养物质的运输,有利于细胞的生长。对Gel-500 Zr MOF水凝胶进行元素能谱分析,证明锆-金属有机框架材料封装于水凝胶内部(图 3C、D)。

|
| A:水凝胶的切面观察;B:水凝胶孔壁的空隙分布观察;C:Gel-500 Zr MOF水凝胶的元素(碳C、氧O、锆Zr)能谱分布检测;D:Gel-500 Zr MOF水凝胶的元素(碳C、氧O、锆Zr)能谱点检测结果 图 3 扫描电镜观察水凝胶的内部结构和元素图谱分析 |
2.4 水凝胶的溶胀和降解性能
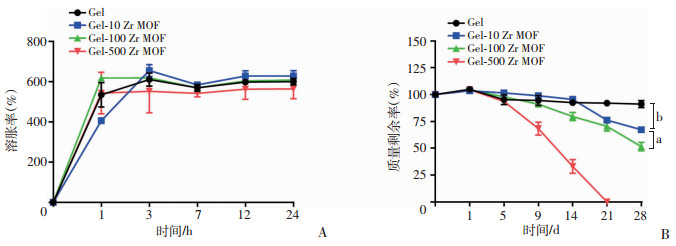
水凝胶的溶胀平衡结果显示:随着纳米Zr MOF材料含量的增加,越快达到溶胀平衡(图 4A)。Gel-100 Zr MOF和Gel-500 Zr MOF组能在1 h内就达到溶胀平衡,溶胀率分别为(618.2±4.3)%和(551.5±106.5)%。Gel和Gel-10 Zr MOF组则在3 h内能达到溶胀平衡,溶胀率分别为(610.1±32.8)%和(654.7±29.9)%。所有水凝胶显示出较好的溶胀能力,但是纳米Zr MOF材料的引入能缩短溶胀的时间,可以为细胞提供更充足的营养物质。水凝胶的降解实验结果显示:随着纳米Zr MOF材料含量的增加,降解速度加快(图 4B)。Gel-500 Zr MOF组在21 d就完全降解,而Gel、Gel-10 Zr MOF和Gel-100 Zr MOF在28 d的质量剩余率分别为(91.2±3.2)%、(67.3±2.7)%和(51.6±3.9)%。纳米Zr MOF材料的引入会缩短水凝胶的溶胀时间及水凝胶的降解时间,通过TEM结果可见:纳米Zr MOF材料的引入能使水凝胶孔壁上出现更多的小孔,有利于水分的渗透。表明纳米Zr MOF材料的引入能缩短溶胀的时间,同时孔的增多导致水凝胶内部结构稳定性降低,降解速度加快。
|
| A:不同纳米Zr MOF材料含量水凝胶的溶胀平衡随时间的变化曲线;B:不同纳米Zr MOF材料含量水凝胶的质量剩余随时间的变化曲线 a: P<0.05, b: P<0.01 图 4 水凝胶的溶胀和降解性能表征结果 |
2.5 水凝胶的流变力学性能
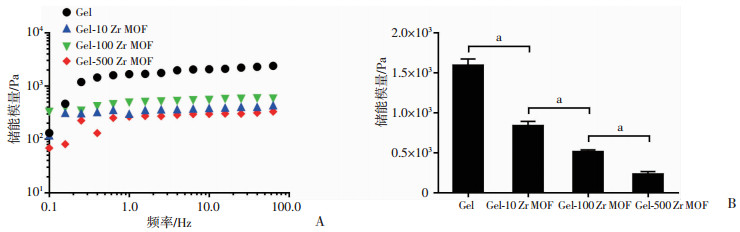
水凝胶的储能模量(G′)随着纳米Zr MOF材料含量增加而减低(图 5A)。在1.0 Hz频率时,对Gel、Gel-10 Zr MOF、Gel-100 Zr MOF和Gel-500 Zr MOF各组的储能模量分别进行计算(图 5B),当频率从0.1到100.0 Hz变化时,只有Gel-100 Zr MOF组的储能模量值没有出现明显的波动,证明Gel-100 Zr MOF水凝胶具有较稳定的内部结构。结合前面的水凝胶内部结构、溶胀平衡和降解实验结果,综合考虑选取Gel-100 Zr MOF水凝胶进行后期细胞实验。
|
| A:不同纳米Zr MOF材料含量水凝胶在0.1~100.0 Hz频率间储能模量变化;B:在1.0 Hz频率时不同纳米Zr MOF材料含量水凝胶的储能模量值 a:P<0.01 图 5 水凝胶的流变力学性能 |
2.6 纳米Zr MOF材料对抗炎肽KAFAK的包裹及释放结果
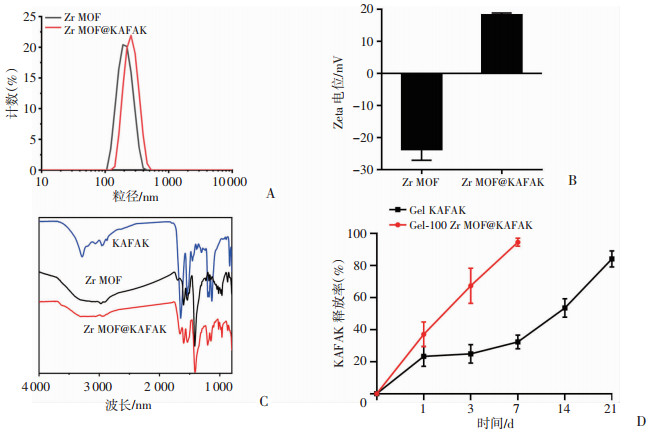
纳米Zr MOF材料对抗炎肽KAFAK负载后水合粒径为352.5 nm,粒径分布(PDI)为0.29,Zeta电位为18.9 mV(图 6A)。和单独的纳米Zr MOF材料相比,水合粒径有所增加,Zeta电位从(-23.77±3.33)mV变为(18.27±0.55)mV (图 6B),这是因为抗炎肽KAFAK是阳离子多肽,成功被负载到纳米Zr MOF材料上,从而使Zr MOF@KAFAK材料显示出正电荷。红外图谱结果显示(图 6C):Zr MOF@KAFAK包含了KAFAK和Zr MOF的特征吸收峰,证明Zr MOF材料成功对抗炎肽KAFAK进行包裹。对抗炎肽KAFAK从水凝胶中的释放速率进行表征,结果显示(图 6D):单独封装于水凝胶内的抗炎肽KAFAK会快速地从水凝胶中释放,到第3天已经释放(67.3±10.9)%,而到第7天时已经基本完全释放[(94.4±2.6)%]。抗炎肽KAFAK负载到Zr MOF后再用水凝胶进行封装,到第3天只有(32.2±4.3)%的释放,直到第21天时才有(84.1±5.0)%的释放,显示出对抗炎肽KAFAK较好的缓释作用。
|
| A:纳米Zr MOF材料负载抗炎肽KAFAK后的粒径分布;B:Zeta电位;C:红外图谱;D:负载抗炎肽KAFAK的锆-金属有机框架封装于水凝胶后对抗炎肽KAFAK的释放曲线 图 6 纳米Zr MOF材料对抗炎肽KAFAK的包裹及释放 |
2.7 细胞毒性实验
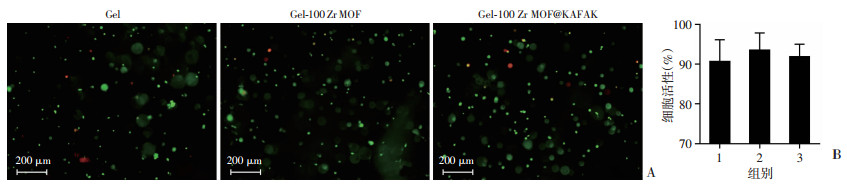
将兔BMSCs细胞作为种子细胞培养在水凝胶内,在培养3 d后,通过活/死细胞染色观察细胞生长状态。活细胞在Gel、Gel-100 Zr MOF和Gel-100 Zr MOF@KAFAK组的存活比率都大于90%,显示出较好的细胞相容性,各组间差异无统计学意义,证明普鲁兰多糖/聚乙二醇复合水凝胶封装纳米Zr MOF和Zr MOF@KAFAK材料后不会增加水凝胶的毒性(图 7)。
|
| A:荧光显微镜观察各组活细胞和死细胞绿色:活细胞;红色:死细胞;B:各组活细胞所占比例 1:Gel;2:Gel-100 Zr MOF;3:Gel-100 Zr MOF@KAFAK 图 7 活/死细胞染色观察兔BMSCs作为种子细胞在水凝胶中培养3 d时的细胞活性 |
2.8 总糖胺聚糖及软骨相关基因含量
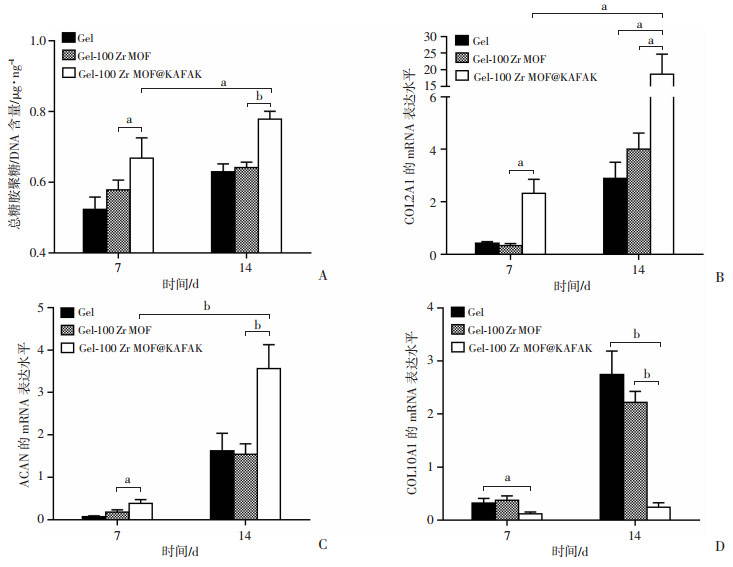
总糖胺聚糖作为软骨细胞外基质的重要组成部分,是成软骨能力的关键指标。通过对水凝胶的总糖胺聚糖量用DNA含量进行平均(图 8A),培养7 d后,相较于Gel和Gel-100 Zr MOF组,Gel-100 Zr MOF@KAFAK组糖胺聚糖含量显著提高(P<0.05)。培养14 d后,Gel-100 Zr MOF@KAFAK组糖胺聚糖含量进一步提高,较Gel组和Gel-100 Zr MOF组糖胺聚糖含量仍具有显著优势(P<0.01)。结果表明:水凝胶封装负载抗炎肽KAFAK的纳米Zr MOF材料后能提高水凝胶中的BMSCs成软骨细胞外基质产生能力。
|
|
a: P<0.05, b: P<0.01 A:总糖胺聚糖含量用DNA含量进行平均后的结果;B~D:分别为RT-PCR检测COL2A1、ACAN和COL10A1的表达 图 8 含兔BMSCs的水凝胶在成软骨诱导培养基培养7 d和14 d总糖胺聚糖含量和成软骨标志物基因的表达 |
为了验证水凝胶封装负载抗炎肽KAFAK的纳米Zr MOF材料后维持软骨细胞表型的能力,对软骨特异性标志物COL2A1和ACAN以及肥大化标志物COL10A1分别进行RT-PCR定量测定。如图 8B所示,在培养14 d后,Gel-100 Zr MOF@KAFAK组中COL2A1的表达显著高于Gel和Gel-100 Zr MOF组(P<0.05)。同时,培养第7、14天,Gel-100 Zr MOF@KAFAK组水凝胶的COL2A1表达显著升高(P<0.05)。ACAN的表达和COL2A1的表达具有一致性(图 8C)。肥大化标志物COL10A1的表达Gel-100 Zr MOF@KAFAK组显著低于Gel和Gel-100 Zr MOF组(P<0.05,图 8D)。证明水凝胶通过缓慢释放抗炎肽KAFAK有利于维持软骨细胞表型和抑制BMSCs肥大化。
3 讨论关节软骨缺乏血管、神经和淋巴,自我修复能力有限,伴随有骨关节炎的情况下就更难自我修复[34]。软骨再生过程中,炎性因子会抑制软骨细胞维持软骨表型,导致干细胞凋亡或降低其成软骨分化能力,从而减少软骨相关基质的合成,同时炎性因子还能诱导软骨基质降解酶的释放进而加速软骨缺损和骨关节炎进程[35-37]。因此,在软骨再生过程中有必要控制软骨缺损部位的炎性微环境。软骨再生组织在考虑支架材料、种子细胞和生长因子的同时应加入抗炎因子。
本研究选用普鲁兰多糖/聚乙二醇水凝胶作为支架材料,BMSCs作为种子细胞,水凝胶封装负载有抗炎肽KAFAK的纳米Zr MOF材料达到控制炎性微环境的目的。成功制备了纳米Zr MOF材料,通过透射电镜和扫描电镜表征呈长梭形,分布均一,水合粒径为328.8 nm,Zeta电位为(-23.77±3.33)mV。纳米Zr MOF材料负载抗炎肽KAFAK后水合粒径为352.5 nm,Zeta电位为(18.27±0.55)mV。KAFAK是阳性肽,负载后整个纳米金属有机框架带正电荷,软骨基质糖胺聚糖是负电荷,从水凝胶中释放的Zr MOF@KAFAK会通过电荷相互作用和糖胺聚糖结合,起到更持久的炎性控制作用。水凝胶封装Zr MOF@KAFAK后能延长抗炎肽KAFAK的释放时间达到21 d,保证持续控制炎性微环境的能力。可通过控制封装纳米Zr MOF材料的含量对水凝胶的理化性质进行调控,扫描电镜观察纳米Zr MOF材料(100 μg/mL)高含量组水凝胶孔壁上有更多的小孔,达到溶胀平衡时间更短(1 h),降解速度更快,以及具有更稳定的流变性能,这些特性有利于营养物质的转运和代谢废物的排出和软骨再生。
本研究通过对成软骨能力的关键指标糖胺聚糖含量进行测定,结果显示:水凝胶封装Zr MOF@KAFAK材料后能显著提高水凝胶中的BMSCs分泌软骨细胞外基质的能力。同时对软骨特异性标志物COL2A1和ACAN以及肥大化标志物COL10A1基因的表达进行了定量测定,结果表明:水凝胶封装Zr MOF@KAFAK材料后能通过缓慢释放抗炎肽KAFAK进而有利于维持软骨细胞表型和抑制BMSCs肥大化。证明在具有炎性条件下的软骨再生过程中,通过控制炎性微环境能达到更好的软骨再生效果。该结果对于组织工程修复软骨缺损具有一定指导意义。
综上,本研究选择具有良好生物活性的普鲁兰多糖/聚乙二醇复合水凝胶作为支架材料,封装负载有抗炎肽KAFAK的纳米Zr MOF材料,成功构建具有抗炎活性的软骨组织工程支架,并证明其良好的生物相容性和细胞外软骨基质产生能力,为构建兼具软骨再生和炎性微环境调控的支架材料提供一种新策略。
| [1] |
KATZ J N, ARANT K R, LOESER R F. Diagnosis and treatment of hip and knee osteoarthritis: areview[J]. JAMA, 2021, 325(6): 568-578. |
| [2] |
MARTEL-PELLETIER J, BARR A J, CICUTTINI F M, et al. Osteoarthritis[J]. Nat Rev Dis Primers, 2016, 2: 16072. |
| [3] |
KWON H, BROWN W E, LEE C A, et al. Surgical and tissue engineering strategies for articular cartilage and meniscus repair[J]. Nat Rev Rheumatol, 2019, 15(9): 550-570. |
| [4] |
ARMIENTO A R, ALINI M, STODDART M J. Articular fibrocartilage: why does hyaline cartilage fail to repair?[J]. Adv Drug Deliv Rev, 2019, 146: 289-305. |
| [5] |
MAKRIS E A, GOMOLL A H, MALIZOS K N, et al. Repair and tissue engineering techniques for articular cartilage[J]. Nat Rev Rheumatol, 2015, 11(1): 21-34. |
| [6] |
BALAKRISHNAN B, BANERJEE R. Biopolymer-based hydrogels for cartilage tissue engineering[J]. Chem Rev, 2011, 111(8): 4453-4474. |
| [7] |
HUA Y J, XIA H T, JIA L T, et al. Ultrafast, tough, and adhesive hydrogel based on hybrid photocrosslinking for articular cartilage repair in water-filled arthroscopy[J]. Sci Adv, 2021, 7(35): eabg0628. |
| [8] |
XIE Y L, ZINKLE A, CHEN L, et al. Fibroblast growth factor signalling in osteoarthritis and cartilage repair[J]. Nat Rev Rheumatol, 2020, 16(10): 547-564. |
| [9] |
SWEET M B, THONAR E J, IMMELMAN A R, et al. Biochemical changes in progressive osteoarthrosis[J]. Ann Rheum Dis, 1977, 36(5): 387-398. |
| [10] |
YANG K G, SARIS D B, VERBOUT A J, et al. The effect of synovial fluid from injured knee joints on in vitro chondrogenesis[J]. Tissue Eng, 2006, 12(10): 2957-2964. |
| [11] |
LI X, LU Y, WANG Y X, et al. Thermo-responsive injectable naringin-loaded hydrogel polymerised sodium alginate/bioglass delivery for articular cartilage[J]. Drug Deliv, 2021, 28(1): 1290-1300. |
| [12] |
BRUGNANO J L, CHAN B K, SEAL B L, et al. Cell-penetrating peptides can confer biological function: regulation of inflammatory cytokines in human monocytes by MK2 inhibitor peptides[J]. J Control Release, 2011, 155(2): 128-133. |
| [13] |
POH S, LIN J B, PANITCH A. Release of anti-inflammatory peptides from thermosensitive nanoparticles with degradable cross-links suppresses pro-inflammatory cytokine production[J]. Biomacromolecules, 2015, 16(4): 1191-1200. |
| [14] |
BARTLETT R L, PANITCH A. Thermosensitive nanopar-ticles with pH-triggered degradation and release of anti- inflammatory cell-penetrating peptides[J]. Biomacromolecules, 2012, 13(8): 2578-2584. |
| [15] |
BARTLETT R L 2nd, SHARMA S, PANITCH A. Cell-penetrating peptides released from thermosensitive nanoparticles suppress pro-inflammatory cytokine response by specifically targeting inflamed cartilage explants[J]. Nanomedicine, 2013, 9(3): 419-427. |
| [16] |
MCMASTERS J, POH S, LIN J B, et al. Delivery of anti-inflammatory peptides from hollow PEGylated poly(NIPAM) nanoparticles reduces inflammation in an ex vivo osteoarthritis model[J]. J Control Release, 2017, 258: 161-170. |
| [17] |
LIN J B, POH S, PANITCH A. Controlled release of anti-inflammatory peptides from reducible thermosensitive nanoparticles suppresses cartilage inflammation[J]. Nanomedicine, 2016, 12(7): 2095-2100. |
| [18] |
LI T, YANG J J, WENG C M, et al. Intra-articular injection of anti-inflammatory peptide-loaded glycol chitosan/fucoidan nanogels to inhibit inflammation and attenuate osteoarthritis progression[J]. Int J Biol Macromol, 2021, 170: 469-478. |
| [19] |
DOONAN C, RICCÒ R, LIANG K, et al. Metal-organic frameworks at the biointerface: synthetic strategies and applications[J]. Acc Chem Res, 2017, 50(6): 1423-1432. |
| [20] |
ZHOU Z X, VÁZQUEZ-GONZÁLEZ M, WILLNER I. Stimuli-responsive metal-organic framework nanoparticles for controlled drug delivery and medical applications[J]. Chem Soc Rev, 2021, 50(7): 4541-4563. |
| [21] |
DELLA ROCCA J, LIU D M, LIN W B. Nanoscale metal-organic frameworks for biomedical imaging and drug delivery[J]. Acc Chem Res, 2011, 44(10): 957-968. |
| [22] |
XUE S, ZHOU X J, SANG W L, et al. Cartilage-targeting peptide-modified dual-drug delivery nanoplatform with NIR laser response for osteoarthritis therapy[J]. Bioact Mater, 2021, 6(8): 2372-2389. |
| [23] |
XIONG F, QIN Z N, CHEN H M, et al. pH-responsive and hyaluronic acid-functionalized metal-organic frameworks for therapy of osteoarthritis[J]. J Nanobiotechnol, 2020, 18(1): 139. |
| [24] |
LI Z, PENG Y, XIA X Y, et al. Sr/PTA metal organic framework as a drug delivery system for osteoarthritis treatment[J]. Sci Rep, 2019, 9(1): 17570. |
| [25] |
LI Z, PENG Y, PANG X C, et al. Potential therapeutic effects of Mg/HCOOH metal organic framework on relieving osteoarthritis[J]. Chem Med Chem, 2020, 15(1): 13-16. |
| [26] |
LI Z, ZHAO S J, WANG H Z, et al. Functional groups influence and mechanism research of UiO-66-type metal-organic frameworks for ketoprofen delivery[J]. Colloids Surf B Biointerfaces, 2019, 178: 1-7. |
| [27] |
SHYNGYS M, REN J, LIANG X Q, et al. Metal-organic framework (MOF)-based biomaterials for tissue engineering and regenerative medicine[J]. Front Bioeng Biotechnol, 2021, 9: 603608. |
| [28] |
TOPRAK Ö, TOPUZ B, MONSEF Y A, et al. BMP-6 carrying metal organic framework-embedded in bioresorbable electrospun fibers for enhanced bone regeneration[J]. Mater Sci Eng C Mater Biol Appl, 2021, 120: 111738. |
| [29] |
XUE Y Y, ZHU Z, ZHANG X, et al. Accelerated bone regeneration by MOF modified multifunctional membranes through enhancement of osteogenic and angiogenic performance[J]. Adv Healthc Mater, 2021, 10(6): e2001369. |
| [30] |
ZHONG L N, CHEN J Y, MA Z Y, et al. 3D printing of metal-organic framework incorporated porous scaffolds to promote osteogenic differentiation and bone regeneration[J]. Nanoscale, 2020, 12(48): 24437-24449. |
| [31] |
TELGERD M D, SADEGHINIA M, BIRHANU G, et al. Enhanced osteogenic differentiation of mesenchymal stem cells on metal-organic framework based on copper, zinc, and imidazole coated poly-l-lactic acid nanofiber scaffolds[J]. J Biomed Mater Res A, 2019, 107(8): 1841-1848. |
| [32] |
QIN X P, HE R, CHEN H, et al. Methacrylated pullulan/polyethylene (glycol) diacrylate composite hydrogel for cartilage tissue engineering[J]. J Biomater Sci Polym Ed, 2021, 32(8): 1057-1071. |
| [33] |
ZHANG Y, WANG F M, LIU C Q, et al. Nanozyme decorated metal-organic frameworks for enhanced photodynamic therapy[J]. ACS Nano, 2018, 12(1): 651-661. |
| [34] |
HALEEM A M, CHU C R. Advances in tissue engineering techniques for articular cartilage repair[J]. Oper Tech Orthop, 2010, 20(2): 76-89. |
| [35] |
LOESER R F, GOLDRING S R, SCANZELLO C R, et al. Osteoarthritis: a disease of the joint as an organ[J]. Arthritis Rheum, 2012, 64(6): 1697-1707. |
| [36] |
STEINERT A F, GHIVIZZANI S C, RETHWILM A, et al. Major biological obstacles for persistent cell-based regeneration of articular cartilage[J]. Arthritis Res Ther, 2007, 9(3): 213. |
| [37] |
LIU Y Z, PENG L Q, LI L L, et al. 3D-bioprinted BMSC-laden biomimetic Multiphasic scaffolds for efficient repair of osteochondral defects in an osteoarthritic rat model[J]. Biomaterials, 2021, 279: 121216. |




