低氧性肺动脉高压(hypoxic pulmonary hypertension,HPH)是由于持续暴露于低氧环境而引起的致命的进行性血管疾病。慢性缺氧可导致肺血管异常收缩、肺血管重塑、肺动脉压力升高,最终导致右心衰竭死亡[1-2]。其中肺血管重构过程涉及3层血管壁(内膜、中膜和外膜)的改变,这是由细胞肥大、增生、炎症、凋亡、迁移和细胞外基质积累产生的结果[3]。到目前为止,HPH的确切发病机制尚不清楚,临床也缺乏有效的治疗手段。
Krüppel样因子5(Krüppel-like factor 5,KLF5)是一种锌指转录因子,可调节各种细胞过程,包括增殖、分化、发育和凋亡[4]。低氧诱导因子1α(hypoxia-inducible factor 1α,HIF-1α)是一种具有氧依赖性的转录因子,常氧状态时HIF-1α泛素化降解,低氧状态时泛素化降解受阻,HIF-1α积聚,核转位与HIF-1β结合形成异二聚体,转录激活与细胞增殖、细胞外基质重组以及细胞炎症等有关的基因,如VEGF、TGF-β1、IL-6、TNF-α等,参与HPH的病理进程[5-7]。此外,LI等[8]研究发现KLF5/HIF-1α通路通过上调Cyclin B1、Cyclin D1等蛋白的表达介导HPH的肺血管重构。
黄芪多糖(Astragalus polysaccharide,APS)是黄芪中的天然活性成分之一,属于高分子物质,主要成分包括杂多糖、葡聚糖、中性多糖和酸性多糖。研究表明APS具有多种药理作用,包括调节免疫功能、抗衰老、抗肿瘤、降血糖、降血脂、抗纤维化等作用[9]。YUAN等[10]研究发现,黄芪多糖对野百合碱诱导的肺动脉高压具有保护作用,但APS是否通过KLF5/HIF-1α信号通路参与HPH的调控尚不清楚。因此本研究通过检测APS对低氧诱导的肺动脉高压小鼠血流动力学,肺小动脉形态学变化,肺小动脉胶原纤维沉积面积,血清CRP、IL-6、TNF-α的含量以及肺组织中KLF5、HIF-1α、Cyclin B1、Cyclin D1、VEGF、TGF-β1蛋白水平的影响,探讨APS对低氧诱导的肺动脉高压小鼠肺血管重构的保护作用及其与KLF5/HIF-1α信号通路的相关性。
1 材料与方法 1.1 实验动物SPF级健康雄性C57BL/6小鼠,体质量20~25 g,购自辽宁长生生物技术股份有限公司,动物合格证号:SCXK(辽)2020-0001。
1.2 药品与试剂APS购自南京景竹生物技术有限公司,纯度为95%。HE染色试剂盒购自碧云天生物技术研究所;Masson染色液购自北京雷根生物技术有限公司;CRP、IL-6、TNF-α ELISA试剂盒购自上海酶联生物科技有限公司;一抗α-SMA、KLF5、HIF-1α、VEGF、Cyclin B1、Cyclin D1、GAPDH购自ABclonal公司;一抗TGF-β1购自万类生物有限公司;HRP标记山羊抗兔IgG抗体和FITC标记山羊抗兔IgG二抗购自ABclonal公司;BCA蛋白定量试剂盒购自北京鼎国昌盛生物技术有限公司;ECL化学发光显色试剂盒购自南京诺唯赞生物科技有限公司。
1.3 仪器动物常压低氧舱(上海塔望智能科技有限公司);BL-420S生物机能实验系统(成都泰盟科技有限公司);低温高速离心机(美国Sigma公司);DNM-9602G酶标分析仪(北京普朗新技术有限公司);电泳仪、电泳槽、半干转膜仪、凝胶成像仪(美国Bio-Rad公司);荧光显微镜(德国Leica公司)。
1.4 方法 1.4.1 动物分组及给药将50只雄性C57BL/6小鼠按完全随机法分为正常对照组,模型组,模型+APS 200、400、800 mg/kg组。正常对照组小鼠置于含21% O2的正常环境中;模型组,模型+APS 200、400、800 mg/kg组小鼠置于含10% O2的常压低氧舱中,持续饲养4周制备肺动脉高压模型。APS给药组从造模的第1天开始按相应剂量灌胃给药,其余组给予生理盐水灌胃,1次/d,共4周。
1.4.2 血流动力学及右心肥厚指数测定4周后,用1%戊巴比妥钠(40 mg/kg i.p.)麻醉小鼠,分离出右颈静脉,用细线阻断回心血流,然后通过右颈静脉切口缓慢插入与生物功能实验系统连接的Miller导管测量右心室收缩压(right ventricular systolic pressure,RVSP)[11]。开胸取出小鼠心脏,用PBS洗净血液,将其分离成右心室(RV)和左心室+室间隔(LV+S)两部分,分别称其干重。根据右心室肥厚指数[RV/(LV+S)]计算评价右心室肥厚程度[12]。
1.4.3 组织形态学检测用4%多聚甲醛固定肺组织48 h,梯度乙醇脱水后石蜡包埋,切成4 μm厚的切片备用。石蜡切片分别进行HE染色和Masson染色,光学显微镜下观察肺血管形态和胶原纤维沉积面积变化情况。用Image J计算肺动脉血管壁面积/血管总面积(WA/TA)和血管壁直径/血管壁总直径(WT/TT);肺组织胶原纤维沉积指数=(胶原纤维面积/总面积)×100%。
1.4.4 组织免疫荧光检测肺组织石蜡切片常规脱蜡水化后进行高压抗原修复,然后用0.5%曲拉通打孔1 h,5% BSA封闭1 h,滴加一抗α-SMA在4 ℃孵育过夜。第2天用FITC标记山羊抗兔IgG二抗避光孵育3 h,抗荧光淬灭封片液封片,荧光显微镜下观察。
1.4.5 ELISA检测根据ELISA试剂盒说明书对血清中CRP、IL-6、TNF-α的含量进行检测。
1.4.6 Western blot检测称取100 mg肺组织,加1 mL含1% PMSF的RIPA强裂解液在冰上裂解,提取总蛋白。BCA蛋白定量后制样,用SDS-PAGE凝胶分离各样品中的蛋白质,然后用半干转膜仪将凝胶上的蛋白质转移到PVDF膜上。将PVDF膜用5%脱脂牛奶室温封闭1.5 h,加一抗KLF5、HIF-1α、Cyclin B1、Cyclin D1、VEGF、TGF-β1、GAPDH在4 ℃孵育过夜。第2天加HRP标记山羊抗兔IgG二抗孵育1 h,滴加ECL化学发光显色试剂后用凝胶成像仪检测分析。
1.5 统计学分析采用GraphPad Prism 8.0.2进行统计学分析,所有数据以x±s表示。多组间显著性检验采用单因素方差分析和LSD法,P < 0.05认为差异有统计学意义。
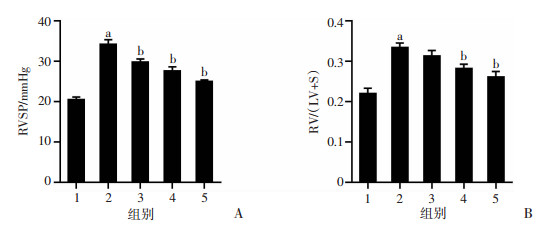
2 结果 2.1 APS对HPH小鼠血流动力学和右心肥厚的影响实验结果显示,与正常对照组相比,模型组小鼠RVSP、[RV/(LV+S)]均显著增加(P<0.01);与模型组相比,模型+APS 200、400、800 mg/kg组小鼠RVSP不同程度减轻(P < 0.01),模型+APS 400、800 mg/kg组小鼠RV/(LV+S)不同程度减轻(P < 0.01),见图 1。
|
|
1:正常对照组;2:模型组;3:模型+APS 200 mg/kg组;4:模型+APS 400 mg/kg组;5:模型+APS 800 mg/kg组 A:各组小鼠RVSP的测定;B:各组小鼠RV/(LV+S)的测定;a:P < 0.01,与正常对照组比较;b:P < 0.01,与模型组比较 图 1 APS对HPH小鼠RVSP和RV/(LV+S)的影响 |
2.2 APS对HPH小鼠肺动脉重构的影响
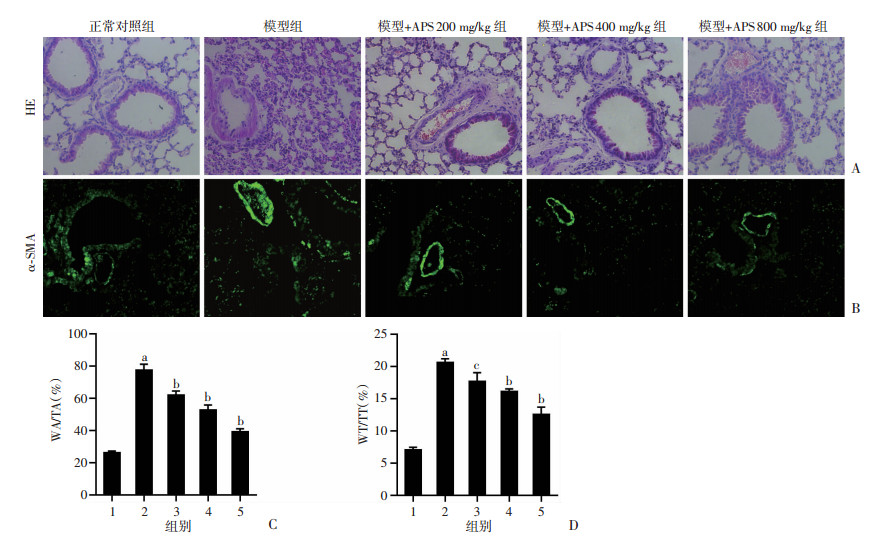
HE和α-SMA IF染色结果显示,与正常对照组相比,模型组小鼠WA/TA、WT/TT以及α-SMA的蛋白水平均显著增加(P < 0.01);与模型组相比,模型+APS 200、400、800 mg/kg组小鼠WA/TA、WT/TT以及α-SMA的蛋白水平均不同程度降低(P < 0.05,P < 0.01)。见图 2。
|
|
1:正常对照组;2:模型组;3:模型+APS 200 mg/kg组;4:模型+APS 400 mg/kg组;5:模型+APS 800 mg/kg组;a:P < 0.01,与正常对照组比较;b:P < 0.01,c:P < 0.05,与模型组比较 A:各组小鼠肺组织HE染色结果;B:各组小鼠肺组织α-SMA IF染色结果;C:各组小鼠WA/TA量化值;D:各组小鼠WT/TT量化值; 图 2 APS对HPH小鼠肺动脉重构的影响 |
2.3 APS对HPH小鼠肺组织纤维化的影响
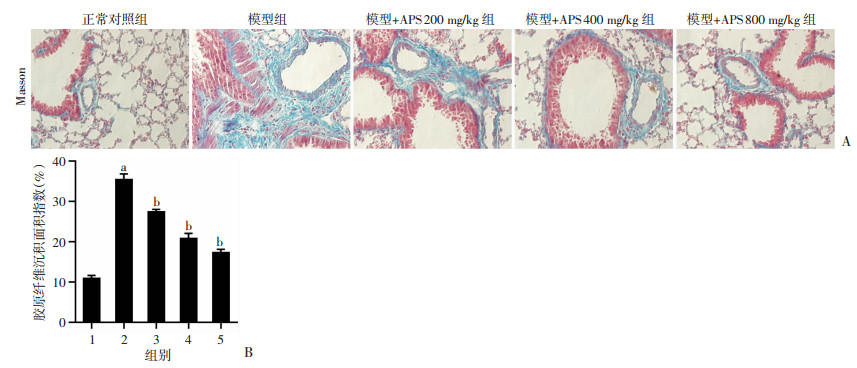
Masson染色结果显示,与正常对照组相比,模型组小鼠胶原纤维沉积面积显著增大(P < 0.01);与模型组相比,模型+APS 200、400、800 mg/kg组小鼠胶原纤维沉积面积均不同程度的降低(P < 0.01)。见图 3。
|
|
1:正常对照组;2:模型组;3:模型+APS 200 mg/kg组;4:模型+APS 400 mg/kg组;5:模型+APS 800 mg/kg组 A:各组小鼠肺组织Masson染色结果;B:各组小鼠肺组织胶原纤维沉积面积指数a:P < 0.01,与正常对照组比较;b:P < 0.01,与模型组比较 图 3 APS对HPH小鼠肺组织纤维化的影响 |
2.4 APS对HPH小鼠血清中CRP、IL-6、TNF-α含量的影响
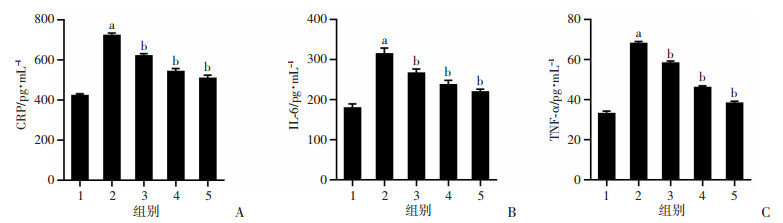
ELISA检测结果显示,与正常对照组相比,模型组小鼠血清中CRP、IL-6、TNF-α含量显著增加(P < 0.01);与模型组相比,模型+APS 200、400、800 mg/kg组小鼠血清中CRP、IL-6、TNF-α含量均不同程度的减少(P < 0.01)。见图 4。
|
|
1:正常对照组;2:模型组;3:模型+APS 200 mg/kg组;4:模型+APS 400 mg/kg组;5:模型+APS 800 mg/kg组 A:ELISA检测各组小鼠血清中CRP的含量;B:ELISA检测各组小鼠血清中IL-6的含量;C:ELISA检测各组小鼠血清中TNF-α的含量;a:P < 0.01,与正常对照组比较;b:P < 0.01,与模型组比较 图 4 APS对HPH小鼠血清中CRP、IL-6、TNF-α含量的影响 |
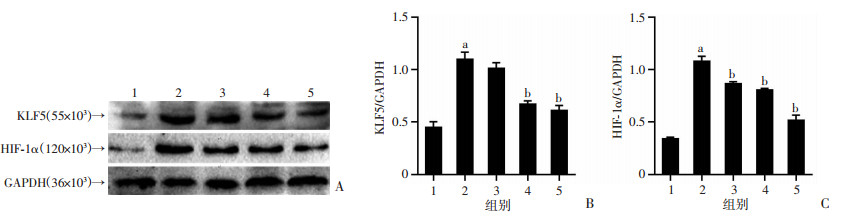
2.5 APS对HPH小鼠肺组织中KLF5、HIF-1α蛋白水平的影响
Western blot实验结果显示,与正常对照组相比,模型组小鼠肺组织中KLF5、HIF-1α蛋白水平显著升高(P < 0.01);与模型组相比,模型+APS 400、800 mg/kg组小鼠肺组织中KLF5蛋白水平均不同程度的降低(P < 0.01),模型+APS 200、400、800 mg/kg组小鼠肺组织中HIF-1α蛋白水平均不同程度的降低(P < 0.01)。见图 5。
|
|
1:正常对照组;2:模型组;3:模型+APS 200 mg/kg组;4:模型+APS 400 mg/kg组;5:模型+APS 800 mg/kg组 A:各组小鼠肺组织Western blot检测结果;B:KLF5/GAPDH比值;C:HIF-1α/GAPDH比值;a:P < 0.01,与正常对照组比较;b:P < 0.01,与模型组比较 图 5 APS对HPH小鼠肺组织中KLF5、HIF-1α蛋白水平的影响 |
2.6 APS对HPH小鼠肺组织中Cyclin B1、Cyclin D1、VEGF、TGF-β1蛋白水平的影响
Western blot实验结果显示,与正常对照组相比,模型组小鼠肺组织中Cyclin B1、Cyclin D1、VEGF、TGF-β1蛋白水平显著升高(P < 0.01);与模型组相比,模型+APS 200、400、800 mg/kg组小鼠肺组织中Cyclin B1、Cyclin D1、VEGF、TGF-β1蛋白水平显著降低(P < 0.01)。见图 6。

|
|
1:正常对照组;2:模型组;3:模型+APS 200 mg/kg组;4:模型+APS 400 mg/kg组;5:模型+APS 800 mg/kg组 A:各组小鼠肺组织Western blot检测结果;B:Cyclin B1/GAPDH比值;C:Cyclin D1/GAPDH比值;D:VEGF/GAPDH比值;E:TGF-β1/GAPDH比值;a:P < 0.01,与正常对照组比较;b:P < 0.01,与模型组比较 图 6 APS对HPH小鼠肺组织中Cyclin B1、Cyclin D1、VEGF、TGF-β1蛋白水平的影响 |
3 讨论
肺动脉高压(pulmonary hypertension,PH)是一种致命的血管疾病,最新血流动力学诊断标准为静息状态时平均肺动脉压(mPAP)≥20 mm Hg,根据临床分类,HPH属于PH中的第三类,以肺动脉重塑为显著特征[13]。为探讨APS对低氧诱导的HPH小鼠肺血管重构的影响及相关作用机制,本研究采用在含10% O2的常压低氧舱中持续饲养小鼠4周以制备肺动脉高压模型,期间按相应剂量进行APS灌胃。结果显示,APS治疗组可明显降低HPH小鼠的RVSP、右心肥厚指数和肺血管壁厚度,提示APS对低氧诱导的HPH小鼠肺血管重构具有保护作用,这与YUAN等[10]的研究结果类似。
Cyclin B1和Cyclin D1分别是细胞周期中促进细胞G1/S和G2/M期间隙过渡的关键细胞周期蛋白,参与细胞增殖、凋亡和转移[14]。VEGF是肺血管内皮细胞、平滑肌细胞等分泌的特异性生长因子,可促进平滑肌细胞增殖,使血管壁增厚、管腔狭窄,从而导致PH的形成[15]。本研究结果显示,APS治疗组明显降低HPH小鼠肺组织中Cyclin B1、Cyclin D1、VEGF的蛋白水平,提示APS可抑制HPH小鼠肺血管细胞增殖。多项研究表明,TGF-β1主要通过调控多种信号通路促进平滑肌细胞增殖、细胞外基质沉积等过程参与肺动脉高压的形成,主要包括TGF-β1/Smad、p38/MAPK、JNK、ERK1/2、PI3K及Rho蛋白激酶等信号通路[16]。本研究Masson染色和TGF-β1的Western blot实验结果显示,APS治疗组明显减少HPH小鼠肺组织胶原沉积面积,降低TGF-β1的蛋白水平,提示APS可抑制HPH小鼠肺组织纤维化。
有研究表明KLF5/HIF-1α通路可以通过调控Cyclin B1、Cyclin D1等多种蛋白的表达,促进HPH的血管重构[8]。KLF5是一种在HPH中上调的锌指转录因子,可促进PASMC的增殖和抗凋亡[17]。作为转录因子,KLF5也可以调节细胞周期、血管生成、细胞凋亡和迁移相关的基因,如细胞周期蛋白D1、VEGF、MMP9,还可介导TGF-β1信号传导[18-20]。已有研究证实,HIF-1α在低氧条件下参与炎症细胞迁移(单核细胞和巨噬细胞)和单核细胞向巨噬细胞的分化过程,促进IL-6、IL-1β、TNF-α等细胞因子的释放[7]。CRP是血管炎症的标志,常作为炎症性动脉疾病(包括肺动脉高压)的生物标志物用于临床检测[21]。为进一步探讨APS对HPH小鼠肺血管重构的保护作用与KLF5/HIF-1α通路的相关性,我们对小鼠肺组织中KLF5和HIF-1α的蛋白水平进行检测,结果显示,APS治疗组明显降低了HPH小鼠肺组织中KLF5和HIF-1α的蛋白水平。此外,小鼠血清ELISA检测结果显示,APS治疗组明显降低HPH小鼠血清中炎症因子IL-6、TNF-α和炎症标志物CRP的含量。综上所述,本研究证实APS可通过调控与细胞周期、细胞增殖、细胞炎症和纤维化相关蛋白的表达改善HPH小鼠的肺血管重构,其机制可能与抑制KLF5/HIF-1α信号通路有关。这一结论为APS在低氧性肺动脉高压中的治疗作用提供了理论依据。
| [1] |
CAI G X, LIU J J, WANG M B, et al. Mutual promotion of FGF21 and PPARγ attenuates hypoxia-induced pulmonary hypertension[J]. Exp Biol Med (Maywood), 2019, 244(3): 252-261. |
| [2] |
KLINGER J R, PEREIRA M, DEL TATTO M, et al. Mesenchymal stem cell extracellular vesicles reverse sugen/hypoxia pulmonary hypertension in rats[J]. Am J Respir Cell Mol Biol, 2020, 62(5): 577-587. |
| [3] |
CHRISTOPHE G, PETER D. Pathology and pathobiology of pulmonary hypertension[J]. Semin Respir Crit Care Med, 2017, 38(5): 571-584. |
| [4] |
SUZUKI T, SAWAKI D, AIZAWA K, et al. Krüppel-like factor 5 shows proliferation-specific roles in vascular remodeling, direct stimulation of cell growth, and inhibition of apoptosis[J]. J Biol Chem, 2009, 284(14): 9549-9557. |
| [5] |
FALLAH J, RINI B I. HIF inhibitors: status of current clinical development[J]. Curr Oncol Rep, 2019, 21(1): 6. |
| [6] |
LEI W, HE Y, SHUI X R, et al. Expression and analyses of the HIF-1 pathway in the lungs of humans with pulmonary arterial hypertension[J]. Mol Med Rep, 2016, 14(5): 4383-4390. |
| [7] |
PENA E, BRITO J, EL ALAM S, et al. Oxidative stress, kinase activity and inflammatory implications in right ventricular hypertrophy and heart failure under hypobaric hypoxia[J]. Int J Mol Sci, 2020, 21(17): E6421. |
| [8] |
LI X C, HE Y Z, XU Y J, et al. KLF5 mediates vascular remodeling via HIF-1α in hypoxic pulmonary hypertension[J]. Am J Physiol Lung Cell Mol Physiol, 2016, 310(4): L299-L310. |
| [9] |
ZHENG Y J, REN W Y, ZHANG L N, et al. A review of the pharmacological action of Astragalus polysaccharide[J]. Front Pharmacol, 2020, 11: 349. |
| [10] |
YUAN L B, HUA C Y, GAO S, et al. Astragalus polysaccharides attenuate monocrotaline-induced pulmonary arterial hypertension in rats[J]. Am J Chin Med, 2017, 45(4): 773-789. |
| [11] |
LI Y, REN W D, WANG X, et al. microRNA-150 relieves vascular remodeling and fibrosis in hypoxia-induced pulmonary hypertension[J]. Biomedecine Pharmacother, 2019, 109: 1740-1749. |
| [12] |
WANG Y L, WU F, HU F, et al. Drag-reducing polymers attenuates pulmonary vascular remodeling and right ventricular dysfunction in a rat model of chronic hypoxia-induced pulmonary hypertension[J]. Clin Hemorheol Microcirc, 2020, 74(2): 189-200. |
| [13] |
SIMONNEAU G, MONTANI D, CELERMAJER D S, et al. Haemodynamic definitions and updated clinical classification of pulmonary hypertension[J]. Eur Respir J, 2019, 53(1): 1801913. |
| [14] |
YOU B Y, LIU Y B, CHEN J, et al. Vascular peroxidase 1 mediates hypoxia-induced pulmonary artery smooth muscle cell proliferation, apoptosis resistance and migration[J]. Cardiovasc Res, 2018, 114(1): 188-199. |
| [15] |
陈刚, 宋军, 相虹, 等. γ氨基丁酸对肺动脉高压大鼠肺组织VEGF、MMP-9表达的影响[J]. 重庆医学, 2014, 43(30): 4043-4045. CHEN G, SONG J, XIANG H, et al. Effect of GABA on expression of VEGF and MMP-9 in monocrotaline-induced pulmonary hypertension rats[J]. Chongqing Med, 2014, 43(30): 4043-4045. |
| [16] |
王丹姝, 方莲花, 杜冠华. 转化生长因子β1在肺动脉高压中作用的研究进展[J]. 中国药理学通报, 2017, 33(6): 741-744. WANG D S, FANG L H, DU G H. Research progress on role of TGF-β1 in pulmonary artery hypertension[J]. Chin Pharmacol Bull, 2017, 33(6): 741-744. |
| [17] |
DING D D, JIANG H X, HE Y Z, et al. miR-320-3p regulates the proliferation, migration and apoptosis of hypoxia-induced pulmonary arterial smooth muscle cells via KLF5 and HIF1α[J]. Am J Transl Res, 2021, 13(4): 2283-2295. |
| [18] |
WAN H J, LUO F M, WERT S E, et al. Kruppel-like factor 5 is required for perinatal lung morphogenesis and function[J]. Development, 2008, 135(15): 2563-2572. |
| [19] |
LI Y X, ZHANG B T, XIANG L W, et al. TGF-β causes docetaxel resistance in prostate cancer via the induction of Bcl-2 by acetylated KLF5 and protein stabilization[J]. Theranostics, 2020, 10(17): 7656-7670. |
| [20] |
SHINODA Y, OGATA N, HIGASHIKAWA A, et al. Kruppel-like factor 5 causes cartilage degradation through transactivation of matrix metalloproteinase 9[J]. J Biol Chem, 2008, 283(36): 24682-24689. |
| [21] |
SKORO-SAJER N, GERGES C, GERGES M, et al. Usefulness of thrombosis and inflammation biomarkers in chronic thromboembolic pulmonary hypertension-sampling plasma and surgical specimens[J]. J Heart Lung Transplant, 2018, 37(9): 1067-1074. |




