2. 100039 北京,解放军总医院第三医学中心眼科医学部;
3. 100853 北京,解放军总医院第一医学中心
2. Senior Department of Ophthalmology, Third Medical Center of Chinese PLA General Hospital, Beijing 100039;
3. First Medical Center of Chinese PLA General Hospital, Beijing, 100853, China
角膜光密度(corneal densitometry,CD)是生物角膜的一种固有属性,与角膜的透明程度相关,可以作为评价角膜透明性的一个重要指标[1]。但是由于既往活体角膜透明性的测定方法存在一定的限制,很难在无创条件下重复测定CD值。Pentacam三维眼前节分析系统(Oculus, 德国)的出现及商业化应用使得无创、可重复的CD测定成为可能[1-3]。CD在感染性角膜炎、角膜基质营养不良、近视屈光手术、Fuch角膜内皮营养不良等疾病中都有应用[2-7],ALNAWAISE等[8]发现CD可以监测胺碘酮的累积和治疗情况,能够对胺碘酮相关的角膜病变进行定量的分析。
圆锥角膜(keratoconus,KC)是一种以角膜中央或旁中央扩张变薄、向前锥形突出为主要临床表现的一类致盲性眼病,好发于青春期,主要威胁青少年人群[9],针对KC的不同进展主要有3种手术治疗策略:角膜交联术(corneal collagen crosslinking,CXL)、角膜基质环植入术(intracorneal ring segments,ICRS or INTACS)和角膜移植术(keratoplasty)[10]。CXL作为进展期KC的有效治疗方法,可以提高角膜的硬度,降低其顺应性,进而能够阻止圆锥角膜的进展[11]。
张梦雨等[12]通过研究发现KC患者的角膜中央区域的CD值较正常人群高,可能与KC患者的角膜基质层纤维排列遭到破坏从而导致角膜硬度和透明度下降有关。DONG等[2]通过对拟行角膜屈光手术的近视人群的观察发现,近视人群的CD值较正常人群低。本研究旨在探究KC患者接受CXL前后CD值的变化情况,同时将单眼行CXL患者的CD值与对侧眼进行横向对比并观察其变化趋势,旨在对接受CXL的KC患者的术后恢复评估提供有益的参考。
1 资料与方法 1.1 一般资料选取2017年1月至2019年12月就诊于解放军总医院第一医学中心眼科已行CXL的KC患者28例(其中单眼手术患者14例,双眼手术患者14例)。纳入标准:①年龄≥16周岁,合并存在近视和或散光病史;②框架镜片矫正视力小于1.0,不排除硬性透气性角膜接触镜(rigid gas permeable contact lens,RGPCL)矫正视力≥1.0;③裂隙灯生物显微镜下检查至少检出一项包括角膜中央变薄并呈锥形前突在内的典型KC临床体征;④特殊检查:Pentacam检查提示后表面异常抬高,前节OCT检查提示角膜中央厚度变薄等其他检查;⑤在我院行角膜交联手术并按时间节点复查Pentacam,相关病例资料留存完整者。排除标准:①中央角膜厚度(central corneal thickness, CCT)过薄(CCT < 380 μm)无法行角膜交联手术;②角膜穿孔或存在瘢痕;③既往存在其他眼病史或眼部手术病史。
所有行CXL的KC患者纳入圆锥角膜-角膜光密度组(KC-CD组),共纳入42只眼(22只左眼,20只右眼),单眼行CXL的圆锥角膜患者的手术眼和非手术眼分别纳入CXL组(8只左眼,6只右眼)和Non-CXL组(6只左眼,8只右眼),两组各纳入14例。本研究为病例回顾性研究,遵循赫尔辛基宣言,对所有受试者的风险不大于最小风险,本研究经解放军总医院伦理委员会审查通过(批件号: S2021-111-01),所有患者签署知情同意。
1.2 检查方法所有受试者进行详细的病史采集,并进行一般的常规眼科检查(裸眼视力和最佳矫正视力、非接触眼压、裂隙灯生物显微镜检查、电脑验光和显然验光等)和Pentacam三维眼前节综合分析检查,利用Pentacam获取的全角膜数据和该系统内置的分析程序获取以角膜中心为圆点的0~2 mm、>2~6 mm、>6~10 mm、>10~12 mm的4个同心圆环和全角膜(0~12 mm)范围以及不同深度层次(前层Anterior Layer:前120 μm,中层Central Layer:前120 μm~后60 μm,后层Posterior Layer:后60 μm,全层角膜厚度Total Cornea)的CD值(CD值以灰度为单位(GSU),0表示完全透明,100表示完全不透明),同时获取单眼行角膜交联手术患者的角膜形态学指标:角膜曲率(corneal curvature)K1、K2和Kmax,角膜最薄点(thinnest corneal thickness,TCT)。所有Pentacam检查由一位操作熟练的技术人员在暗室环境下进行,每只眼分别采集3次,选取其中质控指标为“OK”的一次检查进行数据录入。对于所有受试者在术前、术后1个月、术后3个月、术后1年分别进行眼科常规检查和Pentacam检查并进行数据录入。
1.3 角膜交联手术方法及步骤所有患者采用去上皮CXL模式。术前3 d使用0.5%左氧氟沙星滴眼液(参天制药株式会社,日本)点术眼,4次/d。术前使用0.4%盐酸奥布卡因滴眼液(参天制药株式会社,日本)点术眼3次,待表面麻醉生效后,9 mm直径角膜环钻沿中央角膜标记,上皮刮刀刮除标记区域内角膜上皮,使用含0.1%核黄素盐溶液和羟丙基甲基纤维素的VibeX Rapid核黄素滴眼液滴眼,1次/2 min,共5次,持续10 min。BSS冲洗后,应用紫外线交联加固仪(Avedro, 美国),波长365 nm,照射量10 mW/cm2,紫外线交联照射9 min,总照射能量为5.4 J/cm2。术毕予以抗生素滴眼液点眼,术眼佩戴软性角膜接触镜(纯视,博士伦)。术后予以术眼1%氟米龙滴眼液(参天制药株式会社,日本)4次/d,1周后改为2次/d,2周后停药,视角膜上皮愈合情况取出角膜接触镜。
1.4 统计学分析采用SPSS 26.0(IBM,美国)进行统计学分析处理,利用GraphPad Prism 9.0(GraphPad Software, 美国)和Excel(微软,美国)进行图表绘制,对于连续型变量采用单样本Kolmogorov-Smirnov检验其正态性,对于符合正态分布的数据采用x±s表示,对于不符合正态分布的数据采用中位数和四分位数进行表示。在KC-CD组和Non-CXL组和CXL组内的CD值的比较采用多个相关样本Friedman检验,两两比较采用Friedman检验中的多重比较方法(成对比较),多重比较采用Bonferroni校正,而Non-CXL组与CXL组的组间比较采用了配对样本t检验;以α=0.05为检验水准。
2 结果 2.1 基本资料共收集28例受试者(共42只眼),将所有接受角膜交联手术CXL的眼别纳入圆锥角膜光密度组(KC-CD组),KC-CD组共42只眼,其中男性29只眼,女性13只眼,年龄16~32岁,平均年龄25岁;将其中14例接受单眼角膜交联手术的眼别纳入CXL组,其对侧未接受手术的眼别作为对照,纳入Non-CXL组,CXL组和Non-CXL组各14只眼,其中男性11例,女性3例,年龄19~32岁,平均年龄25岁。
2.2 KC-CD组角膜光密度结果KC-CD组中不同时间、不同深度与直径范围的CD值及统计量见表 1。前层0~2 mm、中层0~2 mm、后层0~2 mm及全层0~2 mm 4个层次的CD值在不同时间点上(术前、术后1个月、术后3个月、术后1年)经Friedman检验有统计学差异(P < 0.05)。进一步分析比较同一层次不同时间节点的CD值(利用Friedman检验中的多重比较,检验结果经Bonferroni校正),前层0~2 mm、中层0~2 mm、后层0~2 mm及全层0~2 mm术后1个月的CD值与术前相比明显升高(P < 0.05);前层0~2 mm、中层0~2 mm、全层0~2 mm术后3个月的CD值较术前升高(P < 0.01),而后层0~2 mm则没有统计学差异;术后1年的CD与术前相比,中层0~2 mm与后层0~2 mm无统计学差异,仅有前层0~2 mm较术前存在统计学差异(P=0.011,表 1)。角膜各层0~2 mm区域的CD值在术后1个月达到峰值,而后呈逐渐下降趋势,其中前层中央角膜的变化程度最大,而后层角膜及周边角膜的变化程度则较小,与CXL的核黄素的渗透距离和紫外线照射范围和时间可能存在一定联系。
| 层次 | 术前(42眼) | 术后1个月(42眼) | 术后3个月(42眼) | 术后1年(42眼) | Friedman Test | |
| χ2 | P值 | |||||
| 前层 | ||||||
| 0~2 mm | 22.30(21.38~24.10) | 34.10(29.98~38.05) | 29.55(26.18~34.15) | 25.80(22.23~30.33) | 74.914 1 | 0.000 0 |
| >2~6 mm | 19.00(18.35~20.83) | 27.20(23.45~30.30) | 24.20(21.58~27.20) | 21.20(18.68~24.08) | 78.789 5 | 0.000 0 |
| >6~10 mm | 15.75(14.63~18.60) | 18.60(16.50~21.83) | 17.05(15.40~20.48) | 17.60(16.05~19.83) | 37.405 3 | 0.000 0 |
| >10~12 mm | 27.40(20.83~31.80) | 30.80(23.10~37.43) | 29.95(22.15~36.55) | 32.80 (24.43~39.23) | 14.054 9 | 0.002 8 |
| 0~12 mm | 19.85(17.58~21.45) | 25.60 (23.25~29.40) | 24.20(20.58~27.30) | 23.00 (20.30~25.60) | 72.293 6 | 0.000 0 |
| 中层 | ||||||
| 0~2 mm | 14.70(14.08~15.50) | 18.35(16.40~20.85) | 16.50(15.40~18.50) | 15.00(14.30~15.73) | 75.971 2 | 0.000 0 |
| >2~6 mm | 12.45(12.08~12.93) | 15.30(13.28~16.78) | 13.55(12.68~14.63) | 12.50(11.98~13.03) | 84.347 0 | 0.000 0 |
| >6~10 mm | 11.35(10.65~12.83) | 12.13(11.18~13.70) | 11.80(10.70~13.55) | 11.30(10.90~12.93) | 23.404 4 | 0.000 0 |
| >10~12 mm | 18.90(17.28~22.10) | 20.65(17.65~23.40) | 19.80(17.25~22.48) | 19.90(16.23~23.93) | 0.860 2 | 0.835 0 |
| 0~12 mm | 13.55(12.7~14.40) | 16.05(14.2~17.38) | 14.55(13.28~15.45) | 13.60(12.98~14.63) | 60.266 8 | 0.000 0 |
| 后层 | ||||||
| 0~2 mm | 7.85(7.08~9.53) | 9.50(7.75~12.00) | 8.60(7.18~10.20) | 8.60(6.55~11.23) | 18.101 4 | 0.000 0 |
| >2~6 mm | 8.50(7.78~9.33) | 9.20(8.50~10.83) | 8.70(8.28~9.50) | 8.80(7.30~11.55) | 13.841 1 | 0.003 1 |
| >6~10 mm | 8.30(7.80~9.93) | 8.80(8.10~10.03) | 8.75(7.80~9.90) | 9.40(8.25~10.93) | 4.638 4 | 0.200 3 |
| >10~12 mm | 13.80(12.10~17.13) | 14.65(12.35~17.33) | 14.50(12.18~17.68) | 15.85(12.35~20.50) | 2.522 9 | 0.471 2 |
| 0~12 mm | 9.20(8.38~9.93) | 10.30(9.05~10.93) | 9.45(8.48~11.28) | 10.00(8.40~12.10) | 12.311 6 | 0.006 4 |
| 全层 | ||||||
| 0~2 mm | 15.15(14.20~16.28) | 20.80(18.98~23.53) | 18.75(16.8~20.10) | 16.80(14.38~18.90) | 75.744 6 | 0.000 0 |
| >2~6 mm | 13.60(12.85~14.45) | 17.20(15.85~19.38) | 15.70(14.25~17.15) | 14.35(12.90~16.33) | 69.604 3 | 0.000 0 |
| >6~10 mm | 12.05(11.05~14.10) | 13.40(11.95~14.93) | 12.70(11.43~14.65) | 13.00(11.60~14.10) | 16.518 1 | 0.000 9 |
| >10~12 mm | 19.75(16.65~24.33) | 21.50(18.53~25.75) | 21.50(18.18~26.03) | 23.30(16.83~27.28) | 6.469 9 | 0.090 9 |
| 0~12 mm | 14.25(13.08~15.30) | 17.70(15.45~18.90) | 16.35(14.38~17.75) | 15.45(14.60~17.35) | 63.000 0 | 0.000 0 |
| 各层次不同时间点的比较采用了Friedman检验;P < 0.05,表示该组在不同时间点内存在差异,利用Friedman检验的多重比较进行不同时间点的比较,多重比较采用Bonferroni校正 | ||||||
2.3 Non-CXL组和CXL组角膜光密度及形态结果
接受角膜交联手术的Non-CXL组不同深度和直径范围的CD值在术前、术后各个时间点的变化不具有统计学差异,而CXL组术前的前层0~2 mm、>2~6 mm,中层0~2 mm、>2~6 mm,全层0~2 mm、>2~6 mm的CD值与术后1个月、术后3个月和术后1年存在统计学差异(P < 0.05),其CD值的变化趋势与KC-CD组相类似。Non-CXL组与CXL组的CD值符合正态性分布(方差不齐),利用配对t检验对Non-CXL组和CXL组在各相同的时间点同一角膜层次和深度的CD值进行配对比较。在术后1个月,CXL组的前层0~2 mm、>2~6 mm,中层0~2 mm、>2~6 mm,后层>2~6 mm,全层0~2 mm、>2~6 mm的CD值均较Non-CXL组明显升高(P < 0.05);术后3个月上述CXL组各层CD值与Non-CXL组相比仍偏高(P < 0.05),但其平均CD值较CXL术后1个月下降;在接受CXL术后1年,CXL组各层CD值较Non-CXL组无明显变化(图 1)。Non-CXL组和CXL组的术前角膜形态学数据与术后各个时间点相比未见明显变化,在接受CXL术后,其术眼的角膜形态学未见进一步改变,而非术眼的角膜形态学进展的数据相比仅CXL组术后1个月和术后3个月的TCT较术前变薄(P < 0.05, 采用Friedman检验的多重比较,采用Bonferroni校正),其余参数并未发生进一步的变化(表 2, 3),表明单眼CXL手术能够很好地控制术眼的疾病进展,对侧眼在未接受CXL手术的情况下也趋于稳定。
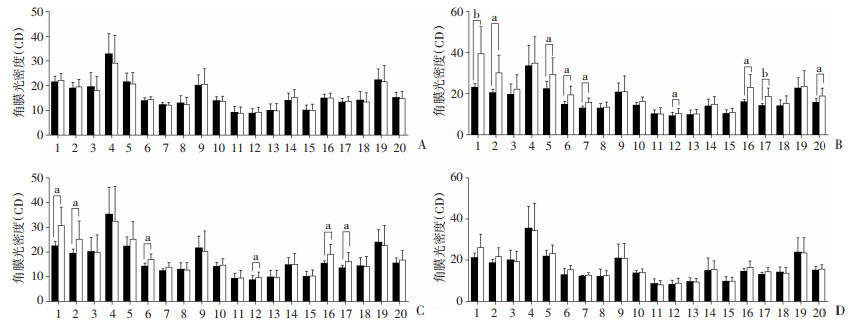
|
|
1:前层0~2 mm;2:前层>2~6 mm;3:前层>6~10 mm;4:前层>10~12 mm;5:前层全层;6:中层0~2 mm;7:中层>2~6 mm;8:中层>6~10 mm;9:中层>10~12 mm;10:中层全层;11:后层0~2 mm;12:后层>2~6 mm;13:后层>6~10 mm;14:后层>10~12 mm;15:后层全层;16:全层0~2 mm;17:全层>2~6 mm;18:全层>6~10 mm;19:全层>10~12 mm;20:全层角膜 A:CXL组和Non-CXL组术前;B:接受CXL术后1个月CXL组的CD值;C:接受CXL术后3个月CXL组的CD值;D:接受CXL术后1年CXL组的CD值 a: P < 0.05, b: P < 0.01 图 1 CXL组和Non-CXL组不同时间下角膜各直径和层次的CD值比较 |
| 参数 | 术前 | 术后1个月 | 术后3个月 | 术后1年 | Friedman Test | |
| χ2 | P值 | |||||
| K1(D) | 43.000(42.300~44.875) | 43.000(42.150~44.925) | 42.950(42.200~44.725) | 43.000(42.300~44.925) | 1.098 2 | 0.790 9 |
| K2(D) | 44.150(42.675~46.400) | 44.000(42.750~46.700) | 43.950(42.700~46.250) | 44.050(42.500~46.375) | 3.888 0 | 0.280 3 |
| Kmax(D) | 45.200(43.675~47.975) | 44.900(43.675~48.550) | 44.900(43.675~48.225) | 44.650(43.325~48.400) | 5.165 4 | 0.160 3 |
| TCT(μm) | 510.500(487.250~527.000) | 508.500(491.750~534.750) | 508.500(483.750~525.250) | 505.50(490.500~524.750) | 0.022 1 | 0.999 8 |
| 参数 | 术前 | 术后1个月 | 术后3个月 | 术后1年 | Friedman Test | |
| χ2 | P值 | |||||
| K1(D) | 46.400(44.675~51.225) | 46.750(44.925~52.475) | 46.300(44.825~51.25) | 45.950(44.3~50.70) | 2.574 6 | 0.476 6 |
| K2(D) | 50.700(47.475~57.550) | 51.000(47.225~58.400) | 51.000(47.500~58.225) | 49.150(46.875~58.275) | 0.626 9 | 0.895 5 |
| Kmax(D) | 59.050(51.450~67.250) | 58.800(52.650~65.125) | 58.400(51.250~65.550) | 56.750(50.675~67.475) | 3.000 0 | 0.401 3 |
| TCT(μm) | 462.000(438.000~484.000) | 443.000(428.500~460.750) | 454.000(414.500~461.250 | 454.500(410.750~471.000) | 9.264 7 | 0.022 5a |
| 注:各参数不同时间点的比较采用了Friedman检验;a: 表示TCT组不同时间内存在差异,利用Friedman检验的多重比较,术后1个月、术后3个月vs术前存在差异(P < 0.05, 多重比较采用Bonferroni校正) | ||||||
3 讨论
角膜光密度(CD)作为角膜透明度和角膜健康的一个重要指标,是一种全新的测量方法[8]。KOSEKAHYA等[13]对痛风患者CD的研究发现前层及中层中央角膜CD值会随着尿酸水平的升高和病程的延长而增加。RAMM等[14]将糖尿病患者的CD与正常人群相比较,发现糖尿病患者的CD值较正常人群低,1型糖尿病以及并发黄斑病变的患者较2型糖尿病患者和不伴黄斑病变患者的值低,说明CD能够作为糖尿病的一种新的检测工具。HO等[15]发现5%高渗剂对术后角膜水肿的患者能够减轻角膜水肿,显著提高视力,但CD差异不明显,提示视力与CD的相关性不明显。JABBARVAND等[16]尝试利用角膜基质环植入(ICRS)治疗KC,研究结果提示ICRS植入能够显著改善KC患者的最佳矫正视力(best corrected visual acuity, BCVA)和角膜形态学指标,而CD值较术前无明显差异,提示CD值与视力的相关性不大。CD值作为角膜透明性的一个指标,能反映角膜透明的程度,理论上能够对视力产生影响,而上述研究及其他类似研究并未提示视力和CD的相关性,CD与视力的相关性仍需更细致的研究。但可以肯定的是,相较于CD对视力的影响,圆锥角膜患者角膜形态学的改变对视力的影响更为显著,同时考虑到常规的显然验光很难完全矫正KC患者的不规则散光,也难以反映其真实的BCVA。ALZAHRANI等[17]的研究也未发现术前、术后BCVA存在差异,PIRCHER等[18]研究也证实CXL术后CD值的升高与视力无明显关系,而与视网膜上散射光的增加相关,故本研究未将视力等内容纳入。
英国ALZAHRANI等[17]将接受CXL的KC患者分为成人组和青少年组,在术前、术后3个月、术后6个月和术后1年分别进行Pentacam检查并获取CD值数据,结果表明角膜中央光学区0~2 mm、>2~6 mm直径范围的CD值在术后3个月最高,且与术前、术后6个月有明显差异,另外该研究并未发现术后BCVA较术前有所差异。PIRCHER等[18-19]的研究也提示CXL术后CD值逐渐升高达到峰值,在12个月消退,而这两项研究在CD值的峰值时间上存在差异,前者为3个月,后者为1个月。而本研究探究了角膜交联手术对KC患者CD值的影响,在CXL术后1个月可以看到角膜中央光学区(0~2 mm、>2~6 mm)CD值较术前明显升高,并在1个月达到顶峰,而后逐步下降,在术后1年其CD值与术前基本没有差异。ALZAHRANI等[17-19]的结果提示CXL术后CD值的变化趋势与本研究结果相符合,所得出的CXL术后最高CD值出现的时间存在差异,可能是因为实验设计的随访时间及具体手术方案略有不同,CD值高峰的具体时间并不相同,而本研究发现术后CD值的高峰出现在术后1个月,而术后3个月的CD值较术后1个月的CD值有所下降,因此CXL术后CD值的峰值出现时间,仍需要进一步的实验探索。
此外,本研究利用单眼接受CXL的KC患者的对侧眼作为Non-CXL组,手术眼作为CXL组,并将两组作为配对数据横向观察CXL术后CD值的变化。术后1个月和3个月Non-CXL组和CXL组CD值存在差异的主要为前层0~2 mm、>2~6 mm,在KC-CD组中也观察到了同样的情况。CXL的主要作用是增加角膜基质胶原之间的相互连接,从而达到增加角膜硬度[20],导致CXL术后CD值的升高,而角膜组织学的紊乱(如角膜板层排列和间距的改变、炎症、雾状混浊和瘢痕形成)可能影响角膜的透明度,被认为是CD升高的最有可能的原因[4, 21-22]。XIA等[23]利用偏振光显微镜对角膜交联术后的新西兰白兔进行观察,结果提示3型胶原在30d较对照组显著增加,并在90d达到最大值,在术后180d(6个月)与对照组水平相当,提示3型胶原合成及降解会扰乱角膜胶原的有序排列,从而增加光的散射,进而增加CD值,该研究从微观层面证实了CXL术后角膜基质内胶原的变化过程,其3型胶原的变化趋势与本研究中的CD值变化趋势相一致。CXL术后CD值的升高可能与CXL的原理和操作步骤有关,角膜交联手术会导致角膜基质纤维的排列混乱,从而引起角膜散射增多,CD值增加[24-25],也有学者认为出现CD值增大的原因主要是角膜前弹力层的破裂以及基质下神经纤维的损伤从而引起角膜透明度降低、光密度值增加[26-27]。
WANG等[28]在兔眼上验证了核黄素在角膜上的累积随作用时间的延长而累积,在该研究的实验浓度上,相较于跨上皮CXL,去上皮CXL能够在安全范围内更好地渗透到角膜基质,且在紫外线光照下能够完全降解。LOMBARDO等[29]利用双光子显微镜观察紫外线光照前后0.1%核黄素溶液(去上皮CXL模式)在角膜基质的浸润深度和富集浓度,结果发现在角膜的前基质层核黄素富集浓度最高达0.038%。O’BRART等[30]发现核黄素浓度越高,交联术后的角膜经胃蛋白酶消化后的干重越多,其角膜交联的程度越高。核黄素在紫外线的照射下能增加角膜胶原交联,但不可避免地在角膜基质内存在部分残留,但浓度较低[29],至于残留的核黄素是否影响CD值的升高,目前尚未有文献报道。
另外,本研究结果提示在接受单眼CXL手术后其术眼角膜形态较术前无明显差异,说明CXL手术能够阻止KC的进展,此外术后1个月和3个月的TCT较术前明显变薄,而术后1年则较术前无差异,说明CXLn在增加角膜基质交联程度的同时减小角膜厚度、进而增强角膜。此外,Non-CXL组的K1、K2、Kmax和TCT在手术前后没有明显变化,这提示对于单眼行CXL手术患者不仅能够控制术眼KC的进展,其对侧非手术眼的进展也受到控制。KC作为一种非炎性扩张性疾病,具体的发病原因尚不明确[31],KOSEKAHYA等[32]研究发现,接受单眼CXL的KC患者角膜形态学数据较接受双眼CXL患者并无明显变化,仅仅是最终的D值存在差异。KIM等[19]通过对双眼KC接受单眼CXL的患者进行随访,并在术后观察双眼CD值的变化,结果提示除术眼的CD值较非术眼升高之外,双眼的角膜形态学指标(Kmax、散光度等)以及矫正视力等指标未见明显变化,这也提示单眼的CXL能够控制双眼KC的进展。而上述现象可能与单眼发病后对眼睛保护的重视以及用眼卫生习惯的改变有关(如停止揉眼等),但同时也不能否认KC的双眼发病是否存在某种内在的联系,当一只眼进展或停止时对侧眼也会出现相对应的变化,对于这部分内容仍需进一步研究。
本研究的不足之处:本研究因客观原因未尽可能地纳入更多的数据,仍需要扩大样本量做进一步的研究,在扩大样本量的基础上,结合患者进行角膜形态学数据和最佳矫正视力以及圆锥角膜等级分级,细化不同KC等级,进一步全面分析不同亚组之间CD的变化趋势和分布情况。
综上,本研究回顾了KC患者接受CXL手术前后CD值的变化趋势和分布,研究结果提示KC患者CXL术后CD值先升高再逐渐恢复的动态过程,其CD值的高峰出现在术后1个月,为患者提供了更为详细的术前知情情况,同时利用单眼接受CXL的KC患者的对侧眼作为对照,进一步验证了KC患者的CD值变化过程,同时发现单眼CXL手术能对双眼KC进行有效的控制,为CXL术后KC患者的角膜动态变化过程评估提供了有益的参考。
| [1] |
OTRI A M, FARES U, AL-AQABA M A, et al. Corneal densitometry as an indicator of corneal health[J]. Ophthalmology, 2012, 119(3): 501-508. |
| [2] |
DONG J, ZHANG Y Q, ZHANG H N, et al. Corneal densitometry in high myopia[J]. BMC Ophthalmol, 2018, 18(1): 182. |
| [3] |
CHO Y K, CHANG H S, LA T Y, et al. Anterior segment parameters using Pentacam and prediction of corneal endothelial cell loss after cataract surgery[J]. Korean J Ophthalmol, 2010, 24(5): 284-290. |
| [4] |
LOPES B, RAMOS I, AMBRÓSIO R Jr. Corneal densitometry in keratoconus[J]. Cornea, 2014, 33(12): 1282-1286. |
| [5] |
CHU H Y, HSIAO C H, CHEN P Y F, et al. Corneal backscatters as an objective index for assessing fuchs' endothelial corneal dystrophy: a pilot study[J]. J Ophthalmol, 2017, 2017: 8747013. |
| [6] |
SEKEROGLU M A, ANAYOL M A, GULEC M, et al. Corneal densitometry: a new technique for objective assessment of corneal clarity in pseudoexfoliation syndrome[J]. J Glaucoma, 2016, 25(9): 775-779. |
| [7] |
袁倩, 刘蕾, 张亚丽, 等. SMILE和FS-LASIK对角膜光密度的影响[J]. 中华眼视光学与视觉科学杂志, 2018, 20(12): 719-724. YUAN Q, LIU L, ZHANG Y L, et al. Effect of SMILE and FS-LASIK on corneal densitometry after myopic correction[J]. Chin J Optom Ophthalmol Vis Sci, 2018, 20(12): 719-724. |
| [8] |
ALNAWAISEH M, ZUMHAGEN L, ZUMHAGEN S, et al. Corneal densitometry as a novel technique for monitoring amiodarone therapy[J]. Ophthalmology, 2016, 123(11): 2294-2299. |
| [9] |
XU L, WANG Y X, GUO Y, et al. Prevalence and associations of steep cornea/keratoconus in Greater Beijing. The Beijing Eye Study[J]. PLoS One, 2012, 7(7): e39313. |
| [10] |
张梦瑶, 林启, 邵毅. 儿童圆锥角膜的治疗进展[J]. 国际眼科杂志, 2020, 20(4): 619-623. ZHANG M Y, LIN Q, SHAO Y. Application advancement of corneal cross-linking inpediatric keratcoconus[J]. Int Eye Sci, 2020, 20(4): 619-623. |
| [11] |
李金晶, 薛劲松, 蒋沁, 等. 角膜胶原交联术治疗圆锥角膜的研究进展[J]. 国际眼科杂志, 2020, 20(3): 477-480. LI J J, XUE J S, JIANG Q, et al. Research progress of corneal collagen cross-linking in the treatment of keratoconus[J]. Int Eye Sci, 2020, 20(3): 477-480. |
| [12] |
张梦雨, 田磊, 郭莉莉, 等. 圆锥角膜的光密度分析及其与角膜形态学的相关性研究[J]. 眼科, 2020, 29(4): 278-283. ZHANG M Y, TIAN L, GUO L L, et al. Corneal densitometry analysis and its correlation with corneal topography in keratoconus[J]. Ophthalmol China, 2020, 29(4): 278-283. |
| [13] |
KOSEKAHYA P, ATILGAN K G, ATILGAN C U, et al. Could corneal densitometry be used as a diagnostic and screening tool for ocular involvement in patients with gout?[J]. Int Ophthalmol, 2019, 39(5): 991-1001. |
| [14] |
RAMM L, SPOERL E, PILLUNAT L E, et al. Corneal densitometry in diabetes mellitus[J]. Cornea, 2020, 39(8): 968-974. |
| [15] |
HO WANG YIN G, SAMPO M, SOARE S, et al. Visual acuity, pachymetry and corneal density after 5% sodium chloride treatment in corneal edema after surgery[J]. J Fr Ophtalmol, 2015, 38(10): 967-973. |
| [16] |
JABBARVAND M, KHODAPARAST M, JAMALI A, et al. Changes in the optical corneal densitometry, visual acuity, and refractive error after the annular intracorneal inlay implantation[J]. J Curr Ophthalmol, 2021, 33(1): 23-30. |
| [17] |
ALZAHRANI K, MOFTY H, LIN E Y, et al. Corneal imaging and densitometry measurements in juvenile and adult keratoconus patients to evaluate disease progression and treatment effects after corneal cross-linking[J]. Clin Optom(Auckl), 2019, 11: 173-180. |
| [18] |
PIRCHER N, PACHALA M, PRAGER F, et al. Changes in straylight and densitometry values after corneal collagen crosslinking[J]. J Cataract Refract Surg, 2015, 41(5): 1038-1043. |
| [19] |
KIM B Z, JORDAN C A, MCGHEE C N J, et al. Natural history of corneal haze after corneal collagen crosslinking in keratoconus using Scheimpflug analysis[J]. J Cataract Refract Surg, 2016, 42(7): 1053-1059. |
| [20] |
MAIER P, REINHARD T, KOHLHAAS M. Corneal collagen cross-linking in the stabilization of keratoconus[J]. Dtsch Arztebl Int, 2019, 116(11): 184-190. |
| [21] |
ELFLEIN H M, HOFHERR T. Measuring corneal clouding in patients suffering from mucopolysaccharidosis with the Pentacam densitometry programme[J]. Br J Ophthalmol, 2013, 97(7): 829-833. |
| [22] |
GREENSTEIN S A, KRISTEN L F, BHATT J, et al. Natural history of corneal haze after collagen crosslinking for keratoconus and corneal ectasia: Scheimpflug and Biomicroscopic analysis[J]. J Cataract Refract Surg, 2010, 36(12): 2105-2114. |
| [23] |
XIA Y, LIU B C, FAN Z J, et al. Corneal collagen fibril changes after ultraviolet a/riboflavin corneal crosslinking[J]. Cornea, 2014, 33(1): 56-59. |
| [24] |
FREEGARD T J. The physical basis of transparency of the normal cornea[J]. Eye(Lond), 1997, 11(Pt 4): 465-471. |
| [25] |
ROZEMA J J, KOPPEN C, BRAL N, et al. Changes in forward and backward light scatter in keratoconus resulting from corneal cross-linking[J]. Asia Pac J Ophthalmol(Phila), 2013, 2(1): 15-19. |
| [26] |
RABINOWITZ Y S. Keratoconus[J]. Surv Ophthalmol, 1998, 42(4): 297-319. |
| [27] |
UÇAKHAN O O, KANPOLAT A, YLMAZ N, et al. In vivo confocal microscopy findings in keratoconus[J]. Eye Contact Lens, 2006, 32(4): 183-191. |
| [28] |
WANG M M, ZHANG F J, ZHAO X, et al. Riboflavin concentration analysis in rabbit corneas before and after corneal collagen cross-linking using confocal laser scanning microscopy[J]. Asia Pac J Ophthalmol, 2014, 3(6): 388-394. |
| [29] |
LOMBARDO G, MICALI N L, VILLARI V, et al. Assessment of stromal riboflavin concentration-depth profile in nanotechnology-based transepithelial corneal crosslinking[J]. J Cataract Refract Surg, 2017, 43(5): 680-686. |
| [30] |
O'BRART N A L, O'BRART D P S, ALDAHLAWI N H, et al. An investigation of the effects of riboflavin concentration on the efficacy of corneal cross-linking using an enzymatic resistance model in porcine corneas[J]. Invest Ophthalmol Vis Sci, 2018, 59(2): 1058-1065. |
| [31] |
GOMES J A P, TAN D, RAPUANO C J, et al. Global consensus on keratoconus and ectatic diseases[J]. Cornea, 2015, 34(4): 359-369. |
| [32] |
KOSEKAHYA P, KOC M, CAGLAYAN M, et al. Longitudinal corneal tomographical changes in eyes of patients with unilateral and bilateral non-progressive keratoconus[J]. Cont Lens Anterior Eye, 2019, 42(4): 434-438. |




