卒中的复杂性和异质性,以及相关的合并症,可能会降低神经保护药物在临床实践中的有效性,因此,针对特定患者亚群的靶向治疗的开发已成为转化卒中研究的重中之重[1]。与一般人群相比较,糖尿病患者患缺血性卒中的风险高2~6倍;大约30%的卒中患者患有糖尿病。合并糖尿病的卒中患者的死亡率几乎翻倍,神经系统预后更差,出血转化风险更高,对组织型纤溶酶原激活剂(tissue-type plasminogen activator)治疗的反应较差[2],因此,寻求对糖尿病合并脑缺血损伤的新的治疗手段十分迫切。
利拉鲁肽(liraglutide)是一种人工合成的长效胰高血糖素肽-1(glucagon-like peptide-1,GLP-1)类似物,近年研究发现其可通过抗氧化、抗炎、抗细胞凋亡及促进血管再生等机制改善糖尿病大鼠脑缺血损伤[3-5]。但目前对其机制的研究仍有限。越来越多的证据表明,小胶质细胞/巨噬细胞极化在糖尿病加重脑缺血损伤中起着极为重要的作用。抑制小胶质细胞/巨噬细胞向M1型转换,促进其向M2型转换,可减轻糖尿病鼠脑缺血损伤[6-8]。新近研究发现,烟酰胺腺嘌呤二核苷酸磷酸氧化酶(nicotinamide adenine dinucleotide phosphate oxidase, NOX2) 对小胶质细胞/巨噬细胞极化有重要的调控作用[9]。而利拉鲁肽可通过增加AMPKα磷酸化水平,降低NOX2表达,阻止β细胞凋亡[10]。本课题拟以糖尿病合并局灶性脑缺血损伤的动物模型为研究对象,观察利拉鲁肽对缺血侧脑组织中NOX2、M1型与M2型小胶质细胞/巨噬细胞的表面标记物及其分泌的炎症因子表达的影响,进一步探讨利拉鲁肽的神经保护机制,以期为其临床应用提供可靠的实验室依据。
1 材料与方法 1.1 实验材料及分组健康SD雄性大鼠75只,年龄8~10周,体质量为280~320 g,于广东省医学实验动物中心购入, 合格证号:SCXK(粤)2018-0006。按照随机数字表法分笼,适应性高糖高脂饮食喂养4周,自由进水,饲养温度为22 ℃左右,湿度为50%左右。大鼠被随机分为5组:脑缺血(CI)组、糖尿病脑缺血(DCI)组、胰岛素(Ins)组、利拉鲁肽(Lir)组、NOX2激动剂TBCA(tetrabromocinnamic acid)+ 利拉鲁肽(TBCA)组,每组15只。采用腹腔注射链脲佐菌素(streptozocin, STZ)模拟糖尿病模型,再通过线栓法建立永久性大脑中动脉栓塞(middle cerebral artery-occlusion,MCAO)模型。TBCA组MCAO前30 min左侧侧脑室注射TBCA[50 nmol, 溶于5 μL 50%二甲基亚砜(DMSO)],MCAO后左下腹腔注射利拉鲁肽(700 μg/kg)qd×3 d。Lir组于MCAO前30 min侧脑室注射等剂量DMSO,MCAO后腹腔注射利拉鲁肽(700 μg/kg) qd×3 d。Ins组大鼠于MCAO前30 min侧脑室注射等剂量DMSO,MCAO后腹腔注射胰岛素(2 U/kg) gd×3 d。DCI组及CI组于相同时间点、相同途径分别注入等剂量DMSO及生理盐水。
1.2 方法 1.2.1 糖尿病模型造模各组动物禁食禁饮6~8 h后, 左下腹腔注射STZ 2 mg/100 g,24 h后再一次予3.5 mg/100 g STZ腹腔注射;48 h后测尾尖血糖。造模成功为空腹血糖>16.7 mmol/L,并出现多尿、多饮、多食、体质量下降等表现。未达标准或未到时间点死亡大鼠被剔除,随机补充。
1.2.2 永久性局灶性脑缺血模型的建立采用改良线栓法建立MCAO模型。2% 戊巴比妥钠(30 mg/kg)腹腔麻醉,颈前正中切口,充分暴露颈总动脉及其分支,特制尼龙栓线自颈总动脉插入向颈内动脉方向入颅,进入大脑中动脉与大脑前动脉分叉处(此时有阻力增大),线头距颈动脉分叉处约18 mm阻断血流。术后动物置于干净通风的鼠笼内单笼饲养,维持笼内温度25 ℃左右。观察大鼠一般情况、生命体征至麻醉苏醒。
1.2.3 神经功能评分参照Zea-Longa 5分制评分标准对各组大鼠进行神经功能缺损评分。2分或2分以上者视为造模成功,0、5分者剔除,随机补充。
1.2.4 梗死体积测定麻醉大鼠,冰上断头取脑,完整取出脑组织,将其放于-20 ℃冰箱中约(15~20 min),冠状切片,厚度约2 mm,放入2% TTC溶液中,置于37 ℃烘箱中避光孵育30 min,取出,4%多聚甲醛固定24 h后拍照,用Image J软件检测脑梗死体积。
1.2.5 免疫荧光双标记法检测小胶质细胞/巨噬细胞M1、M2型表面标志物CD16/32、CD206与Iba1共标情况各组动物麻醉后,心脏灌注PBS溶液和4%多聚甲醛,直至肝脏、肺脏、眼球颜色变为白色。断头取脑,留取缺血侧脑组织,放入10%多聚甲醛固定24 h。行冠状切片,厚度小于2 mm,脱水、包埋,细切,厚度20 μm。免疫荧光步骤如下:石蜡切片脱蜡,依次放入二甲苯中(30 min)、无水乙醇5 min、95%乙醇5 min、85%乙醇5 min、75%乙醇5 min、50%乙醇5 min。然后用蒸馏水冲洗5 min。再放入枸橼酸缓冲液中,煮沸15 min,室温晾干,用PBS洗3次,每次5 min。用牛血清白蛋白孵育30 min,倒掉血清,按说明书加入稀释好的一抗Iba-1(1 ∶1 000),CD16/32(1 ∶50),CD206(1 ∶50)孵育。隔日取出,PBS冲洗3次,每次5 min。避光加入二抗,室温孵育1 h,用PBS冲洗3次,每次5 min,然后加入DAPI染液,孵育10 min,PBS冲洗3次,每次5 min,封片。荧光显微镜下拍照保存。用Imag J软件对阳性细胞进行荧光定量分析。
1.2.6 Western blot检测NOX2、TNF-α、IL-1β、IL-10、TGF-β的蛋白表达取各组大鼠缺血侧标本,以100 mg组织样本加入100 μL RIPA裂解液将组织样本迅速研磨后冰上裂解10 min,玻璃匀浆器匀浆,离心后收集上清液,提取总蛋白,应用BCA试剂盒进行蛋白定量。将总蛋白加入等体积2×电泳样品缓冲液后100 ℃沸水中水浴5 min使其变性,经SDS-PAGE电泳后用半干转印仪转膜至硝酸纤维膜;5%脱脂奶粉封闭后,室温孵育1 h,加入相应一抗兔抗NOX2(1 ∶500),小鼠抗TNF-α(1 ∶500),小鼠抗IL-1β(1 ∶500),小鼠抗TGF-β(1 ∶500),小鼠抗IL-10(1 ∶500)(英国Abcam公司),4 ℃缓慢摇振孵育过夜;应用TBS-T洗膜3~4次,每次10 min;分别加入辣根过氧化物酶标记二抗,室温避光孵育60 min;TBS-T洗膜4次,每次10 min;于暗室中滴入ECL显色剂显色后放于暗盒中曝光,并通过Image J对显示的蛋白电泳条带进行数据分析,获取各组蛋白质印迹条带平均灰度值(目的蛋白与内参灰度值的比值即为目的蛋白表达的相对值)。
1.3 统计学分析采用SPSS 21.0软件进行统计学分析,计量资料服从正态分布或近似正态分布的采用x±s表示。多个均数间比较采用单因素方差分析,若方差齐,两两比较采用LSD-t检验,若方差不齐,两两比较采用Tamhane’s T2检验。检验标准:α=0.05。
2 结果 2.1 药物干预对各组大鼠血糖水平的影响Lir组、Ins组、TBCA组在分别腹腔注射利拉鲁肽、胰岛素及利拉鲁肽的前后其血糖值均明显下降(P < 0.05)。CI组、DCI组在腹腔注射生理盐水前后血糖值比较均无明显差异(表 1)。
| 组别 | 药物干预前血糖值/mmol·L-1 | 药物干预后血糖值/mmol·L-1 | 神经功能缺损评分/分 |
| CI组 | 4.30±0.37 | 5.15±0.58 | 2.80±0.41 |
| DCI组 | 24.08±2.06 | 25.98±1.08 | 3.27±0.46b |
| Ins组 | 23.87±2.09 | 15.06±0.77a | 3.33±0.62 |
| Lir组 | 24.43±1.78 | 14.03±0.92a | 2.27±0.48c |
| TBCA组 | 24.27±1.37 | 15.76±1.14a | 2.93±0.45d |
| a: P < 0.05, 与同组比较; b: P < 0.05, 与CI组比较;c: P < 0.05, 与DCI组比较;d: P>0.05, 与Lir组比较 | |||
2.2 利拉鲁肽对糖尿病大鼠脑缺血后神经功能缺损评分的影响
DCI组神经功能缺损评分高于CI组,Lir组低于DCI组,TBCA组高于Lir组(P均<0.05),而Ins组与Lir组间比较无明显差异(表 1)。
2.3 利拉鲁肽对糖尿病大鼠脑缺血后脑梗死体积的影响各组均出现不同程度的脑梗死。DCI组脑梗死体积大于CI组,Lir组小于DCI组,TBCA组大于Lir组(P均<0.05),而Ins组与DCI组间比较无明显差异(图 1)。

|
| A: 各组大鼠脑缺血后脑组织TTC染色;B: 半定量分析 1:CI组;2:DCI组;3:Ins组;4:Lir组;5:TBCA组;a:P < 0.05,与CI组比较;b:P < 0.05,与DCI组比较;c:P < 0.05,与Lir组比较 图 1 利拉鲁肽对糖尿病大鼠脑缺血后脑梗死体积的影响 |
2.4 利拉鲁肽对糖尿病大鼠脑缺血后小胶质细胞/巨噬细胞M1/M2型极化的影响 2.4.1 利拉鲁肽对糖尿病大鼠脑缺血后小胶质细胞/巨噬细胞M1型极化的影响
各组均出现不同程度的Iba1+/CD16/32+细胞。与CI组相比,DCI组显著增多(P < 0.05);与DCI组相比,Lir组显著减少(P < 0.05),而Ins组无明显差异;与Lir组相比,TBCA组显著增多(P < 0.05,图 2)。

|
| A: 免疫荧光双标记法检测各组Iba1+/CD16/32+细胞;B: 半定量分析 1:CI组;2:DCI组;3:Ins组;4:Lir组;5:TBCA组;a:P < 0.05,与CI组比较; b:P < 0.05,与DCI组比较;c:P < 0.05,与Lir组比较 图 2 利拉鲁肽对糖尿病大鼠脑缺血后小胶质细胞/巨噬细胞M1型极化的影响 |
2.4.2 利拉鲁肽对糖尿病大鼠脑缺血后小胶质细胞/巨噬细胞M2型极化的影响
各组均出现不同程度的Iba1+/CD206+细胞。与CI组相比,DCI组显著减少(P < 0.05);与DCI组相比,Lir组显著增多(P < 0.05),而Ins组无明显差异;与Lir组相比较,TBCA组显著减少(P < 0.05,图 3)。
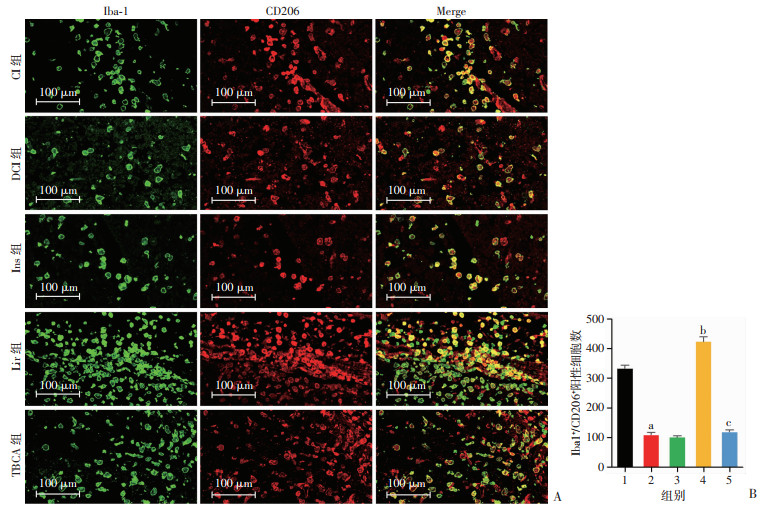
|
| A: 免疫荧光双标记法检测各组Iba1+/CD206+细胞;B: 半定量分析 1:CI组;2:DCI组;3:Ins组;4:Lir组;5:TBCA组;a:P < 0.05,与CI组比较;b:P < 0.05,与DCI组比较;c:P < 0.05,与Lir组比较 图 3 利拉鲁肽对糖尿病大鼠脑缺血后小胶质细胞/巨噬细胞M2型极化的影响 |
2.5 利拉鲁肽对糖尿病大鼠脑缺血后缺血侧脑组织NOX2、TNF-α、IL-1β、IL-10、TGF-β表达的影响
各组大鼠缺血侧脑组织中均可见NOX2、TNF-α、IL-1β、IL-10、TGF-β表达。其中,与CI组相比较,DCI组NOX2、TNF-α、IL-1β表达显著增多(P < 0.05);IL-10、TGF-β表达显著减少(P < 0.05)。与DCI组相比,Lir组NOX2、TNF-α、IL-1β的表达显著减少(P < 0.05);IL-10、TGF-β表达显著增多(P < 0.05),而Ins组无明显差异。与Lir组相比,TBCA组NOX2、TNF-α、IL-1β表达明显增多(P < 0.05);IL-10、TGF-β表达显著减少(P < 0.05)。
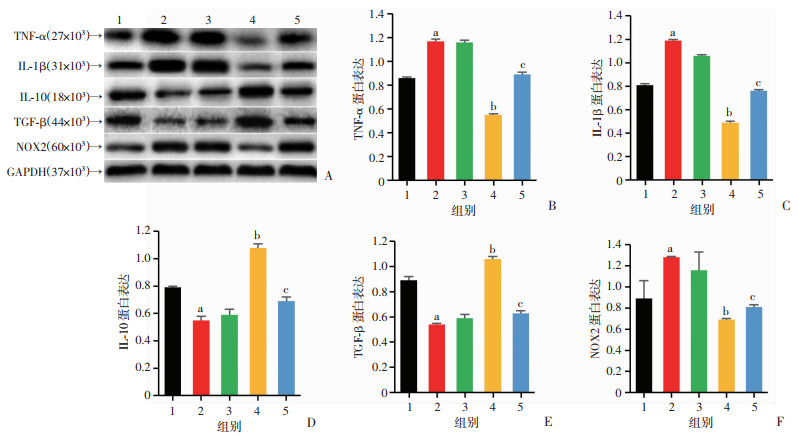
|
| 1:CI组;2:DCI组;3:Ins组;4:Lir组;5:TBCA组 A:Western blot检测各组大鼠缺血脑组织NOX2、TNF-α、IL-1β、IL-10、TGF-β表达;B~F:半定量分析 a:P < 0.05,与CI组比较;b:P < 0.05,与DCI组比较;c:P < 0.05,与Lir组比较 图 4 利拉鲁肽对糖尿病大鼠脑缺血后缺血侧脑组织NOX2、TNF-α、IL-1β、IL-10、TGF-β表达的影响 |
3 讨论
糖尿病是脑卒中重要的危险因素。约30%的卒中合并有糖尿病。与普通脑卒中相比较,合并糖尿病的缺血性卒中患者病情更重,神经系统预后更差[2]。本研究结果显示,与CI组相比较,DCI组大鼠神经功能评分增多,梗死体积增大,与上述研究一致,进一步证实糖尿病可加重脑缺血损伤。有研究证实,糖尿病脑缺血患者均会出现卒中后高血糖及高胰岛素血症、低脂连素血症等其他代谢紊乱,这些代谢紊乱中的每一种都独立被证明与卒中后不良结局相关[1],表明糖尿病加重脑缺血损伤是由多种因素相互作用的结果。
利拉鲁肽属GLP-1受体激动剂。GLP-1是一种由肠L细胞分泌的肽类激素,也是由神经细胞合成的神经肽,主要通过与靶器官细胞表面的GLP-1受体结合而发挥生物学效应。由于GLP-1受体在脑中广泛分布,GLP-1对中枢神经系统的影响日益受到关注。业已发现,GLP-1受体激动剂可改善阿尔茨海默病、帕金森病、肌萎缩侧索硬化、外伤、多发性硬化和脑缺血等疾病的脑损伤[11]。近年的研究发现,利拉鲁肽可减轻糖尿病大鼠脑缺血损伤[3-5]。本实验显示,利拉鲁肽与胰岛素给药均可显著降低血糖,但仅有利拉鲁肽可改善糖尿病大鼠的神经功能缺损评分及脑梗死体积,而胰岛素无此效应。另有研究发现,胰岛素可降低血糖至正常水平,却不能改善并发急性缺血性卒中的糖尿病患者的预后[12]。以上表明单纯控制高血糖不是神经保护的主要机制,也进一步证实利拉鲁肽是一种神经保护剂,对糖尿病合并缺血性损伤有确切的神经保护作用。
小胶质细胞作为大脑中的巨噬细胞,是防御缺血性中风的第一道防线。脑缺血后,常驻小胶质细胞和循环巨噬细胞被激活并募集到受损区域。小胶质细胞/巨噬细胞具有高度可塑性,可被极化为功能上完全相反的表型:M1型与M2型。M1型的表面标志物主要有CD16、CD32等,主要释放促炎因子如白介素-1β(interleukin,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等,加剧脑组织损伤。M2型的表面标志物有CD206等,主要产生抗炎介质如IL-10、转化生长因子-β(transforming growth factor-β,TGF-β)等,促进组织修复[13-14]。众多证据表明,在缺血性中风的进展过程中,小胶质细胞/巨噬细胞表型呈动态变化;而通过抑制小胶质细胞/巨噬细胞向M1型转换,促进其向M2型转换,可改善糖尿病合并脑缺血损伤[6-8]。因此,调控小胶质细胞/巨噬细胞极化可作为糖尿病合并脑缺血损伤的有效治疗策略。此外,在合并局灶性脑缺血的糖尿病动物模型中研究发现,MCAO后第3天可见小胶质细胞/巨噬细胞的M1和M2型表面标记物表达增加[7]。本研究结果显示,MCAO后第3天,与CI组相比,DCI组Iba1+/CD16/32+阳性细胞数及TNF-α、IL-1β表达显著增加,而Iba1+/CD206阳性细胞数及IL-10、TGF-β表达明显减少;同时神经功能评分及脑梗死体积明显恶化。利拉鲁肽给药可显著减少Iba1+/CD16/32+阳性细胞数及TNF-α、IL-1β的表达,增加Iba1+/CD206阳性细胞数及IL-10、TGF-β的表达,同时改善神经功能评分及脑梗死体积。既往有研究发现,利拉鲁肽可减少AD小鼠[15]以及暴露于X线的炎症大脑中[16]的小胶质细胞激活,同时降低促炎介质如IL-6、IL-1β等。还可诱导小胶质细胞向M2型极化,伴随着TNF-α和IL-6表达的显著降低[17]。上述研究进一步证实小胶质细胞/巨噬细胞极化在糖尿病加重脑缺血损伤中起着重要的作用。另一方面表明,抑制小胶质细胞/巨噬细胞向M1型转换,促进其向M2型转换是利拉鲁肽神经保护的潜在机制。
本研究进一步发现NOX2参与了利拉鲁肽的神经保护作用。NOX2是由活化的小胶质细胞表达的NADPH氧化酶的亚基,在维持大脑的正常生理过程中起着重要的作用。研究发现,NOX2基因敲除可显著减少氧化应激和减轻炎症反应,并改善高血糖及氧糖剥夺所致的神经元损伤[18]。新近研究发现,NOX2基因缺失可促使小胶质细胞向M2型表型转换[19]。NOX2抑制剂可改变M1/M2型小胶质细胞的平衡,有利于小胶质细胞向M2表型转换,并显著降低脑损伤后的神经元氧化损伤[20]。本研究结果显示,利拉鲁肽可下调NOX2表达,同时减少M1小胶质细胞/巨噬细胞Iba1+/CD16/32+阳性细胞数及TNF-α、IL-1β的表达,增加M2型小胶质细胞/巨噬细胞Iba1+/CD206阳性细胞数及IL-10、TGF-β的表达;而且上述效应可被NOX2激动剂TBCA所逆转,表明NOX2参与了利拉鲁肽对小胶质细胞/巨噬细胞极化的调控作用。
综上所述,通过抑制NOX2,同时促进小胶质细胞/巨噬细胞从M1型向M2型转化,抑制炎症反应,可能是利拉鲁肽的神经保护作用机制之一。本研究结果进一步表明,利拉鲁肽等GLP-1受体激动剂可能是针对患有或不患有糖尿病的卒中患者的一种有前景的神经保护疗法。然而,利拉鲁肽目前临床上仍主要用于糖尿病的治疗,其针对卒中患者的前瞻性临床干预实验正在进行中,对其神经保护特性的研究仍需加强,以合理地评估其可用性。
| [1] |
JIANG Y H, LIU N, WANG Q Z, et al. Endocrine regulator rFGF21(recombinant human fibroblast growth factor 21) improves neurological outcomes following focal ischemic stroke of type 2 diabetes mellitus male mice[J]. Stroke, 2018, 49(12): 3039-3049. |
| [2] |
BORGGREFE J, GLVCK B, MAUS V, et al. Clinical outcome after mechanical thrombectomy in patients with diabetes with major ischemic stroke of the anterior circulation[J]. World Neurosurg, 2018, 120: e212-e220. |
| [3] |
BAI B, LI D F, XUE G F, et al. The novel GLP-1/GIP dual agonist DA3-CH is more effective than liraglutide in reducing endoplasmic Reticulum stress in diabetic rats with cerebral ischemia-reperfusion injury[J]. Nutr Metab Cardiovasc Dis, 2021, 31(1): 333-343. |
| [4] |
何婧, 韩江全, 施宁华, 等. 利拉鲁肽通过激活过氧化物酶体增殖物激活受体改善合并糖尿病的局灶性脑缺血损伤[J]. 重庆医科大学学报, 2020, 45(3): 350-355. HE J, HAN J Q, SHI N H, et al. Liraglutide protects against focal cerebral ischemic injury with diabetes mellitus by activating peroxisome proliferator-activated receptors[J]. J Chongqing Med Univ, 2020, 45(3): 350-355. |
| [5] |
SHI N H, HE J, GUO Q Q, et al. Liraglutide protects against diabetes mellitus complicated with focal cerebral ischemic injury by activating mitochondrial ATP-sensitive potassium channels[J]. Neuroreport, 2019, 30(7): 479-484. |
| [6] |
MA S B, WANG J Y, WANG Y L, et al. Diabetes mellitus impairs white matter repair and long-term functional deficits after cerebral ischemia[J]. Stroke, 2018, 49(10): 2453-2463. |
| [7] |
DARSALIA V, HUA S S, LARSSON M, et al. Exendin-4 reduces ischemic brain injury in normal and aged type 2 diabetic mice and promotes microglial M2 polarization[J]. PLoS One, 2014, 9(8): e103114. |
| [8] |
JACKSON-COWAN L, ELDAHSHAN W, DUMANLI S, et al. Delayed administration of angiotensin receptor(AT2R) agonist C21 improves survival and preserves sensorimotor outcomes in female diabetic rats post-stroke through modulation of microglial activation[J]. Int J Mol Sci, 2021, 22(3): 1356. |
| [9] |
RUSSO M V, MCGAVERN D B. Inflammatory neuroprotection following traumatic brain injury[J]. Science, 2016, 353(6301): 783-785. |
| [10] |
DING M, FANG Q H, CUI Y T, et al. Liraglutide prevents β-cell apoptosis via inactivation of NOX2 and its related signaling pathway[J]. J Diabetes Complications, 2019, 33(4): 267-277. |
| [11] |
KUROKI T, TANAKA R, SHIMADA Y, et al. Exendin-4 inhibits matrix metalloproteinase-9 activation and reduces infarct growth after focal cerebral ischemia in hyperglycemic mice[J]. Stroke, 2016, 47(5): 1328-1335. |
| [12] |
CERECEDO-LOPEZ C D, CANTU-ALDANA A, PATEL N J, et al. Insulin in the management of acute ischemic stroke: a systematic review and meta-analysis[J]. World Neurosurg, 2020, 136: e514-e534. |
| [13] |
MA Y Y, WANG J X, WANG Y T, et al. The biphasic function of microglia in ischemic stroke[J]. Prog Neurobiol, 2017, 157: 247-272. |
| [14] |
HU X M, LEAK R K, SHI Y J, et al. Microglial and macrophage polarization—new prospects for brain repair[J]. Nat Rev Neurol, 2015, 11(1): 56-64. |
| [15] |
MCCLEAN P L, PARTHSARATHY V, FAIVRE E, et al. The diabetes drug liraglutide prevents degenerative processes in a mouse model of Alzheimer's disease[J]. J Neurosci, 2011, 31(17): 6587-6594. |
| [16] |
PARTHSARATHY V, HÖLSCHER C. The type 2 diabetes drug liraglutide reduces chronic inflammation induced by irradiation in the mouse brain[J]. Eur J Pharmacol, 2013, 700(1/2/3): 42-50. |
| [17] |
BARRETO-VIANNA A R C, AGUILA M B, MANDARIM-DE-LACERDA C A. Beneficial effects of liraglutide(GLP1 analog) in the hippocampal inflammation[J]. Metab Brain Dis, 2017, 32(5): 1735-1745. |
| [18] |
ZENG X Z, REN H L, ZHU Y N, et al. Gp91phox(NOX2) in activated microglia exacerbates neuronal damage induced by oxygen glucose deprivation and hyperglycemia in an in vitro model[J]. Cell Physiol Biochem, 2018, 50(2): 783-797. |
| [19] |
NAYERNIA Z, JAQUET V, KRAUSE K H. New insights on NOX enzymes in the central nervous system[J]. Antioxid Redox Signal, 2014, 20(17): 2815-2837. |
| [20] |
KUMAR A, ALVAREZ-CRODA D M, STOICA B A, et al. Microglial/macrophage polarization dynamics following traumatic brain injury[J]. J Neurotrauma, 2016, 33(19): 1732-1750. |




