2. 400030 重庆,重庆大学附属肿瘤医院肿瘤放射治疗中心
2. Department of Radiation Oncology, Chongqing University Cancer Hospital, Chongqing, 400030, China
肝纤维化是指由病毒感染、免疫紊乱等各种因素所致肝内结缔组织异常增生,导致肝内弥漫性细胞外基质过度沉淀的病理过程,疾病进展可出现肝功能减退、门静脉高压等,可导致肝硬化、肝癌等严重后果[1-2]。慢性、持续性的炎性刺激介导的免疫性损伤和修复是肝纤维化形成和发展的主要推动因素。近年研究显示,NOD样受体家族(NOD-like receptor family)成员包括NOD样受体蛋白1 (NOD-like receptor protein 1 inflammasome,NLRP1)、NLRP3、黑色素瘤缺如因子(Absent in melanoma 2,AIM2)、NLR家族CARD域包含蛋白4(NLR family CARD domain containing 4,NLRC4)等[3]。其中,NLRP3炎症小体信号通路研究较多,它可通过活化肝星状细胞(hepatic stellate cells,HSCs)、促进细胞外基质沉积等方式在肝纤维化的发生发展中起重要作用[4]。Toll样受体4(toll like receptor 4,TLR4)/髓样分化因子(myeloid differentiation primary response 88,Myd88)/核因子Kappa B(nuclear factor kappa B,NF-κB)信号通路活化后诱导白细胞介素1β(interleukin 1 beta,IL-1β)和白细胞介素18(interleukin 18,IL-18)前体的转录和表达,受刺激后NLRP3炎症小体的组分完成募集并组装,导致半胱氨酸天冬氨酸蛋白酶-1(Caspase-1)前体裂解为活性形式,从而引起IL-1β和IL-18前体剪切为活性形式。NLRP3炎症小体活化并产生有活性的IL-1β和IL-18,诱导细胞焦亡,与肝脏炎症和肝纤维化密切相关[5]。因此,调控NLRP3炎症小体信号通路表达,抑制下游炎症因子的释放,抑制细胞焦亡,可能是减少肝脏炎性损伤、防止或逆转肝纤维化发生发展的途径之一。
中药在改善肝纤维化症状、恢复肝功能、改善肝内血液循环,甚至逆转肝纤维化、调节免疫等方面的优势已成为共识[6]。柴胡为伞形科植物柴胡(Bupleurum Chinense DC.)或狭叶柴胡(Bupleurum Scorzonerifolium Willd.)的干燥根,始载于《神农本草经》:其味苦、辛,性微寒,归肝胆经,具有解表退热、疏肝解郁、升举清气之功效[7]。柴胡的主要生物活性成分为柴胡皂苷(saikosaponins,SS),含量较高的SS包括SSA、SSC、SSD等,其中SSD被证实为药理学活性最强的成分之一。SSD的药理作用广泛,具有抗肿瘤、抗炎、抗癫痫及雌激素样作用等[8-10]。在肝脏疾病中,近年研究表明SSD在抑制肝星状细胞活化、减轻肝脏炎症等方面发挥重要作用[11-12]。SSD抗肝纤维化的作用和具体机制尚不明确,鉴于此,本研究拟通过网络药理学方法分析SSD对自身免疫性肝病的作用机制;采用腹腔注射猪血清诱导大鼠建立免疫性肝纤维化动物模型,观察SSD减轻肝脏炎症的保护性作用,探讨SSD对免疫性肝纤维化的作用机制,为进一步的机制研究和临床应用提供理论基础。
1 材料与方法 1.1 药物及试剂无菌猪血清(北京索莱宝科技有限公司,中国,批号20251113);柴胡皂苷D(SSD,HPLC ≥98%,上海源叶生物科技有限公司,中国,批号P26N11F132137);无水乙醇[重庆川东化工(集团)有限公司,中国,批号20190201];0.9%氯化钠注射液(四川科伦药业股份有限公司,中国,批号B14200853444);水合氯醛(成都市科隆化工试剂厂,中国,批号15050501)。一抗NLRP3(美国affbiotech公司,货号DF7438)、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing A CARD,ASC,美国affbiotech公司,货号DF6304)、Caspase-1(美国affbiotech公司,货号AF4005)、消皮素D(gasdermin D,GSDMD,美国affbiotech公司,货号AF4012)、TLR4(美国affbiotech公司,货号AF5418)、Myd88(美国affbiotech公司,货号AF5195)、转录因子p65 (transcription factor p65,p65,美国Novus公司,货号NB100-2176)、p-p65(美国Novus公司,货号NB100-82088)、β-actin(美国Santa Cruz公司,货号SC-47778)。大鼠IL-1β酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)试剂盒(北京索莱宝科技有限公司,货号SEKR-0002)、大鼠IL-18 ELISA试剂盒(北京索莱宝科技有限公司,货号SEKR-0054)、大鼠肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)ELISA试剂盒(北京索莱宝科技有限公司,货号SEKR-0009)。蛋白提取试剂盒(碧云天生物技术,中国,货号p0013B)、二抗(杭州联科生物,中国,货号70-GRT007)、IumiQ通用型ECL发光试剂盒(上海圣尔生物,中国,货号SB-WB012)。丙氨酸氨基转移酶(alanine aminotransferase,ALT)测试盒(南京建成生物研究所,中国,货号C009-2-1)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)测试盒(南京建成生物研究所,中国,货号C010-2-1)。
1.2 实验仪器光学显微镜(ZEISS公司,德国,型号Imager A2);涡旋振荡仪(海门市其林贝尔仪器制造有限公司,中国,型号Vortex-5);超纯水机(重庆力德高端水处理设备研发有限公司,中国,型号CCT-3320A);电子天平(上海舜宇恒平科学仪器有限公司,中国,型号YP202N);恒温水浴箱(江苏金坛市华欧实验仪器厂,中国,型号HH-601);垂直电泳转移装置(Bio-Rad公司,美国,型号Mini-PROTEAN Tetra 1658001)、Trans-Blot转膜装置(Bio-Rad公司,美国,型号Mini Trans-Blot Module 1703935)、凝胶成像系统(Bio-Rad公司,美国,型号CFX96);水平脱色摇床(海门市麒麟医用仪器厂,中国,型号TS-2000A);酶标仪(Bio-Tek仪器有限公司,美国,型号ELX800);高速台式离心机(湖南湘仪实验室仪器开发有限公司,中国,型号TG16-WS);-80 ℃低温冰箱(海尔生物医疗股份有限公司,中国,型号DW-86L388J)。
1.3 实验动物及分组SPF级雄性SD大鼠40只,体质量(200±20)g,由北京华阜康生物科技股份有限公司提供[实验动物生产许可证号SCXK(京)2014-0004]。已通过重庆市中医院医学伦理委员会审查批准使用,符合实验室动物管理与使用准则,实验动物使用许可证号SYXK(渝)2017-0005。实验期间实验环境温度23~26 ℃,湿度50%~60%。SD大鼠40只,随机分为5组(n=8):①正常对照组;②模型组;③SSD高剂量(3.00 mg/kg)组;④SSD中剂量(1.50 mg/kg)组;⑤SSD低剂量(0.75 mg/kg)组。模型组和SSD组大鼠予以无菌猪血清0.5 mL/只腹腔注射,每周2次,连续8周。SSD组从第5周开始每天2次腹腔注射各组剂量的SSD,共4周。对照组和模型组腹腔注射等体积的0.9%氯化钠注射液。观察各组大鼠的状态,记录死亡数。样本采集前大鼠禁食不禁水12 h,称量并记录。将大鼠按0.7 mL/100 g注射5%水合氯醛,腹主动脉采血10 mL左右置于无菌抗凝管中,3 000×g离心10 min,吸取血清,-80 ℃分装保存待用。将大鼠剖腹取肝脏组织,4%多聚甲醛固定用于病理学检测;-80 ℃保存用于蛋白的检测。
1.4 网络药理学分析 1.4.1 柴胡皂苷D治疗自身免疫性肝病潜在靶点的获取运用ChemDraw professional 16.0绘制SSD的化合物结构,将其保存为*.mol2格式,导入PharmMapper(http://lilab.ecust.edu.cn/pharmmapper)网站,采用反向分子对接的方法进行SSD相关靶点的预测。从Pubchem(https://pubchem.ncbi.nlm.nih.gov/)数据库获取SSD的Smiles格式,导入SWISS target prediction(http://www.swisstargetprediction.ch)数据库预测SSD相关靶点。同时检索BATMAN-TCM(http://bionet.ncpsb.org.cn/batman-tcm/)、ETCM(http://www.tcmip.cn/ETCM/index.php/Home/Index/)和Coremine medical(https://www.coremine.com/medical/#search)数据库获取SSD的相关靶点,选择物种为“Homo sapiens”。将以上数据库检索获得的相关靶点汇总,利用UniProt(http://www.uniprot.org)数据库校正为官方名称(official symbol),获得的结果作为SSD的相关靶点以进一步分析。
从Drugbank(https://www.drugbank.ca)和Genecards(https://www.genecards.org)数据库分别检索关键词“Autoimmune hepatic diseases”或“Autoimmune liver diseases”或“Primary biliary cholangitis”或“Primary sclerosing cholangitis”或“Autoimmune hepatitis”以寻找与自身免疫性肝病相关的基因,利用Venn图将SSD的相关靶点和自身免疫性肝病的相关靶点进行比对取交集,得到SSD治疗自身免疫性肝病的潜在靶点。
1.4.2 潜在靶点蛋白相互作用网络图的构建和信号通路分析将SSD治疗自身免疫性肝病的潜在靶点导入STRING(http://string-db.org)网站,选择物种为“Homo sapiens”,combined score>0.4,构建蛋白相互作用网络图(protein-protein interaction,PPI)。将结果导入到Cytoscape 3.5.1软件中进行可视化处理,网络图中节点的大小表示靶点度值的大小。利用Network analyzer插件进行网络拓扑学分析,寻找PPI中的关键节点。
将潜在靶点导入富集分析工具注释、可视化和集成发现(the database for annotation,visualization and integrated discovery,DAVID)数据库6.8(http://david.ncifcrf.gov)进行京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)信号通路富集分析,选择“Official gene symbol”、物种为“Homo sapiens”,提交进行分析并获得结果,以P < 0.05为有统计学意义。
1.5 柴胡皂苷D抗大鼠免疫性肝纤维化的作用机制研究 1.5.1 血清生化及细胞因子的测定ELISA试剂盒测量大鼠血清ALT、AST表达水平。全血标本于室温放置2 h后以1 000×g离心20 min,取上清检测。BCA法测定蛋白浓度,采用ELISA试剂盒检测大鼠血清中TNF-α、IL-1β和IL-18的含量。
1.5.2 肝脏HE病理切片观察4%多聚甲醛固定大鼠肝脏组织,经脱水、石蜡包埋、切片后行HE染色,光学显微镜镜检,图像采集分析,观察大鼠肝脏组织的形态学变化。
1.5.3 Western blot分析研钵中加入液氮研磨组织至微末,收集50~80 mg至1.5 mL EP管中,每管加适量(约100 μL/10 mg)蛋白裂解液(用前需提前加入蛋白酶抑制剂);冰上裂解30 min,超声处理。4 ℃、12 000×g离心10 min。离心后取上清装入干净的1.5 mL EP管中,取一部分通过BCA法测定蛋白浓度,-80 ℃分装保存。取适量蛋白加入样品缓冲液于95 ℃煮沸10 min。上样后经SDS-PAGE凝胶电泳分离,将蛋白条带电转至PVDF膜上,5%脱脂奶粉室温封闭2 h,加入1∶500稀释的一抗(NLRP3、ASC、Caspase-1、GSDMD、TLR4、p65、p-p65)和1∶1 000稀释的一抗(β-actin)4 ℃孵育过夜,洗膜后加入1∶1 000稀释的二抗室温孵育2 h,洗膜后采用ECL发光法检测蛋白条带,凝胶成像仪记录条带灰度值。以β-actin为内参,以目的蛋白/内参蛋白表示目的蛋白的相对表达水平。
1.6 统计学分析应用SPSS 21.0统计软件处理数据,计量资料用x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P < 0.05为有统计学意义。
2 结果 2.1 柴胡皂苷D与自身免疫性肝病的潜在靶点及蛋白相互作用网络图通过检索PharmMapper、Swiss target prediction、Batman-TCM、ETCM和Coremine medical数据库获得SSD的相关靶点,将结果进行汇总、去重,最终得到SSD的相关靶点240个。在Gencards和Drugbank数据库中筛选获得自身免疫性肝病相关靶点7 286个,与SSD的相关靶点进行比对取交集后获得SSD与自身免疫性肝病的潜在靶点共177个(图 1A)。利用STRING数据库和Cytoscape软件构建SSD与自身免疫性肝病潜在靶点的PPI(图 1B),PPI网络图拓扑学性质分析结果显示白蛋白(albumin,ALB)、肿瘤蛋白P53(tumor protein P53,TP53)、白细胞介素6(interleukin 6,IL-6)、肿瘤坏死因子(tumor necrosis factor,TNF)、半胱氨酸天冬氨酸蛋白酶-3(caspase-3,CASP3)、表皮生长因子受体(epidermal growth factor receptor,EGFR)、转录因子AP-1(transcription factor AP-1,JUN)、信号转导与转录激活因子3(signal transducer and activator of transcription 3,STAT3)、白细胞介素10(interleukin 10,IL-10)和TLR4等基因的度值(Degree)排名靠前,表明它们在网络图中处于较为重要的位置。
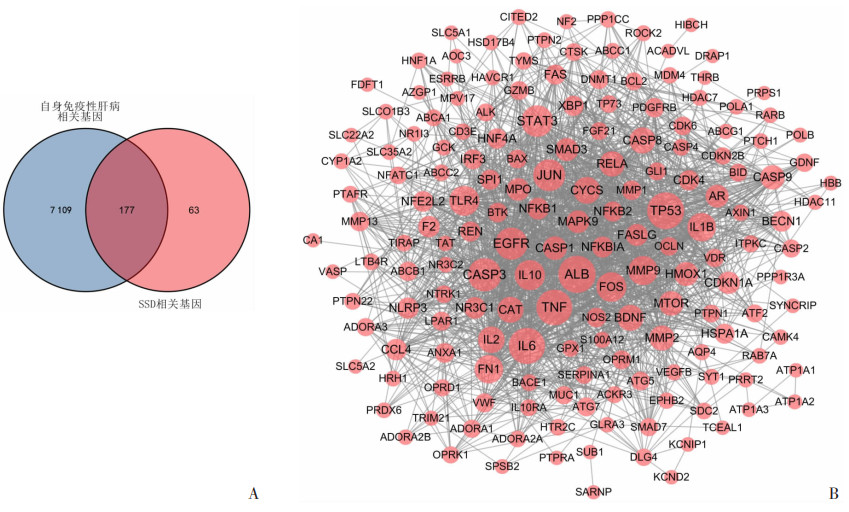
|
| A: 柴胡皂苷D与自身免疫性肝病潜在靶点的Venn图; B: 潜在靶点的蛋白相互作用网络图 图 1 柴胡皂苷D与自身免疫性肝病潜在靶点的Venn图和蛋白相互作用网络图 |
2.2 潜在靶点的信号通路分析
利用DAVID数据库分析SSD与自身免疫性肝病潜在靶点富集的信号通路(P < 0.05),共获得107条富集的信号通路,筛选与免疫系统相关的信号通路,共获得10个相关的信号通路(图 2A)。构建免疫系统相关信号通路和潜在靶点的网络图,分析网络图拓扑学性质,结果显示核苷酸结合寡聚域受体(NOD)样受体信号通路(NOD-like receptor signaling pathway)是SSD治疗自身免疫性肝病的主要信号通路之一(图 2B)。进一步分析发现该信号通路中富集的潜在靶点主要包括NLRP3、CASP1、IL-1β、NF-κB、IL-6、TNF-α和半胱氨酸天冬氨酸蛋白酶-8(Caspase-8,CASP8)等,这些靶点主要位于炎症小体信号通路和TLR4/NF-κB信号通路上(图 2C)。
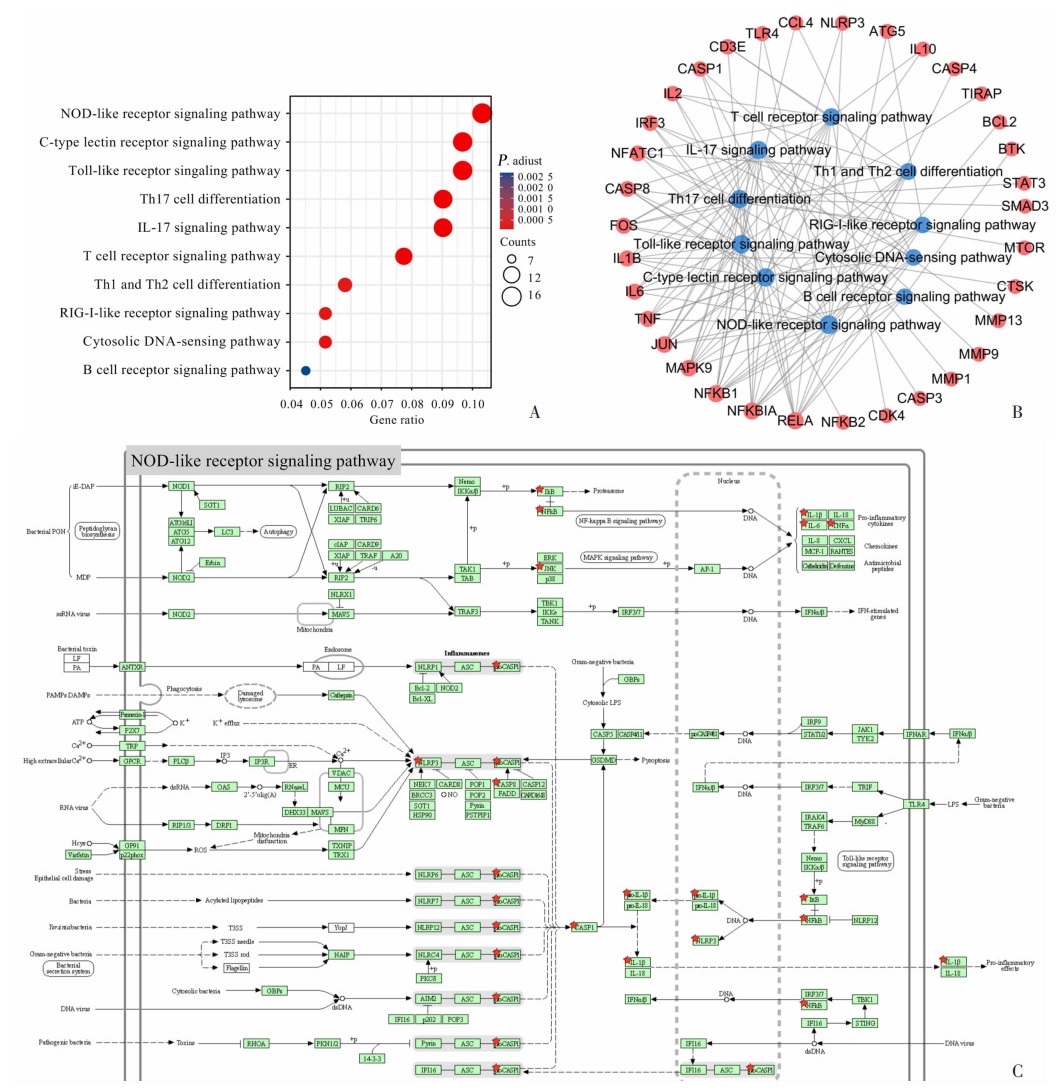
|
| A: 免疫系统相关KEGG通路富集分析; B: 通路-靶点网络图; C: NOD样受体信号通路, 潜在靶点用红星标注 图 2 SSD与自身免疫性肝病潜在靶点的信号通路分析 |
2.3 柴胡皂苷D改善免疫性肝纤维化大鼠肝功能
与正常对照组比较,模型组大鼠血清中的ALT、AST显著升高(图 3)。与模型组比较,SSD低、中、高剂量组大鼠肝功能均得到不同程度的改善,其中SSD高剂量组可显著降低大鼠血清中的ALT水平(P < 0.05),SSD中、高剂量组可显著降低大鼠血清中的AST水平(P < 0.05),表明SSD可改善免疫性肝纤维化大鼠的肝功能。
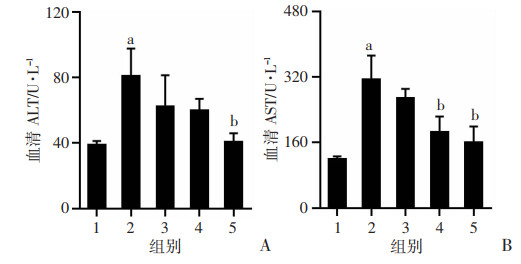
|
|
a: P < 0.05,与正常对照组比较;b: P < 0.05,与模型组比较 1:正常对照组;2:模型组;3:SSD低剂量(0.75 mg/kg)组;4:SSD中剂量(1.50 mg/kg)组;5:SSD高剂量(3.00 mg/kg)组 图 3 柴胡皂苷D对免疫性肝纤维化大鼠肝功能的影响(n=8,x±s) |
2.4 大鼠肝组织病理学变化
HE染色结果显示:正常对照组大鼠的肝小叶结构清晰完整,肝细胞排列整齐(图 4)。模型组大鼠正常小叶结构破坏,肝细胞索排列紊乱,可见灶状坏死区,炎性细胞浸润,纤维间隔形成,表明造模成功。与模型组比较,SSD低剂量组对大鼠肝脏结构的改善不明显,SSD中剂量组肝脏病变稍有减轻,SSD高剂量组肝脏病变明显减轻,肝细胞索排列相对整齐,炎性细胞减少,小叶结构较完整,提示纤维化程度得到缓解,表明SSD对免疫性肝纤维化大鼠具有一定保护作用。
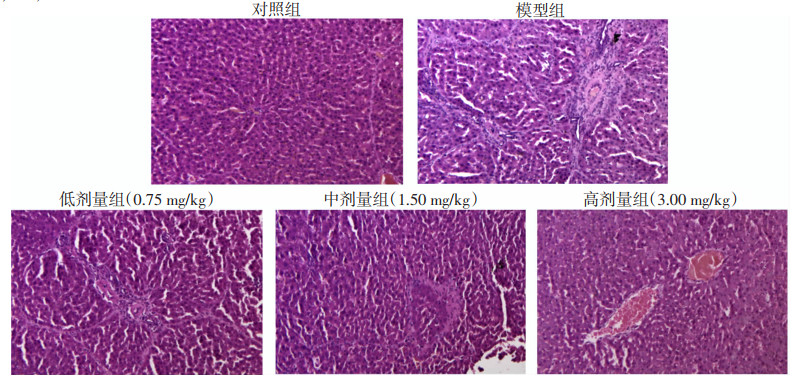
|
| 图 4 柴胡皂苷D对免疫性肝纤维化大鼠肝脏组织形态学的影响(HE ×100) |
2.5 柴胡皂苷D减轻免疫性肝纤维化大鼠肝脏炎症
研究采用ELISA检测SSD对免疫性肝纤维化大鼠血清中炎症因子的影响,结果显示:模型组大鼠中炎症因子TNF-α、IL-1β和IL-18的水平显著高于对照组(图 5,P < 0.05)。与模型组比较,低剂量SSD即可显著降低大鼠中IL-1β的含量,SSD中、高剂量组大鼠中TNF-α和IL-18水平均显著降低(P < 0.05),表明SSD可以抑制免疫性肝纤维化大鼠模型中炎症因子的释放。
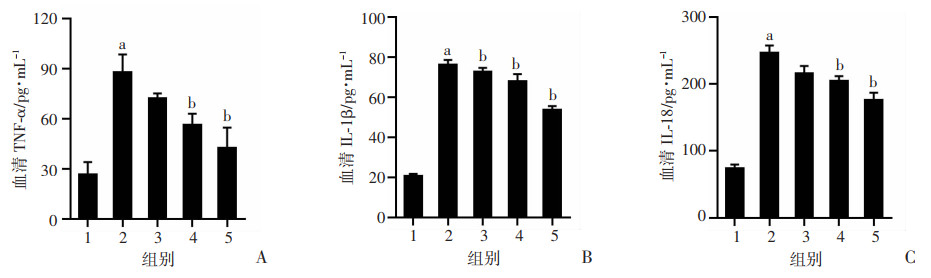
|
| A:TNF-α;B:IL-1β;C:IL-18 1:正常对照组;2:模型组;3:SSD低剂量(0.75 mg/kg)组;4:SSD中剂量(1.50 mg/kg)组;5:SSD高剂量(3.00 mg/kg)组 a: P < 0.05,与正常对照组比较;b: P < 0.05,与模型组比较 图 5 柴胡皂苷D对免疫性肝纤维化大鼠炎症因子的影响(n=8,x±s) |
2.6 柴胡皂苷D抑制免疫性肝纤维化大鼠肝脏NLRP3炎症小体激活和细胞焦亡
研究采用Western blot检测SSD对NLRP3炎症小体和细胞焦亡相关蛋白的影响,结果显示:与对照组比较,模型组大鼠肝脏组织中NLRP3、ASC、Caspase-1、GSDMD蛋白显著增加(P < 0.05),提示免疫性损伤促进了NLRP3炎症小体的激活并启动了细胞焦亡(图 6)。SSD中、高剂量可以显著降低大鼠肝脏NLRP3、ASC、Caspase-1和GSDMD的水平(P < 0.05),表明SSD可以抑制免疫性肝纤维化大鼠中NLRP3炎症小体的激活和细胞焦亡。
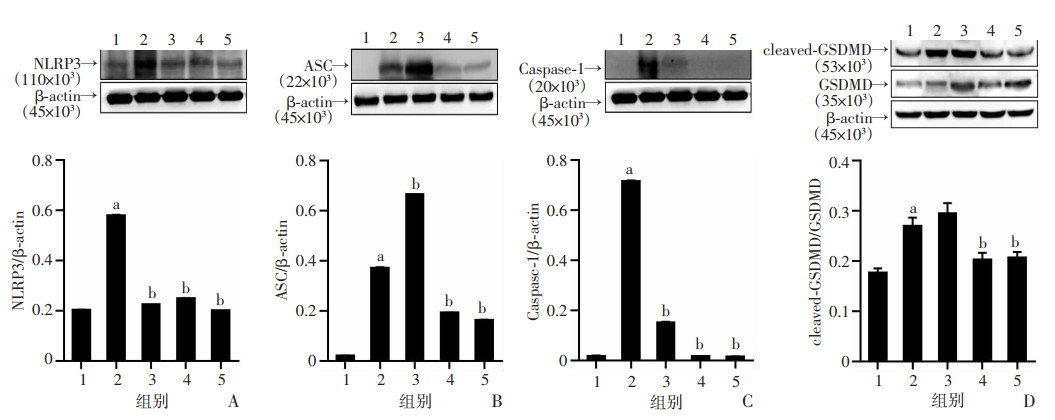
|
| A:NLRP3;B:ASC;C:Caspase-1;D:GSDMD 1:正常对照组;2:模型组;3:SSD低剂量(0.75 mg/kg)组;4:SSD中剂量(1.50 mg/kg)组;5:SSD高剂量(3.00 mg/kg)组 a: P < 0.05,与正常对照组比较;b: P < 0.05,与模型组比较 图 6 柴胡皂苷D对免疫性肝纤维化大鼠肝脏组织中NLRP3炎症小体和细胞焦亡蛋白的影响(n=8,x±s) |
2.7 柴胡皂苷D抑制免疫性肝纤维化大鼠肝脏TLR4/Myd88/NF-κB信号通路
为进一步探究SSD抑制NLRP3炎症小体活化的机制,本研究检测了SSD对TLR4/Myd88/NF-κB信号通路的影响。结果显示,模型组大鼠肝脏组织中TLR4、Myd88、p65的表达水平及p65磷酸化水平显著高于对照组(P < 0.05),提示免疫性肝纤维化大鼠中TLR4/ Myd88/NF-κB信号通路被激活(图 7)。给予中、高剂量的SSD可明显降低TLR4和Myd88的表达水平及p65磷酸化水平(P < 0.05),表明SSD可以下调免疫性肝纤维化大鼠肝脏中的TLR4/ Myd88/NF-κB信号通路的活化水平。
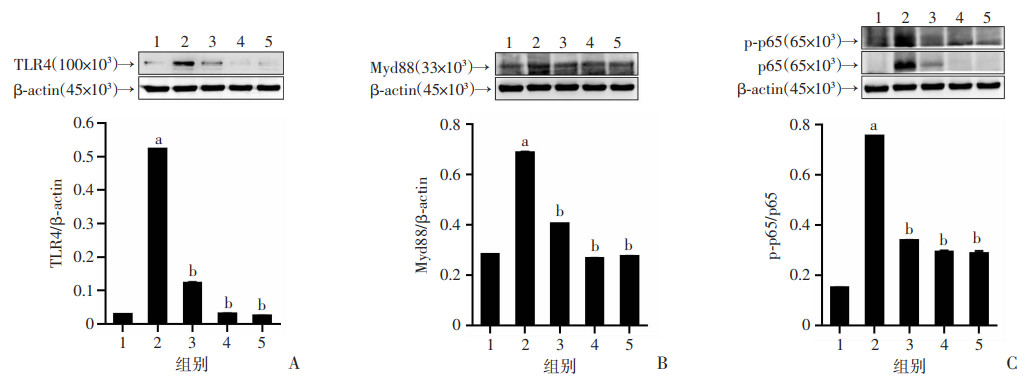
|
| A:TLR4;B:Myd88;C:p65 1:正常对照组;2:模型组;3:SSD低剂量(0.75 mg/kg)组;4:SSD中剂量(1.50 mg/kg)组;5:SSD高剂量(3.00 mg/kg)组 a: P < 0.05,与正常对照组比较;b: P < 0.05,与模型组比较 图 7 柴胡皂苷D对免疫性肝纤维化大鼠肝脏组织中TLR4/Myd88/NF-κB信号通路的影响(n=8,x±s) |
3 讨论
肝纤维化的形成由多种病理因素介导。在病毒、抗原、药物等各种因素的影响下,肝脏固有免疫和细胞免疫状态发生变化,造成肝脏细胞微环境发生变化、炎性细胞浸润、胶原沉积,进而导致肝纤维化形成。免疫诱导形成的肝纤维化是人体肝纤维化的重要病理类型,因此,免疫性肝纤维化动物模型是研究肝纤维化发病机制和治疗的重要途径。本研究采用大鼠腹腔注射猪血清构建免疫性肝纤维化动物模型,猪血清中的白蛋白可作为异种抗原,诱导机体形成免疫复合物,介导细胞毒性反应,活化肝星状细胞,对肝脏造成慢性损伤,刺激胶原纤维增生,最终引发免疫性肝纤维化[13]。既往研究显示大鼠腹腔注射猪血清与免疫性肝纤维化形成有关,于4周时肝纤维化可初步形成,8周时免疫性肝纤维化动物模型成功建立,该模型病理过程与人类慢性肝炎肝纤维化的形成过程相似,因此是研究免疫性肝纤维化的主要动物模型[14]。本研究采用无菌猪血清注射大鼠腹腔建立免疫性肝纤维化动物模型,模型建立后血清学检测显示模型组ALT、AST较对照组明显升高,差异具有统计学意义,采用病理切片染色观察大鼠肝脏的形态学变化,结果显示模型组大鼠肝脏纤维组织增生明显,假小叶形成,部分肝实质细胞出现坏死、炎性细胞浸润等表现,表明动物模型成功建立。
SSD是中药柴胡中药理活性最强的成分之一,具有抗炎抗氧化、抗肝纤维化和调节免疫等作用。本研究首先利用网络药理学的方法分析了SSD治疗自身免疫性肝病的潜在靶点,初步探索了SSD治疗自身免疫性肝病的可能作用机制。自身免疫性肝病主要包括自身免疫性肝炎、原发性胆汁性胆管炎和原发性硬化性胆管炎,发病机制涉及机体自身免疫系统的异常[15]。因此,研究免疫系统相关信号通路的活化水平与调节免疫反应的有效药物,是探索自身免疫性肝病治疗方法的重要途径。本研究获取SSD与自身免疫性肝病的潜在靶点后,分析了这些靶点富集的免疫系统相关信号通路,结果提示NOD样受体信号通路、C型凝集素受体信号通路(C-type lectin receptor signaling pathway)、Toll样受体信号通路(toll-like receptor signaling pathway)、Th17细胞分化(Th17 cell differentiation)和IL-17信号通路(IL-17 signaling pathway)等是主要富集的信号通路。既往研究表明,在细菌脂多糖(lipopolysaccharide,LPS)的刺激下,TLR4及其下游的信号传导被激活,促进TNF-α、IL-1β、IL-6等多种促炎因子的释放,可激活HSCs,促进纤维化的形成。在克雷白杆菌性重症肺炎大鼠模型中,SSD可明显减轻大鼠肺组织损伤和纤维化,肺组织病理结果显示加药组细胞凋亡数目显著降低,IL-6、TNF-α和一氧化氮合酶(inducible nitric oxide synthases,iNOS)等炎症因子水平显著降低,切割型半胱氨酸天冬氨酸蛋白酶-3(cleaved Caspase-3)、切割型半胱氨酸天冬氨酸蛋白酶-9(cleaved Caspase-9)水平明显下降,TLR4和磷酸化p65(p-p65)蛋白表达显著下调,提示SSD可通过调节炎症因子释放、促进细胞凋亡等机制缓解大鼠肺组织的纤维化[16]。李敏等[17]用柴胡皂苷D-黄芩苷联合干预四氯化碳(carbon tetrachloride,Ccl4)诱导的HSCs,可见细胞增殖受到抑制,TLR4、NF-κB等蛋白水平降低,透明质酸酶、层粘连蛋白、Ⅲ型前胶原、Ⅳ型胶原等肝纤维化相关因子的浓度降低,减轻了下游炎症因子的释放。郝健亨等[18]利用不同剂量SSD处理刀豆A诱导的自身免疫性肝炎小鼠模型,结果显示SSD可降低小鼠血清ALT、AST的水平,并能降低炎症因子IL-17 mRNA的水平,升高抗炎因子IL-10和细胞毒性T淋巴细胞特异性抗原-4(cytotoxic T-lymphocyte associated protein 4,CTLA-4)的mRNA表达水平,提示SSD通过调控以上抗炎因子和促炎因子的水平,起到改善小鼠肝脏炎症的作用。以上研究结果提示SSD可通过Toll样受体信号通路、IL-17信号通路等途径发挥抗炎和调节免疫的作用,与本研究的网络药理学分析结果基本符合。
本研究结果显示:SSD能显著改善免疫性肝纤维化大鼠的肝功能,降低血清ALT和AST表达水平,减轻肝脏细胞炎性浸润,改善肝脏纤维化程度,表明SSD可有效地减轻免疫性肝纤维化大鼠中的肝脏损伤。同时,SSD可显著降低大鼠血清中TNF-α、IL-1β和IL-18的表达水平,表明SSD还可抑制免疫性肝纤维化大鼠肝脏中的炎症反应。在Ccl4诱导的急性肝损伤小鼠模型中,不同剂量SSD干预后肝脏损伤程度减轻,小鼠血清中的ALT、AST明显降低,且呈剂量依赖性,抑制氧化应激产物丙二醛(malondialdehyde,MDA)的产生,并能提高抗氧化酶超氧化物歧化酶(superoxide dismutase,SOD)的活性。进一步的机制研究显示急性肝损伤小鼠Janus激酶(janus kinase,JAK)/ STAT信号通路激活,下游的炎症介质高迁移率族蛋白B1(high mobility group box 1,HMGB1)的表达水平显著升高,HMGB1可通过刺激单核巨噬细胞产生IL-1β和IL-18等炎症因子。给予SSD后急性肝损伤小鼠中JAK/STAT信号通路的磷酸化及HMGB1蛋白的表达受到抑制,下游炎症因子IL-1β和IL-18表达受到抑制,且呈剂量依赖性[19]。
细胞因子TNF-α、IL-1β和IL-18均是位于TLR4/Myd88/NF-κB及NLRP3炎症小体信号通路下游的促炎因子。NLRP3炎症小体信号通路是近年来发现调控炎症的重要信号通路,对肝纤维化的形成和发现具有直接的推动作用。NLRP3炎症小体由NLRP3、ACS、pro-Caspase-1组成,是最典型的炎症小体之一[20]。目前研究认为NLRP3炎症小体信号通路的启动和激活是两个独立的步骤,其中,启动步骤由TLR4/Myd88/NF-κB信号通路执行,促进NLRP3和IL-1β前体蛋白的表达,而激活步骤由病原体相关分子模式(pathogen associated molecular patterns,PAMPs)和危险信号分子模式(danger-associated molecular patterns,DAMPs)执行,促进NLRP3炎症小体组分的组装,活化的Caspase-1可促进促炎因子IL-1β和IL-18前体转变为成熟形式并分泌[21],同时也可诱导细胞焦亡的标志性蛋白GSDMD的裂解,破坏细胞膜,为IL-1β和IL-18的分泌提供条件[22]。因此,TLR4/Myd88/NF-κB及NLRP3炎症小体信号通路介导细胞炎症反应和焦亡可推动肝脏炎性损伤和肝纤维化的形成。张娜等[23-24]报道在过氧化氢(hydrogen peroxide,H2O2)诱导的人肝星状细胞(LX-2)氧化应激模型中,SSD可减少H2O2诱导的活性氧(reactive oxygen species,ROS)水平,线粒体三磷酸腺苷(adenosine triphosphate,ATP)水平明显下降,且炎症小体相关蛋白NLRP3、ASC、Caspase-1表达水平明显降低;而在H2O2诱导的人肝细胞(L02)损伤模型中,SSD可抑制细胞焦亡相关指标Caspase-1、IL-1β和IL-18的表达,表明SSD可通过下调NLRP3炎症小体信号通路以减轻氧化应激损伤、抑制细胞焦亡,从而发挥抗肝纤维化作用。在Ccl4诱导的急性肝损伤细胞和动物模型中,SSD也可抑制NLRP3、ASC、Caspase-1、IL-1β和IL-18的水平,并能升高细胞内抗氧化酶SOD等的活性,降低氧化应激产物MDA等的水平,从而减轻Ccl4诱导的急性肝细胞损伤[25-26]。本研究结果显示SSD可降低免疫性肝纤维化大鼠肝脏中NLRP3、ASC、Caspase-1和GSDMD蛋白的表达水平,提示SSD对NLRP3炎症小体信号通路诱导的炎性反应和细胞焦亡具有抑制作用。此外,SSD还能降低TLR4和Myd88蛋白的表达水平,抑制p65蛋白的磷酸化,提示SSD可通过抑制TLR4/Myd88/NF-κB信号通路从而抑制NLRP3炎症小体信号通路的启动。
综上所述,本研究通过网络药理学研究方法初步发现了SSD治疗自身免疫性肝病的可能作用机制。在免疫性大鼠肝纤维化动物模型中,SSD可抑制TLR4/Myd88/NF-κB信号通路和NLRP3炎症小体的启动和激活,减轻下游炎症因子的释放,减轻肝脏炎症反应,起到保护性的作用。因此,本研究为SSD的进一步开发和临床利用提供了研究基础。
| [1] |
WEISKIRCHEN R, TACKE F. Liver fibrosis: from pathogene-sis to novel therapies[J]. Dig Dis, 2016, 34(4): 410-422. |
| [2] |
徐列明, 刘平, 沈锡中, 等. 肝纤维化中西医结合诊疗指南(2019年版)[J]. 中国中西医结合杂志, 2019, 39(11): 1286-1295. XU L M, LIU P, SHEN X Z, et al. Chinese guidelines for the diagnosis and treatment of liver fibrosis with integrated Chinese and Western medicine (2019)[J]. Chin J Integr Tradit West Med, 2019, 39(11): 1286-1295. |
| [3] |
KETELUT-CARNEIRO N, FITZGERALD K A. Inflammasomes[J]. Curr Biol, 2020, 30(12): R689-R694. |
| [4] |
INZAUGARAT M E, JOHNSON C D, HOLTMANN T M, et al. NLR family pyrin domain-containing 3 inflammasome activation in hepatic stellate cells induces liver fibrosis in mice[J]. Hepatology, 2019, 69(2): 845-859. |
| [5] |
WREE A, MCGEOUGH M D, INZAUGARAT M E, et al. NLRP3 inflammasome driven liver injury and fibrosis: roles of IL-17 and TNF in mice[J]. Hepatology, 2018, 67(2): 736-749. |
| [6] |
陆伦根, 尤红, 谢渭芬, 等. 肝纤维化诊断及治疗共识(2019年)[J]. 实用肝脏病杂志, 2019, 22(6): 793-803. LU L G, YOU H, XIE W F, et al. Consensus on the diagnosis and therapy of hepatic fibrosis[J]. J Pract Hepatol, 2019, 22(6): 793-803. |
| [7] |
国家药典委员会. 中华人民共和国药典(2010年版一部)[J]. 中国医药科技出版社, 2010, 163-164. National Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (2010 Volume 1)[J]. China Medical Science and Technology Press, 2010, 163-164. |
| [8] |
冯杰鑫, 吴雄, 陈建辉, 等. 柴胡皂苷D通过下调JAK2/STAT3通路抑制乳腺癌细胞的增殖并促进其凋亡[J]. 第三军医大学学报, 2021, 43(9): 852-857. FENG J X, WU X, CHEN J H, et al. Saikosaponin D inhibits proliferation and promotes apoptosis in breast cancer cells through down-regulating JAK2/STAT3 pathway[J]. J Third Mil Med Univ, 2021, 43(9): 852-857. |
| [9] |
JIANG J S, MENG Y F, HU S F, et al. Saikosaponin D: a potential therapeutic drug for osteoarthritis[J]. J Tissue Eng Regen Med, 2020, 14(8): 1175-1184. |
| [10] |
阮君, 肖铁刚, 王兵. 柴胡皂苷D对非酒精性脂肪性肝炎大鼠糖脂代谢紊乱的影响[J]. 中西医结合肝病杂志, 2019, 29(5): 399-401. RUAN J, XIAO T G, WANG B. Effects of Saikosaponin-D on glucose and lipid metabolism disorder in rats with non-alcoholic steatohepatitis[J]. Chin J Integr Tradit West Med Liver Dis, 2019, 29(5): 399-401. |
| [11] |
王祎, 庞旭, 张保财, 等. 柴胡皂苷d对肝星状细胞的作用分析[J]. 北京化工大学学报(自然科学版), 2020, 47(5): 76-82. WANG Y, PANG X, ZHANG B C, et al. Effects of saikosaponin D on hepatic stellate cells[J]. J Beijing Univ Chem Technol Nat Sci Ed, 2020, 47(5): 76-82. |
| [12] |
SHI Y, HUANG H H, CHEN C Y, et al. Reparative and toxicity-reducing effects of liposome-encapsulated saikosaponin in mice with liver fibrosis[J]. Biosci Rep, 2020, 40(8): BSR20201219. |
| [13] |
张艳, 都广礼, 陈德兴, 等. 猪血清致大鼠免疫性肝纤维化的动态观察[J]. 中国中西医结合消化杂志, 2007, 15(2): 74-77. ZHANG Y, DU G L, CHEN D X, et al. Dynamic observation of immune liver fibrosis in rats induced by porcine serum[J]. Chin J Integr Tradit West Med Dig, 2007, 15(2): 74-77. |
| [14] |
王宪东, 石安华, 陈文玲. 肝纤维化大鼠模型的研究进展[J]. 世界最新医学信息文摘, 2016, 16(94): 39-30. WANG X D, SHI A H, CHEN W L. Progress on rat model of hepatic fibrosis[J]. World Latest Med, 2016, 16(94): 39-30. |
| [15] |
李尧, 徐晓欧. 自身免疫性肝病的发病机制及诊疗进展[J]. 医学综述, 2021, 27(9): 1707-1711. LI Y, XU X O. Pathogenesis and diagnosis and treatment of autoimmune liver diseases[J]. Med Recapitul, 2021, 27(9): 1707-1711. |
| [16] |
赵琼, 刘恒军. 柴胡皂苷D对克雷伯杆菌肺炎大鼠肺组织损伤和纤维化及免疫功能的调节作用[J]. 沈阳药科大学学报, 2019, 36(9): 823-829. ZHAO Q, LIU H J. The regulating effect of saikosaponin D on lung tissue injury, fibrosis and immune function in Klebsiella pneumoniae rats[J]. J Shenyang Pharm Univ, 2019, 36(9): 823-829. |
| [17] |
李敏, 高凯, 王华林, 等. 柴胡皂苷d-黄芩苷配伍对CCl4诱导大鼠HSC的TLR4-NF-κB通路作用研究[J]. 陕西中医, 2018, 39(1): 3-5. LI M, GAO K, WANG H L, et al. Inhibitory effects of Saikosaponin D-Baicalin on activation of rat HSC induced by CCl4[J]. Shaanxi J Tradit Chin Med, 2018, 39(1): 3-5. |
| [18] |
郝健亨, 陈浩, 高艳, 等. 柴胡皂苷d对自身免疫性肝炎小鼠差异表达基因CTLA-4、IL-10和IL-17的影响[J]. 上海交通大学学报(医学版), 2020, 40(3): 303-309. HAO J H, CHEN H, GAO Y, et al. Effects of saikosaponin D on differentially expressed genes CTLA-4, IL-10 and IL-17 in mice with autoimmune hepatitis[J]. J Shanghai Jiao tong Univ Med Sci, 2020, 40(3): 303-309. |
| [19] |
林柳兵, 阙任烨, 李毅平, 等. 柴胡皂苷d对急性肝损伤小鼠高迁移率族蛋白B1表达的影响[J]. 时珍国医国药, 2019, 30(3): 527-531. LIN L B, QUE R Y, LI Y P, et al. Effect of Saikosaponin D on the expression of high mobility group box 1 in mice with acute liver injury[J]. Lishizhen Med Materia Medica Res, 2019, 30(3): 527-531. |
| [20] |
PLACE D E, KANNEGANTI T D. Recent advances in inflammasome biology[J]. Curr Opin Immunol, 2018, 50: 32-38. |
| [21] |
王丹姝, 燕柳艳, 孙姝婵, 等. 葛根素通过TLR4/Myd88/NF-κB抑制NLRP3炎症小体抗大鼠心肌缺血再灌注损伤[J]. 药学学报, 2021, 56(5): 1343-1351. WANG D S, YAN L Y, SUN S C, et al. Puerarin protects against myocardial ischemia/reperfusion injury by suppressing NLRP3 inflammasome activation via TLR4/Myd88/NF-κB pathway in rats[J]. Acta Pharm Sin, 2021, 56(5): 1343-1351. |
| [22] |
FISCHER F A, CHEN K W, BEZBRADICA J S. Posttranslational and therapeutic control of gasdermin-mediated pyroptosis and inflammation[J]. Front Immunol, 2021, 12: 661162. |
| [23] |
张娜, 晏旎, 周蒙恩, 等. 柴胡皂苷d对氧化应激诱导的人肝星状细胞活化后ROS形成及NLRP3炎性小体表达的影响[J]. 时珍国医国药, 2020, 31(4): 805-809. ZHANG N, YAN N, ZHOU M E, et al. Effects of Saikosaponin D on ROS formation and NLRP3 inflammasome expression after oxidative stress-induced activation of human hepatic stellate cells[J]. Lishizhen Med Materia Medica Res, 2020, 31(4): 805-809. |
| [24] |
张娜, 李勇. 柴胡皂苷d对人肝细胞损伤的保护作用研究及抗肝纤维化机制探讨[J]. 中华中医药学刊, 2021, 39(12): 21-27, 275. ZHANG N, LI Y. Study on protective effect of bupleurin D on human hepatocyte injury and mechanism of anti-liver fibrosis[J]. Chin Arch Tradit Chin Med, 2021, 39(12): 21-27, 275. |
| [25] |
LIN L B, QUE R Y, SHEN Y T, et al. Saikosaponin-D alleviates carbon-tetrachloride induced acute hepatocellular injury by inhibiting oxidative stress and NLRP3 inflammasome activation in the HL-7702 cell line[J]. Mol Med Rep, 2018, 17(6): 7939-7946. |
| [26] |
CHEN Y R, QUE R Y, LIN L B, et al. Inhibition of oxidative stress and NLRP3 inflammasome by Saikosaponin-d alleviates acute liver injury in carbon tetrachloride-induced hepatitis in mice[J]. Int J Immunopathol Pharmacol, 2020, 34: 2058738420950593. |




