结直肠癌作为一种恶性肿瘤,是西方国家第二常见的癌症[1],也是世界范围内的主要死亡原因之一[2]。饮食、遗传、息肉病变及慢性炎症均是导致结直肠癌高发的原因[3]。结直肠癌患者的临床症状通常表现在疾病进展的晚期[4],因此,早期诊断和治疗仍然是改善结直肠癌患者预后的关键。近年来,尽管结直肠癌的诊断和治疗方法不断进步,但其预后仍无明显改善。高复发率和转移风险导致5年总生存率不理想。因此,迫切需要开发有效的结直肠癌诊断和预后评估的生物标志物。
N6甲基腺苷(N6-methyladenosine,M6A)修饰是真核mRNAs中最常见的化学修饰[5],是近年来的研究热点。M6A修饰是一种可逆的动态RNA表观遗传过程,受M6A调控因子的调控,包括“writers”甲基转移酶蛋白3(methyltransferase like 3,METTL3)、甲基转移酶蛋白14(methyltransferase like 14,METTL14)、甲基转移酶蛋白16(methyltransferase like 16,METTL16)、肾母细胞瘤1相关蛋白(wilms tumor 1-associating protein,WTAP)、RNA结合基序蛋白15(RNA binding motif protein 15,RBM15)、RNA结合基元蛋白15B(RNA binding motif protein 15B,RBM15B)、含锌指CCCH结构域的蛋白质13(zinc finger CCCH domain-containing protein 13,ZC3H13)、锌指CCHC型4(zinc finger CCHC domain containing 4,ZCCHC4)、Cbl原癌基因E3泛素连接酶蛋白类似物1(casitas B-lineage lymphoma 1,CBLL1);“erasers”肥胖相关蛋白(FaT mass and obesity associated,FTO)、烷基化修复同源蛋白5(a-ketoglutarate-dependent dioxygenase alk B homolog 5,ALKBH5);“readers” YTH结构域蛋白(YTHDCs)家族YTHDC1、YTHDC2和YTHDF1/2/3(YT521-B homology,YTH)、IGF2BP1/2/3的胰岛素样生长因子2 mRNA结合蛋白(IGF2BP)(recombinant insulin like growth factor 2 mRNA binding protein 1/2/3(IGF2BP1/2/3)、异质性胞核核糖核蛋白c(heterogeneous nuclear ribonucleoprotein c,HNRNPC)、异质核核糖核蛋白A2B1(heterogeneous nuclear ribonucleoprotein A2/B1,HNRNPA2B1)、RNA结合基元蛋白X连锁(RNA binding motif protein, X-linked,RBMX)、三角状五肽重复结构蛋白(leucine-rich pentatricopeptide repeat containing,LRPPRC)、脆性X智力低下1(fragile X mental retardation 1,FMR1)[6-7]。研究表明M6A修饰参与许多生物学过程,如mRNA稳定性、翻译、RNA剪接和亚细胞定位等[8-9]。最近研究表明M6A修饰与肿瘤的发生[10]、增殖[11]、侵袭[12]和转移[13]有关。然而,通过分析M6A相关基因来探讨M6A在结直肠癌中预后价值的研究较少。因此,本研究首先分析M6A相关基因在结直肠癌中的差异表达情况,结合Cox分析和LASSO算法建立风险模型,评估具有预后价值的M6A甲基化调控因子。然后,基于差异表达M6A相关基因和差异表达长链非编码RNA(DElncRNAs)构建共表达网络。从共表达网络图中可发现FMR1基因占据主导地位,说明其可能较为重要,后续细胞实验观察敲除FMR1对结直肠癌细胞的增殖、迁移、侵袭、凋亡的影响,以期为结直肠癌的治疗提供新的生物标志物。
1 材料与方法 1.1 数据收集从肿瘤基因组图谱(The Cancer Genome Atlas,TCGA)数据库中下载结直肠癌的转录组数据和临床病理资料(包括患者的ID、年龄、生存时间、生存状态、肿瘤的分级、分期及TNM分期),截止日期2020年5月10日。共下载480个结直肠癌样本和41个对照患者的资料,18例因临床资料不完整而被排除在外。最终纳入462例结直肠癌样本和41例正常对照。
1.2 M6A相关基因的差异表达分析及相关性分析从R软件(版本3.6.1)中提取21个M6A相关基因writers(METTL3、METTL14、METTL16、WTAP、RBM15、RBM15B、ZC3H13、ZCCHC4、CBLL1)、erasers(FTO、ALKBH5)、readers(YTHDC1、YTHDC2、YTHDF1、YTHDF2、YTHDF3、HNRNPC、HNRNPA2B1、RBMX、LRPPRC、FMR1),用DESeq2包鉴定正常组和癌症组差异基因,利用R语言中的“Pheatmap”和“ggplot 2”软件包绘制差异基因的表达热图和小提琴图。利用检索基因相互作用的搜索工具(STRING,http://string.embl.de/)分析M6A甲基化调控因子之间的相互作用。Pearson相关分析揭示M6A RNA甲基化调控因子之间的相关性,R语言的“corrplot”包绘制可视化相关性分析图。
1.3 样本分型使用R语言中的“ConsensusClusterPlus”包对M6A相关基因进行样本聚类分析,设定参数为:iterations=50,resamplerate=80%。并对聚类结果进行主成分分析(principal component analysis,PCA)。此外,在R软件中进行临床信息与聚类结果的相关分析,利用ggplots软件包构建热图和生存分析图。
1.4 Cox风险回归模型的建立为了确定M6A甲基化相关基因在结直肠癌中的预后价值,首先,以log2(x+1)的方式对M6A相关基因的原始数据进行转化和标准化。使用R语言中的“survival”包对M6A相关基因采用单因素Cox分析筛选预后相关基因,通过“forest”包绘制森林图;使用R语言的“glment”和“survival”包通过LASSO回归构建Cox比例风险模型,计算风险评分,将风险评分的中位值作为临界值,将患者分为高、低风险组;进一步使用“survival”包通过KM分析比较高、低风险组的总生存率(overall survival,OS),绘制生存曲线。使用“Survival ROC”包通过受试者工作特征曲线(receiver operator characteristic curve,ROC)的曲线下面积(area under roc curve,AUC)评估LASSO回归Cox比例风险构建模型的预测价值。为了研究风险分组与临床特征之间的差异,应用χ2检验评估高、低风险组的临床特征差异,并使用“pheatmap”软件包绘制热图。使用“survival”包进行单因素和多因素Cox分析以选择影响OS的独立预测因子,并通过“forest”软件包可视化。
1.5 差异lncRNA的筛选及M6A相关基因和DElncRNAs共表达网络的构建使用TCGA中的注释文件Homo sapiens.gencode.v22.annotation.gtf.gz对差异表达的lncRNA进行鉴定和注释,其筛选条件为| log2(FC)|>2,FDR(adjusted P-value) < 0.01。利用ggplots软件包构建了热图和火山图。使用Pearson进行M6A相关基因和差异lncRNA相关性分析,然后,在Cytoscape3.7.2软件中对相关性分析结果进行可视化。
1.6 临床样本收集2019年7月至2020年9月海南省人民医院收治的30例结直肠癌患者的组织及相应的癌旁组织标本,标本经手术切除后立即置于液氮中冻存。临床标本由至少3名病理学家诊断。患者均签署知情同意书。本研究获得海南省人民医院伦理委员会审批(医伦研[2021]321号),实验过程中严格遵守《赫尔辛基宣言》。
1.7 细胞培养和细胞转染人结直肠癌细胞系HT-29购买自美国典型培养物保藏中心(ATCC;Manassas,VA,USA),置于含有100 U/mL青霉素(Gibco)、100 μg/mL链霉素(Gibco) 和10%胎牛血清(FBS;Gibco)的DMEM培养基(Invitrogen;Thermo Fisher Scientific,Inc.)中并在37 ℃,5% CO2的培养箱中培养。将细胞以5.0×105/孔接种于6孔板中,37 ℃、5%CO2条件下培养24 h。收集生长状态良好的HT-29细胞,严格按照lipofectamineTM2000转染试剂盒(Invitrogen;Thermo Fisher Scientific,Inc.)说明书转染序列(FMR1 siRNA:5′-CCAGAGCAAATGAAAAAGAGC-3′;siRNA-control:5′-TTCTCCGAACGTGTCACGT-3′),记为si-FMR1组和Control组。转染48 h后用于后续实验。
1.8 细胞计数试剂盒-8(cell counting kit-8,CCK-8)实验细胞转染48 h后,将细胞以5×103/孔接种于96孔板中培养。分别于培养24、48、72、96 h在每孔加入20 μL CCK-8溶液。培养4 h后终止培养,并用酶标仪(Thermo Fisher Scientific,Shanghai,China)测量每孔450 nm处的光密度值[D(450)]。
1.9 细胞划痕实验细胞培养24 h后,待细胞生长至90%时,用无菌枪头垂直于尺子的水平线划伤细胞。用1×PBS洗涤2次,加入含2%FBS的培养基继续培养。将培养物置于相同的观察位置,在0、24、48 h用显微镜(Nikon,New York,USA)观察细胞的迁移情况。
1.10 Transwell实验为评价细胞侵袭能力,将200 μL细胞悬液加入已预先包被Matrigel的上室,下室加入500 μL含10% FBS的DMEM。37 ℃孵育24 h后,去除上室细胞,下室细胞用5%戊二醛于4 ℃固定15 min,PBS洗涤,0.1%结晶紫染色5 min。随机选择3个视野,使用光学显微镜观察染色细胞。
1.11 流式细胞术检测细胞凋亡Annexin V-FITC/PI细胞凋亡检测试剂盒(Abcam,ab14085)用于检测细胞凋亡。细胞转染48 h后,收集细胞,用PBS溶液洗涤2次,离心,重悬于200 μL结合缓冲液中,与10 μL Annexin V-FITC和5 μL PI轻轻混合,室温避光孵育15 min。此后,将300 μL结合缓冲液添加到样品中。通过流式细胞术(FACS Calibur;BD Biosciences)在488 nm检测细胞凋亡,实验重复3次。
1.12 统计学分析用R软件进行统计分析,正态分布的连续变量以x±s表示,两两比较采用t检验。非正态分布的连续变量以中位数表示。χ2检验、Fisher精确检验、Pearson相关分析用于检验组间差异。采用Kaplan-Meier曲线和对数秩检验分析生存率。采用多因素Cox回归分析,确定总生存率(OS)的独立预后因素。采用SPSS 18.0统计软件进行数据分析。P < 0.05为差异有统计学意义。
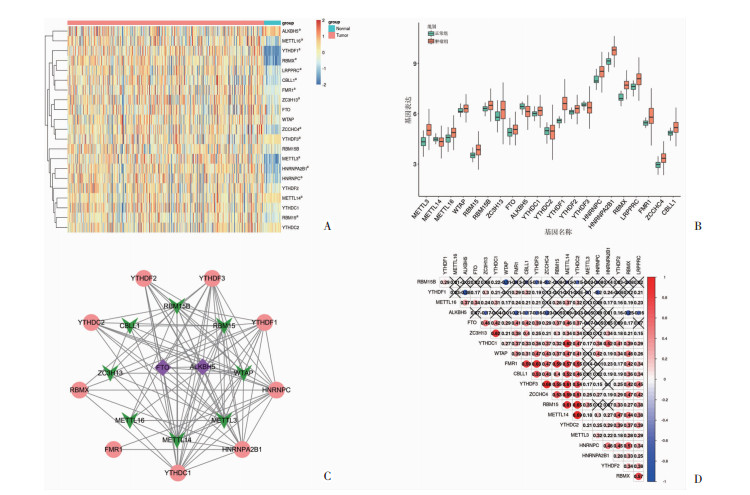
2 结果 2.1 M6A相关基因差异表达分析及相关性分析从TCGA数据库中下载462个结直肠癌样本和41例正常患者的基因表达谱数据及相应的临床数据,并对原始数据进行log2(x+1)归一化处理。然后,从转录组数据中提取21个M6A相关基因的表达谱,鉴定出15个差异表达的M6A相关基因。其中,YTHDF1、RBMX、METTL3、HNRNPA2B1、ZCCHC4、HNRNPC、LRPPRC、CBLL1、RBM15、FMR1、METTL16、ZC3H13在肿瘤组织中高表达,ALKBH5、METTL14和YTHDF3在肿瘤组织中低表达(图 1A、B)。从STRING数据库中检索21个M6A RNA甲基化相关基因之间的相互关系,构建PPI网络,PPI网络分析结果表明,ZCCHC4和LRPPRC与其他调节因子均无联系,故在网络图中未体现,METTL3和METTL14与其他调节因子有更多的联系,相互作用靶点较多(图 1C)。在结直肠癌肿瘤组织中,21种M6A甲基化调节因子的mRNA表达间存在普遍的相关性。相关性分析显示:RBMX与LRPPRC、HNRNPC,HNRNPA2B1与YTHDC1,YTHDC2与METTL14、RBM15、ZCCHC4、YTHDF3、FMR1,METTL14与RBM15、ZCCHC4、YTHDF3、CBLL1、FMR1、YTHDC1,RBM15与ZCCHC4、YTHDF3、FMR1,ZCCHC4与YTHDF3,YTHDF3与CBLL1、FMR1,CBLL1与FMR1,YTHDC1与ZC3H13间存在较强程度的正相关性,Pearson相关系数为0.5以上;WTAP与YTHDF1,RBMX与ALKBH等存在负相关性(图 1D)。
|
| A:M6A相关基因在结直肠癌中的表达水平热图 a: P < 0.05,与正常组比较;B:M6A相关基因的差异表达分析;C:M6A相关基因蛋白互作关系;D:M6A甲基化调节因子相关性红色代表正相关;蓝色代表负相关;黑色“×”表示无相关性 图 1 21个M6A相关基因在结直肠癌中的表达水平及相关性分析 |
2.2 M6A甲基化调控因子对应结直肠癌肿瘤分型与临床特征及预后的相关性
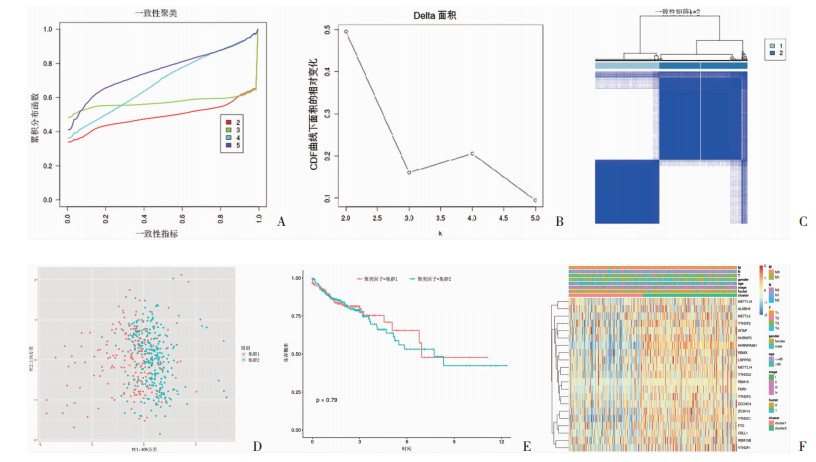
M6A甲基化调控因子的一致性聚类分析结果表明:k=2时,CDF值增速平缓(图 2A),Delta面积增长不明显(图 2B);分型矩阵显示k=2时,分组内的相关性高,分组间相关性低(图 2C)。主成分分析结果显示,M6A甲基化调节因子的mRNA表达特征可代表肿瘤组织的mRNA表达特征,k=2时样本间的重叠较少(图 2D);为了明确结直肠癌亚组与临床预后和临床病理特征的关系,分析了不同结直肠癌亚型总生存时间,k=2时,两分型间OS不存在差异(图 2E);卡方检验显示肿瘤分型与临床特征均无关(图 2F)。
|
| A:M6A甲基化调控因子的一致性聚类分析;B: Delta面积曲线;C:分型矩阵分析;D:主成分分析;E:两分型生存分析;F:肿瘤分型与临床特征的聚类分析 图 2 结直肠癌肿瘤分型与临床特征及预后的相关性结果图 |
2.3 结直肠癌21种M6A甲基化调控因子的风险模型与临床及预后的相关性
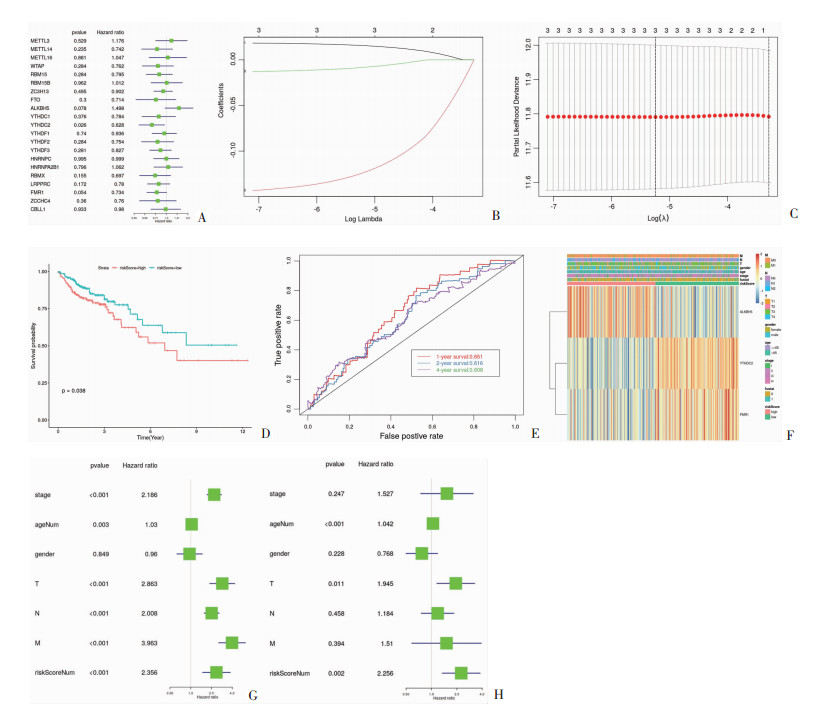
单因素Cox分析结果显示,21个M6A甲基化调节因子中ALKBH5、YTHDC2和FMR1的mRNA表达与预后相关(P < 0.1),YTHDC2和FMR1为保护因子(HR < 1),ALKBH5为危险因子(HR>1),见图 3A。使用LASSO回归算法对筛选的3个基因建立风险预测模型并计算风险值,风险得分=(0.0157×ALKBH5表达水平)+(-0.124 6×YTHDC2表达水平)+(-0.142 0×FMR1),见图 3B、C。根据风险模型的中位数将结直肠癌患者分为高风险组和低风险组,采用R语言进行生存分析,KM生存分析显示风险评分与患者预后相关(图 3D),高低风险的5年OS分别为0.555(95%CI:0.436~0.706)、0.682(95%CI:0.566~0.821);ROC曲线显示风险模型的AUC为0.6以上,具有较好的预测价值(图 3E)。结果显示,结直肠癌肿瘤风险评分与分级及T、N、M分期等临床特征均无关(图 3F)。单因素Cox分析表明结直肠癌的预后与年龄,分级,T、M、N分期、风险评分相关(图 3G),均为危险因子;多因素Cox分析显示,结直肠癌的预后与年龄、T分期及风险评分相关(图 3H),年龄是结直肠癌的较差预后的独立预测因子。
|
| A:单因素Cox分析21个M6A甲基化调节因子的预后;B、C:LASSO回归算法建立风险预测模型并计算风险值1、2、3分别为纳入风险模型的基因个数;D:结直肠癌患者高低风险组预后生存分析;E:ROC曲线风险模型的AUC结果;F:风险评分与临床特征及ALKBH5、YTHDC2和FMR1 m RNA表达的相关性;G:单因素Cox分析结直肠癌的预后与年龄,分级,T、M、N分期、风险评分相关性;H:多因素Cox分析结直肠癌的预后与年龄、T分期及风险评分相关性 图 3 结直肠癌21种M6A甲基化调控因子的风险模型与临床及预后的相关性 |
2.4 M6A相关基因与lncRNA共表达网络的构建
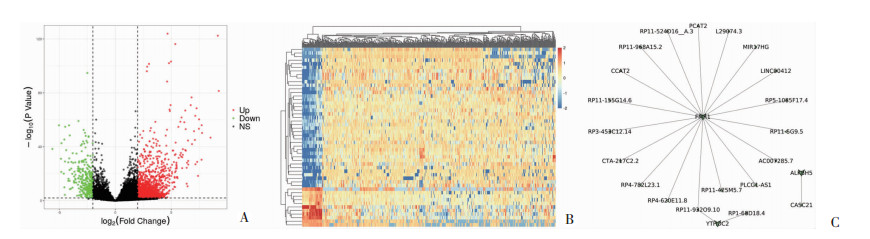
采用R软件构建的共表达网络。以|log2 FC|>2且P < 0.01为筛选标准,共得到1 784个DElncRNAs,其中285个下调,1 499个上调,DElncRNAs的火山图和热图见图 4A、B。随后,构建的共表达网络中包括3个预后相关的M6A相关基因和18个DElncRNAs,结果显示FMR1基因在共表达网络中占据主导地位(图 4C),说明其可能较为重要,于是后续实验对FMR1进行研究。
|
| A:M6A相关基因对应差异lncRNA火山图;B:M6A相关基因对应差异lncRNA热图;C:M6A相关基因与lncRNA的共表达网络图 图 4 差异lncRNA火山图和热图以及预后相关M6A调控因子-lncRNA网络图 |
2.5 M6A调控因子FMR1的敲除对结直肠癌细胞增殖、迁移、侵袭和凋亡的影响
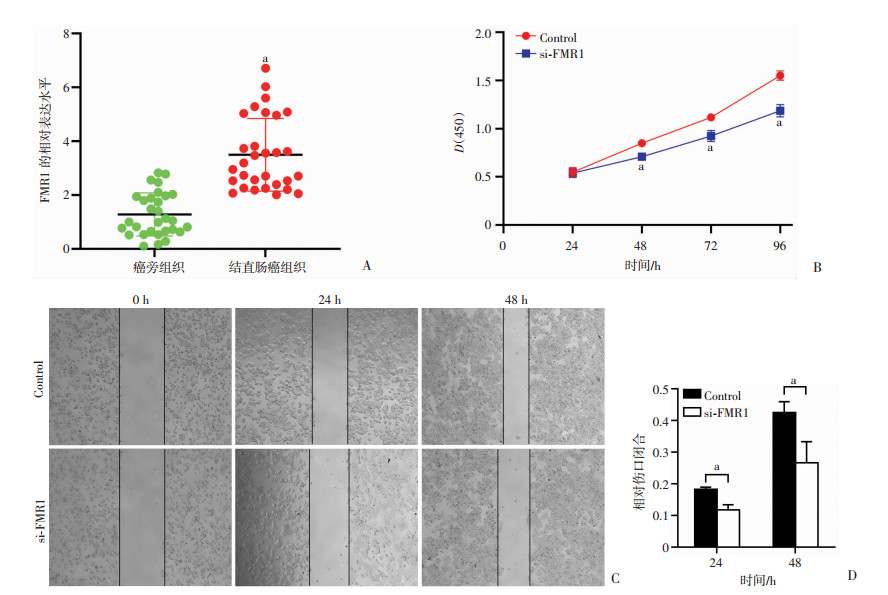
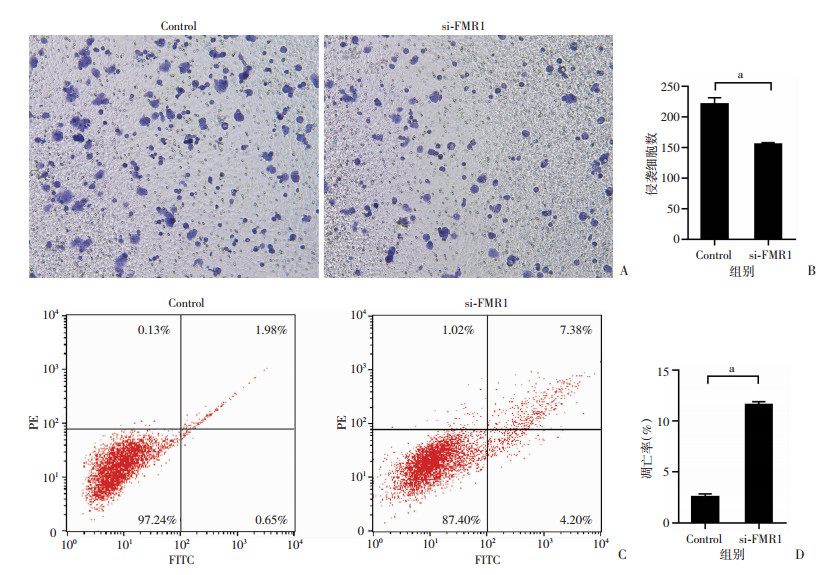
RT-qPCR结果表明,FMR1在结直肠癌组织中显著上调(图 5A);在结直肠癌细胞中敲除FMR1基因后,CCK-8实验结果表明,FMR1基因的敲除能抑制结直肠癌HT-29细胞的增殖(图 5B);细胞划痕实验结果显示,FMR1基因的敲除能抑制结直肠癌HT-29细胞的迁移能力(图 5C、D);Transwell实验结果表明,FMR1基因的敲除能抑制结直肠癌HT-29细胞的侵袭能力(图 6A、B);细胞凋亡实验结果表明,FMR1基因的敲除能促进结直肠癌HT-29细胞的凋亡(图 6C、D)。
|
| A:RT-qPCR验证了FMR1在结直肠癌组织中的表达情况 a: P < 0.05,与癌旁组织比较;B:CCK-8实验检测细胞的增殖能力a: P < 0.05,与Control组比较;C、D:划痕实验检测细胞迁移能力a: P < 0.05 图 5 M6A调控因子FMR1的敲除抑制结直肠癌细胞增殖,迁移和侵袭促进细胞凋亡 |
|
| A、B:Transwell实验检测细胞侵袭能力;C、D:流式细胞术检测细胞凋亡能力 a: P < 0.05 图 6 M6A调控因子FMR1的敲除抑制结直肠癌细胞增殖,迁移和侵袭促进细胞凋亡 |
3 讨论
结直肠癌已成为美国发病率和死亡率排名第三的癌症[14]。尽管筛查试验和生活方式的改变降低了发病率和死亡率,但转移性结直肠癌患者的预后仍然很差(5年生存率约为13%)[15]。最近的研究表明M6A在人类癌症的发生和发展过程中是一个重要的调节因子[16-17]。然而,研究M6A在结直肠癌中致瘤作用的研究较少。因此,探讨M6A的作用有助于了解结直肠癌的发生和发展。
本研究从TCGA中提取了21个M6A相关基因,根据M6A相关基因的表达情况,进行聚类分析和PCA分析。结果表明,M6A相关基因的表达水平可以区分结直肠癌患者。利用Cox回归分析筛选3个预后相关基因,分别为ALKBH5、YTHDC2和FMR1。进一步LASSO算法确定结直肠癌患者生存预后的关键调节因子仍为ALKBH5、YTHDC2和FMR1,由此建立风险预测模型,根据中位风险值将结直肠癌患者分为低、高风险组。分析发现高风险组与低风险组患者的总体生存率差异有统计学意义,单因素与多因素Cox回归分析结果显示风险值可以作为独立预后的指标,最终确定3个与预后相关的M6A甲基化调控因子(ALKBH5、YTHDC2和FMR1)。其中,ALKBH5可通过降低lncRNA NEAT1的甲基化促进结肠癌的进展[18];骨肉瘤中ALKBH5通过M6A依赖的前miR-181b-1/YAP信号轴表观遗传沉默抑制肿瘤进展[19];M6A读取器YTHDC2通过抑制SLC7A11依赖的抗氧化功能抑制肺腺癌的发生[20];M6A相关基因YTHDC2的下调促进非小细胞肺癌的肿瘤进展并预测不良预后[21];以上研究表明ALKBH5和YTHDC2与癌症中的M6A修饰密切相关。其中,FMR1是新鉴定出的“M6A reader”,在细胞质中,其可直接readers,也可刺激mRNA的翻译[22]。截至目前为止关于FMR1的研究并不多见,我们将在后续的研究中进行深入的分析。此外,越来越多的研究表明,lncRNA以M6A的方式在癌症中发挥了重要作用[13, 23],研究显示,lncRNA IGF2BP2-AS1是IGF2BP2的反义表达,以M6A方式与结直肠癌的进展相关[24]。于是,本研究构建ALKBH5、YTHDC2和FMR1与其对应lncRNA的共表达网络图,共表达网络图中发现ALKBH5连接lncRNA CASC21。研究发现,lncRNA CASC21通过调节miR-7-5p/YAP1轴在结直肠癌中发挥致癌作用[25];YTHDC2连接RP11-932O9.10和RP1-68D18.4;其中FMR1连接较多的lncRNA,其LncRNA CCAT2在结直肠癌的表达水平显著高于癌旁非肿瘤组织,lncRNA CCAT2的高表达与晚期结直肠癌患者相关[26];lncRNA MIR17HG通过miR-17-5p促进结直肠癌进展[27]。对于共表达网络图中涉及的lncRNA目前没有相关研究证实是否以M6A方式在结直肠癌的发生发展中发挥重要作用,这将在后续进一步研究。由于共表达网络图中FMR1基因连接较多的lncRNA,说明FMR1基因可能占据主导地位,在结直肠癌中较为重要。本研究重点对FMR1在结直肠癌中的作用进行研究,结果发现FMR1在结直肠癌组织中上调,敲除FMR1基因能抑制结直肠癌HT-29细胞的增殖,迁移和侵袭能力,促进结直肠癌细胞的凋亡。表明FMR1是结直肠癌的一个独立的预后生物标志物,并可能在结直肠癌的癌变过程中发挥重要作用。
综上所述,本研究通过生物信息学分析证实M6A甲基化调控因子在结直肠癌肿瘤中具有显著差异性,且M6A甲基化调控因子的异常表达与结直肠癌临床病理及患者预后密切相关,建立的风险预测模型对指导结直肠癌后期个性化治疗及改善预后具有重要的参考价值,但目前本研究仍具有一定的局限性。比如:样本量和临床标本太少,后续我们将扩大样本量和临床标本,对本研究确定的独立预后因子FMR1进行更加深入的研究。
| [1] |
FERLAY J, STELIAROVA-FOUCHER E, LORTET-TIEULENT J, et al. Cancer incidence and mortality patterns in Europe: Estimates for 40 countries in 2012[J]. Eur J Cancer, 2013, 49(6): 1374-1403. |
| [2] |
FERLAY J, SOERJOMATARAM I, DIKSHIT R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359-E386. |
| [3] |
王唯全, 李萍, 王楚盈, 等. 结直肠癌的病因病机与药物治疗的研究进展[J]. 长春中医药大学学报, 2020, 36(1): 194-197. WANG W Q, LI P, WANG C Y, et al. Advances in etiology, pathogenesis and drug therapy of colorectal cancer[J]. J Changchun Univ Chin Med, 2020, 36(1): 194-197. |
| [4] |
INADOMI J M. Screening for colorectal neoplasia[J]. N Engl J Med, 2017, 376(2): 149-156. |
| [5] |
HUANG H, WENG H, CHEN J. The biogenesis and precise control of RNA M6A methylation[J]. Trends Genet, 2020, 36(1): 44-52. |
| [6] |
HUANG H, WENG H, SUN W, et al. Recognition of RNA N6-methyladenosine by IGF2BP proteins enhances mRNA stability and translation[J]. Nat Cell Biol, 2018, 20(3): 285-295. |
| [7] |
ROUNDTREE I A, EVANS M E, PAN T, et al. Dynamic RNA modifications in gene expression regulation[J]. Cell, 2017, 169(7): 1187-1200. |
| [8] |
SUI X, HU Y, REN C, et al. METTL3-mediated M6A is required for murine oocyte maturation and maternal-to-zygotic transition[J]. Cell Cycle, 2020, 19(4): 391-404. |
| [9] |
LIU L, WANG J, SUN G, et al. M6A mRNA methylation regulates CTNNB1 to promote the proliferation of hepatoblastoma[J]. Mol Cancer, 2019, 18(1): 188. |
| [10] |
LIN S, CHOE J, DU P, et al. The m(6)A methyltransferase METTL3 promotes translation in human cancer cells[J]. Mol Cell, 2016, 62(3): 335-345. |
| [11] |
LIU J, ECKERT M A, HARADA B T, et al. M6A mRNA methylation regulates AKT activity to promote the proliferation and tumorigenicity of endometrial cancer[J]. Nat Cell Biol, 2018, 20(9): 1074-1083. |
| [12] |
CHENG X, LI M, RAO X, et al. KIAA1429 regulates the migration and invasion of hepatocellular carcinoma by altering M6A modification of ID2 mRNA[J]. Onco Targets Ther, 2019, 12: 3421-3428. |
| [13] |
WU Y, YANG X, CHEN Z, et al. M6A-induced lncRNA RP11 triggers the dissemination of colorectal cancer cells via upregulation of Zeb1[J]. Mol Cancer, 2019, 18(1): 87. |
| [14] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68(1): 7-30. |
| [15] |
UNSELD M, DRIMMEL M, SIEBENHÜNER A, et al. Optimizing treatment sequence for late-line metastatic colorectal cancer patients using trifluridine/tipiracil and regorafenib[J]. Clin Colorectal Cancer, 2018, 17(4): 274-279. |
| [16] |
ZHANG S, ZHAO B S, ZHOU A, et al. M6A demethylase ALKBH5 maintains tumorigenicity of glioblastoma stem-like cells by sustaining FOXM1 expression and cell proliferation program[J]. Cancer Cell, 2017, 31(4): 591-606.e6. |
| [17] |
CAI X, WANG X, CAO C, et al. HBXIP-elevated methyltransferase METTL3 promotes the progression of breast cancer via inhibiting tumor suppressor let-7g[J]. Cancer Lett, 2018, 415: 11-19. |
| [18] |
GUO T, LIU D F, PENG S H, et al. ALKBH5 promotes colon cancer progression by decreasing methylation of the lncRNA NEAT1[J]. Am J Transl Res, 2020, 12(8): 4542-4549. |
| [19] |
YUAN Y, YAN G, HE M, et al. ALKBH5 suppresses tumor progression via an M6A-dependent epigenetic silencing of pre-miR-181b-1/YAP signaling axis in osteosarcoma[J]. Cell Death Dis, 2021, 12(1): 60. |
| [20] |
MA L, CHEN T, ZHANG X, et al. The M6A reader YTHDC2 inhibits lung adenocarcinoma tumorigenesis by suppressing SLC7A11-dependent antioxidant function[J]. Redox Biol, 2021, 38: 101801. |
| [21] |
SUN S, HAN Q, LIANG M, et al. Downregulation of m6 A reader YTHDC2 promotes tumor progression and predicts poor prognosis in non-small cell lung cancer[J]. Thorac Cancer, 2020, 11(11): 3269-3279. |
| [22] |
EDUPUGANTI R R, GEIGER S, LINDEBOOM R G H, et al. N6-methyladenosine (M6A) recruits and repels proteins to regulate mRNA homeostasis[J]. Nat Struct Mol Biol, 2017, 24(10): 870-878. |
| [23] |
NI W, YAO S, ZHOU Y X, et al. Long noncoding RNA GAS5 inhibits progression of colorectal cancer by interacting with and triggering YAP phosphorylation and degradation and is negatively regulated by the M6A reader YTHDF3[J]. Mol Cancer, 2019, 18(1): 143. |
| [24] |
LI T, HU P S, ZUO Z, et al. METTL3 facilitates tumor progression via an M6A-IGF2BP2-dependent mechanism in colorectal carcinoma[J]. Mol Cancer, 2019, 18(1): 112. |
| [25] |
ZHENG Y, NIE P, XU S. Long noncoding RNA CASC21 exerts an oncogenic role in colorectal cancer through regulating miR-7-5p/YAP1 axis[J]. Biomed Pharmacother, 2020, 121: 109628. |
| [26] |
WANG L, DUAN W, YAN S, et al. Circulating long non-coding RNA colon cancer-associated transcript 2 protected by exosome as a potential biomarker for colorectal cancer[J]. Biomed Pharmacother, 2019, 113: 108758. |
| [27] |
XU J, MENG Q T, LI X B, et al. Long noncoding RNA MIR17HG promotes colorectal cancer progression via miR-17-5p[J]. Cancer Res, 2019, 79(19): 4882-4895. |




