2. 400037 重庆,陆军军医大学(第三军医大学)第二附属医院消化内科
2. Department of Gastroenterology, Second Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400037, China
巨噬细胞是人体重要的免疫细胞,具有可塑性,它可以根据不同微环境改变其表型,呈现出不同的功能。它在人体的多方面都发挥重要作用,包括发育、稳态、修复以及对病原体的免疫反应[1-2]。它通过对病原菌的吞噬、杀灭,产生非特异性的免疫应答,同时还具有抗原提呈作用,参与特异性的免疫应答。巨噬细胞在许多慢性疾病中起主要作用,包括肿瘤、动脉粥样硬化、哮喘、炎症性肠病、类风湿性关节炎和纤维化等[1-5]。在疾病早期,巨噬细胞的激活可引起促炎细胞因子的分泌,后期参与组织修复可导致干细胞增殖、血管生成、纤维化。在慢性炎症性疾病的防治中,可以利用巨噬细胞的固有可塑性来调节它们的形态,以通过降低炎症细胞因子来控制炎症[6]。
钙(Ca2+)对生命至关重要。它通常作为重要的细胞内第二信使,通过与细胞内钙传感器结合来调节细胞的各种功能,如有丝分裂、基因表达、能量代谢、细胞死亡等。钙敏感受体(calcium-sensing receptor, CaSR)作为重要的钙离子传感器,在维持血清Ca2+稳态方面发挥关键作用[7]。CaSR在甲状腺、肾上腺等促骨化组织中表达,也在其他非骨化组织中广泛表达,如单核细胞、巨噬细胞、平滑肌细胞和内皮细胞[8]。在免疫细胞中CaSR可作为初始炎症反应的启动子和介质,也可作为炎症的促进者,促进炎症性疾病的发生、发展。CaSR的异常表达与肿瘤[8-10]、炎症性肠病[10]、过敏性哮喘[11]、炎症性肺疾病[12]、心肌梗死后和肥胖后的炎症[8, 13]等密切相关。有研究报道CaSR通过涉及细胞内Ca2+增加和cAMP水平降低的机制激活NLRP3炎症小体, 促进IL-1β分泌[14]。然而,CaSR如何调节胞内钙信号,特别是通过何种离子通道参与细胞功能的调控仍然不清楚。
瞬时受体电位阳离子通道蛋白6 (transient receptor potential cation channel 6,TRPC6)是TRP(transient receptor potential, TRP)基因超家族C亚家族(canonical) 的成员之一,编码钙可通过的非选择性阳离子通道。在过去几年中,人们对免疫细胞中的TRP通道家族的表达和功能越来越感兴趣。已证明TRPC6分子参与动物体内许多重要的生理和病理调节过程, 如血管与气道平滑肌收缩[15-16]、肾小球滤过膜滤过功能[17]、免疫调节[18-19]等。有研究报道脓毒症的T淋巴细胞中CaSR的激活增加了TRPC3/6的表达[18]。本课题组前期研究发现:CaSR与瞬时性受体电位香草素受体4 (transient receptor potential vanilloid 4, TRPV4) 通道偶联可促进胃癌的发展[20]。因此,本研究探讨CaSR是否通过TRPC6通道对巨噬细胞炎症反应起调控作用及其中所涉及的分子机制,以期为临床炎症性疾病的防治提供新的思路。
1 材料与方法 1.1 实验动物及材料清洁健康级C57BL/6小鼠(雄性,6~8周,体质量20~25 g),购自重庆医科大学实验动物中心。Cinacalcet hydrochloride、Calhex231、GSK1016790A、SKF96365和SAR7334购自MCE公司(美国), LPS购自Solarbio,高糖DMEM培养基、RPMI1640培养基及胎牛血清购自HyClone公司(美国),coverslip购自Millicell,Furo-2/AM购自Invitrogen公司(美国), 12孔板购自Corning公司(美国), CaCl2购自上海生工。逆转录和定量q-PCR试剂盒购自日本TaKaRa公司。IL-1β ELISA试剂盒购自NOVUS BIOLOGICALS(美国)。
1.2 细胞培养小鼠单核巨噬细胞系(RAW264.7)由本实验室保存。于含10%胎牛血清的高糖DMEM培养基复苏,置于37 ℃、5%CO2的细胞培养箱中培养。
小鼠腹腔巨噬细胞(peritoneal macrophages,PMs)分离与培养。取C57BL/6小鼠经腹腔无菌注射3 mL 3%硫乙醇酸盐流体培养基。3 d后颈椎脱臼处死,经腹腔注射5 mL/次RPMI1640培养基进行灌洗,重复3次,收集腹腔灌洗液,1 000 r/min离心5 min后,弃上清,RPMI1640完全培养液重悬,取适量细胞悬液接种12孔板盖玻片。置于37℃、5%CO2细胞培养箱中培养,12 h后弃去未黏附细胞,贴壁细胞即为小鼠巨噬细胞,重新加入适量RPMI1640完全培养基培养。
1.3 单细胞荧光钙成像及离子浓度测定将RAW264.7细胞或PMs细胞适量接种于24孔板爬片,于37 ℃、5%CO2细胞培养箱培养24 h。
1.3.1 激活CaSR对巨噬细胞内Ca2+信号的影响准备4片细胞爬片:①cinacalcet;②:cinacalcet+Calhex231;③CaCl2;④CaCl2+Calhex231。将细胞爬片用生理盐溶液(PSS)漂洗,并于5 μmol/L Fura-2/AM PSS溶液中避光孵育1 h。孵育结束后用PSS(或PSS+Calhex231液,Calhex231终浓度为5 μmol/L)漂洗15 min。将爬片细胞贴合面倒置安装于荧光显微镜的标准灌注室中,注入PSS(或PSS+Calhex231液,Calhex231终浓度为5 μmol/L)500 μL,圈定明亮饱满的细胞,使用增强型CCD相机记录加药前荧光图像变化,Metafluo软件每隔3 s记录340/380 nm激发波下荧光强度变化,即F(340/380)。基线平稳后,在灌流室中加入cinacalcet(终浓度1 μmol/L)或CaCl2(终浓度5 mmol/L),记录加药后荧光图像及荧光强度变化。
1.3.2 激活CaSR后RAW264.7细胞内Ca2+信号的来源准备2片细胞爬片:①cinacalcet(无Ca2+,2 mmol/L Ca2+);②GdCl3(无Ca2+,2 mmol/L Ca2+)。同上用5 μmol/L Fura-2/AM PSS溶液中避光孵育1 h,孵育结束后用PSS漂洗15 min。如上述上片,灌流槽注入PSS 500 μL,记录F(340/380)值,基线平稳后先将灌流槽中换为无Ca2+ PSS +cinacalcet液500 μL (cinacalcet终浓度1 μmol/L)或者无Ca2+ PSS +GdCl3液500 μL (GdCl3终浓度5 mmol/L),继续观察待基线平稳,再往灌流槽中加入CaCl2(终浓度2 mmol/L),观察并记录F(340/380)的变化。
1.3.3 激活CaSR后引起细胞外钙内流的钙通道准备5片细胞爬片:①GSK1016790A;②cinacalcet;③cinacalcet+SKF96365;④cinacalcet+SAR7334。如上述孵育细胞,用PSS或(PSS+SKF96365, PSS+SAR7334液)漂洗15 min,上机,使用激动剂(GSK1016790A, cinacalcet)刺激,观察并记录F(340/380)的变化。
F(340/380)代表细胞内钙离子浓度变化。ΔF(340/380)计算方法:加药后F(340/380)最大值-加药前F(340/380)基础值。PSS成分包括(mmol/L):140 Na+、5 K+、2 Ca2+、147 Cl-、10 HEPES和10葡萄糖,pH=7.4;无Ca2+ PSS成分包括(mmol/L):140 Na+、5 K+、145 Cl-、0.5 EGTA、10 HEPES和10葡萄糖,pH=7.4。
1.4 实时荧光定量PCR(q-PCR)检测将RAW264.7细胞适量铺于12孔板,过夜培养,分组:对照组(加入DMSO 2 μL作为溶剂对照),LPS组,LPS+cinacalcet组,LPS+cinacalcet+Calhex231组,LPS+cinacalcet+SAR7334组。Calhex(终浓度5 μmol/L),SAR7334(终浓度30 μmol/L)先处理1 h,加入cinacalcet(终浓度1 μmol/L)、LPS(1 μg/mL)继续培养11 h。细胞用PSS清洗2次,加入TRIzol 500 μL/孔进行裂解,与三氯甲烷以5∶1比例提取总RNA,并将RNA逆转录至cDNA。PCR反应总体积是20 μL, 包括模板DNA 1 μL,10 μmol/L上下游引物各0.8 μL,5U TaqDNA聚合酶10 μL,ROX Reference DyeⅠ 0.4 μL, H2O 7 μL。PCR程序:95 ℃持续3 min预变性、94 ℃持续30 s变性、58 ℃持续30 s退火,72 ℃持续30~60 s延伸,总共循环40次,72 ℃持续10 min修复延伸。引物序列见表 1。
| 引物 | 序列(5′→3′) | 片段长度/bp |
| GAPDH | 上游: TCTCCCTCACAATTTCCATCCCAG 下游: GGGTGCAGCGAACTT TATTGATGG |
100 |
| IL-1β | 上游: GCAACTGTTCCTGAACTCAACT 下游: ATCTTTTGGGGTCCGTCAACT |
89 |
| IL-18 | 上游:AAGAAAGCCGCCTCAAACCT 下游:AGTGAAGTCGGCCAAAGTTGT |
174 |
1.5 ELISA检测
收集不同条件下的细胞上清液,14 000 r/min离心5 min,取上清液,储存于-80℃冰箱中备用。使用小鼠IL-1β ELISA试剂盒测定上清液。根据制造商的说明操作实验室程序。结果通过Multiskan EX读板机(Thermo Fisher Scientific,德国)进行测试。
1.6 统计学分析采用GraphPad Prism 8.0统计软件进行实验数据分析和图片绘制,所有数据以x±s表示。2组之间比较采用独立样本t检验,多组之间比较采用单因素方差分析。检验水准:α=0.05。
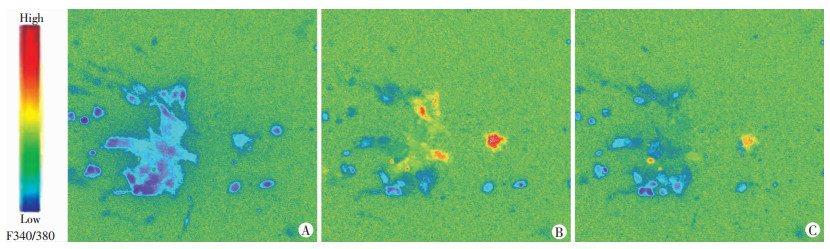
2 结果 2.1 CaSR引起细胞内钙荧光信号改变加药前F340/380基值低,荧光呈蓝色(或紫色)(图 1A);加入CaCl2后F340/380比值明显增高,荧光强度增强,荧光呈红色或黄色(图 1B);CaSR抑制剂Calhex231孵育后,F340/380比值减小,荧光呈蓝色,部分黄色(图 1C)。上述结果显示:在静息状态下,RAW264.7细胞质中Ca2+浓度较低,当受到刺激后细胞内Ca2+快速升高。
|
| A:加药前;B:加入CaCl2 5 mmol/L;C:加入Calhex231 10 μmol/L 图 1 加药前后RAW264.7细胞内Ca2+信号荧光强度变化 (×200) |
2.2 激活CaSR增加细胞内Ca2+信号
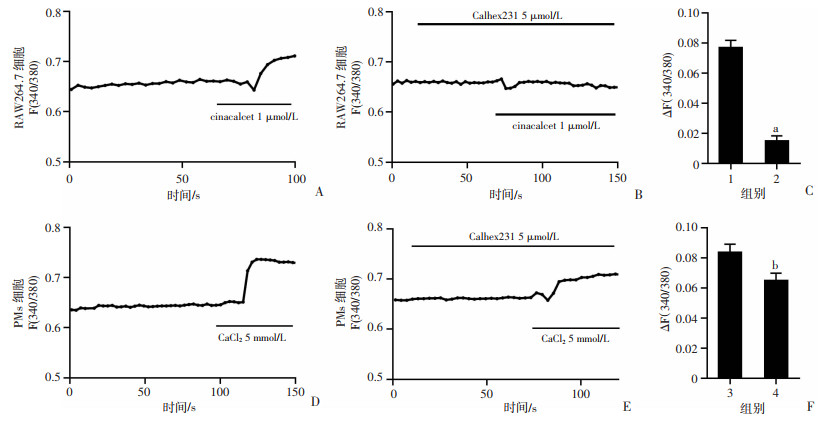
单细胞荧光Ca2+测定结果显示:使用CaSR特异性激动剂cinacalcet刺激RAW264.7细胞,其细胞内Ca2+信号升高,而该作用能被Calhex231阻断(0.077 0± 0.004 7 vs 0.015 0±0.003 2, P < 0.01,图 2A~C)。同样,在PMs细胞中,CaCl2引起胞内Ca2+信号升高,而Calhex231可阻断此作用(0.085 0±0.006 4 vs 0.004 7± 0.007 3,P < 0.05,图 2D~F)。表明RAW264.7与PMs细胞中CaSR具有相同的功能表达,均可引起细胞内Ca2+信号增加。
|
| A: cinacalcet引起Ca2+信号的变化(n=16);B:使用Calhex231后cinacalcet引起Ca2+信号的变化(n=17);C:比较2组Ca2+信号的变化 1:cinacalcet组;2:cinacalcet+Calhex231组;a: P < 0.01,与cinacalcet组比较;D:CaCl2引起Ca2+信号的变化(n=18);E: 使用Calhex231后CaCl2引起Ca2+信号的变化(n=13);F:比较2组Ca2+信号的变化 3:CaCl2组;4:CaCl2+Calhex231组;b: P < 0.05,与CaCl2组比较 图 2 荧光钙离子检测激活CaSR对巨噬细胞内Ca2+信号的影响 |
2.3 CaSR介导的细胞内Ca2+信号升高以细胞外Ca2+内流为主
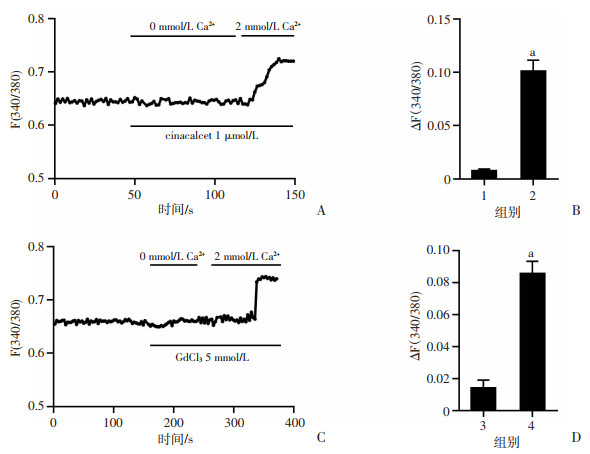
Cinacalcet在无Ca2+液中检测到较弱Ca2+信号,而在2 mmol/L Ca2+液中则引起明显的细胞内Ca2+信号升高(0.007 7±0.001 7 vs 0.101 0±0.010 2,P < 0.01,图 3A、B)。同样,CaSR另一种激动剂氯化钆(GdCl3) 也具此作用(0.008 0±0.002 9 vs 0.085 7±0.007 6,P < 0.01,图 3C、D)。提示在RAW264.7细胞中,CaSR介导的细胞内Ca2+信号升高是以细胞外Ca2+内流为主。
|
| A、C:cinacalcet、GdCl3在无Ca2+液、2 mmol/L Ca2+液中对细胞内Ca2+信号的影响;B、D:2组细胞内Ca2+信号变化分析 1:cinacalce+无Ca2+液组(n=14);2:cinacalce+2 mmol/L Ca2+液组(n=14);3:GdCl3+无Ca2+液组(n=22);4:GdCl3+2 mmol/L Ca2+液组(n=22);a: P < 0.01,与无Ca2+液组比较 图 3 荧光钙离子检测激活CaSR后RAW264.7细胞内Ca2+信号的来源 |
2.4 TRPC6参与CaSR引起胞内Ca2+信号的调节
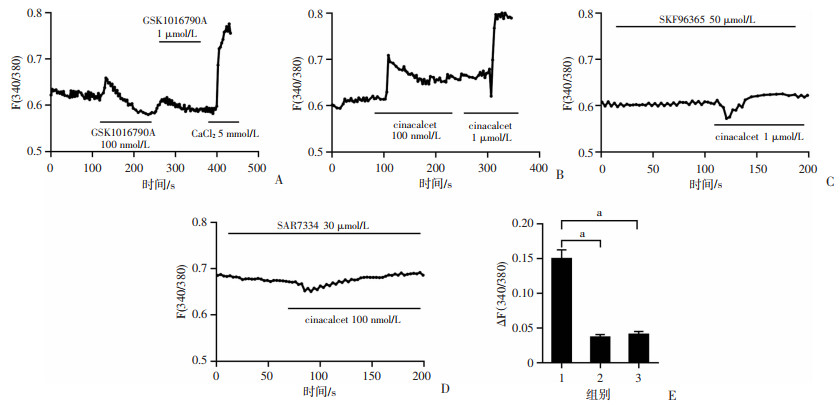
使用选择性TRPV4激动剂GSK1016790A后,在RAW264.7细胞中检测到弱的Ca2+信号(0.032 0±0.007 0,图 4A),且药物浓度的增加并未增加细胞内Ca2+信号,而CaCl2 5 mmol/L则引起明显Ca2+信号增加(0.184 4±0.011 2, P < 0.01),表明在RAW264.7细胞中,非TRPV4对Ca2+信号发挥主要调控作用。低浓度cinacalcet刺激RAW264.7细胞,检测到小幅度的Ca2+信号升高(0.094 4±0.008 3),浓度增加至1 μmol/L时,Ca2+信号明显升高(0.150 0±0.012 4,图 4B),而TRPC抑制剂SKF96365明显阻断此作用(0.036 7±0.003 7, P < 0.01,图 4C),表明TRPC通道参与调控CaSR介导细胞外Ca2+内流的过程。进一步使用TRPC6的特异性拮抗剂SAR7334,同样能明显阻断CaSR激活引起的细胞内Ca2+信号升高(0.039 2±0.004 5,P < 0.01,图 4D、E)。提示在RAW264.7细胞中TRPC6通道参与了CaSR介导的细胞外Ca2+内流。
|
| A: GSK1016790A、CaCl2引起细胞内Ca2+信号变化;B:cinacalcet引起细胞内Ca2+信号变化;C:SKF96365孵育后,cinacalcet引起细胞内Ca2+信号变化;D:SAR7334孵育后,cinacalcet引起细胞内Ca2+信号变化;E:各组Ca2+信号变化差异分析 1:cinacalcet组;2:cinacalcet+SKF96365组;3:cinacalcet+SAR7334组;a: P < 0.01 图 4 荧光钙离子检测激活CaSR后引起细胞外钙内流的钙通道 |
2.5 CaSR/TRPC6/Ca2+信号轴调节IL-1β和IL-18 mRNA表达
q-PCR检测IL-1β和IL-18 mRNA表达(表 2)。在RAW264.7细胞中,LPS组IL-1β和IL-18 mRNA的表达明显增加(P < 0.01),表明LPS成功诱导细胞炎症模型。Cinacalcet显著增加LPS诱导的IL-1β和IL-18 mRNA的表达(P < 0.05);而Calhex231明显抑制此作用(P < 0.05), 表明激活CaSR产生了促炎效应。进一步研究表明:TRPC6的拮抗剂SAR7334能明显抑制cinacalcet的作用(P < 0.01)。提示CaSR/TRPC6/Ca2+信号轴可能通过增加IL-1β和IL-18 mRNA的表达,从而促进炎症反应。
| 组别 | IL-1β | IL-18 |
| 对照组 | 1.00±0.08 | 1.00±0.01 |
| LPS组 | 6 880.00±156.30a | 2.18±0.02a |
| LPS+cinacalcet组 | 7 525.00±169.80b | 2.71±0.06b |
| LPS+cinacalcet+Calhex231组 | 5 513.00±206.40c | 2.50±0.03c |
| LPS+cinacalcet+SAR7334组 | 4 571.00±76.45d | 1.48±0.01d |
| a:P < 0.01,与对照组比较; b:P < 0.05,与LPS组比较; c:P < 0.05,d:P < 0.01,与LPS+cinacalcet组比较 |
||
2.6 CaSR/TRPC6/Ca2+信号轴调节IL-1β蛋白分泌
使用ELISA检测IL-1β蛋白含量(图 5)。在RAW264.7细胞中,cincacalcet促进IL-1β蛋白分泌(P < 0.05),而CaSR的抑制剂Calhax231和TRPC6的抑制剂SAR7334都能抑制此作用(P < 0.05)。表明CaSR/TRPC6/Ca2+信号轴促进了IL-1β蛋白的分泌。

|
| 1:对照组;2:LPS组;3:LPS+cinacalcet组;4:LPS+cinacalcet+calhex231组;5:LPS+cinacalcet+SAR7334组;a: P < 0.05 图 5 ELISA检测CaSR对RAW264.7细胞IL-1β蛋白分泌的影响 |
3 讨论
炎症性疾病是存在于人类生命活动中的普遍性疾病, 给人体的生命健康带来严重危害, 目前受到人们越来越多的关注[21]。而炎症性疾病的病因复杂,发病机制仍不清楚。已被证明巨噬细胞中CaSR可通过磷脂酶C(PLC)-三磷酸肌醇受体(IP3R)-Ca2+促进炎症小体激活[14]。但胞内Ca2+是如何增加的,有待进一步探讨。本研究聚焦于CaSR激活后对巨噬细胞Ca2+信号的调控作用,结果显示:①在RAW264.7细胞中激活CaSR可引起胞内Ca2+信号升高;②在不同溶液中测定Ca2+,发现RAW264.7胞内Ca2+增加以外Ca2+内流为主;③通过药理学筛选,发现抑制TRPC6通道后,CaSR激活引起的Ca2+信号显著降低;④通过q-PCR及ELISA检测,发现在RAW264.7中抑制TRPC6能够降低CaSR介导的炎症因子分泌。综上所述,巨噬细胞CaSR通过TRPC6/ Ca2+信号轴促进了炎症因子的分泌,参与了其介导的炎症反应。
已知细胞内Ca2+信号在免疫调节过程中发挥重要调节作用。在巨噬细胞中,细胞内Ca2+作为第二信使,对于激活巨噬细胞至关重要,如吞噬体溶酶体融合、激活细胞激酶和磷酸酶、转录控制等[22]。CaSR通过Gα-磷脂酰肌醇3激酶(PI3K)和磷脂酶C(PLC)发出胞饮吞噬信号,从而感知细胞外Ca2+、招募因子及驱动肌动蛋白,从而产生了胞饮作用[23]。CaSR/NLRP3炎症小体通过PLC-肌醇三磷酸(IP3)途径发挥重要作用,以促进大鼠心梗后心肌重塑[24]。CaSR在分化的THP-1细胞中功能性表达,并且激活CaSR通过Gq-PLC-IP3途径促进细胞内Ca2+增加,并参与细胞因子的分泌[25]。本研究也证实CaSR可以触发RAW264.7细胞内Ca2+信号。结果提示激活CaSR可能通过Ca2+信号引起巨噬细胞的活化,从而产生促炎反应。因此,本研究后续实验对CaSR- Ca2+促进巨噬细胞炎症反应的机制进行了初步探讨。
CaSR是GPCR超家族的一员。已证明GPCR在功能上调节离子通道并有助于微调神经传递。GPCR超家族的信号通路可在TRP通道上汇聚,导致通道活性或表达的改变,从而放大疼痛、瘙痒、咳嗽和神经源性炎症[26]。本课题组前期研究发现,CaSR通过与TRPV4偶联产生Ca2+信号促进人胃癌的生长和转移[20]。然而,巨噬细胞中CaSR是否通过TRP通道促进炎症的进展,目前尚不清楚。本研究结果发现:在RAW264.7细胞中激活CaSR可以促进炎症因子IL-1β和IL-18的表达,进一步证实了CaSR的激活通过细胞内Ca2+信号促进细胞炎症。特异性阻断TRPC6则显著抑制了CaSR激动所引起的IL-1β和IL-18升高,证实了CaSR产生的促炎反应与TRPC6/ Ca2+信号之间的密切关系。既往文献报道:在肾脏的远曲小管和连接小管腔膜上,激活CaSR通过PMA不敏感的PKC途径刺激TRPV5介导Ca2+流入[27]。本课题组在人主动脉平滑肌细胞中发现,CaSR可通过PLC/PKCε调节TRPC6编码的受体操作通道(ROC),最终介导Ca2+进入细胞内部[16]。在RAW264.7细胞中,CaSR与TRPC6分子水平上的相互调控应该也是通过PLC/PKC来实现的。
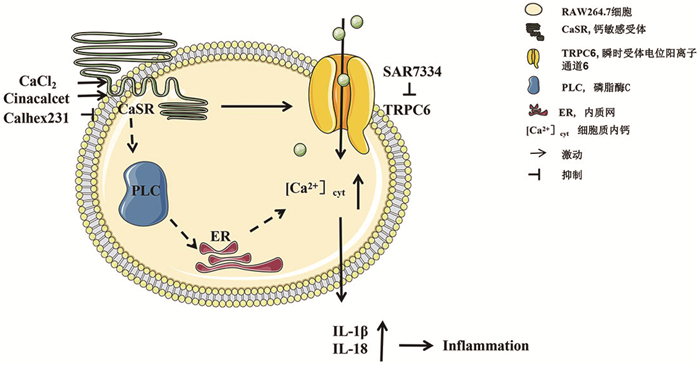
综上所述,本研究以RAW264.7为细胞模型,发现激活CaSR能够通过TRPC6通道增加细胞内Ca2+信号,进而增加炎症因子的表达,最终促进了巨噬细胞介导的炎症反应(图 6)。CaSR/TRPC6/Ca2+信号轴在调控巨噬细胞炎症反应中的发现,为临床炎症性疾病的防治提供了新的研究思路。
|
| 图 6 CaSR通过TRPC6增加细胞内Ca2+信号促进炎症反应 |
| [1] |
WYNN T A, CHAWLA A, POLLARD J W. Macrophage biology in development, homeostasis and disease[J]. Nature, 2013, 496(7446): 445-455. |
| [2] |
MOYANO A, FERRESSINI GERPE N M, DE MATTEO E, et al. M1 macrophage polarization prevails in EBV infected children in an immuneregulatory environment[J]. J Virol, 2021, 2021Oct13;JVI0143421. |
| [3] |
MURRAY P J, WYNN T A. Protective and pathogenic functions of macrophage subsets[J]. Nat Rev Immunol, 2011, 11(11): 723-737. |
| [4] |
CHEN T L, WANG Y, NAN Z D, et al. Interaction between macrophage extracellular traps and colon cancer cells promotes colon cancer invasion and correlates with unfavorable prognosis[J]. Front Immunol, 2021, 12: 779325. |
| [5] |
JÄGER E, MURTHY S, SCHMIDT C, et al. Calcium-sensing receptor-mediated NLRP3 inflammasome response to calciprotein particles drives inflammation in rheumatoid arthritis[J]. Nat Commun, 2020, 11(1): 4243. |
| [6] |
ARTYOMOV M N, SERGUSHICHEV A, SCHILLING J D. Integrating immunometabolism and macrophage diversity[J]. Semin Immunol, 2016, 28(5): 417-424. |
| [7] |
BROWN E M. Role of the calcium-sensing receptor in extracellular calcium homeostasis[J]. Best Pract Res Clin Endocrinol Metab, 2013, 27(3): 333-343. |
| [8] |
HANNAN F, KALLAY E, CHANG W H, et al. The calcium-sensing receptor in physiology and in calcitropic and noncalcitropic diseases[J]. Nat Rev Endocrinol, 2018, 15: 33-51. |
| [9] |
TENNAKOON S, AGGARWAL A, KÁLLAY E. The calcium-sensing receptor and the hallmarks of cancer[J]. Biochim Biophys Acta, 2016, 1863(6 Pt B): 1398-1407. |
| [10] |
IAMARTINO L, ELAJNAF T, KALLAY E, et al. Calcium-sensing receptor in colorectal inflammation and cancer: current insights and future perspectives[J]. World J Gastroenterol, 2018, 24(36): 4119-4131. |
| [11] |
YAROVA P L, STEWART A L, SATHISH V, et al. Calcium-sensing receptor antagonists abrogate airway hyperresponsiveness and inflammation in allergic asthma[J]. Sci Transl Med, 2015, 7(284): 284ra60. |
| [12] |
LEE J W, PARK H A, KWON O K, et al. NPS 2143, a selective calcium-sensing receptor antagonist inhibits lipopolysaccharide-induced pulmonary inflammation[J]. Mol Immunol, 2017, 90: 150-157. |
| [13] |
LIU W X, SUN J X, GUO Y T, et al. Calhex231 ameliorates myocardial fibrosis post myocardial infarction in rats through the autophagy-NLRP3 inflammasome pathway in macrophages[J]. J Cell Mol Med, 2020, 24(22): 13440-13453. |
| [14] |
LEE G S, SUBRAMANIAN N, KIM A I, et al. The calcium-sensing receptor regulates the NLRP3 inflammasome through Ca2+ and cAMP[J]. Nature, 2012, 492(7427): 123-127. |
| [15] |
DIETRICH A, SCHNITZLER M M Y, GOLLASCH M, et al. Increased vascular smooth muscle contractility in TRPC6-/- mice[J]. Mol Cell Biol, 2005, 25(16): 6980-6989. |
| [16] |
CHOW J Y C, ESTREMA C, ORNELES T, et al. Calcium-sensing receptor modulates extracellular Ca(2+) entry via TRPC-encoded receptor-operated channels in human aortic smooth muscle cells[J]. Am J Physiol Cell Physiol, 2011, 301(2): C461-C468. |
| [17] |
RIEHLE M, BVSCHER A K, GOHLKE B O, et al. TRPC6 G757D loss-of-function mutation associates with FSGS[J]. J Am Soc Nephrol, 2016, 27(9): 2771-2783. |
| [18] |
WU Q Y, SUN M R, WU C L, et al. Activation of calcium-sensing receptor increases TRPC3/6 expression in T lymphocyte in sepsis[J]. Mol Immunol, 2015, 64(1): 18-25. |
| [19] |
PARENTI A, DE LOGU F, GEPPETTI P, et al. What is the evidence for the role of TRP channels in inflammatory and immune cells?[J]. Br J Pharmacol, 2016, 173(6): 953-969. |
| [20] |
XIE R, XU J Y, XIAO Y F, et al. Calcium promotes human gastric cancer via a novel coupling of calcium-sensing receptor and TRPV4 channel[J]. Cancer Res, 2017, 77(23): 6499-6512. |
| [21] |
GUAN Q D, XIAO C, ZHANG M G. Immune regulatory cells in inflammation, infection, tumor, metabolism, and other diseases 2019[J]. Mediat Inflamm, 2019, 2019: 3182198. |
| [22] |
YE Y X, HUANG X Y, ZHANG Y X, et al. Calcium influx blocked by SK & F 96365 modulates the LPS plus IFN-γ-induced inflammatory response in murine peritoneal macrophages[J]. Int Immunopharmacol, 2012, 12(2): 384-393. |
| [23] |
CANTON J, SCHLAM D, BREUER C, et al. Calcium-sensing receptors signal constitutive macropinocytosis and facilitate the uptake of NOD2 ligands in macrophages[J]. Nat Commun, 2016, 7: 11284. |
| [24] |
LIU W X, ZHANG X, ZHAO M, et al. Activation in M1 but not M2 macrophages contributes to cardiac remodeling after myocardial infarction in rats: a critical role of the calcium sensing receptor/NRLP3 inflammasome[J]. Cell Physiol Biochem, 2015, 35(6): 2483-2500. |
| [25] |
XI Y H, LI H Z, ZHANG W H, et al. The functional expression of calcium-sensing receptor in the differentiated THP-1 cells[J]. Mol Cell Biochem, 2010, 342(1/2): 233-240. |
| [26] |
VELDHUIS N A, POOLE D P, GRACE M, et al. The G protein-coupled receptor-transient receptor potential channel axis: molecular insights for targeting disorders of sensation and inflammation[J]. Pharmacol Rev, 2015, 67(1): 36-73. |
| [27] |
TOPALA C N, SCHOEBER J P H, SEARCHFIELD L E, et al. Activation of the Ca2+-sensing receptor stimulates the activity of the epithelial Ca2+ channel TRPV5[J]. Cell Calcium, 2009, 45(4): 331-339. |




