2. 030619 山西 晋中,晋中市中医院风湿免疫科
2. Department of Rheumatology and Immunology, Jinzhong Hospital of Traditional Chinese Medicine, Jinzhong, Shanxi Province, 030619, China
自身免疫性肝炎(autoimmune hepatitis,AIH)是一种由肝细胞免疫介导的炎症疾病,其特征是肝实质进行性破坏和慢性纤维化,如果治疗不及时,后期会导致肝硬化,肝衰竭甚至死亡[1]。该病多发于欧美发达国家的女性当中,其发病率和流行率在当前世界范围内正在不断增加[2]。目前,AIH的确切病因及发病机制尚不完全明确,皮质类固醇和细胞抑制药物为主的传统治疗手段导致的高复发率等副作用,让AIH的诊断和治疗仍面临巨大挑战[2-3]。丹参酮ⅡA(tanshinoneⅡA,TanⅡA)是从中药丹参提取的主要亲脂性化合物之一,具有多种药理作用。它主要通过抗炎、抗氧化、抗凋亡等作用来保护肝细胞,还能够通过抑制部分炎症信号通路,减轻肝脏的损伤[4],对多种肝脏疾病都表现出积极的治疗效果。
近些年来生物信息学和药理学的飞速发展,推动了新兴的网络药理学形成。它基于“疾病-基因-靶标-药物”相互作用网络,通过研究药物成分,然后预测靶标,分析途径,进而对疾病进行实验验证。它全面系统地阐述了药物对疾病网络的干预和影响,揭示“多靶点,多成分”对疾病的作用机制。因此,本研究将网络药理学与实验验证相结合,构建一个完整的系统网络来对TanⅡA治疗AIH的作用机制进行探讨,为临床上应用TanⅡA治疗AIH提供依据。
1 材料与方法 1.1 TanⅡA靶点的收集通过Tcmsp中药系统药理数据库(http://tcmspw.com/tcmsp.php),Genecards数据库(https://www.genecards.org/),Stitch数据库(http://stitch.embl.de/),Swiss Target Prediction数据库(http://swisstargetprediction.ch/)进行检索,收集TanⅡA中所包含的靶点,并将这些靶点信息通过Uniprot网站(http://www.uniprot.org/)进行标准化转换,得到目标基因名称。
1.2 AIH的基因检索利用Omim数据库(https://www.omim.org/),GeneCards数据库(https://www.genecards.org/)和DisGeNET数据库(http://www.disgenet.org/),选取“autoimmune hepatitis”为关键词进行检索,将3个数据库中符合疾病的基因汇总,去除其中的重复靶点,筛选得到最终AIH的相关靶点基因。
1.3 AIH和TanⅡA交集基因的收集以及PPI网络构建绘制Venn图,将TanⅡA与AIH的相关靶点基因进行比对,取交集部分为TanⅡA治疗AIH的靶点基因。将收集的交集基因靶点信息输入到String线上数据库(https://String-db.org/),选择物种为“Homo sapiens”,最高置信度设置为0.9,隐藏PPI网络中游离的靶标基因,导出tsv相关信息文件,运用Cytoscape 3.7.2软件将文件转化为PPI网络图。
1.4 KEGG通路和GO富集分析将最终选出的TanⅡA治疗AIH的共有基因靶点,结合R语言,进行京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集和基因本体论(Gene Ontology,GO)富集分析。将校正P值≤0.05的项目进行筛选,根据富集基因的校正P值来排序,选取排名在前的相关信号通路,使用R 3.6.3软件,安装利用相关R包,绘制柱状图和气泡图。
1.5 实验动物及主要试剂 1.5.1 实验动物鼠龄9~10周的雌性SPF级C57BL/6小鼠18只,体质量为(20±2)g,购自北京维通利华实验动物技术有限公司,动物许可证编号为SCXK(京)2016-0006。将小鼠按随机数字表法分为正常组、模型组和TanⅡA治疗组,每组6只。小鼠常规饲养,摄食自由,饲养环境适宜。
1.5.2 主要实验试剂TanⅡA、ConA(索莱宝有限公司,中国北京);谷丙转氨酶测试盒、谷草转氨酶测试盒(建城生物研究所,中国南京);PI3K、AKT和NF-κB抗体(博士德生物有限公司,中国武汉);引物序列见表 1。
| 引物名称 | 引物(5′→3′) | 产物长度/bp |
| PI3K | 上游:GCTTAACACAGAAGAAACCGTGA | 71 |
| 下游:TACACAGGAGCTCGGTTCCA | ||
| AKT | 上游:ACTCATTCCAGACCCACGAC | 176 |
| 下游:CCGGTACACCACGTTCTTCT | ||
| NF-κB | 上游:TCCCCCCAGAGACCTCATAGT | 135 |
| 下游:TGGAAATTCCTGATCCCGAC | ||
| β-actin | 上游:CCCATCTATGAGGGTTACGC | 150 |
| 下游:TTTAATGTCACGCACGATTTC |
1.6 实验方法 1.6.1 AIH小鼠的模型建立及分组处理
正常组常规饲养;模型组常规饲养1周后,按15 mg/kg剂量给予尾静脉注射Con A;Tan ⅡA治疗组按照30 mg/kg剂量先腹腔预防性注射Tan ⅡA,1周后按15 mg/kg剂量给予尾静脉注射Con A。各组小鼠于造模8 h后,先通过眶内取血收集各组小鼠静脉血并制备血清,后处死全部小鼠,取出肝脏组织,经液氮速冻后迅速转移至-80 ℃冰箱以保存备用。
1.6.2 肝组织病理学检测取部分小鼠肝组织,OCT包埋后用冰冻切片机切片,片厚为5 μm,泡入丙酮约20 min进行固定,最后进行常规苏木精-伊红(HE)染色,在光学显微镜下观察各实验组小鼠肝脏病理学改变。
1.6.3 血清学指标检测麻醉小鼠后,采用眼球取血的方法,每只小鼠取血1 mL左右,室温条件下静置30 min后分离血清根据试剂盒说明书进行检测,通过酶标仪测定各实验组小鼠血清中谷草转氨酶(aspartate aminotransferase,AST)和谷丙转氨酶(alanine aminotransferase,ALT)水平。
1.6.4 肝组织荧光定量PCR技术检测取各实验组小鼠肝组织各50 mg,提取总RNA。根据反转录试剂盒说明书要求,将相关试剂与10 μL总RNA均匀混合,进行反转录。反应条件:37 ℃×15 min,1个循环;85 ℃×5 s,1个循环。然后用Real-time PCR试剂盒相关试剂与2 μL反转录产物混合均匀,进行PCR扩增,反应条件为:95 ℃×30 s,1次循环;95 ℃×5 s,60 ℃×34 s,40个循环。最后根据Real-time PCR原始检测结果,采用2-△△Ct相对定量公式计算并分析所得PCR结果。
1.6.5 Western blot检测肝组织蛋白水平先提取肝组织总蛋白,并测定总蛋白浓度。后配10%胶后加入蛋白样品15 μL跑电泳,用湿转法转运蛋白至PVDF膜,2 h后封闭,加一抗4 ℃孵育过夜;第2天TBST洗膜,羊抗兔IgG-HRP二抗(浓度1 ∶500)摇床孵育1 h;TBST洗膜3×10 min后滴加显影剂进行扫描显影,利用ImageJ软件分析结果。
1.7 统计学分析实验数据连续性资料以x±s表示,应用GraphPad Prism 8统计软件分析处理数据,两样本均数比较采用t检验,多组间比较采用方差分析,检验水准α=0.05。
2 结果 2.1 TanⅡA和AIH靶点信息的收集基于Tcmsp数据库收集到TanⅡA中所包含的靶点37个,Genecards数据库收集到134个,Stitchi数据库收集到8个,Swiss Target Prediction数据库收集到47个,通过Uniprot信息匹配并去除重复成分后,最终预测TanⅡA有效作用靶点为208个;将Omim、Genecards和DisGeNET 3个数据库中检索到的AIH疾病相关基因汇总并去重,共收集到AIH的相关基因7 128个。
2.2 TanⅡA和AIH共同靶点基因的收集通过在线Venn图设计网站(http://bioinfogp.cnb.Csic.es/tools/venny/)对TanⅡA和AIH共同靶点基因分析制图,共得到174个交集基因靶点(图 1)。将交集基因靶点输入在String数据库,把生成的含有节点信息的TSV文件通过Cytoscape软件构建靶点的PPI网络,其中包括节点149个,边线755条(在String数据库中设置最高置信度为0.9,并隐藏无关联的节点,所以25个交集靶标基因未参与网络构建)。图中线条的粗细代表综合得分(combined scoer),线条越粗颜色越深(颜色由浅蓝到深红逐步加深),表示靶点间的相互作用越紧密。节点的大小代表自由度,节点越大颜色越深,表示其在网络中的作用越重要,见图 2。
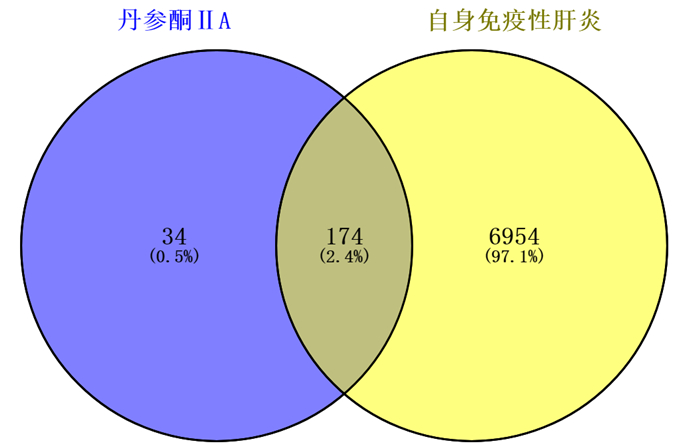
|
| 图 1 TanⅡA和AIH共同靶点Venn图 |
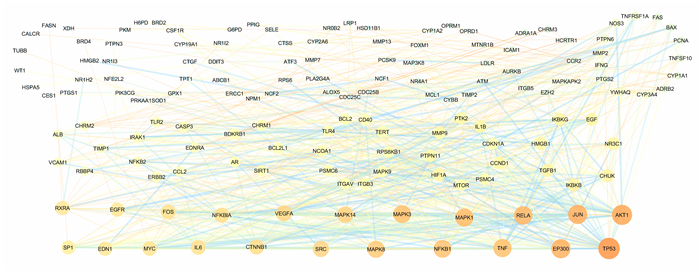
|
| 图 2 TanⅡA和AIH共同靶点基因PPI网络图 |
2.3 GO富集分析结果
将药物疾病共有靶点进行GO的生物过程(biological process,BP)、细胞组分(cell component,CC)和分子功能(molecular function,MF)富集分析,引用String数据库,将校正P≤0.05的项目进行筛选,总共富集到2 559条生物过程,174项分子功能相关,97项细胞组成相关。使用R 3.6.3软件,进行条形图和气泡图绘制(图 3)。分析结果显示,TanⅡA-AIH基因参与的生物学过程变化主要包括活性氧代谢过程、对氧化应激的反应、对脂多糖的反应等;这些靶点发生在膜筏、小窝、质膜筏等细胞组分间;同时这些靶点与类固醇激素受体活性、DNA结合转录激活因子活性等分子功能关系密切。
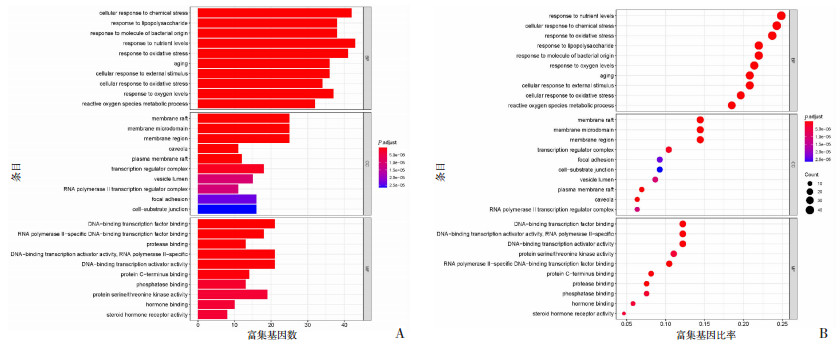
|
| A:GO富集分析条形图;B:GO富集分析气泡图 图 3 GO富集分析结果 |
2.4 KEGG通路富集分析结果
将TanⅡA和AIH共同靶点基因进行KEGG通路富集分析,引用String数据库,将校正P≤0.05的项目进行筛选,总共富集到157条信号通路。使用R 3.6.3,安装并引用clusterProfiler包后,进行条形图和气泡图绘制(图 4)。图中气泡的颜色从蓝到红反映P值逐步减小,其显著性越强。气泡从小到大表示富集到的基因数目逐步增加。分析结果表明这些靶点主要涉及的信号通路有肿瘤坏死因子(TNF)信号通路、磷脂酰肌醇三激酶-蛋白激酶B(PI3K-AKT)信号通路、IL-17信号通路、细胞凋亡和缺氧诱导因子1信号通路等,同时与恰加斯病(Chagas disease)、乙型肝炎等疾病信号密切相关。反映出TanⅡA通过多途径,多靶点治疗AIH的作用特点。
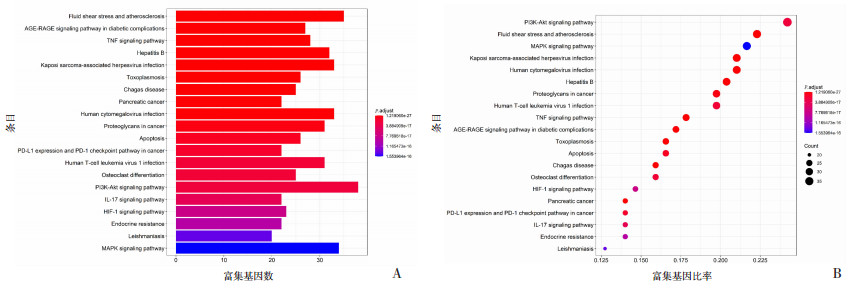
|
| A:KEGG分析条形图;B:KEGG分析气泡图 图 4 KEGG信号通路分析结果 |
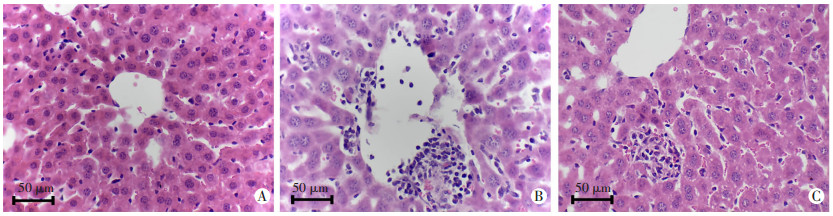
2.5 小鼠肝脏组织HE染色
正常组小鼠肝小叶结构清晰,汇管区无炎症浸润;模型组小鼠出现炎症细胞浸润,肝细胞大量坏死,血管充血和扩张以及肝窦结构紊乱;与模型组比较,TanⅡA治疗组显示出不同程度的肝损伤减轻和炎细胞浸润减少(图 5)。
|
| A:正常组;B:模型组;C:TanⅡA治疗组 图 5 HE染色观察小鼠肝组织病理学变化 |
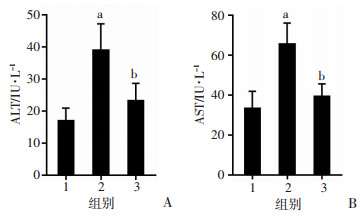
2.6 小鼠血清ALT、AST的含量变化
与正常组比较,模型组小鼠血清中ALT、AST水平均明显升高(P<0.05);与模型组比较,TanⅡA治疗组小鼠血清ALT、AST水平均显示出不同程度减低(P<0.05,图 6)。
|
| 1: 正常组;2:模型组;3:TanⅡA治疗组;a:P<0.05,与正常组比较;b:P<0.05,与模型组比较 图 6 小鼠血清ALT、AST的含量变化 |
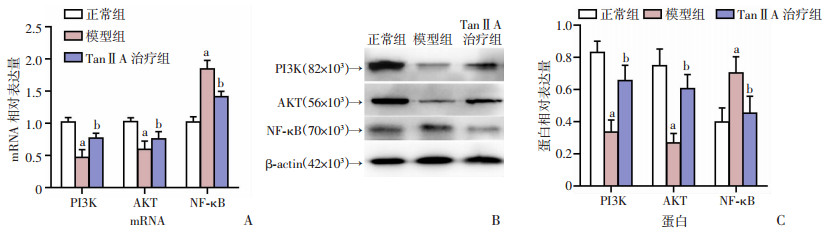
2.7 小鼠肝组织mRNA和蛋白的表达变化
qRT-PCR检测结果显示:与正常组比较,模型组小鼠肝组织PI3K和AKT mRNA水平降低(P<0.05),NF-κB水平显著升高(P<0.05);与模型组比较,TanⅡA治疗组小鼠肝组织PI3K、AKT mRNA水平显著升高,NF-κB mRNA水平降低显著(P<0.05,图 7A)。
|
| A:PI3K、AKT和NF-κB mRNA的相对表达水平;B:PI3K、AKT和NF-κB蛋白的表达;C:PI3K、AKT和NF-κB蛋白的表达水平a:P<0.05,与正常组比较;b:P<0.05,与模型组比较 图 7 小鼠肝组织mRNA及蛋白的表达变化 |
Western blot检测结果显示:与正常组比较,模型组小鼠肝组织PI3K和AKT蛋白水平显著降低,NF-κB (p65)蛋白水平显著升高(P<0.05);与模型组比较,TanⅡA治疗组小鼠肝组织PI3K和AKT蛋白水平显著升高,NF-κB(p65)蛋白水平显著降低(P<0.05,图 7B、C)。
3 讨论AIH是由自身免疫反应介导的慢性进行性肝脏实质炎症,与T淋巴细胞的增殖活化密切相关。其特征表现为界面性肝炎、高ALT、AST和免疫球蛋白G(IgG)水平以及自身抗体的存在[5]。该病主要影响女性,常见于在欧美发达国家,当前中国国内关于AIH的相关研究也明显增多[2]。AIH的确切发病机制目前仍不清楚,但是遗传易感性,分子模拟机制等因素诱导自身免疫平衡状态的破坏,进而导致的肝脏损伤被认为与该病的发生、发展密切相关[1-2]。AIH的治疗原则主要是抑制异常的自身免疫反应,临床上以类固醇疗法为主,但是长时间用药也会产生骨质疏松症、糖尿病等副作用[3]。因此,今后研究新的药物并优化改良AIH的治疗策略是十分有必要的。
丹参是一种传统中药,具有促进血液循环、祛瘀消肿等作用,并且可以通过抗氧化作用和改善微循环来保护肝脏,用于多种肝脏疾病的预防和治疗[6]。Tan ⅡA是从丹参的根部提取的主要亲脂性成分之一,具有多种药理作用,例如抗炎、抗氧化和抗血小板凝聚等作用。有研究表明Tan ⅡA可诱导肝星状细胞凋亡,从而减少肝纤维化的水平[4]。此外,TanⅡA还可以通过抑制Kupffer细胞中NF-κB信号传导,降低TNF-α、IL-6等促炎细胞因子的释放,减轻了肝炎的发生,有效保护肝脏[7]。网络药理学是一种结合系统网络分析和药理学的新颖方法,可以在短时间内以高通量的方式系统了解药物对疾病的影响,了解药物与疾病之间的相互作用机制。本实验首先采用网络药理学的方法筛选其成分,从TanⅡA中筛选得出有效作用靶点208个,收集到AIH有关的靶点基因7 128个,两者共得到174个交集基因靶点。GO富集分析结果显示,TanⅡA-AIH基因主要参与活性氧代谢、对氧化应激的反应等生物学过程;KEGG通路分析提示多条信号通路参与AIH的发病,其中PI3K-AKT信号通路可能在TanⅡA治疗AIH中起重要作用。这些分析结果初步阐释了TanⅡA治疗AIH的可能作用机制,为后期进一步的实验研究提供了基础。
Con A是一种促进细胞分化的植物凝集素,主要通过激活T细胞的有丝分裂原,活化T淋巴细胞而诱发急性免疫性肝损伤,它通过模拟人类急性AIH的病理生理过程,被广泛用于研究AIH的致病机制[8]。因此本实验通过小鼠尾静脉注射Con A,建立了AIH模型,并通过多个实验对网络药理学筛选的信号通路的进行验证[9]。ALT和AST都是肝细胞损害的标志,会在肝细胞死亡后释放到血液中,帮助判断肝损伤程度。本实验结果显示,注射Con A后,模型组的ALT和AST水平明显升高,光学显微镜下观察模型组小鼠肝组织,可见肝细胞坏死肿胀,并伴有大量淋巴细胞浸润及多处片状坏死区域,均提示该模型的成功建立。PI3K-AKT信号转导通路的机制靶点可促进细胞生长、增殖、分化和侵袭,在抗凋亡、免疫调节中也起关键作用。有多项研究表明,黄芪甲苷、郁金散、丹酚酸等药物对CCl 4诱导的肝硬化具有保护作用,其机制可能与抑制PI3K-AKT信号通路有密切关系[10-12]。PI3K能够上调抗炎细胞因子,抑制促炎细胞因子的表达,抑制肝细胞的炎症反应,抑制肝星状细胞的增殖和侵袭。PI3K激活后会进一步激活AKT,导致其磷酸化并从细胞质转移到细胞膜,引起一系列与细胞凋亡相关的细胞因子变化。同时下游途径的NF-κB也被激活,促进炎症因子的大量产生,进一步加重了炎症反应。因此,本研究造模后,模型组小鼠肝组织PI3K、AKT mRNA和蛋白水平显著降低,NF-κB mRNA和蛋白水平升高明显。目前,有越来越多的研究证明了丹参酮会通过影响PI3K-AKT对多种免疫性疾病和肝脏炎性病证有很好的治疗效果。在许多肝脏疾病中,氧化应激相关的炎症和细胞凋亡是重要的致病成分,最终会导致急性肝功能衰竭。曹慧敏等[13]发现,TanⅡA可能通过调控PI3K-AKT信号通路促进自噬,对氧化低密度脂蛋白诱导的EA. Hy926细胞氧化应激损伤起到保护作用,帮助动脉粥样硬化的治愈。同样的,姜黄素治疗会抑制PI3K-AKT信号的传导和细胞凋亡,减轻LPS诱导的肝损伤[14]。GONG等[15]研究结果证实,大黄蛰虫丸可以通过灭活PI3K-AKT通路在动物模型中发挥抗纤维化作用,从而保护大鼠免受肝损伤。此外,TanⅡA可能通过调节PI3K-AKT-mTOR信号通路提高高脂血症大鼠肝脏自噬水平, 有效降低肝脏脂质沉积,并且通过激活PI3K-AKT信号通路可以抑制受压脊髓组织中的细胞凋亡,帮助缓解脊髓压迫大鼠模型的脊髓损伤[16-17]。本实验结果显示,相比于模型组,治疗组小鼠肝组织PI3K、AKT蛋白和mRNA表达升高,炎症激活因子NF-κB蛋白和mRNA表达下降,TanⅡA可能通过上调PI3K、AKT,抑制NF-κB的激活进而保护肝脏。
目前为止,TanⅡA的研究多集中在自身免疫性脑脊髓炎或者类风湿关节炎等免疫性疾病中,TanⅡA对AIH治疗作用的相关研究很少。本研究基于网络药理学方法分析了TanⅡA治疗AIH的潜在靶点与通路之间关系,并通过动物实验验证TanⅡA可能通过调节PI3K-AKT信号通路改善AIH小鼠肝脏炎症反应,对于今后进一步研究AIH的发病机制具有重要的意义。但是TanⅡA对AIH的治疗机制极为复杂,由于时间及技术有限,部分实验结果未在人体组织上验证,未来我们将补充完成人体相关实验,从而体现实验上的一致性,更加深入了解TanⅡA对AIH患者的临床疗效及其预后影响。
综上所述,TanⅡA可能通过影响PI3K-AKT信号通路进而调节炎症反应减轻Con A诱导的小鼠急性肝损伤。网络药理学与基础研究方法的有效结合也将为AIH发病机制相关的研究提供坚实的基础,促进中西医结合治疗AIH的进步。
| [1] |
PAPE S, SCHRAMM C, GEVERS T J. Clinical management of autoimmune hepatitis[J]. United Eur Gastroent, 2019, 7(9): 1156-1163. |
| [2] |
SUCHER E, SUCHER R, GRADISTANAC T, et al. Autoimmune hepatitis-immunologically triggered liver pathogenesis-diagnostic and therapeutic strategies[J]. J Immunol Res, 2019, 2019: 9437043. |
| [3] |
DALEKOS G N, KOSKINAS J, PAPATHEODORIDIS G V. Hellenic association for the study of the liver clinical practice guidelines: Autoimmune hepatitis[J]. Ann Gastroenterol, 2019, 32(1): 1-23. |
| [4] |
LIU Y W, HUANG Y T. Inhibitory effect of tanshinone ⅡA on rat hepatic stellate cells[J]. PLoS One, 2014, 9(7): e103229. |
| [5] |
THAN N N, JEFFERY H C, OO Y H. Autoimmune hepatitis: progress from global immunosuppression to personalised regulatory T cell therapy[J]. Can J Gastroenterol Hepatol, 2016, 2016: 7181685. |
| [6] |
SHI M J, DONG B S, YANG W N, et al. Preventive and therapeutic role of Tanshinone ⅡA in hepatology[J]. Biomed Pharmacother, 2019, 112: 108676. |
| [7] |
YUE S Q, HU B, WANG Z P, et al. Salvia miltiorrhiza compounds protect the liver from acute injury by regulation of p38 and NFκB signaling in Kupffer cells[J]. Pharm Biol, 2014, 52(10): 1278-1285. |
| [8] |
WANGH X, LIU M, WENG S Y, et al. Immune mechanisms of concanavalin A model of autoimmune hepatitis[J]. World J Gastroenterol, 2012, 18(2): 119-125. |
| [9] |
郝健亨, 陈浩, 高艳, 等. 柴胡皂苷d对自身免疫性肝炎小鼠差异表达基因CTLA-4、IL-10和IL-17的影响[J]. 上海交通大学学报(医学版), 2020, 40(3): 303-309. HAO J H, CHEN H, GAO Y, et al. Effects of Saikosaponin d on differentially expressed genes CTLA-4, IL-10 and IL-17 in mice with autoimmune hepatitis[J]. J Shanghai Jiaotong Univ Med Sci, 2020, 40(3): 303-309. |
| [10] |
WEI R D, LIU H D, CHEN R, et al. Astragaloside Ⅳ combating liver cirrhosis through the PI3K/Akt/mTOR signaling pathway[J]. Exp Ther Med, 2019, 17(1): 393-397. |
| [11] |
WU W, PIAO H Y, WU F S, et al. Yu Jin pulvis inhibits carbon tetrachloride-induced liver fibrosis by blocking the MAPK and PI3K/Akt signaling pathways[J]. Am J Transl Res, 2019, 11(9): 5998-6006. |
| [12] |
WANG R, SONG F X, LI S N, et al. Salvianolic acid A attenuates CCl 4-induced liver fibrosis by regulating the PI3K/AKT/mTOR, Bcl-2/Bax and caspase-3/cleaved caspase-3 signaling pathways[J]. Drug Des Devel Ther, 2019, 13: 1889-1900. |
| [13] |
曹慧敏, 宋囡, 张妮, 等. 丹参酮ⅡA通过PI3K/Akt/mTOR信号通路调控自噬抗内皮细胞氧化应激损伤研究[J]. 北京中医药大学学报, 2017, 40(11): 933-939. CAO H M, SONG N, ZHANG N, et al. Regulation on autophagy with tanshinone ⅡA for anti-oxidative stress damage of endothelial cells through PI3K/Akt/mTOR pathway[J]. J Beijing Univ Tradit Chin Med, 2017, 40(11): 933-939. |
| [14] |
ZHONG W H, QIAN K J, XIONG J B, et al. Curcumin alleviates lipopolysaccharide induced Sepsis and liver failure by suppression of oxidative stress-related inflammation via PI3K/AKT and NF-κB related signaling[J]. Biomed Pharmacother, 2016, 83: 302-313. |
| [15] |
GONG Z H, LIN J Y, ZHENG J, et al. Dahuang Zhechong pill attenuates CCl4-induced rat liver fibrosis via the PI3K-Akt signaling pathway[J]. J Cell Biochem, 2020, 121(2): 1431-1440. |
| [16] |
高云飞, 杨国元, 贾连群, 等. 丹参酮ⅡA调控PI3K/Akt/mTOR通路对高脂血症大鼠肝脏自噬的影响[J]. 中华中医药学刊, 2017, 35(12): 3051-3054. GAO Y F, YANG G Y, JIA L Q, et al. Effect of tanshinone ⅡA on hyperlipidemia rats' liver autophagy through regulating PI3K/Akt/mtor signaling pathway[J]. Chin Arch Tradit Chin Med, 2017, 35(12): 3051-3054. |
| [17] |
刘伟, 赵宝辉, 王建忠, 等. 丹参酮ⅡA通过PI3K/AKT信号通路调节脊髓神经元凋亡的实验研究[J]. 中华骨科杂志, 2019, 39(10): 622-629. LIU W, ZHAO B H, WANG J Z, et al. Experimental study on effect of tanshinone ⅡA in spinal cord compression through PI3K/AKT signaling pathway[J]. Chin J Orthop, 2019, 39(10): 622-629. |




