2. 400042 重庆,陆军特色医学中心血液科
2. Department of Haematology, Army Medical Center of PLA, Chongqing, 400042, China
高原地区是我国国防安全和经济建设的重要战略阵地,世居平原人员在高原缺氧环境下进行长期作业,除了会诱发高原肺水肿、高原脑水肿等疾病外,还可使自发性血管栓塞的发生率增加30倍[1],严重危害健康。近年来,国内外的相关研究发现,高原地区的特殊环境能够影响平原移居人群的凝血功能,出现高凝和纤溶抑制状态[1],但是相关凝血异常激活的机制尚未达成共识。凝血功能异常与血小板的数量和功能异常密切相关,研究发现,高原地区平原移居人群出现血小板数量增减的结果并不一致[2-4],但多数研究支持血小板数量出现显著降低,提示导致血栓性疾病剧增的重要因素并非血小板数量,而是其功能的紊乱。现有研究结果普遍认为,CD62p等表达异常增高可以说明血小板功能激活[5],但目前相关研究多集中在效应指标的观察,对其变化产生的机制尚缺乏深入的探索。
表达于免疫细胞的唾液酸结合性Ig样凝集素(sialic-acid-binding immunoglobulin-like lectin,Siglec)是能与唾液酸末端的聚糖结构特异性结合的一类细胞膜蛋白,属于凝集素家族。既往研究证实,Siglec-9(人源,小鼠同系物为Siglec-E)主要表达于单核/巨噬细胞和中性粒细胞等,激活后通过募集SHP-1和SHP-2发挥抑制炎症反应的作用[6]。最近有研究发现,血小板表面亦有Siglec9/E表达,并参与了血小板活化杀菌反应的调控[7],考虑到血小板内SHP-1富集具有抑制血小板活性的作用[8],提示Siglec9/E极可能会抑制血小板活化。Siglec-9/E的生物学活性需要与其特异性配体结合才能激活,进而发挥生理学作用,如红细胞上Siglec-9配体能维持外周血液循环中性粒细胞“静默”[9]、人工合成的Siglec-9聚糖配体能够显著抑制免疫细胞炎症反应[10]等,所以其聚糖配体是实现效应的关键。但重度糖基化的血小板表面是否存在Siglec9/E聚糖配体尚少见报道。本课题组在前期对多种细胞上Siglec9/E聚糖配体生物学活性及表达调控的研究基础上[11-12],对血小板表面是否存在Siglec9/E配体及配体是否参与血小板活化调控,以及缺氧是否对该聚糖配体的表达产生影响进而诱发血小板异常活化进行探索,为高原缺氧导致血栓性疾病的防治提供新的干预靶点。
1 材料与方法 1.1 试剂与仪器改良台式液、抗荧光猝灭封片剂购自索莱宝公司;CGS缓冲液购自源叶生物;RIPA裂解液、BCA试剂盒购自碧云天公司;anti-CD41-FITC、anti-human IgG Fc-PE、anti-CD62P-PE荧光抗体购自Biolegend公司(美国);anti-Siglec-E-APC、anti-Siglec-9-APC、重组Human Siglec-9 Fc蛋白、重组Mouse Siglec-E Fc蛋白、Human Polypeptide GalNac Transferase2 antibody、Sheep IgG HRP antibody购自R&D公司(美国);ST3GAL3 antibody购自Abcam公司(美国);GALE(C-4)antibody购自Santa Cruz Biotechnology(美国);胶原购自Chrono-Log公司(美国);ADP购自MCE公司(美国);凝血酶购自罗氏公司(德国);唾液酸神经节甘脂(Ganglioside GT1b, GT1b)购自Millipore公司(德国);α2-3, 6, 8唾液酸酶购自New England BioLabs(美国);奥司他韦购自MCE公司(美国);流式细胞仪型号为BD AccruiTM C6(美国)。
1.2 实验动物本研究符合陆军军医大学实验动物福利伦理审查委员会制定的伦理学标准(AMUWE20210936)。24只6~8周龄雄性C57BL/6小鼠,购自湖南斯莱克景达实验动物有限公司,动物生产许可证号为SCXK(湘)20190004,使用单位许可证号SYXK(渝)20170002。6只6~8周龄雄性Siglec-E基因敲除小鼠(Lyz2-cre:Siglec-Eflox/flox)购自江苏赛业模式生物研究中心有限公司,生产许可证为SCXK(苏)20180003,使用单位许可证号SYXK(渝)20170002。所有小鼠于陆军军医大学药剂学教研室动物房饲养,饲养环境温度为(22±1)℃,湿度为50%~60%,昼夜交替时间为12 h/12 h。
1.3 实验方法 1.3.1 人血小板分离及处理取健康志愿者全血10 mL,标本取材经陆军特色医学中心伦理委员会批准(医研伦审2021第218号),本人知情同意。以1∶10体积的柠檬酸钠溶液抗凝全血100×g离心30 min后,取上清以1 500×g离心20 min获得血小板沉淀,以CGS缓冲液洗涤血小板3次,1640培养基重悬血小板至3×108/mL。分组(n=3):①对照组:细胞培育箱培育48 h;②缺氧48 h组:缺氧箱(氧气浓度为2%)放置48 h;③GT1b组:缺氧箱放置48 h后加入5 μmol/L GT1b 1 h;④奥司他韦组:缺氧箱放置48 h后加入0.2 μmol/L奥司他韦1 h;⑤唾液酸酶组:血小板样本中加入300 U/mL α2-3, 6, 8唾液酸酶,置细胞培养箱中18 h后进行后续检测。
1.3.2 血小板siglec-9本身和配体表达以及活化后CD62p表达每管取50 μL血小板加入anti-siglec-9-APC室温避光孵育20 min,加入200 μL PBS终止反应,使用流式细胞仪进行检测;每管取50 μL血小板加入一抗Siglec-9-fc 8 μL 4℃孵育1 h,之后加入anti-human IgG Fc PE,室温避光孵育20 min,加入200 μL PBS终止反应,用anti-CD41-FITC对血小板进行特异性标记,使用流式细胞仪进行检测;分别取500 μL血小板到1.5 mL EP管中,加入终浓度为100 μmol/L ADP、2 μg/mL胶原和0.2 U/mL凝血酶,37 ℃孵育10 min;加入anti-CD62p-PE室温避光孵育20 min,加入200 μL PBS终止反应,上机检测,统计其平均荧光强度值。
1.3.3 免疫组化多聚甲醛重悬血小板,固定15 min,1 500×g离心,DPBS重悬;免疫组化笔画圈将细胞滴加在圈里,放入37 ℃烘箱烤干。5%山羊血清封闭1 h,滴加一抗Siglec 9-fc,4 ℃湿盒内孵育过夜。PBS清洗3次,滴加FITC山羊抗人,室温避光孵育2 h。PBS清洗30 min,抗荧光猝灭封片剂封片,荧光显微镜下观察拍照。
1.3.4 动物分组动物分为4组,每组6只,分别为对照3 d组、缺氧3 d组、对照7 d组和缺氧7 d组。对照组正常条件饲养3 d或7 d;缺氧组置于缺氧箱(氧气浓度为10%)放置3 d或7 d。小鼠自由进食和饮水。采集小鼠血液后按上述方法分离制备血小板,并测定血小板Siglec-E本身和配体表达以及不同刺激剂对血小板活化影响,统计其平均荧光强度值。
1.3.5 蛋白质免疫印迹法Western blot测定血小板糖基转移酶表达水平:收集上述各组血小板加样本后加入RIPA细胞裂解液,于冰上裂解20 min后12 000 r/min离心10 min取上清液,用BCA法测定蛋白质含量。等蛋白浓度样品100 ℃加热10 min,上样SDS凝胶电泳,转膜,5%脱脂牛奶封闭2 h。随后用ST3GAL3 (1∶1 000)、Human Polypeptide GalNac Transferase2 antibody(1∶200)或GALE(C-4)antibody(1∶200)4 ℃孵育过夜,PBST清洗3次后加入相应二抗,室温孵育1 h,PBST清洗3次,发光液显影后采集图片。
1.4 统计学分析采用GraphPad Prism 8.0统计软件,计量资料以x±s表示,多组间比较采用单因素方差分析,两组间比较采用Student’s t检验,检验水准α=0.05。
2 结果 2.1 血小板广泛表达Siglec-9/E聚糖配体Western blot(图 1A)结果显示,Siglec-9配体的相对分子质量约为130×103,且经唾液酸酶处理后该条带信号消失(P < 0.01)。免疫组化(图 1B)和流式细胞术(图 1C、D)结果均显示该配体在细胞膜表面广泛表达,且经唾液酸酶处理后失去与Siglec-9-Fc结合的能力(P < 0.05),提示该配体是具有唾液酸末端的聚糖结构。
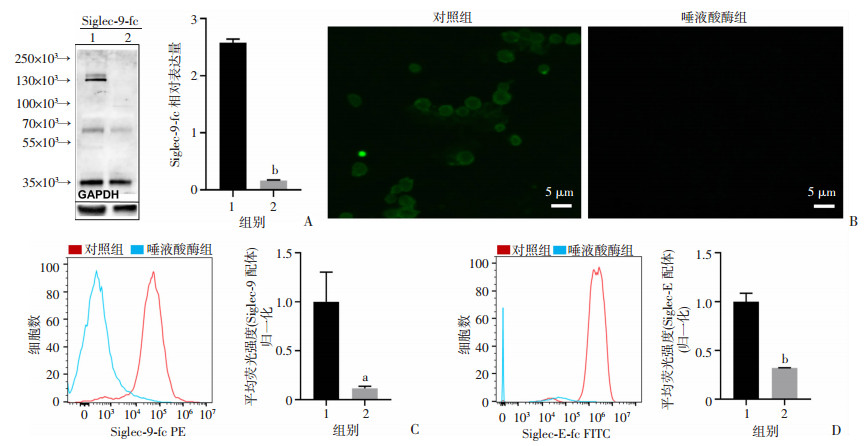
|
| A:Western blot检测血小板Siglec-9聚糖配体表达;B:免疫荧光检测血小板Siglec-9聚糖配体表达;C:流式细胞术检测人血小板Siglec-9聚糖配体表达;D:流式细胞术检测鼠血小板Siglec-E聚糖配体表达 1:对照组;2:唾液酸酶组;a:P < 0.05,b: P < 0.01,与对照组比较 图 1 血小板广泛表达Siglec-9/E聚糖配体(n=3,x±s) |
2.2 缺氧处理后小鼠血小板数量、Siglec-E聚糖配体表达降低,血小板活化增加
流式细胞术检测小鼠血小板Siglec-E聚糖配体及活化指标CD62p,结果显示,与对照组相比,缺氧7 d组小鼠血小板数量(图 2A)和Siglec-E配体水平(图 2B)均显著降低(P < 0.05),而血小板上Siglec-E表达2组无统计学差异(图 2C)。利用多种刺激对血小板进行活化后发现,缺氧7 d组小鼠血小板在各种刺激下的活化水平较对照组均显著增强(P < 0.01,图 2D)。而在缺氧处理3 d组的小鼠血小板中,以上指标与对照组均差异无统计学意义。
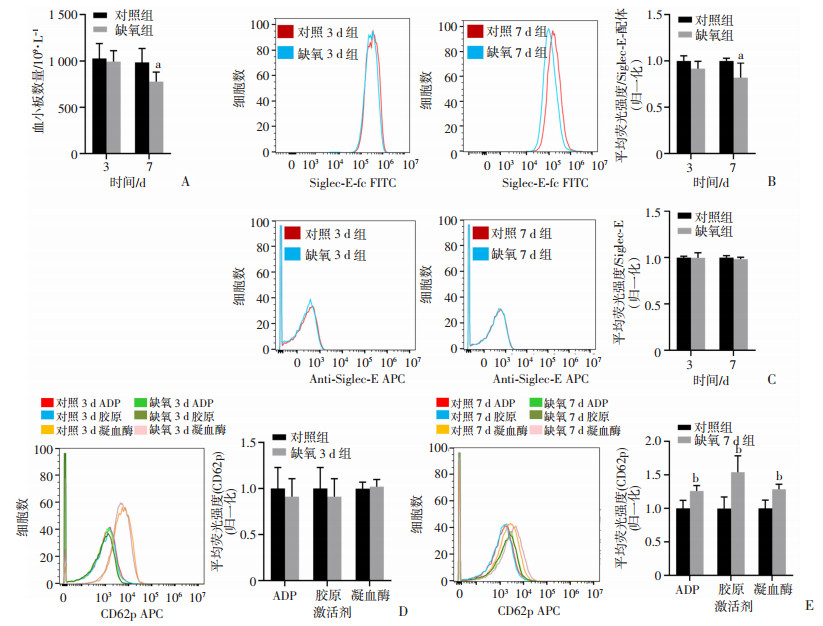
|
| A:缺氧处理3、7 d小鼠血小板数量变化;B:缺氧处理3、7 d小鼠Siglec-E配体表达水平;C:缺氧处理3、7 d小鼠Siglec-E表达水平;D:缺氧处理3 d小鼠血小板ADP、胶原和凝血酶刺激活化程度;E: 缺氧处理7 d小鼠血小板ADP、胶原和凝血酶刺激活化程度 a:P < 0.05,b: P < 0.01,与对照组比较 图 2 缺氧对小鼠血小板Siglec-E配体和活化的影响(n=6, x±s) |
2.3 缺氧培养后血小板Siglec-9聚糖配体表达降低,血小板活化增加
流式细胞术检测人血小板Siglec-9配体及活化指标CD62p。结果显示,缺氧处理导致血小板表面Siglec-9配体水平较对照组明显降低(P < 0.01,图 3A),而血小板上Siglec-9的表达量无统计学差异(图 3B)。与对照组比较,缺氧处理后的血小板受到ADP、胶原和凝血酶刺激后的活化水平显著增强(P < 0.01,图 3C)。以上结果与动物模型结果一致。
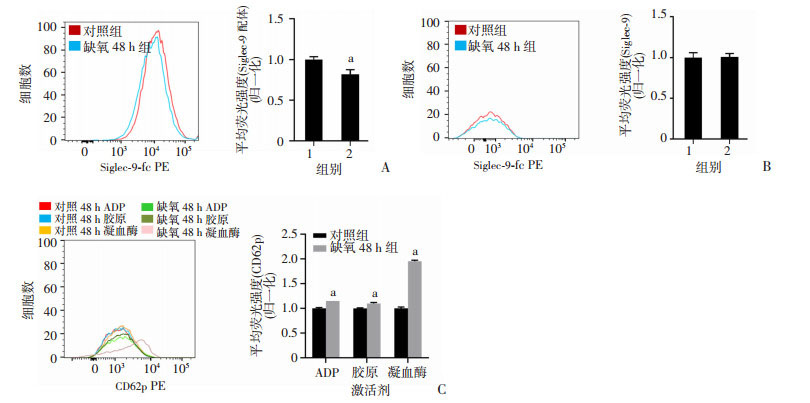
|
| A: 血小板在缺氧条件下培养48 h后Siglec-9配体表达水平; B: 血小板在缺氧条件下培养48 h后Siglec-9表达水平; C: 血小板在缺氧条件下培养48 h后ADP、胶原和凝血酶刺激血小板活化程度 1 : 对照组; 2:缺氧48 h; a: P < 0.01, 与对照组比较 图 3 缺氧对人血小板Siglec-9配体以及活化的影响(n=3, x±s) |
2.4 NEU1增高导致Siglec-E聚糖配体表达降低
与野生型比较,敲基因小鼠血小板在ADP、胶原和凝血酶刺激下CD62p水平显著增高73.37%、143.02%和25.81%(P < 0.01,图 4A)。外源性Siglec-9特异性配体GT1b能够逆转缺氧处理导致的血小板异常活化(P < 0.05,图 4B)。Western blot检测缺氧处理后人血小板中聚糖合成相关酶GALNT2、ST3GAL3、GALE表达水平,均未发现显著变化(图 4C)。流式细胞术检测结果显示,与对照组比较,缺氧处理组血小板表面NEU1表达水平显著升高(P < 0.05,图 4D),而神经氨酸酶抑制剂奥司他韦能够逆转由缺氧处理导致的Siglec-9聚糖配体表达的降低(P < 0.05,图 4E)。
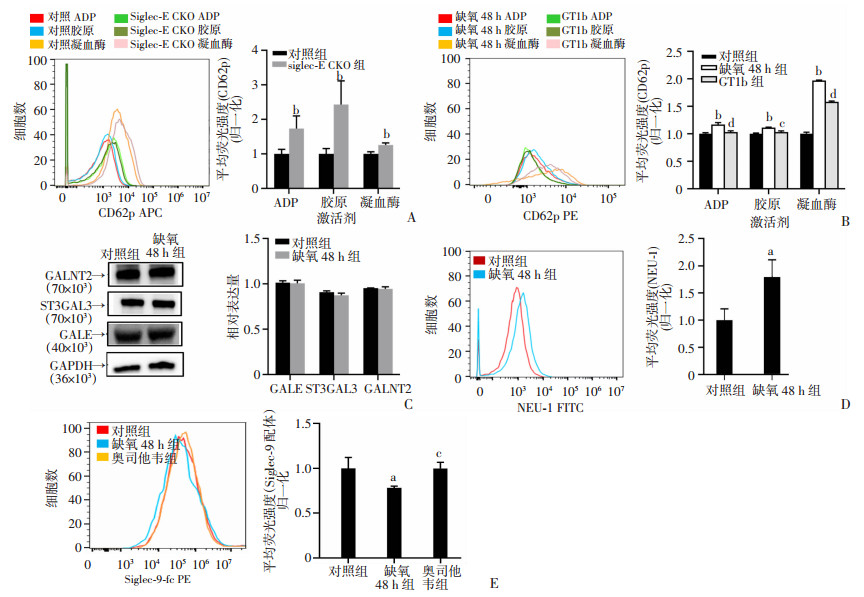
|
| A:Siglec-E特异性敲除小鼠ADP、胶原和凝血酶刺激血小板活化程度;B:GTIb处理缺氧培养血小板的活化程度;C:缺氧处理对聚糖合成相关酶表达水平的影响;D:缺氧处理对NUE1表达水平的影响;E: 奥司他韦加入缺氧血小板对Siglec-9配体表达影响 a:P < 0.05,b: P < 0.01,与对照组比较;c:P < 0.05,d:P < 0.01,与缺氧48 h组比较 图 4 Siglec-E信号通路抑制血小板活化能力(n=3, x±s) |
3 讨论
血小板是血液的重要组成部分,其活化与止血性血栓形成等多种重要过程紧密相关[13]。血小板出现异常活化可导致血栓性疾病发生[14],故维持其“静息平衡”状态具有重要的生理学意义。相关研究目前主要集中在血小板活化过程方面,发现不同刺激因素能通过各自信号通路引起血小板活化聚集[5],但对于正常条件下维持其静息的抑制性信号通路研究尚不够深入。
现有研究证实,Siglec-9/E与特定配体结合后可发挥抑制嗜中性粒细胞等炎症细胞活性的生物学作用[9, 15],且其配体的重要特征是具有Lewis-X聚糖结构,在不同组织中可表现为不同糖蛋白或者糖脂等。因为Siglec-9/E胞内部分包括了免疫受体酪氨酸抑制性基序(immunoreceptor tyrosine-based inhibitory motif,ITIM)结构,激活后具有募集含有Src同源区2结构域的磷酸酶(Src homology region 2 domain-containing phosphatases,SHP)-1和SHP-2的作用,而研究证实,血小板内SHP-1信号通路的激活是维持血小板静息状态的重要机制[16-17],提示Siglec-9/E通路激活可能具有抑制血小板活化的作用。
本研究发现,髓系细胞Siglec-E特异性敲除的小鼠血小板出现了异常活化的现象,分别给予ADP、胶原和凝血酶刺激后,CD62p水平较野生型分别增高了73.37%、143.02%和25.81%,证实Siglec-E确实参与了血小板“静息平衡”的维持机制。同时,本研究发现,血小板表面广泛表达Siglec-9/E的配体,与Siglec-9/E的结合具有唾液酸特异性。该配体与Siglec-9/E共同表达在血小板表面,以顺式结合的方式结合后激活Siglec-9/E,从而发挥抑制血小板活化的作用,与单核细胞上该通路顺式激活的研究结果一致[18]。
大量临床研究结果提示,高原缺氧环境可以影响高海拔地区移居人群血小板的活化状态,进而升高血栓风险,但是具体机制尚未阐明[19]。基于以上对血小板“静息平衡”新机制的发现,本研究对缺氧对血小板Siglec-9/E配体表达的影响及其在血小板活性改变中的作用进行了探索。与既往研究结果一致,经过低压仓处理的小鼠在第7天出现了血小板的数量减少和异常活化。同时,血小板上Siglec-E表达未发生显著改变,而Siglec-E聚糖配体表达水平出现显著降低,体外培养的血小板也出现了相同的变化。结合既往研究发现,内皮细胞上Siglec-9/E配体表达水平增高能够增强抑制巨噬细胞炎症反应[20],以及红细胞上Siglec-9配体表达降低能够导致中性粒细胞异常激活[21]等结果,提示该配体表达水平可能与血小板异常活化相关。而给予Siglec-9/E的特异性激动剂GT1b能够显著逆转缺氧导致的血小板异常活化,进一步证实了该配体水平的降低是血小板在缺氧情况下发生异常活化的机制之一。
为进一步探索Siglec-9/E配体出现显著降低的机制,本研究对该聚糖配体表达相关的关键酶进行了检测。血小板具有相对完整的与聚糖合成和分解相关的系统[22],与该配体表达水平相关的关键酶主要包括与聚糖合成相关的GALNT2、ST3GAL3和GALE,以及与唾液酸移除相关的NEU1等。结果发现与聚糖合成相关的酶表达水平无显著变化,而流式细胞术检测发现血小板表面NEU1出现了显著升高。既往研究发现,炎症刺激能够诱导THP-1细胞质中NEU1易位到细胞表面发挥切除Siglec-E配体末端唾液酸的功能[23],且NEU1在细胞膜上水平增高导致的唾液酸剪切在多种循环性疾病中有重要作用[24],与本研究结果一致。提示缺氧导致的Siglec-9/E配体水平降低的机制应该与细胞膜上NEU1水平增高有关,而且由于成熟血小板中无细胞核,细胞膜上增加的NEU1应该来自于细胞质蛋白的易位,但具体机制尚待进一步探索。此外,Siglec-9/E配体水平的变化可能源于载体蛋白表达量的变化和糖基数量的变化两个层面,本研究发现,利用神经氨酸酶抑制剂奥司他韦处理血小板能够阻止缺氧导致的Siglec-9配体水平的降低,提示该配体水平的变化发生在聚糖层面而非蛋白层面。
本研究证实,血小板表面siglec-9/E聚糖配体能通过抑制血小板活化参与维持其“静息稳态”。在此基础上,发现该配体表达减少可能是缺氧导致血小板出现异常活化的新机制,为缺氧引起血小板异常活化进而导致血栓性疾病的防治从糖生物学角度提供了新的潜在干预靶点。
| [1] |
邱义稳, 宋航, 赵婕, 等. 高原环境血小板的变化及其作用机制探讨[J]. 西南国防医药, 2015, 25(10): 1146-1148. QIU Y W, SONG H, ZHAO J, et al. The changes of platelets in high altitude environment and the mechanism of action[J]. Med J Natl Defend Forces Southwest China, 2015, 25(10): 1146-1148. |
| [2] |
周建丽, 王斌, 谢祥红, 等. 不同海拔高原驻训人员外周血小板参数变化及意义[J]. 武警医学院学报, 2010, 19(4): 304-305. ZHOU J L, WANG B, XIE X H, et al. Changes of peripheral platelet count in training personnel at different altitude[J]. Acta Acad Med CPAF, 2010, 19(4): 304-305. |
| [3] |
柯景彬, 晋军, 黄岚, 等. 急性高原暴露及短期习服对青年男性血小板相关参数的影响[J]. 解放军医学杂志, 2018, 43(3): 251-256. KE J B, JIN J, HUANG L, et al. Influence of acute high altitude exposure and short-term acclimation on platelet-associated parameters in healthy young man[J]. Med J Chin PLA, 2018, 43(3): 251-256. |
| [4] |
SHANG C X, WUREN T N, GA Q, et al. The human platelet transcriptome and proteome is altered and pro-thrombotic functional responses are increased during prolonged hypoxia exposure at high altitude[J]. Platelets, 2020, 31(1): 33-42. |
| [5] |
秦芳梅, 叶洁瑜, 黄顺桦, 等. 血小板活化功能及血小板微粒对重型血友病A临床异质性的意义[J]. 第三军医大学学报, 2015, 37(13): 1362-1366. QIN F M, YE J Y, HUANG S H, et al. Significance of platelet activating capacity and platelet-derived microparticles in clinical phenotype heterogeneity of hemophlia A: report of 31 cases[J]. J Third Mil Med Univ, 2015, 37(13): 1362-1366. |
| [6] |
MACAULEY M S, CROCKER P R, PAULSON J C. Siglec-mediated regulation of immune cell function in disease[J]. Nat Rev Immunol, 2014, 14(10): 653-666. |
| [7] |
UCHIYAMA S, SUN J, FUKAHORI K, et al. Dual actions of group B Streptococcus capsular sialic acid provide resistance to platelet-mediated antimicrobial killing[J]. Proc Natl Acad Sci USA, 2019, 116(15): 7465-7470. |
| [8] |
KORPORAAL S J, KOEKMAN C A, VERHOEF S, et al. Downregulation of platelet responsiveness upon contact with LDL by the protein-tyrosine phosphatases SHP-1 and SHP-2[J]. Arterioscler Thromb Vasc Biol, 2009, 29(3): 372-379. |
| [9] |
LIZCANO A, SECUNDINO I, DÖHRMANN S, et al. Erythrocyte sialoglycoproteins engage Siglec-9 on neutrophils to suppress activation[J]. Blood, 2017, 129(23): 3100-3110. |
| [10] |
DELAVERIS C S, CHIU S H, RILEY N M, et al. Modulation of immune cell reactivity with cis-binding Siglec agonists[J]. Proc Natl Acad Sci USA, 2021, 19: e2012408118. |
| [11] |
JIA Y, YU H F, FERNANDES S M, et al. Expression of ligands for Siglec-8 and Siglec-9 in human airways and airway cells[J]. J Allergy Clin Immunol, 2015, 135(3): 799-810.e7. |
| [12] |
ZHANG Y X, ZHENG Y, LI J, et al. Immunoregulatory Siglec ligands are abundant in human and mouse aorta and are up-regulated by high glucose[J]. Life Sci, 2019, 216: 189-199. |
| [13] |
HEBER S, VOLF I. Effects of physical (in)activity on platelet function[J]. Biomed Res Int, 2015, 2015: 165078. |
| [14] |
TOMAIUOLO M, BRASS L F, STALKER T J. Regulation of platelet activation and coagulation and its role in vascular injury and arterial thrombosis[J]. Interv Cardiol Clin, 2017, 6(1): 1-12. |
| [15] |
STANCZAK M A, SIDDIQUI S S, TREFNY M P, et al. Self-associated molecular patterns mediate cancer immune evasion by engaging Siglecs on T cells[J]. J Clin Invest, 2018, 128(11): 4912-4923. |
| [16] |
MA P S, CIERNIEWSKA A, SIGNARVIC R, et al. A newly identified complex of spinophilin and the tyrosine phosphatase, SHP-1, modulates platelet activation by regulating G protein-dependent signaling[J]. Blood, 2012, 119(8): 1935-1945. |
| [17] |
COXON C H, SADLER A J, HUO J, et al. An investigation of hierachical protein recruitment to the inhibitory platelet receptor, G6B-B[J]. PLoS One, 2012, 7(11): e49543. |
| [18] |
HSU Y W, HSU F F, CHIANG M T, et al. Siglec-E retards atherosclerosis by inhibiting CD36-mediated foam cell formation[J]. J Biomed Sci, 2021, 28(1): 5. |
| [19] |
谢玉海, 王学军. 高原地区患者术前凝血功能特征及血栓弹力图评估凝血功能的价值研究[J]. 中国现代医学杂志, 2017, 27(17): 80-83. XIE Y H, WANG X J. Preoperative coagulation function of patients in plateau area and value of thrombelastography in assessment of coagulative function[J]. China J Mod Med, 2017, 27(17): 80-83. |
| [20] |
LIU H, ZHENG Y, ZHANG Y, et al. Immunosuppressive Siglec-E ligands on mouse aorta are up-regulated by LPS via NF-κB pathway[J]. Biomed Pharmacother, 2020, 122: 109760. |
| [21] |
KISER Z M, LIZCANO A, NGUYEN J, et al. Decreased erythrocyte binding of Siglec-9 increases neutrophil activation in sickle cell disease[J]. Blood Cells Mol Dis, 2020, 81: 102399. |
| [22] |
WANDALL H H, RUMJANTSEVA V, SØRENSEN A L, et al. The origin and function of platelet glycosyltransferases[J]. Blood, 2012, 120(3): 626-635. |
| [23] |
CHEN G Y, BROWN N K, WU W, et al. Broad and direct interaction between TLR and Siglec families of pattern recognition receptors and its regulation by Neu1[J]. eLife, 2014, 3: e04066. |
| [24] |
ZHANG L, WEI T T, LI Y, et al. Functional metabolomics characterizes a key role for N-acetylneuraminic acid in coronary artery diseases[J]. Circulation, 2018, 137(13): 1374-1390. |




