丙泊酚是临床常见的静脉麻醉药,被广泛用于麻醉的诱导、维持以及ICU镇静。研究表明,丙泊酚对发育期大脑具有潜在的神经毒性[1]。氧是影响细胞功能的重要因素,低氧可严重影响细胞功能,促进细胞凋亡[2],是许多疾病的共同病理过程。临床上麻醉、药物、低血压及分流等均可引起低氧。本课题组前期研究证实,丙泊酚麻醉复合低氧可引起新生大鼠较长期的学习和记忆功能下降,死亡海马神经细胞显著增多,但其机制尚不清楚[3-4]。聚核糖性死亡(parthanatos) 是一种新型的非半胱天冬酶(caspase)依赖的程序性细胞死亡方式,在多种神经疾病发病机制中发挥关键作用[5]。在聚核糖性死亡细胞死亡机制中,氧化应激和兴奋性毒性引起DNA损伤,进而导致DNA损伤传感器聚腺苷二磷酸核糖聚合酶-1[poly(ADP-ribose)polymerase-1,PARP-1]过度活化,产生大量多聚ADP核糖(polymerized ADP-ribose, PAR),使细胞凋亡诱导因子(apoptosis-inducing factor,AIF)从线粒体易位到细胞核,诱导大规模DNA碎裂和细胞死亡。有研究报道,聚核糖性死亡在七氟烷暴露后的发育性神经毒性中起重要作用[6]。本研究以经神经生长因子(nerve growth factor,NGF)诱导的PC12细胞为模型,探讨低氧环境下丙泊酚对PC12细胞聚核糖性死亡的影响,为进一步理解低氧复合丙泊酚的神经毒性作用及其潜在机制提供新的理论参考。
1 材料与方法 1.1 材料与试剂PC12细胞(中国科学院上海生命科学研究院细胞库)。丙泊酚注射液(20 mL/100 mg,批号:1708109,意大利阿斯利康有限公司);脂肪乳注射液(250 mL,批号:F18020309,四川科伦药业有限公司);RPMI1640培养基、EDTA-胰蛋白酶(Gibco公司,美国);胎牛血清(FBS,上海双洳生物科技有限公司);乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒(南京建成);Trizol(Invitrogen公司,美国);Annexin V-FITC/PI细胞凋亡检测试剂盒(深圳欣博盛);逆转录试剂盒(MedChem Express公司,美国);Anti-PRA(Ab-1)、多聚赖氨酸(Sigma公司,美国);重组Anti-GAP43抗体(ab75810)、重组Anti-AIF单克隆抗体(ab32516)、重组Anti-PARP1单克隆抗体(ab32138,Abcam公司,英国);鼠源GAPDH抗体、鼠源Histone-H3抗体、山羊抗兔Ⅱ抗和兔抗鼠Ⅱ抗体(成都正能生物);3-Aminobenzamide(MedChem Express,Sigma公司,美国)。
1.2 方法 1.2.1 细胞培养及分化PC12细胞用1640完全培养基(含10%FBS、1%青霉素-链霉素双抗)在37 ℃、5% CO2恒温培养箱中培养,每1~2天换液,待细胞生长至90%左右时进行传代。使用含1%热灭活马血清、100 ng/mL NGF和1%青霉素-链霉素双抗的1640培养基诱导细胞分化[7],GAP43作为突触生长及PC12细胞分化的标记物[8]。
1.2.2 细胞分组与处理将步骤1.2.1所得分化成功的PC12细胞采用随机数字表法分为6组,并予以不同的处理。①空白对照组(NC组):正常培养;②脂肪乳空气对照组(CA组):加入100 μmol/L脂肪乳剂后正常培养;③脂肪乳低氧对照组(CH组):加入100 μmol/L脂肪乳剂后放入低氧(5%O2)空气(21%O2)培养箱中培养;④丙泊酚空气组(PA组):加入丙泊酚后正常培养;⑤丙泊酚低氧组(PH组):加入丙泊酚后放入低氧(5% O2)空气(21% O2)培养箱中培养;⑥3-AB(PARP-1抑制剂)组:250 μmol/L 3-AB预处理1 h,再加入丙泊酚后放入低氧(5% O2)空气(21% O2) 培养箱中培养。各组细胞分别处理后,孵育4 h。处理完毕收集细胞培养上清液和细胞,并测定下列指标。
1.2.3 乳酸脱氢酶(LDH)检测取各组经过处理的细胞上清液,按照检测试剂盒说明书操作步骤,用酶标仪检测450 nm处各组样本的光密度值[D(450)],计算各组乳酸脱氢酶的活性。
1.2.4 细胞凋亡率检测收集各组经过处理的细胞,取1×106个细胞至流式细胞离心管,预冷PBS洗涤3次,向细胞沉淀中加入100 μL结合缓冲液重悬,依次加入5 μL FITC、5 μL PI,震荡后室温避光孵育15 min,向流式管中加入400 μL结合缓冲液,采用流式细胞仪检测细胞凋亡率。
1.2.5 RT-qPCR法检测PARP-1、AIF的mRNA水平用TRIzol提取细胞总RNA,用逆转录试剂盒获取cDNA,使用SYBR Green进行RT-qPCR,目标基因引物见表 1。逆转录的条件设定为:25 ℃ 5 min,42 ℃ 30 min,85 ℃ 2 min。实时荧光定量PCR条件设定为:95 ℃ 3 min;95 ℃ 10 s,60 ℃ 30 s,共39个循环。所有实验至少重复3次。
| 基因 | 序列(5′→3′) | 片段大小/bp |
| PARP-1 | 正义: GGCATTGGTGAGTGTGAGTCTGAG | |
| 反义: GGAGGTTGGTACTTGTCTGGTGAAG | 142 | |
| AIF | 正义: CACTCCAAGAAGTCTGTCTGCTATCG | |
| 反义: CCAAGGAAGCCTCCACCAATAACTG | 150 | |
| GAPDH | 正义: TGAAGCAGGCATCTGAGGG | |
| 反义: CGAAGGTGGAAGAGTGGGAG | 102 |
1.2.6 Western blot检测相关蛋白表达
取各组培养的细胞,去除培养基后,经PBS洗2次后加入裂解液裂解细胞,收集蛋白。采用二喹啉甲酸(Bicinchoninic acid, BCA) 法测定蛋白浓度后将蛋白煮沸12 min变性。取25 μg蛋白样品进行SDS-PAGE电泳、转膜。5%脱脂奶粉室温摇床封闭100 min。Tris-HCl-Tween缓冲盐溶液(TBST)冲洗3次,每次5 min。分别添加一抗GAP43、PARP-1、AIF、PAR(1 ∶1 000),4 ℃摇床孵育过夜。TBST洗膜3次,每次10 min,用TBST稀释辣根过氧化物酶标记的二抗IgG(1 ∶5 000)室温孵育100 min后,TBST清洗3次,每次10 min。暗室滴加ECL发光液曝光显影,结果采用Image J图像分析软件进行分析,以GAPDH为内参照,计算各蛋白条带灰度值,以靶蛋白条带与GAPDH蛋白条带比值表示靶蛋白相对表达水平。
1.2.7 免疫荧光观察细胞内AIF核质分布将细胞接种于爬片,经分化及造模处理后,PBS清洗3次,每次5 min,用4%多聚甲醛室温避光孵育20 min,0.5% Triton X-100室温透化10 min后,免疫染色封闭液封闭15 min,然后加入AIF(1 ∶250)一抗,4 ℃孵育过夜。复温后PBS清洗3次,加入荧光二抗(1 ∶500),37 ℃避光孵育1 h,最后加入Hoechst33258并孵育15 min,PBS清洗3次后封片,用共聚焦显微镜观察并拍照。
1.3 统计学分析采用SPSS 20.0统计学软件进行分析,采用GraphPad Prism 7.6软件绘图。数据以x±s表示,组间比较采用单因素方差分析,两两比较采用LSD-t检验。P < 0.05表示差异有统计学意义。
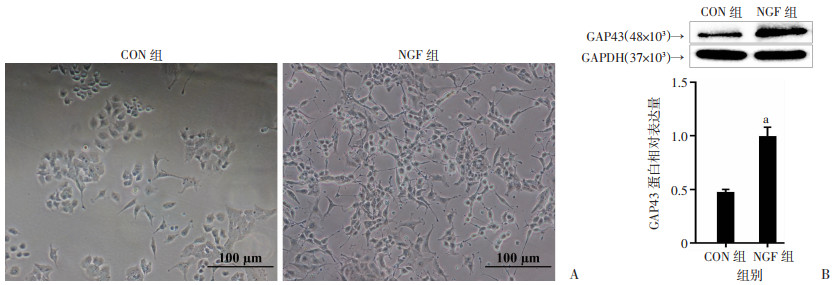
2 结果 2.1 NGF诱导PC12细胞中神经突生长和GAP43蛋白的表达NGF干预前(CON组),PC12细胞呈多边形,无可见神经突起。暴露于100 ng/mL NGF(NGF组) 4 d后,形成广泛的神经突网络,见图 1A。分化后计数含神经突细胞百分比达到70%左右。Western blot检测结果显示,与对照(CON组)PC12细胞相比,分化后的PC12细胞GAP43蛋白水平显著升高(P < 0.01,图 1B),表明NGF诱导了PC12细胞的分化,可用于后续实验。
|
| A:NGF干预前后PC12细胞形态;B:Western blot检测分化前后PC12细胞GAP43蛋白表达(n=3,x±s) a : P < 0.01,与CON组比较 图 1 NGF诱导PC12细胞分化 |
2.2 低氧复合丙泊酚对PC12细胞LDH水平的影响
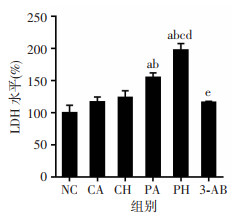
LDH检测结果显示,NC、CA组间比较差异无统计学意义。与NC、CA组比较,PA、PH组LDH水平明显升高(P < 0.01);与CH、PA组比较,PH组LDH水平明显升高(P < 0.01);3-AB预处理后,LDH水平恢复至CA组水平(P>0.05),见图 2。
|
| a:P < 0.01,与NC组比较;b:P < 0.01,与CA组比较;c:P < 0.01,与CH组比较;d:P < 0.01,与PA组比较;e: P < 0.01,与PH组比较 图 2 低氧复合丙泊酚对LDH水平的影响 (n=4,x±s) |
2.3 低氧复合丙泊酚对PC12细胞凋亡的影响
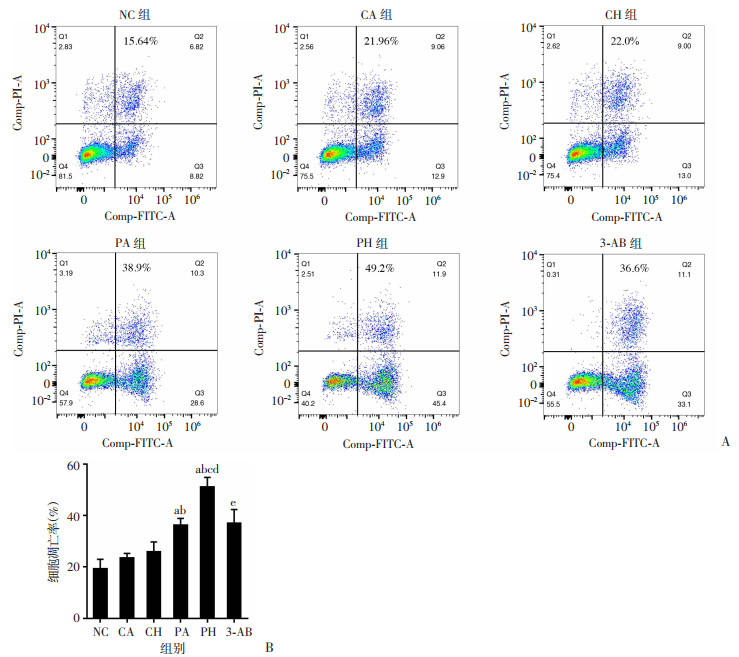
流式检测结果显示:与NC、CA组比较,PA、PH组细胞凋亡增多(P < 0.01);与CH、PA组比较,PH组细胞凋亡增多(P < 0.01)。3-AB预处理后,低氧复合丙泊酚细胞引起的凋亡增加被抑制(P < 0.01),见图 3。
|
| A:流式细胞术检测细胞凋亡;B:各组细胞凋亡率分析(n=3, x±s) a:P < 0.01,与NC组比较;b:P < 0.01,与CA组比较;c:P < 0.01,与CH组比较;d:P < 0.01,与PA组比较;e: P < 0.01,与PH组比较 图 3 低氧复合丙泊酚对PC12细胞凋亡的影响 |
2.4 低氧复合丙泊酚对PC12细胞聚核糖性死亡相关分子mRNA水平的影响
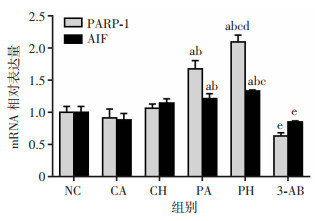
RT-qPCR结果显示,NC、CA组间比较差异无统计学意义。与NC、CA组比较,PA、PH组聚核糖性死亡相关分子PARP-1和AIF的mRNA表达上调(P < 0.01);与CH、PA组比较,PH组PARP-1表达明显上调(P < 0.01)。采用3-AB处理后,低氧复合丙泊酚引起聚核糖性死亡相关蛋白表达上调被抑制(P < 0.01),见图 4。
|
| a:P < 0.01,与NC组比较;b:P < 0.01,与CA组比较;c:P < 0.01,与CH组比较;d:P < 0.01,与PA组比较;e: P < 0.01,与PH组比较 图 4 低氧复合丙泊酚对PC12细胞PARP-1和AIF mRNA表达的影响 (n=3,x±s) |
2.5 低氧复合丙泊酚对PC12细胞聚核糖性死亡相关分子蛋白表达水平的影响
Western blot结果显示,与NC、CA组比较,PA、PH组PARP-1在细胞核及细胞质中表达水平上调(P < 0.05),PAR聚合物水平显著升高(P < 0.01),AIF在细胞核中积累(P < 0.05)。与CH、PA组比较,PH组细胞PARP-1表达水平上调,PAR聚合物水平升高,AIF核转移增多(P < 0.01)。PARP-1抑制剂3-AB可明显缓解PARP-1、细胞质PAR聚合物积累和AIF核转移。见图 5、6。
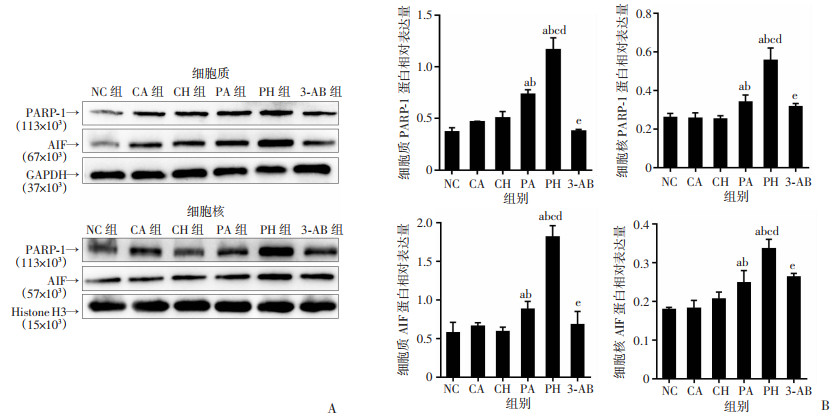
|
| A:Western blot检测PARP-1、AIF蛋白在细胞核及细胞质中的表达;B:各组PARP-1、AIF蛋白在细胞核及细胞质中的相对表达量;a:P < 0.05,与NC组比较;b:P < 0. 05,与CA组比较;c:P < 0.01,与CH组比较;d:P < 0.01,与PA组比较;e: P < 0.01,与PH组比较 图 5 低氧复合丙泊酚对PC12细胞胞质及胞核PARP-1和AIF蛋白表达的影响 (x±s,n=3) |
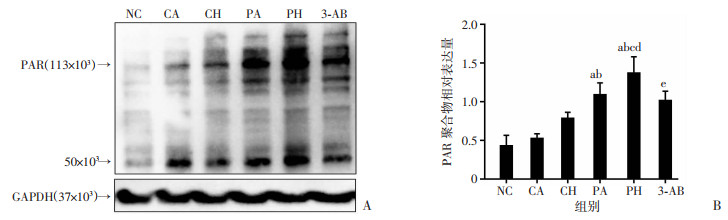
|
| A:Western blot检测PAR聚合物生成水平;B:各组PAR聚合物相对表达量分析;a:P < 0.01,与NC组比较;b:P < 0.01,与CA组比较;c:P < 0.01,与CH组比较;d:P < 0.01,与PA组比较;e: P < 0.01,与PH组比较 图 6 低氧复合丙泊酚对PC12细胞胞质PAR聚合物的影响 (n=4,x±s) |
2.6 低氧复合丙泊酚对PC12细胞AIF核转移的影响
细胞免疫荧光共聚焦结果显示:与各对照组比较,PH组AIF细胞核荧光强度明显增强,而给予3-AB预处理抑制了低氧复合丙泊酚引起的AIF核转移。见图 7。
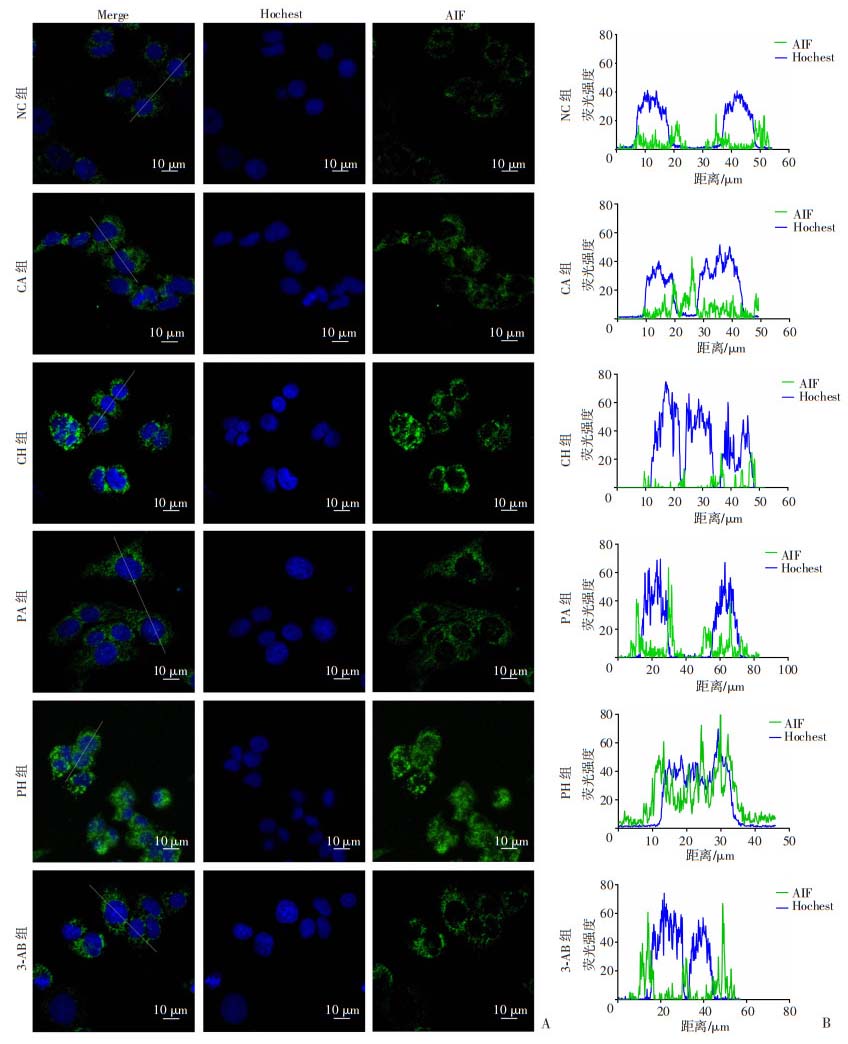
|
| A:激光共聚焦显微镜观察各组细胞AIF核质分布 图中白线示B图进行荧光强度分析的细胞;B:各组荧光强度定量分析 图 7 低氧复合丙泊酚对PC12细胞AIF核质分布的影响 |
3 讨论
PC12细胞株源于大鼠肾上腺嗜铬细胞瘤,经神经生长因子(NGF)分化后具有神经元的形态和生理功能,被广泛用作神经细胞生理、病理及药理相关研究的细胞模型。本研究根据前期预实验结果选择经100 ng/mL NGF诱导分化4 d后的PC12细胞作为研究对象。
丙泊酚是现代医学中较常用的静脉麻醉剂之一[9],低氧是围术期常见的并发症,也是影响细胞功能的重要因素。本课题组前期动物实验已经证实:低氧在丙泊酚致新生大鼠海马神经细胞死亡引起发育期认知功能障碍中起重要促进因素[3-4]。本研究在此基础上通过体外培养PC12细胞进一步研究其可能机制。麻醉期间丙泊酚在人类大脑中的浓度为4~ 20 μg/mL,即22.44~112.2 μmol/L[1, 10]。YANG等[11]研究不同浓度丙泊酚对转染(WT)PS1野生型PC12细胞活性的影响,发现丙泊酚在低浓度(1~20 μmol/L) 时,很少引起细胞损伤,但在较高浓度(50~100 μmol/L) 时引起细胞死亡。结合本研究预实验结果,最终选择100 μmol/L浓度丙泊酚作用于PC12细胞[11-12]。
神经元细胞死亡被认为是丙泊酚诱导的发育性神经毒性的主要机制[1]。死亡细胞的膜完整性破坏释放一定量的LDH,通过检测细胞培养上清液中的LDH水平检测细胞死亡,结果发现:低氧复合丙泊酚作用于细胞时细胞死亡较单独低氧或单独丙泊酚处理时明显增加。聚核糖性死亡是一种新型的PARP-1依赖的程序性细胞死亡方式,主要通过细胞应激引起DNA损伤导致PARP-1激活,活跃的PARP-1利用NAD+作为底物,在自身(自修饰)和细胞核内各种受体蛋白(异型修饰)上建立PAR,PAR积累诱导AIF从线粒体易位到细胞核,导致磷脂酰丝氨酸翻转到外质膜,大规模的DNA断裂和染色质溶解(图 8)[13]。本研究结果显示,与单独低氧或单独丙泊酚处理相比较,低氧复合丙泊酚作用于PC12细胞时,聚核糖性死亡关键分子PARP-1的mRNA和蛋白表达水平显著上调,PAR聚合物增多,AIF发生明显核易位,细胞凋亡增多。这表明,低氧环境下丙泊酚处理细胞后聚核糖性死亡关键信号通路被激活。
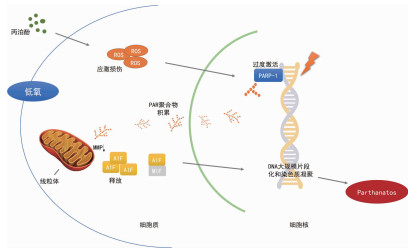
|
| 图 8 聚核糖性死亡分子机制图 |
聚核糖性死亡以PARP-1激活为基础,导致细胞死亡。研究表明,抑制PARP-1可显著保护脑缺血后海马神经元细胞的数量[14]。3-AB是PARP-1特异性抑制剂,可抑制其表达和活性[6]。本研究中,预先采用3-AB处理后,上述聚核糖性死亡通路关键分子的mRNA和蛋白表达水平上调均被有效抑制。此外,3-AB能明显缓解低氧复合丙泊酚处理后细胞损伤标志物LDH水平的升高。研究结果进一步证实,低氧环境下丙泊酚可通过聚核糖性死亡引起PC12细胞损伤,抑制PARP-1活性可有效缓解低氧复合丙泊酚对细胞活性的抑制。
AIF从线粒体到细胞核的易位导致染色质溶解和DNA断裂是聚核糖性死亡的关键步骤。本研究证实低氧环境下丙泊酚作用于细胞时AIF核易位明显增加。本研究条件下抑制AIF核转移可否缓解低氧复合丙泊酚对细胞的损伤有待进一步研究。
综上所述,低氧环境下丙泊酚可导致体外培养的PC12细胞发生聚核糖性死亡,干扰PARP-1通路信号分子抑制聚核糖性死亡可缓解低氧复合丙泊酚对PC12细胞的损伤,提示聚核糖性死亡可能参与低氧环境下丙泊酚引起的临床术后认知功能障碍,但尚需进一步研究证实。
| [1] |
BOSNJAK Z J, LOGAN S, LIU Y N, et al. Recent insights into molecular mechanisms of propofol-induced developmental neurotoxicity: implications for the protective strategies[J]. Anesth Analg, 2016, 123(5): 1286-1296. |
| [2] |
SNYDER C M, CHANDEL N S. Mitochondrial regulation of cell survival and death during low-oxygen conditions[J]. Antioxid Redox Signal, 2009, 11(11): 2673-2683. |
| [3] |
SUN M, YUAN R X, LIU H, et al. The effects of repeated propofol anesthesia on spatial memory and long-term potentiation in infant rats under hypoxic conditions[J]. Genes Dis, 2020, 7(2): 245-252. |
| [4] |
TU S F, WANG X Y, YANG F, et al. Propofol induces neuronal apoptosis in infant rat brain under hypoxic conditions[J]. Brain Res Bull, 2011, 86(1/2): 29-35. |
| [5] |
WANG X Z, GE P F. Parthanatos in the pathogenesis of nervous system diseases[J]. Neuroscience, 2020, 449: 241-250. |
| [6] |
PIAO M H, WANG Y Y, LIU N, et al. Sevoflurane exposure induces neuronal cell parthanatos initiated by DNA damage in the developing brain via an increase of intracellular reactive oxygen species[J]. Front Cell Neurosci, 2020, 14: 583782. |
| [7] |
WIATRAK B, KUBIS-KUBIAK A, PIWOWAR A, et al. PC12 cell line: cell types, coating of culture vessels, differentiation and other culture conditions[J]. Cells, 2020, 9(4): E958. |
| [8] |
ZHONG L Y, FAN X R, SHI Z J, et al. Hyperpolarization-activated cyclic nucleotide-gated ion (HCN) channels regulate PC12 cell differentiation toward sympathetic neuron[J]. Front Cell Neurosci, 2019, 13: 415. |
| [9] |
CHIDAMBARAN V, COSTANDI A, D'MELLO A. Propofol: a review of its role in pediatric anesthesia and sedation[J]. CNS Drugs, 2015, 29(7): 543-563. |
| [10] |
JIANG L L, YANG F Y, ZHAO Q, et al. MicroRNA-665 mediates propofol-induced cell apoptosis in human stem cell-derived neurons[J]. Bioengineered, 2019, 10(1): 493-500. |
| [11] |
YANG M R, WANG Y, LIANG G, et al. Alzheimer's disease presenilin-1 mutation sensitizes neurons to impaired autophagy flux and propofol neurotoxicity: role of calcium dysregulation[J]. J Alzheimers Dis, 2019, 67(1): 137-147. |
| [12] |
LONG B, LI S L, XUE H P, et al. Effects of propofol treatment in neural progenitors derived from human-induced pluripotent stem cells[J]. Neural Plast, 2017, 2017: 9182748. |
| [13] |
ANDRABI S A, DAWSON T M, DAWSON V L. Mitochondrial and nuclear cross talk in cell death: parthanatos[J]. Ann N Y Acad Sci, 2008, 1147: 233-241. |
| [14] |
CZAPSKI G A, CIEŚLIK M, WENCEL P L, et al. Inhibition of poly(ADP-ribose) polymerase-1 alters expression of mitochondria-related genes in PC12 cells: relevance to mitochondrial homeostasis in neurodegenerative disorders[J]. Biochim Biophys Acta Mol Cell Res, 2018, 1865(2): 281-288. |




