2. 400038 重庆,陆军军医大学(第三军医大学)第一附属医院神经内科
2. Department of Neurology, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038, China
缺血性卒中是导致死亡和残疾的主要原因之一,其中占卒中总数近3%的大脑前动脉卒中可导致额叶受损,从而导致记忆、执行功能以及情感功能受损。业已揭示,额叶缺血早期会引起锥体神经元放电频率增加,导致兴奋性氨基酸神经递质浓度急剧增加。大量兴奋性谷氨酸神经递质会产生兴奋性毒性,最终引起神经元坏死,并造成严重的记忆等行为功能障碍[1-3]。目前,额叶皮层早期缺血引起兴奋性递质异常释放的神经机制尚不完全清楚,干预手段更是有限。
小白蛋白(parvalbumin,PV)阳性的抑制性神经元占额叶皮层γ-氨基丁酸(γ-aminobutiric acid,GABA)能抑制性神经元的35%~40%。PV神经元与额叶皮层兴奋性锥体神经元构成局部微环路,对额叶锥体神经元有强烈的抑制作用[4-5]。正常生理条件下,PV阳性的抑制性神经元对产生γ振荡以及相关的空间记忆至关重要。近来研究表明在缺血的早期(24 h内)PV阳性神经元兴奋性显著下降[6]。基于这一现象,我们提出如下假设:缺血早期PV阳性的抑制性神经元兴奋性下降,导致兴奋性锥体神经元放电频率增加,释放更多谷氨酸,造成兴奋毒性和细胞损伤。鉴于此,本研究拟探索缺血早期提高PV阳性抑制性神经元能否减轻细胞损伤,并改善记忆功能障碍。
1 材料与方法 1.1 动物、主要试剂和仪器10~12周龄健康雄性C57BL/6小鼠(PV-Cre)购自美国Jackson Lab(库存编号:008069),在重庆医科大学实验动物中心[许可证号:SCXK(渝)2018-0003]进行繁殖和扩增,体质量20~25 g,室温(22±2)℃,明暗周期12 h,并自由进食与饮水。共使用小鼠69只,其中T-迷宫使用30只,空间物体位置识别使用25只,高尔基染色使用14只。动物操作符合重庆医科大学实验动物伦理规范。
氯氮平(clozapine N-oxide hydrochloride,CNO,批号:SML2304)购自美国西格玛公司。内皮素(批号:Cat. No. 121204)购自Tocris公司(英国)。用于药物遗传学干预的病毒购自武汉枢密公司。用于脑区内微量注射的微量注射仪(IVM-1000)购自英国Scientifica公司。冰冻切片机(CM1950)用于脑组织切片,购自德国Leica公司。脑定位仪购自瑞沃德公司(深圳)。
1.2 方法 1.2.1 病毒微量注射与给药导管埋植将雄性小鼠用异氟醚麻醉后,固定在脑立体定位仪上,使用加热垫将体温维持在35 ℃。去除头皮,清除表面组织,暴露颅骨。根据额叶的坐标,在颅骨两侧钻2个小孔(前囟后+1.5 mm,旁开1.4 mm,深度-1.5 mm)用于注射病毒。连接玻璃移液管的Nanoject Ⅱ用于病毒微量注射。针对化学遗传学实验,病毒注射方法参见文献[7]。将Cre诱导型AAV-EF1α-DIO-hM3D-mCherry(病毒滴度:1×1012 vg/mL)注射到对照组、干预组PV-Cre小鼠的双侧额叶皮层中,总体积约200 nL。模型组注射Cre诱导型AAV-EF1α-DIO-mCherry(病毒滴度:1×1012 vg/mL)作为对照。注射后,移液管在原位保持1 min,然后以约100 nL/2 min的速度注射病毒。移液管在注射部位再保持5 min,然后缓慢取出。
本研究采用药物遗传学技术,该技术已被广泛用于特定神经元的操控[8-9]。其技术原理是使hM3D(乙酰胆碱毒蕈碱受体的一种人工修饰形式)特异表达在某种类型神经元上。CNO可特异性激活人工设计的hM3D受体,进而激活Gq信号通路,Gq信号激活后可增强神经元的兴奋性。因此,表达hM3Dq的神经元经CNO处理后,其兴奋性可急剧增加。本研究所选择的病毒注射剂量和病毒滴度主要参考文献[7, 10]。
病毒注射完成后,将导管沿着骨孔缓慢移至额叶皮层区域,双侧埋置导管。导管的高度高于病毒注射位点0.5 mm。应用牙科水泥将导管固定于颅骨表面。完成后将大鼠放于饲养笼中恢复,7 d后进行造模。
1.2.2 动物分组和造模将手术后的PV-Cre小鼠分为3组:①对照组,动物额叶皮层PV神经元表达hM3D-mCherry,并在额叶皮层注射0.9% NaCl溶剂0.5 μL;②模型组,动物额叶皮层PV神经元表达mCherry,并在额叶皮层区注射400 pmol/μL内皮素0.5 μL;③干预组,动物额叶皮层PV神经元表达hM3D-mCherry,并在额叶皮层区注射400 pmol/μL内皮素0.5 μL。注射完成后,在早起第6、12、18、24小时,分别向对照组和干预组腹腔注射CNO(5 mg/kg),向模型组腹腔注射生理盐水。内皮素和CNO的浓度和体积主要依据文献[3, 6, 11],脑内微注射速度0.05 μL/min,药物注射后留针2 min使药物在脑内充分扩散。CNO给药完成后7 d进行行为测试。
1.2.3 T-迷宫任务T-迷宫常用于检测动物空间工作记忆。主要包括两个阶段。首先是适应阶段,即训练前4 d进行限食,使小鼠体质量降至限食前85%~90%,并且每天让小鼠在T-迷宫中自由探索6 min,让其熟悉空间环境。其次是训练和测试阶段,T-迷宫包括中央臂和2个选择臂。中央臂长30 cm,宽为15 cm。采用交替选择的T-迷宫训练法。小鼠每天训练10次,时间间隔为30 s。第1次时关闭一侧选择臂,小鼠从中央臂出发,进入另一侧开放的选择臂。在开放的选择臂末端可找到食物,在剩下的10次训练中,选择臂两侧入口均开放,小鼠进入上1次已经进入过的臂式,就会没有食物,此时记录为1次错误选择。若小鼠进入前1次未进入的臂则会得到食物奖赏,此时记录为1次正确选择。
T-迷宫任务中,对照组、模型组及干预组每组最终纳入10只小鼠,共计30只小鼠。
1.2.4 空间物体位置识别任务让小鼠在白色实验场(50 cm×50 cm)中自由探索2个相同的物体(A物体和B物体)5 min,4面墙上有黄色正方形、紫色五角星形、粉色三角形和橙色圆圈。间隔5 min后,接着进行5 min的实验阶段。在此阶段,改变1个物体(物体B)的空间位置,允许小鼠重新探索两个物体。进行录像记录探索活动,以便进一步分析。
通过探索分数来反映动物物体空间位置记忆能力,探索分数计算公式为:Tm(B)-Tm(A)/Tm(B) + Tm(A)。Tm代表对每一物体的探索时间。空间物体位置识别任务中,对照组纳入8只小鼠,模型组纳入8只小鼠,干预组纳入9只小鼠,共计25只小鼠。
1.2.5 缺血区域的形态鉴定在注射内皮素后,用过量的1%戊巴比妥钠深度麻醉小鼠,并经心脏灌注生理盐水。大脑被迅速从头骨中取出并放在冰上。在0~4 ℃下使用振动刀制备矢状切片(500 μm厚)。为了量化缺血损伤,在37 ℃的黑暗条件下,将切片用2% 2, 3, 5-三苯基四氮唑氯化物溶液(TTC,Sigma-Aldrich,St.Louis,MO,USA)在盐水中染色20 min,然后将其放入4%多聚甲醛中1 h。按顺序拍摄脑切片,检测缺血的区域。
1.2.6 病毒表达的特异性鉴定行为训练后的小鼠进行灌注固定和取脑。将脑组织置于4%多聚甲醛后固定。随后移至30%蔗糖和4%多聚甲醛溶液中进行脱水。待组织沉底后,进行冰冻切片,切片厚度为20 μm。脑切片随后进行免疫组织化学染色。为了检测hM3D-mCherry是否在PV阳性神经元中特异表达,将含有额叶皮层的切片用PBS洗涤3次,每次持续5 min。然后,在含有0.1% Triton X-100和5%血清的封闭溶液中,37 ℃孵育40 min。切片在4 ℃孵育溶液中与抗小白蛋白抗体的一抗(1 ∶500,ab11427,Abcam)孵育48 h。用PBS洗涤3次,每次持续5 min。将切片在二抗(1 ∶800,Alexa Faur 488,Invitrogen)中孵育2 h。脑片用PBS清洗后,进行贴片和封片,然后用共焦显微镜观察。
1.2.7 膜片钳验证药物遗传激活PV阳性神经元的有效性小鼠注射病毒3周后进行验证,脑片制备如下:在0~4 ℃人工脑脊液(ACSF,119 mmol/L NaCl,2.5 mmol/L KCl,1.2 mmol/L NaHPO4,25 mmol/L NaHCO3,125 mmol/L葡萄糖,2 mmol/L MgCl2,2 mmol/L CaCl2)中,用振动冰机(VT1000,徕卡微系统)制备含脑片(400 μm),同时ACSF中持续灌流95% O2和5% CO2。切片转移到ACSF中孵育,在记录之前,在室温(20~24 ℃)下至少孵育40 min。
目标神经元通过荧光显微镜进行识别。使用玻璃电极(电阻为3~5 MΩ)封接目标细胞,电极内液为125 mmol/L葡萄糖酸钾,20 mmol/L KCl,10 mmol/L HEPES,1 mmol/L EGTA,2 mmol/L MgCl2,4 mmol/L ATP。使用EPC 10放大器(HEKA Elektronik,EPC-10) 获取数据,使用Pulse/Pulsefit v.8.74(HEKA Elektronik) 和Igor Pro v.4.03(WaveMatrics) 进行分析。如果记录期间串联电阻增加>15%或超过25 MΩ,则将细胞从分析中排除。稳定至少5 min后,灌流给予10 μmol/L CNO观测其对神经元放电的影响。
1.2.8 高尔基染色采用FD快速高尔基染色试剂盒(FD神经技术公司)。取额叶皮层区域,将其置于浸渍溶液中。在黑暗中储存2周后,将组织移到蔗糖溶液中。在4 ℃下储存2~7 d后,使用振荡切片机制备含有额叶的切片(100 μm)。额叶切片在蒸馏水中冲洗,并放入硝酸银溶液中10~15 min。然后将载玻片在乙醇中脱水,用二甲苯清除,并用非酸性合成香脂和盖玻片覆盖。
所有图像采集和数据分析以盲法进行。图像通过使用放大400倍的ZESIS共焦显微镜获得。选择用于分析的锥体神经元符合以下标准:细胞体和二级树突完全浸染;在额叶皮层的锥体神经元的二级树突中,树突棘计数的树突长度大于20 μm。对照组纳入11个细胞(4只小鼠),模型组纳入11个细胞(5只小鼠),干预组纳入12个细胞(5只小鼠),共计34个细胞,来自14只小鼠。
1.3 统计学分析采用Sigma Plot 12.5软件进行作图以及数据统计分析。计量资料用x±s表示。单因素方差分析用于组间比较,两两比较采用Fisher LSD检验。检验水准α=0.05。
2 结果 2.1 利用PV-Cre小鼠特异激活PV阳性抑制性神经元免疫组化染色结果发现,hM3D-mCherry特异的表达在PV阳性神经元上,与PV阳性神经元的共标率在90%以上(图 1)。由于CNO能够结合hM3D,进而引起细胞放电增加,故此采用的化学遗传学技术能够特异激活PV阳性神经元。

|
| A:免疫组化对PV蛋白染色;B:hM3D-mCherry荧光蛋白表达;C:PV蛋白染色和hM3D-mCherry荧光蛋白叠加 图 1 hM3D-mCherry在PV阳性的抑制性神经元中选择性地表达 |
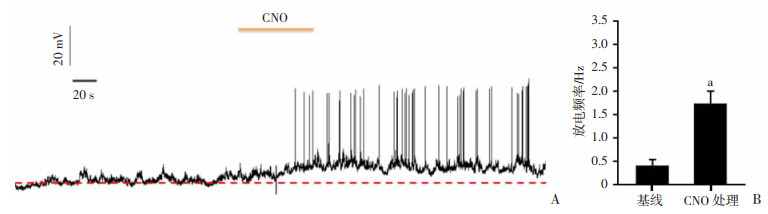
进一步采用全细胞膜片钳记录技术,观测灌流CNO对表达hM3D-mCherry的PV阳性抑制性神经元的影响。在电流钳模式下,记录细胞的膜电位。在灌流CNO后,细胞膜电位出现去极化,并显著引起细胞的放电增加(P < 0.01, 图 2)。结果证明,药物遗传学技术能够显著激活额叶皮层PV阳性抑制性神经元。
|
| A: 膜片钳记录表达hM3D-mCherry细胞的膜电位;B:CNO对PV阳性细胞放电频率的影响 a:P < 0.01,与基线比较 图 2 CNO能降低表达hM3D-mCherry的PV阳性的抑制性神经元放电频率 |
2.2 缺血后早期激活PV阳性神经元可改善空间工作记忆障碍
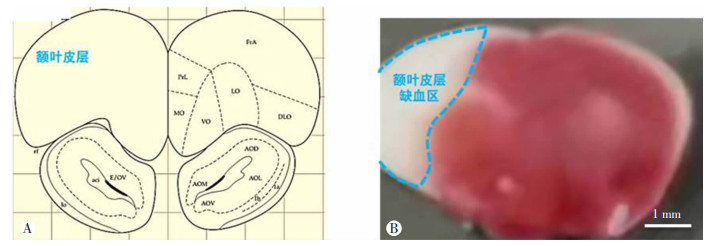
实验中采用TTC染色发现额叶皮层呈现苍白色,并且缺血损伤主要局限于额叶皮层,而其他脑区并无明显改变(图 3)。
|
| A:小鼠脑图谱显示额叶皮层;B:TTC染色显示缺血的区域 图 3 TTC染色发现缺血的区域位于额叶皮层 |
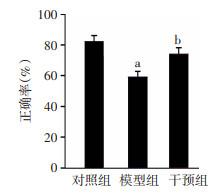
额叶皮层与空间工作记忆高度相关,因此采用T-迷宫检测激活PV阳性神经元后对空间工作记忆的影响。与对照组比较,模型组在T-迷宫中选择的正确率下降(P < 0.01)。这说明额叶皮层局部微量注射内皮素可引起缺血缺氧,导致空间工作记忆功能损伤。
与模型组比较,干预组的正确率显著提高(P < 0.05,图 4),表明早期激活PV阳性神经元可改善缺血缺氧所引起的空间工作记忆功能障碍。
|
| a:P < 0.01,与对照组比较;b:P < 0.05,与模型组比较 图 4 激活PV阳性抑制性神经元对空间工作记忆的影响 |
2.3 缺血后早期激活PV阳性神经元可改善物体位置记忆障碍
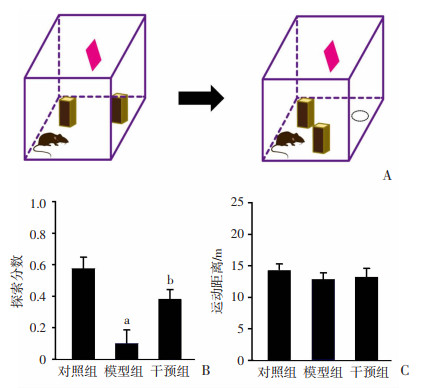
与对照组比较,模型组在物体位置识别记忆任务中探索分数下降(P < 0.01,图 5A、B),说明额叶皮层缺血缺氧导致物体位置记忆功能损伤。
|
|
a:P < 0.01,与对照组比较;b:P < 0.05,与模型组比较 A: 小鼠行为训练模式;B:各组小鼠物体探索分数分析;C:各组小鼠运动距离分析 图 5 激活PV阳性抑制性神经元对物体位置记忆的影响 |
与模型组比较,干预组的探索分数显著提高(P < 0.05,图 5B),表明早期激活PV阳性神经元可改善缺血缺氧所引起的物体位置记忆功能障碍。在进行空间物体探索时,与对照组比较,模型组和干预组并未影响动物的运动功能(图 5C)。
2.4 缺血后早期激活PV阳性神经元可提高额叶皮层锥体神经元树突棘密度通过高尔基染色,发现缺血后神经元树突棘丢失,导致其密度减少,表明缺血后神经元功能受损。相反,激活PV阳性神经元后较模型组树突棘密度显著增加(P < 0.05, 图 6)。提示早期激活PV阳性神经元可降低锥体神经元的兴奋性,减少兴奋毒性和树突棘的丢失,进而改善记忆障碍。

|
| A:额叶皮层高尔基染色显示锥体神经元树突棘;B:神经元树突棘密度统计结果 a:P < 0.01,与对照组比较;b:P < 0.05,与模型组比较 图 6 激活PV阳性抑制性神经元后对额叶锥体神经元树突棘密度的影响 |
3 讨论
本研究的主要发现是缺血后早期激活PV神经元可以改善额叶缺血引起的空间工作记忆障碍和物体位置记忆障碍,而不影响运动功能。早期激活PV神经元可能主要通过减少缺血后树突棘丢失发挥作用。这些结果显示,缺血早期PV神经元功能活动下降可能是脑缺血引起认知损害的重要机制,并且PV神经元可能是缺血早期干预的重要靶点。
缺血后一个突出的细胞事件是锥体神经元的高兴奋性以及过度的谷氨酸释放[12]。在额叶皮质、海马和纹状体等其他多个脑区均检测到这一现象[13-15]。在体外缺氧后也观察到类似现象。过度升高的谷氨酸激活N-甲基-D-天冬氨酸(NMDA)受体,进而使钙超载,导致神经元变性[16-17]。目前,为何会导致锥体神经元兴奋性高和过度释放谷氨酸尚不清楚。业已揭示,锥体神经元的活动由不同类型的GABA能抑制性神经元控制,如PV、SOM阳性抑制性神经元。研究显示,急性缺血后皮质和纹状体中细胞外GABA浓度降低[18]。通过细胞类型特异性干预,本研究进一步发现额叶皮层缺血后激活PV抑制神经元可减少树突棘丢失,改善记忆功能障碍。鉴于PV神经元对其邻近的锥体神经元具有强烈的抑制性控制[4],故此缺血早期PV神经元兴奋性下降会导致锥体神经元的去抑制,使其释放大量谷氨酸,进而诱导了兴奋性毒性过程。为此,本研究为解释缺血诱导的病理损伤提供了一种新的机制。
研究表明,额叶皮层缺血可导致记忆障碍。额叶皮层缺血后1~4个月导致物体识别功能和行为灵活性的损伤,而对运动功能无明显作用[19]。在2~4周后的额叶皮层缺血小鼠中也观察到执行功能和空间记忆的显著损伤[3, 11]。本研究发现早期(24 h内)通过化学遗传学选择性激活PV神经元可改善额叶缺血诱导的记忆损伤,这一发现为改善缺血后早期认知障碍提供了重要的潜在细胞靶点。在此基础上,进一步探索激活PV阳性神经元改善缺血引起记忆功能障碍的机制。树突棘是锥体神经元形成兴奋性突触的重要组成部分,是神经元接受信息的重要部位。树突密度与额叶皮层记忆功能高度关联[20-21]。树突棘密度减少可显著引起记忆障碍。本研究发现额叶皮层缺血后神经元树突棘密度减少,激活PV阳性神经元后树突棘密度显著增加。这些结果表明激活PV阳性神经元可能通过降低了锥体神经元的兴奋性,减少兴奋毒性,减少了树突棘的丢失,从而改善了记忆障碍。
值得注意的是,本研究主要探索激活PV阳性神经元对缺血损伤的效应。目前尚不清楚PV神经元和其他抑制性中间神经元在缺血后不同阶段的活动是如何动态改变,后续还需进一步研究。尽管我们进行了行为测试,发现额叶皮层缺血并不会影响基本的运动功能,但不能排除额叶皮层缺血可能会影响一些高级运动技能。总之,本研究发现缺血后PV神经元兴奋性的降低可能是缺血损伤的一个重要机制,缺血后干预PV神经元可能是保护缺血损伤的一种新策略。
| [1] |
LIVINGSTON-THOMAS J M, JEFFERS M S, NGUEMENI C, et al. Assessing cognitive function following medial prefrontal stroke in the rat[J]. Behav Brain Res, 2015, 294: 102-110. |
| [2] |
QÜ M, MITTMANN T, LUHMANN H J, et al. Long-term changes of ionotropic glutamate and GABA receptors after unilateral permanent focal cerebral ischemia in the mouse brain[J]. Neuroscience, 1998, 85(1): 29-43. |
| [3] |
ZHOU L Y Y, WRIGHT T E, CLARKSON A N. Prefrontal cortex stroke induces delayed impairment in spatial memory[J]. Behav Brain Res, 2016, 296: 373-378. |
| [4] |
TREMBLAY R, LEE S, RUDY B. GABAergic interneurons in the neocortex: from cellular properties to circuits[J]. Neuron, 2016, 91(2): 260-292. |
| [5] |
IACCARINO H F, SINGER A C, MARTORELL A J, et al. Gamma frequency entrainment attenuates amyloid load and modifies microglia[J]. Nature, 2016, 540(7632): 230-235. |
| [6] |
CHEN L, HU J, MU J K, et al. Specific stimulation of PV+ neurons at early stage ameliorates prefrontal ischemia-induced spatial working memory impairment[J]. Behav Brain Res, 2021, 414: 113511. |
| [7] |
SAIKA F, MATSUZAKI S, KISHIOKA S, et al. Chemogenetic activation of CX3CR1-expressing spinal microglia using gq-DREADD elicits mechanical allodynia in male mice[J]. Cells, 2021, 10(4): 874. |
| [8] |
ALLEN D C, JIMENEZ V A, CARLSON T L, et al. Characterization of DREADD receptor expression and function in rhesus macaques trained to discriminate ethanol[J]. Neuropsychopharmacology, 2021, 1-9. |
| [9] |
KHAMBHATI A N, BASSETT D S. A powerful DREADD: revealing structural drivers of functional dynamics[J]. Neuron, 2016, 91(2): 213-215. |
| [10] |
GOMEZ J L, BONAVENTURA J, LESNIAK W, et al. Chem-ogenetics revealed: DREADD occupancy and activation via converted clozapine[J]. Science, 2017, 357(6350): 503-507. |
| [11] |
DÉZIEL R A, RYAN C L, TASKER R A. Ischemic lesions localized to the medial prefrontal cortex produce selective deficits in measures of executive function in rats[J]. Behav Brain Res, 2015, 293: 54-61. |
| [12] |
HAZELL A S. Excitotoxic mechanisms in stroke: an update of concepts and treatment strategies[J]. Neurochem Int, 2007, 50(7/8): 941-953. |
| [13] |
ERDEMLI G, CRUNELLI V. Response of thalamocortical neurons to hypoxia: a whole-cell patch-clamp study[J]. J Neurosci, 1998, 18(14): 5212-5224. |
| [14] |
KRNJEVIĆ K. Electrophysiology of cerebral ischemia[J]. Neuropharmacology, 2008, 55(3): 319-333. |
| [15] |
CALABRESI P, PISANI A, MERCURI N B, et al. Hypoxia-induced electrical changes in striatal neurons[J]. J Cereb Blood Flow Metab, 1995, 15(6): 1141-1145. |
| [16] |
CHEN X, ZHANG J, SONG Y, et al. Deficiency of anti-inflammatory cytokine IL-4 leads to neural hyperexcitability and aggravates cerebral ischemia-reperfusion injury[J]. Acta Pharm Sin B, 2020, 10(9): 1634-1645. |
| [17] |
SONG H, MYLVAGANAM S M, WANG J, et al. Contributions of the hippocampal CA3 circuitry to acute seizures and hyperexcitability responses in mouse models of brain ischemia[J]. Front Cell Neurosci, 2018, 12: 278. |
| [18] |
GŁODZIK-SOBA ŃSKA L, SŁOWIK A, KOZUB J, et al. GABA in ischemic stroke. Proton magnetic resonance study[J]. Med Sci Monit, 2004, 10(Suppl 3): 88-93. |
| [19] |
KRIMER L S, GOLDMAN-RAKIC P S. Prefrontal microcircuits: membrane properties and excitatory input of local, medium, and wide Arbor interneurons[J]. J Neurosci, 2001, 21(11): 3788-3796. |
| [20] |
COSTA J F, DINES M, LAMPRECHT R. The role of rac GTPase in dendritic spine morphogenesis and memory[J]. Front Synaptic Neurosci, 2020, 12: 12. |
| [21] |
MAS R, ZUO Y. Synaptic modifications in learning and memory—a dendritic spine story[J]. Semin Cell Dev Biol, 2021. |




