随着我国人群饮食结构、生活方式等发生改变以及人口老龄化等因素,糖尿病在我国的发病率逐年升高且年轻化趋势明显,2型糖尿病(type 2 diabetes mellitus,T2DM)是其中最为常见的类型,占比超过90%[1]。肾损伤、肾功能降低是T2DM常见并发症,约40%的T2DM患者伴有肾功能下降[2]。由于肾脏储备功能强大,T2DM并发肾损伤患者早期症状不明显,一旦出现蛋白尿等临床症状,肾脏微结构已严重病变、难以逆转,治疗难度大、预后不佳。因此,早期开展T2DM肾损伤的防治工作具有重要意义。T2DM并发肾功能损伤的机制较为复杂,氧化应激、炎症反应在其中发挥重要作用,动物实验[3]及人群研究[4]证实雌激素可通过抗氧化、抗炎效应改善糖尿病患者肾功能、延缓肾功能损伤进展,但由于雌激素或雌激素类药物具有致癌、诱发心血管事件等多种副作用,临床应用具有局限性。雌马酚(equol,Eq)是植物雌激素类物质大豆异黄酮在体内的重要代谢产物,能够模拟雌激素样作用,发挥抗氧化应激[5]、抗炎症反应[6]等多种生物学效应,且能避免雌激素所产生的副作用。本课题组通过建立T2DM大鼠模型,探讨Eq对T2DM的肾脏保护效应及对肾脏组织氧化应激、炎症因子水平的影响和内在机制。
1 材料与方法 1.1 材料高脂高糖饲料成分:10%猪油、20%蔗糖、2%胆固醇、0.5%胆酸钠、67.5%普通饲料(重庆腾鑫生物技术有限公司),普通饲料由陆军军医大学实验动物中心提供,符合动物饲料国家标准。主要材料:链脲佐菌素(≥98%,美国Sigma公司),血糖仪及血糖试纸(罗氏公司),细胞核蛋白提取试剂盒(南京建成生物工程研究所),S-Eq[大赛璐药物手性技术(上海)有限公司],血清尿素氮(blood urea nitrogen, BUN)、肌酐(creatinine,CREA)、尿酸(uric acid,UA)试剂盒(南京建成生物工程研究所),TNF-α、IL-6、IL-1β、ELISA试剂盒(慧佳科技有限公司),丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒(南京建成生物工程研究所),核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)多克隆抗体(Proteintech公司)、血红素氧合酶-1(heme oxygenase 1,HO-1)多克隆抗体(Santa Cruz公司),甘油醛-3-磷酸脱氢酶(glyceraldehyde 3-phosphate dehydrogenase,GAPDH)单克隆抗体,RT-PCR逆转录试剂盒(QIAGEN GmbH公司),全波长多功能酶标仪(Thermo scientific公司),Bio-Rad CFX connect定量PCR仪(BIO-RAD公司)。
1.2 动物雄性SD大鼠,6周龄,SPF级,体质量(200±20)g,北京华阜康生物科技股份有限公司提供,许可证号:SCXK(京)2019-008。
1.3 方法 1.3.1 建立T2DM大鼠模型50只SD大鼠进入陆军军医大学动物实验中心[室温(21±2)℃,湿度60%~70%,昼夜明暗交替照明系统,每12 h轮流照明]适应性喂养1周后,分为对照组(10只)、建模组(40只)。参考文献[7]报道的高脂高糖联合链脲佐菌素构建T2DM大鼠模型方法及本课题组前期T2DM大鼠建模预实验采用4周高脂高糖饮食诱导联合30 mg/kg剂量链脲佐菌素腹腔注射建模结果(大鼠T2DM成模1周内死亡率24%),采用4周高脂高糖饮食诱导联合25 mg/kg剂量链脲佐菌素腹腔注射进行建模,初次腹腔注射链脲佐菌素1周后测空腹血糖(FPG),对FPG<11.0 mmol/L的大鼠再次腹腔注射25 mg/kg链脲佐菌素,1周后测FPG ≥11.0 mmol/L认定为T2DM建模成功,共成模34只,成模率85%。
1.3.2 Eq干预按随机数字表法将T2DM成模大鼠进一步分为Eq高剂量组(EqH,n=8)、中剂量组(EqM,n=8)、低剂量组(EqL,n=9)和模型组(n=9),分别按80、40、20 mg·kg-1·d-1剂量进行Eq灌胃干预,模型组、对照组给予同等剂量溶剂(玉米油)灌胃处理,连续干预12周。Eq干预期间,对照组给予普通饲料喂养,其余各组继续高脂高糖饲料喂养,每周检测大鼠体质量、FPG,记录大鼠精神状态、进食量。
1.3.3 标本取材8%水合氯醛腹腔注射麻醉大鼠,经股动脉取血,静置4 h离心后获取血清,-80 ℃冷冻保存;冰上剥离大鼠双侧肾组织,剔除脂肪、筋膜并用生理盐水冲洗,左侧肾脏-80 ℃冷冻保存;右侧肾脏经多聚甲醛固定备用。
1.3.4 血清肾功能指标检测采用BUN、CREA、UA检测试剂盒,分别检测大鼠血清BUN、CREA、UA水平,具体方法严格按照试剂盒说明书。
1.3.5 肾组织氧化应激和炎症因子水平检测取冻存大鼠肾组织100 mg,按照质量(mg) ∶体积(mL)=1 ∶10比例加入RIPA细胞裂解液,冰上操作,匀浆裂解,12 000×g离心5 min后收取上清,BCA蛋白浓度测定试剂盒测定上清液蛋白浓度,MDA等试剂盒检测上清液氧化应激指标(MDA、SOD)及炎症因子指标(IL-1β、IL-6、TNF-α)水平,具体操作严格按照试剂盒说明书完成。
1.3.6 肾组织形态学观察取多聚甲醛固定的肾组织,经脱水透明、石蜡包埋、切片、脱蜡等处理,进行苏木精-伊红(HE)染色、过碘酸雪夫(PAS)染色及封固处理,正置荧光显微镜下观察肾组织显微结构并拍照记录。
1.3.7 Western blot检测取冻存大鼠肾皮质组织分别提取总蛋白和核蛋白,测定各组上清蛋白浓度并定量处理,按照常规操作进行电泳、转膜,5%脱脂牛奶封闭1 h后,一抗4 ℃孵育过夜,TBST洗膜后二抗室温孵育1 h,ECL显影,总蛋白以GAPDH为内参,核蛋白以Lamin B2为内参,ImageG软件计算各组蛋白相对表达量。
1.3.8 RT-PCR检测取冻存大鼠肾皮质组织加入TRIzol液氮研磨,按照TRIzol RNA提取试剂盒说明书操作提取肾组织总RNA,检测RNA纯度及浓度,加入反转录引物经反转录获取cDNA。配置10 μL PCR反应体系(Mix 5 μL,引物P1 0.5 μL,引物P2 0.5 μL,模板4 μL),以GAPDH为内参,反应条件设置为:95 ℃预变性30 s,95 ℃变性5 s,59 ℃退火15 s,72 ℃延伸20 s,45个循环。扩增后建立溶解曲线,计算目的基因相对表达量。引物序列见表 1。
| 基因 | 引物序列(5′→3′) | 扩增长度/bp | |
| P1 | P2 | ||
| GAPDH | CCATGTTTGTGATGGGTGTG | GGATGCAGGGATGATGTTCT | 245 |
| Nrf2 | TGGCAGAGACATTCCCATTTG | CTGCCAAACTTGCTCCATGT | 197 |
| HO-1 | ACGCATATACCCGCTACCTG | TCTCCAGAGTGTTCATGCGA | 177 |
1.4 统计学分析
采用SPSS 19.0统计软件进行分析。计量资料用x±s表示,多组间比较采用单因素方差分析,两两比较采用LSD检验。检验标准α=0.05。
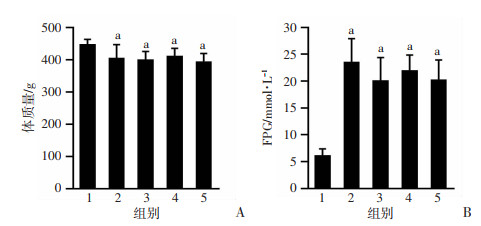
2 结果 2.1 建模成功情况通过4周高脂高糖饮食诱导联合链脲佐菌素腹腔注射后,成功建模T2DM大鼠34只,成模大鼠呈现出明显多饮多食多尿伴体质量减轻,毛色暗淡黄染,将T2DM成模大鼠按1.3.2分组。在Eq干预前检测各组大鼠体质量、FPG,结果显示对照组大鼠体质量显著高于各建模实验组(P < 0.05),FPG显著低于各建模实验组(P < 0.05),各建模实验组组间相比差异无统计学意义(图 1)。在随后的干预期间,5只大鼠死亡,其中EqH组3只、EqM组1只、模型组1只。
|
|
1:对照组(n=10);2:模型组(n=9);3:EqL组(n=9);4:EqM组(n=8);5:EqH组(n=8);a:P < 0.05,与对照组比较 A:各组大鼠体质量比较;B:各组大鼠FPG比较 图 1 各组大鼠建模完成后体质量、FPG比较 |
2.2 Eq干预改善T2DM大鼠肾功能
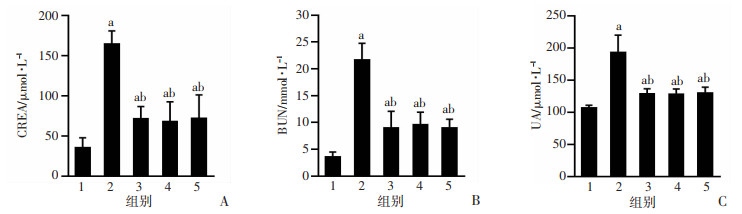
12周后,与对照组相比,模型组大鼠血清BUN、CREA、UA水平均显著升高(P < 0.05),各Eq干预组血清BUN、CREA、UA水平均较模型组显著降低,差异具有统计学意义(P < 0.05),各Eq干预组组间相比,血清BUN、CREA、UA水平差异无统计学意义(P>0.05),见图 2。
|
|
1:对照组(n=10);2:模型组(n=8);3:EqL组(n=9);4:EqM组(n=7);5:EqH组(n=5);a:P < 0.05,与对照组比较;b:P < 0.05,与模型组比较 A:各组大鼠CREA比较;B:各组大鼠BUN比较;C:各组大鼠UA比较 图 2 Eq干预12周后各组大鼠肾功能比较 |
2.3 Eq干预降低T2DM大鼠肾组织氧化应激、炎症因子水平
12周后,与对照组相比,模型组大鼠肾组织MDA、TNF-α、IL-6、IL-1β水平显著升高(P < 0.05),SOD水平显著降低(P < 0.05),而各Eq干预组肾组织MDA、TNF-α、IL-6、IL-1β水平均显著低于模型组(P < 0.05),SOD水平显著高于模型组(P < 0.05),各Eq干预组组间相比差异无统计学意义,见图 3。

|
|
1:对照组(n=10);2:模型组(n=8);3:EqL组(n=9);4:EqM组(n=7);5:EqH组(n=5);a:P < 0.05,与对照组比较;b:P < 0.05,与模型组比较 A:各组大鼠MDA比较;B:各组大鼠SOD比较;C:各组大鼠TNF-α比较;D:各组大鼠IL-6比较;E:各组大鼠IL-1β比较 图 3 Eq干预12周后各组大鼠肾组织氧化应激、炎症因子水平比较 |
2.4 Eq干预改善T2DM大鼠肾组织显微结构
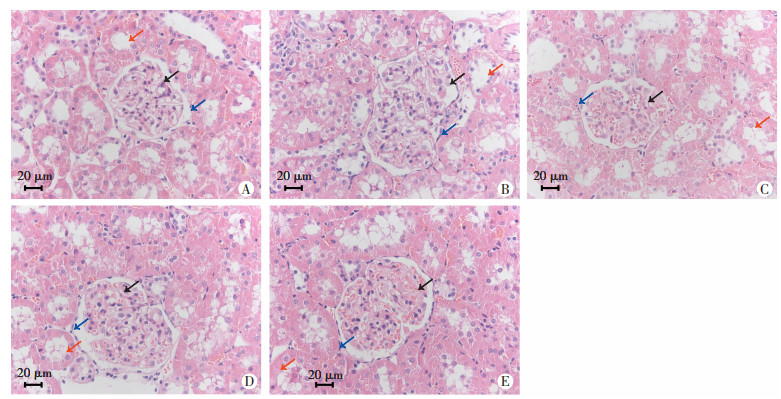
HE染色结果显示,对照组肾小球、肾小管显微结构正常,模型组肾小球体积增大,肾小囊基底膜增厚,肾小管萎缩、管腔扩张,各Eq干预组肾组织显微结构较模型组显著改善,见图 4。
|
| A:对照组;B:模型组;C:EqL组;D:EqM组;E:EqH组;红色箭头:肾小管; 黑色箭头:肾小球;蓝色箭头:肾小囊基底膜 图 4 HE染色观察各组大鼠肾组织病理学变化 |
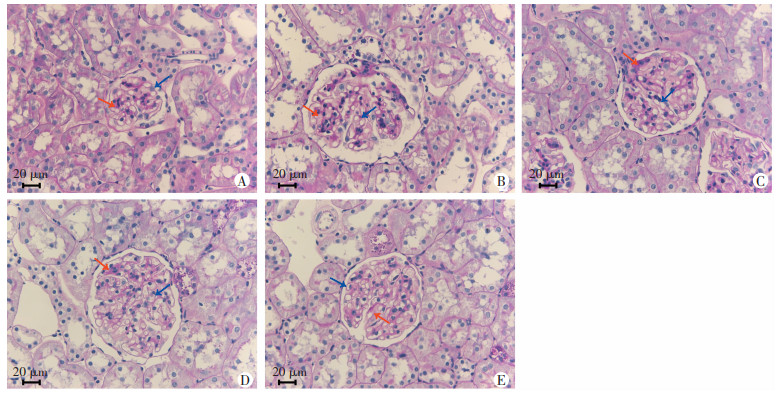
PAS染色结果显示,对照组肾小球显微结构正常,模型组肾小球系膜基质增多,肾小球基底膜增厚,各Eq干预组肾组织显微结构较模型组显著改善,见图 5。
|
| A:对照组;B:模型组;C:EqL组;D:EqM组;E:EqH组;红色箭头:肾小球系膜基质;蓝色箭头:肾小球基底膜 图 5 PAS染色观察各组大鼠肾组织病理学变化 |
2.5 Eq干预激活T2DM大鼠肾组织Nrf2/HO-1通路
Western blot检测结果显示,与对照组相比,模型组大鼠肾组织总Nrf2、核Nrf2以及HO-1蛋白表达量显著降低(P < 0.05),Eq干预组肾组织总Nrf2、核Nrf2以及HO-1蛋白表达量较模型组显著增加(P < 0.05),各Eq干预组组间相比,肾组织总Nrf2、核Nrf2以及HO-1蛋白表达量差异无统计学意义,见图 6。
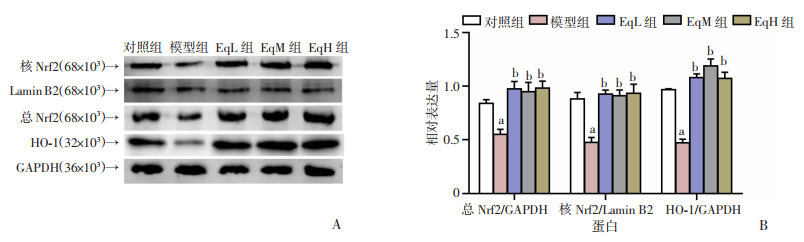
|
| A:Western blot检测结果;B:半定量分析;a:P < 0.05,与对照组比较;b:P < 0.05,与模型组比较 图 6 各组大鼠肾组织Nrf2、HO-1蛋白的表达 |
RT-PCR结果显示,模型组肾组织Nrf2、HO-1 mRNA水平较对照组显著降低(P < 0.05),而各Eq干预组肾组织Nrf2、HO-1 mRNA水平均显著高于模型组(P < 0.05),各Eq干预组组间相比,肾组织Nrf2、HO-1 mRNA水平差异无统计学意义,与Western blot检测结果相吻合,见图 7。
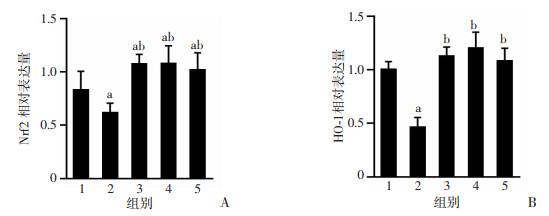
|
| 1:对照组(n=10);2:模型组(n=8);3:EqL组(n=9);4:EqM组(n=7);5:EqH组(n=5);a:P < 0.05,与对照组比较;b:P < 0.05,与模型组比较 图 7 各组大鼠肾组织Nrf2(A)、HO-1(B) mRNA相对表达水平 |
3 讨论
天然植物化合物大豆异黄酮具有抗氧化应激、抗炎、防治骨质疏松症、抗肿瘤等多种生物学效应,Eq是大豆异黄酮在体内的重要代谢产物,对ERβ具有高度亲和力,效能与17β-雌二醇接近,且诱发转录能力在异黄酮类衍生物中最强,在发挥雌激素效应的同时还能避免雌激素的诱发心血管事件、致癌等多种副作用[8-9],是大豆异黄酮发挥生物学效应的主要途径之一[10]。研究表明,由于饮食习惯及肠道微环境差异,仅30%西方人群、50%~60%亚洲人群能够将食物中的大豆异黄酮代谢为Eq[11]。关于Eq生物学效应的研究较少,本课题组通过建立T2DM大鼠模型,探讨Eq对T2DM大鼠的肾保护效应、肾组织氧化应激和炎症反应的影响及其可能机制。
3.1 Eq的抗氧化应激及抗炎效应研究进展氧化应激、炎症反应是多种疾病发生、发展的核心因素,持续的氧化应激可导致慢性炎症反应,慢性炎症反应进一步诱发糖尿病肾损伤、心血管疾病、癌症、皮肤病等多种慢性疾病。ZHANG等[12]采用Eq干预人脐静脉内皮细胞发现,Eq能够以时间和剂量依赖性方式通过PI3K/Akt信号通路提升内皮细胞Nrf2、HO-1蛋白和mRNA表达水平,保护内皮细胞免受过氧化氢诱导的氧化应激所致急性细胞死亡,并且在ERβ抑制剂预处理后,Eq对Nrf2/HO-1通路的激活效应显著降低,提示Eq可能通过ERβ激活Nrf2/HO-1通路发挥抗氧化应激效应。ACHARJEE等[6]对绝经后代谢综合征妇女开展大豆饮食干预研究,根据是否能将大豆代谢为Eq将患者分为产Eq者和非产Eq者,研究表明与非产Eq患者相比,产Eq患者机体C反应蛋白等炎症因子水平显著降低,甘油三酯、体质量指数等指标显著改善。KANG等[13]开展体内和体外研究探讨Eq的抗氧化、抗炎效应,结果显示Eq能够降低脂多糖诱导的小鼠腹膜黏附细胞和体外培养RAW264.7细胞核因子κB生成,抑制一氧化氮合酶基因表达、降低一氧化氮水平,发挥抗氧化抗炎效应。
3.2 Eq改善T2DM大鼠肾功能指标、减轻肾组织显微结构损伤BUN、CREA、UA是评价肾功能的常用血清学指标[14],BUN是蛋白质体内代谢的主要终产物,CREA主要由肌肉代谢产生,UA是嘌呤代谢产物,均是反映肾功能减退的经典指标。在本研究中,T2DM成模12周后,模型组大鼠血清BUN、CREA、UA含量显著高于对照组(P < 0.05),提示T2DM大鼠肾功能显著降低,而各Eq干预组大鼠血清BUN、CREA、UA水平均显著低于模型组(P < 0.05),表明Eq可显著改善T2DM大鼠肾功能。此外,本研究还通过HE染色和PAS染色观察肾脏组织显微结构变化,HE染色结果显示模型组大鼠肾小球增大、肾小囊基底膜增厚,肾小管萎缩、管腔扩张,PAS染色结果显示模型组大鼠肾小球基底膜增厚、系膜基质增多,与钟娟等[15]报道糖尿病大鼠肾脏病变染色结果一致,进一步证实T2DM导致大鼠肾脏显微结构显著受损,而各Eq干预组HE染色和PAS染色结果显示T2DM大鼠肾小球、肾小管等显微结构损伤均较模型组明显减轻,即Eq干预可显著减轻T2DM大鼠肾组织损伤、有助于改善肾功能。
3.3 Eq降低T2DM大鼠肾组织氧化应激及炎症因子水平氧化应激是糖尿病肾损伤的重要机制。T2DM患者由于胰岛素抵抗引发糖脂代谢异常,血脂水平升高,游离脂肪酸增多,活性氧(ROS)生成增加,机体氧化应激水平升高。而ROS对细胞具有毒性损伤作用,过量生成的ROS可损伤细胞DNA,破坏肾小球滤过膜完整性,使之通透性升高,加重肾损伤[16]。此外,高糖环境可致线粒体功能障碍,诱发线粒体裂变,开放线粒体膜通道孔,导致大量促凋亡蛋白进入胞质,诱发线粒体依赖性细胞凋亡,损害肾功能[17]。炎症反应是糖尿病肾损伤发生、发展的另一重要机制,T2DM患者机体血清中CRP、IL-6、IL-18等炎症因子水平显著升高[18],而过量表达的IL-1β、IL-6、TNF-α等炎症因子可激活肾小管上皮细胞TGF-β,抑制细胞周期G1转化为S期,从而抑制细胞增殖分裂并促进纤维化[19]。此外,IL-6可抑制内皮一氧化碳合酶、脂联素分泌启动内皮损伤[20],TNF-α可诱导肾小管上皮细胞发生RIP3/MLKL介导的程序性坏死等[21]。在本研究中,为评价各组大鼠肾组织氧化应激及炎症反应水平,选取SOD、MDA、IL-6、TNF-α、IL-1β等指标进行观察比较。实验结果显示,模型组大鼠肾组织氧化应激和炎症因子水平显著高于对照组,抗氧化能力降低,而各Eq干预组在接受Eq灌胃处理后,大鼠肾组织氧化应激和炎症因子水平显著降低,抗氧化能力提升,表明Eq可显著降低T2DM大鼠肾组织氧化应激和炎症反应、提升肾组织抗氧化能力,从而发挥肾保护效应,延缓糖尿病肾损伤的发生、发展。
3.4 Eq激活T2DM大鼠肾组织Nrf2/HO-1通路Nrf2是机体重要转录调节因子,对氧化还原反应高度敏感,能够调节多种抗氧化、抗炎基因表达,在机体应对氧化应激损伤、炎症反应中处于核心地位,当机体受到氧化应激刺激时,可通过PI3K、MAPK、PKC等信号通路或Keap-1蛋白构象变化激活Nrf2,促进其表达增多和核转位,从而启动下游抗氧化基因转录。HO-1能够调控血红素代谢分解,可将血红素降解为胆绿素、一氧化碳、铁离子(Fe2+),是Nrf2抗氧化、抗炎效应的主要媒介。Nrf2调控HO-1表达并构成的Nrf2/HO-1通路,在应对组织氧化应激损伤和炎症反应中发挥重要作用[22]。多个研究表明,Nrf2/HO-1通路与T2DM肾脏氧化应激、炎症反应密切相关,因此在本次研究中对T2DM大鼠肾皮质组织Nrf2、HO-1蛋白和mRNA表达情况进行检测[23-24]。根据本实验结果,模型组T2DM大鼠肾组织总Nrf2、HO-1的蛋白和mRNA表达水平均低于对照组,核Nrf2蛋白水平亦低于对照组,此结果与刘文等[25]报道结果一致,分析原因在于肾组织发生氧化应激损伤、细胞活性降低,蛋白表达能力下降,Eq干预后,T2DM大鼠肾组织Nrf2、HO-1的蛋白和mRNA表达水平显著增强,进一步检测核Nrf2蛋白量发现,各Eq干预组核Nrf2蛋白量显著高于模型组,即Eq干预不仅能够提高总Nrf2的表达,还可促进Nrf2的核转位并激活HO-1等基因表达,即Nrf2/HO-1通路可能在Eq的抗氧化应激、抗炎效应中发挥重要作用。
本研究发现植物雌激素类物质Eq对T2DM大鼠的肾脏保护效应,且Nrf2/HO-1通路可能在Eq抗氧化应激、抗炎及改善肾功能效应中发挥重要作用,对于植物雌激素类物质的应用及T2DM人群的膳食指导具有重要意义。综上所述,Eq能够降低T2DM大鼠肾组织氧化应激和炎症因子水平,改善肾功能指标、发挥肾脏保护效应,Nrf2/HO-1通路可能在其中发挥重要作用。
本研究结果仍有待进一步完善,如Eq的肾功能保护效应是否存在最适剂量、对钙磷代谢的影响,以及这些效应机制是否通过雌激素受体介导、相关受体下游信号通路等,需在后续研究中进一步深入探索。
| [1] |
KHAN R M M, CHUA Z J Y, TAN J C, et al. From pre-diabetes to diabetes: diagnosis, treatments and translational research[J]. Medicina (Kaunas), 2019, 55(9): 546. |
| [2] |
Kidney Disease: Improving Global Outcomes (KDIGO) Diabetes Work Group. KDIGO 2020 clinical practice guideline for diabetes management in chronic kidney disease[J]. Kidney Int, 2020, 98(4S): S1-S115. |
| [3] |
MARIC C, SANDBERG K, HINOJOSA-LABORDE C. Glomerulosclerosis and tubulointerstitial fibrosis are attenuated with 17beta-estradiol in the aging Dahl salt sensitive rat[J]. J Am Soc Nephrol, 2004, 15(6): 1546-1556. |
| [4] |
HADJADJ S, GOURDY P, ZAOUI P, et al. Effect of raloxi-fene: a selective oestrogen receptor modulator: on kidney function in post-menopausal women with type 2 diabetes: results from a randomized, placebo-controlled pilot trial[J]. Diabet Med, 2007, 24(8): 906-910. |
| [5] |
蔡源发, 张华明, 钮文异, 等. 雌马酚对大肠癌细胞增殖的影响[J]. 北京大学学报(医学版), 2017, 49(3): 383-387. CAI Y F, ZHANG H M, NIU W Y, et al. Effects of equol on colon cancer cell proliferation[J]. J Peking Univ Heal Sci, 2017, 49(3): 383-387. |
| [6] |
ACHARJEE S, ZHOU J R, ELAJAMI T K, et al. Effect of soy nuts and equol status on blood pressure, lipids and inflammation in postmenopausal women stratified by metabolic syndrome status[J]. Metabolism, 2015, 64(2): 236-243. |
| [7] |
GHEIBI S, KASHFI K, GHASEMI A. A practical guide for induction of type-2 diabetes in rat: incorporating a high-fat diet and streptozotocin[J]. Biomed Pharmacother, 2017, 95: 605-613. |
| [8] |
SEKIKAWA A, IHARA M, LOPEZ O, et al. Effect of S-equol and soy isoflavones on heart and brain[J]. Curr Cardiol Rev, 2019, 15(2): 114-135. |
| [9] |
HOD R, MANIAM S, MOHD NOR N H. A systematic review of the effects of equol (soy metabolite) on breast cancer[J]. Molecules, 2021, 26(4): 1105. |
| [10] |
SETCHELL K D, CLERICI C. Equol: history, chemistry, and formation[J]. J Nutr, 2010, 140(7): 1355S-1362S. |
| [11] |
RAFⅡ F. The role of colonic bacteria in the metabolism of the natural isoflavone daidzin to equol[J]. Metabolites, 2015, 5(1): 56-73. |
| [12] |
ZHANG T, LIANG X Y, SHI L Y, et al. Estrogen receptor and PI3K/Akt signaling pathway involvement in S-(-) equol-induced activation of Nrf2/ARE in endothelial cells[J]. PLoS One, 2013, 8(11): e79075. |
| [13] |
KANG J S, YOON Y D, HAN M H, et al. Equol inhibits nitric oxide production and inducible nitric oxide synthase gene expression through down-regulating the activation of Akt[J]. Int Immunopharmacol, 2007, 7(4): 491-499. |
| [14] |
陈静, 刘丽. 常用肾功能检测指标在透析治疗效果评价上的应用价值[J]. 检验医学与临床, 2017, 14(8): 1173-1176. CHEN J, LIU L. The application value of common renal function test indexes in the evaluation of dialysis treatment effect[J]. Lab Med Clin, 2017, 14(8): 1173-1176. |
| [15] |
钟娟, 陈静, 青姚, 等. 川芎嗪通过抑制PI3K/Akt/mTOR通路诱导自噬改善糖尿病肾病大鼠肾损害[J]. 天津医药, 2019, 47(4): 395-400. ZHONG J, CHEN J, QING Y, et al. Experimental study of ligustrazine on improving renal damage in diabetic nephropathy rats by inhibiting the PI3K/Akt/mTOR pathway and inducing autophagy[J]. Tianjin Med J, 2019, 47(4): 395-400. |
| [16] |
张灵灵, 郭利芹, 徐可. Gli2对高糖条件下肾小管上皮细胞凋亡及ROS水平影响[J]. 中国免疫学杂志, 2018, 34(6): 830-834, 839. ZHANG L L, GUO L Q, XU K. Effect of Gli2 on apoptosis and ROS level in renal tubular epithelial cells under high glucose[J]. Chin J Immunol, 2018, 34(6): 830-834, 839. |
| [17] |
李曾一, 王松, 高宛, 等. 下调Drp1对高糖条件下肾小管上皮细胞凋亡、氧化应激及炎症因子表达的影响[J]. 郑州大学学报(医学版), 2021, 56(4): 534-538. LI Z Y, WANG S, GAO W, et al. Effects of down-regulation of Drp1 on renal tubular epithelial cell apoptosis, oxidative stress and expressions of inflammatory factors under high glucose conditions[J]. J Zhengzhou Univ Med Sci, 2021, 56(4): 534-538. |
| [18] |
周建华, 李晓华, 贝鹏剑, 等. 早期2型糖尿病肾病患者血糖波动与氧化应激、炎症及单核细胞自噬的相关性[J]. 中国老年学杂志, 2021, 41(1): 32-36. ZHOU J H, LI X H, BEI P J, et al. Correlation of blood glucose fluctuation with oxidative stress, inflammation and monocyte autophagy in patients with early type 2 diabetic nephropathy[J]. Chin J Gerontol, 2021, 41(1): 32-36. |
| [19] |
KINASHI H, ITO Y, SUN T, et al. Roles of the TGF-β—VEGF-C pathway in fibrosis-related lymphangiogenesis[J]. Int J Mol Sci, 2018, 19(9): 2487. |
| [20] |
SU H, LEI C T, ZHANG C. Interleukin-6 signaling pathway and its role in kidney disease: an update[J]. Front Immunol, 2017, 8: 405. |
| [21] |
朱永俊, 俞容, 李晓燕, 等. AngⅡ联合TNF-α促使肾小管上皮HK-2细胞发生程序性坏死[J]. 中国病理生理杂志, 2021, 37(6): 1084-1090. ZHU Y J, YU R, LI X Y, et al. Angiotension Ⅱ combined with TNF-α promotes necroptosis of renal tu-bular epithelial HK-2 cells[J]. Chin J Pathophysiol, 2021, 37(6): 1084-1090. |
| [22] |
张昊悦, 赵蓓, 王业皇, 等. 大黄素通过调节Nrf2/HO-1和MAPKs抑制炎症和氧化应激机制研究[J]. 中国免疫学杂志, 2021, 37(9): 1063-1068. ZHANG H Y, ZHAO B, WANG Y H, et al. Emodin inhibits inflammation and oxidative stress by regulating Nrf2/HO-1 and MAPKs[J]. Chin J Immunol, 2021, 37(9): 1063-1068. |
| [23] |
徐成. 核因子E2相关因子2信号通路与肾脏疾病[J]. 肾脏病与透析肾移植杂志, 2021, 30(2): 165-169. XU C. Role of nuclear factor erythroid 2-related factor 2 in kidney disease[J]. Chin J Nephrol Dial Transplant, 2021, 30(2): 165-169. |
| [24] |
RIZZO M, ABATE N, CHANDALIA M, et al. Liraglutide reduces oxidative stress and restores heme oxygenase-1 and ghrelin levels in patients with type 2 diabetes: a prospective pilot study[J]. J Clin Endocrinol Metab, 2015, 100(2): 603-606. |
| [25] |
刘文, 章尹岗, 别志霞, 等. 黄芪甲苷对肥胖糖尿病大鼠肾脏氧化应激、Nrf2蛋白表达和胰岛β细胞的影响[J]. 疑难病杂志, 2019, 18(1): 67-71, 109. LIU W, ZHANG Y G, BIE Z X, et al. Effects of astragaloside on oxidative stress, Nrf2 protein expression and islet beta cells in obese diabetic rats[J]. Chin J Difficult Complicat Cases, 2019, 18(1): 67-71, 109. |




