2. 100084 北京,北京体育大学运动人体科学学院
2. Sport Science College, Beijing Sport University, Beijing, 100084, China
肾脏是运动中容易受损的器官之一,正常情况下,肾脏血液大量供应,维持其正常功能,运动增加肌肉的血液灌注,同时导致肾脏灌注不足[1]。运动期间肾的低灌注是一个生理过程,而临床上,它是肾氮质血症前期的重要标志,运动期间肾血流量最多可比静息状态下降70%,肾血流量的大幅下降会导致肾小球滤过率降低,从而导致“功能性”急性肾损伤[2]。一般认为,中低程度“功能性”急性肾损伤是可逆的,可完全恢复[3-4],损伤的最终结果取决于细胞修复与再生之间的平衡,包括炎性浸润、凋亡、去分化、表观遗传因素和纤维化改变等过程[5]。修复不良、再生紊乱、更细微和反复的损伤均可能进一步损伤肾功能,甚至发展为“结构性”损伤[6]。因此,对大强度力竭运动导致肾脏炎症损伤的干预作用研究至关重要。
白藜芦醇(resveratrol,RSV)作为研究较充分的多酚之一,1997年Science首次报道了JANG等[7]关于白藜芦醇介导抗炎作用的研究,20余年来,大量数据证实了其抗炎、抗氧化等多种生理活性和功能[8]。白藜芦醇肾脏保护作用已在大量体内外实验和临床试验中得到了证实[9]。近年来,白藜芦醇补充在男性职业篮球运动员[10]、消防员[11]等大强度运动人群中的抗炎作用已有了初步的探讨,然而,大强度运动致肾组织炎症损伤是否与NOD样受体蛋白3(NOD-like receptors,NLRP3)炎性小体过度激活有关,以及补充白藜芦醇可否通过介导NLRP3炎性小体通路发挥肾脏保护作用尚需更深入的研究。因此,本研究选择大鼠力竭跑台运动模型,模拟人体大强度运动的极限状态,探讨补充白藜芦醇对力竭运动大鼠肾脏炎症损伤的作用及其可能机制。
1 材料与方法 1.1 实验动物与分组36只SD雄性大鼠,8周龄,体质量(340.8±15.2)g,购自维通利华实验中心,动物许可证号:SCXK(京)2018-0006,于北京体育大学SPF级动物实验室饲养,按国家标准固体饲料喂养。将大鼠按随机数字表法分为对照组(Con组,8只)、白藜芦醇组(Rsv组,8只)、力竭运动组(Ex组,10只)、力竭运动+白藜芦醇组(Ex+Rsv组,10只)。Con组和Rsv组普通饲养,Ex组和Ex+Rsv组进行4周力竭跑台训练。
1.2 药品与试剂白藜芦醇(美国MCE公司,批号HY-16561,纯度99%);NLRP3兔多克隆抗体、caspase-1鼠单克隆抗体、ASC兔多克隆抗体、IL-1β兔多克隆抗体(美国Novus公司,批号分别为NBP2-12446、NB100-56565、NBP1-78977、NB600-633);IL-18兔多克隆抗体(美国Abcam公司,批号Ab191860);NLRP3兔多克隆抗体(美国Proteintech公司,批号19771-1-AP);ASC鼠单克隆抗体(美国Santa公司,批号sc-514414);荧光(Cy3)标记羊抗小鼠IgG、荧光(FITC)标记羊抗兔IgG(美国Proteintech公司,批号分别为DyLight 594、DyLight 488);IL-1β、IL-18、IL-6、TNF-α酶联免疫试剂盒(北京金海科隅公司)。
1.3 仪器Allegra 25 R台式高速离心机(Beckman Coulter);LEICA RM2135病理切片机(德国RM公司);JB-P5组织包埋机(武汉俊杰电子有限公司);JJ-12J脱水机(武汉俊杰电子有限公司);Nikon 50i光学显微镜(日本Nikon公司);CM-2000B生物医学图像分析系统(北京航空航天大学);DYCZ-24DN垂直电泳仪,DYCZ-40电转仪(北京六一仪器厂);1652100型电转仪,GelDoc Go凝胶成像系统(美国Bio-Rad公司)。
1.4 力竭运动和白藜芦醇补充方案正式训练前进行3 d运动预适应,每天以10 m/min的速度进行跑台训练30 min。正式训练方案结合参考文献[12]和本实验室前期研究基础[13],进行4周大强度力竭训练,初始速度为10 m/min,每5分钟速度增加5 m/min,直至35 m/min,以最大速度运动至力竭。跑台坡度为10度,运动频率为1次/d,5 d/周,共进行4周,力竭判断标准为用毛刷驱赶不能坚持运动,停止运动后,大鼠翻身反射迟缓且30 min内不主动站起。白藜芦醇补充根据前期研究基础[13]及文献[14],Rsv组和Ex+Rsv组用专业灌胃针灌胃1次,灌胃剂量为50 mg/kg,灌胃体积5 mL/kg。Con组和Ex组灌胃等体积溶解液0.5%羧甲基纤维素钠。灌胃时间为每日8:00,持续4周。
1.5 检测指标 1.5.1 大鼠血清和尿肾功能生物标志物检测全自动生化分析仪检测血清肌酐(serum creatinine,Scr)和尿素氮(blood urea nitrogen,BUN)水平,双抗体夹心酶联免疫吸附检测尿中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinaseassociated lipocalin,NGAL)和肾损伤分子-1 (kidney injury molecule-1,KIM-1)水平。
1.5.2 HE染色观察大鼠肾组织形态学变化肾组织浸泡在多聚甲醛中,固定24 h;修剪组织,在自动脱水机中进行以下步骤:流水冲洗2 h、脱水、透明、浸蜡、包埋;切片机连续切片,厚度为4 μm;HE染色。采用Paller评分法对肾小管损伤程度评分:通过光学显微镜在40个连续选定的视野中评估扩张的肾小管、具有蛋白质管型的肾小管和间质炎症的肾小管进行评分,原始放大倍数为×400,按100个肾小管计分。评分标准:肾小管明显扩张为1分,刷状缘损伤为1分,脱落为2分;肾小管管腔内有脱落的、坏死的细胞为1分,管型为2分,总分5分。
1.5.3 Western blot检测肾脏NLRP3、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein,ASC)、cleaved caspase-1、IL-1β、IL-18蛋白表达蛋白变性;制胶、上样、电泳;转膜、封闭、一抗孵育、洗膜、二抗孵育;一抗稀释比为:NLRP3(NBP2-12446,1 ∶500),ASC(NBP1-78977,1 ∶1 000),IL-18(Ab191860,1 ∶2 000),IL-1β(NB600-633,1 ∶1 000),β-actin(CST4967,1 ∶1 000);ECL显色系统进行免疫印迹显色;晾干胶片,扫描胶片,用IPP分析胶片灰度值。
1.5.4 免疫荧光双染观察NLRP3和ASC共定位固定切片,血清封闭,加一抗,4 ℃孵育过夜;PBST浸洗切片处理后,加荧光二抗,37 ℃孵育1 h;血清封闭室温持续30 min;加一抗,4 ℃湿盒中避光孵育过夜;PBST浸洗切片处理后,加荧光二抗,37 ℃孵育1 h,抗体稀释比为:NLRP3(19771-1-AP,1 ∶100),ASC(sc-514414,1 ∶100),荧光(Cy3)标记羊抗小鼠IgG(DyLight 594,1 ∶100),荧光(FITC)标记羊抗兔IgG(DyLight 488,1 ∶100);PBST浸洗切片,检测第1种抗体选用的是绿色荧光,第2种选择红色荧光;对标本进行染核,用含抗荧光淬灭剂的封片液封片,荧光显微镜下观察:蓝色显示为细胞核,绿色为NLRP3的目标蛋白,红色为ASC的目标蛋白。
1.5.5 ELISA检测大鼠肾组织炎症因子浓度双抗体夹心酶联免疫吸附测定法(ELISA)检测大鼠肾组织中IL-1β、IL-18、IL-6和TNF-α的浓度。严格按照试剂盒说明书进行。
1.6 统计学分析实验结果表示为x±s,采用SPSS 21.0统计软件对实验数据进行分析,采用Shapiro-Wilk检验对数据进行正态分布检验,组间差异采用双因素方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 白藜芦醇对大鼠肾损伤生物标志物的影响大鼠尿肾功能生物标志物NGAL和KIM-1检测结果显示:Ex组显著高于Con组(P < 0.01),Ex+Rsv组显著低于Ex运动组(P < 0.05)。大鼠血清肾功能生物标志物Scr与BUN检测结果显示:Ex组显著高于Con组(P < 0.01),Ex+Rsv组的数值低于Ex组,但差异无统计学意义(表 1)。
| 组别 | NGEL/ng·mL-1 | KIM-1/pg·mL-1 | Scr/μmol·L-1 | BUN/mmol·L-1 |
| Con组 | 8.05±0.29 | 2.83±0.39 | 149.43±9.37 | 6.43±0.29 |
| Rsv组 | 8.03±0.35 | 3.01±0.50 | 151.98±9.86 | 6.59±0.31 |
| Ex组 | 12.09±1.48a | 10.66±1.39a | 176.96±17.01a | 7.79±0.63a |
| Ex+Rsv组 | 10.10±0.99b | 6.07±0.73b | 169.66±8.54 | 7.11±0.41 |
| a: P < 0.01,与Con组比较;b: P < 0.05,与Ex组比较 | ||||
2.2 白藜芦醇对大鼠肾组织形态结构的影响
大鼠肾脏组织HE染色结果显示(图 1):Con组肾小球结构完整,肾小球系膜细胞,内皮细胞等结构均正常。Rsv组肾小球毛细血管襻结构清晰,结构正常;肾小管上皮细胞结构正常。Ex组肾小球囊腔狭窄,血管球与囊腔壁界限不清楚,小管上皮细胞水肿,空泡变性,管腔扩张严重,管腔有少量脱落绒毛和上皮细胞,出现各种管型。Ex+Rsv组肾小球囊腔狭窄,部分血管球与囊腔壁界限不清楚,小管上皮细胞水肿、空泡变性和管腔扩张等程度较Ex组有所减轻。
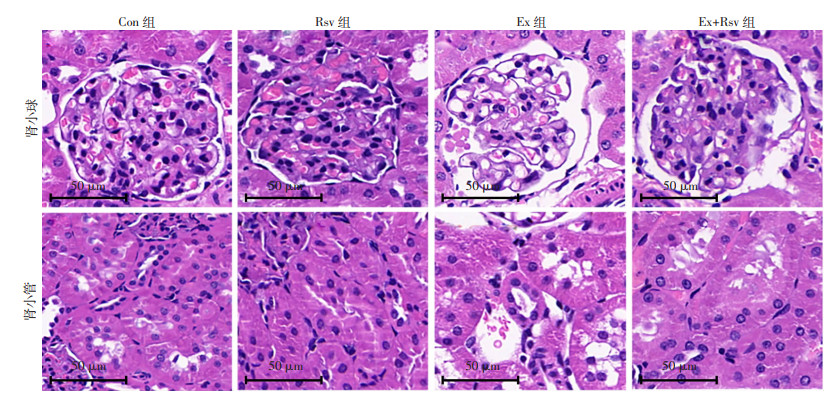
|
| 图 1 各组大鼠肾组织HE染色观察 |
与Con组相比,Ex组肾损伤Paller评分显著升高(P < 0.01)。与Ex组相比,Ex+Rsv组肾损伤Paller评分显著降低(P < 0.05)。Con组和Rsv组肾损伤Paller评分差异无统计学意义(图 2)。
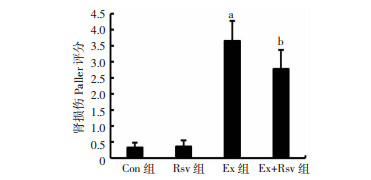
|
| a: P < 0.01,与Con组比较;b: P < 0.05,与Ex组比较 图 2 各组大鼠肾损伤Paller评分的比较 |
2.3 白藜芦醇对大鼠肾组织NLRP3炎性小体蛋白表达的影响
各组大鼠NLRP3、ASC和cleaved caspase-1蛋白表达呈现一致的变化(图 3),与Con组相比,Ex组大鼠肾组织的NLRP3、ASC和cleaved caspase-1蛋白表达均显著升高(P < 0.01),而Ex组相比,Ex+Rsv组的NLRP3、ASC和cleaved caspase-1蛋白表达则显著降低(P < 0.01)。
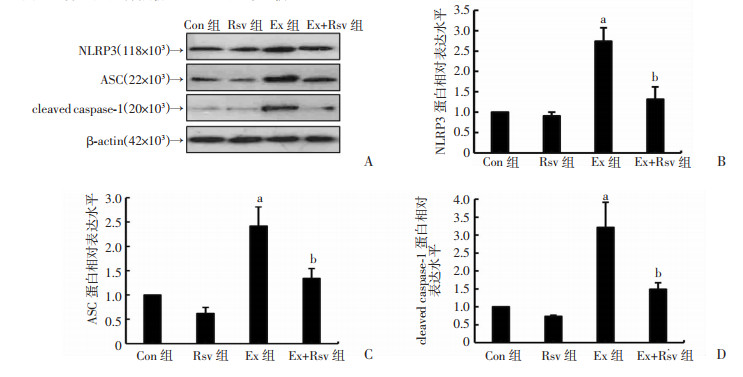
|
| A:Western blot检测各组大鼠肾组织NLRP3炎性小体蛋白表达;B~C:分别为NLRP3、ASC、cleaved caspase-1蛋白表达相对水平分析 a: P < 0.01,与Con组比较;b: P < 0.01,与Ex组比较 图 3 白藜芦醇对大鼠肾组织NLRP3炎性小体蛋白水平的影响 (n=6) |
2.4 白藜芦醇对大鼠肾组织NLRP3和ASC蛋白共定位的影响
大鼠肾组织免疫荧光双染结果显示(图 4):在Con组和Rsv组,只检测到微弱的NLRP3表达,而进行4周力竭运动后NLRP3高表达;在Con组中,ASC和NLRP3弥漫的分布于肾小管细胞质中,而Ex组大鼠肾小管组织内形成ASC斑点,且细胞质中NLRP3和ASC斑点高度共定位,提示力竭运动大鼠肾组织内NLRP3募集ASC蛋白形成NLRP3炎性小体;与Ex组相比,Ex+Rsv组细胞质中ASC蛋白的表达及ASC斑点的形成大幅度降低。

|
| 图 4 白藜芦醇对大鼠肾组织NLRP3和ASC蛋白共定位的影响 (荧光显微镜) |
2.5 白藜芦醇对大鼠肾组织IL-1β和IL-18蛋白表达的影响
IL-1β和IL-18蛋白表达变化趋势一致,Ex组显著高于Con组(P < 0.01),而Ex+Rsv组则显著低于Ex组(P < 0.01,图 5)。
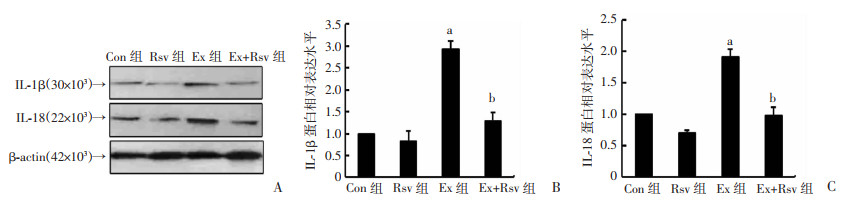
|
| A:Western blot检测各组大鼠肾组织IL-1β和IL-18蛋白表达;B、C:分别为IL-1β、IL-18蛋白表达相对水平分析 a: P < 0.01,与Con组比较;b: P < 0.01,与Ex组比较 图 5 白藜芦醇对大鼠肾组织IL-1β和IL-18蛋白表达的影响 (n=6) |
2.6 白藜芦醇对大鼠肾组织炎症因子浓度的影响
TNF-α、IL-1β、IL-18和IL-6呈现一致的变化,Ex组TNF-α、IL-1β、IL-18和IL-6均显著高于Con组(P < 0.01),Ex+Rsv组显著低于Ex组(P < 0.05,表 2)。
| 组别 | IL-1β | IL-18 | IL-6 | TNF-α |
| Con组 | 5.03±0.23 | 15.59±1.45 | 52.49±0.54 | 41.73±2.1 |
| Rsv组 | 5.02±0.19 | 15.42±1.16 | 53.37±1.03 | 41.77±1.82 |
| Ex组 | 6.61±0.22a | 18.77±0.80a | 64.12±1.15a | 51.47±1.90a |
| Ex+Rsv组 | 5.91±0.28b | 16.49±1.22b | 58.68±1.80b | 48.59±1.06b |
| a: P < 0.01,与Con组相比较;b: P < 0.05,与Ex组比较 | ||||
3 讨论
炎症是导致急性和慢性肾脏疾病发生、发展的关键机制之一,促炎细胞因子的水平升高是运动性肾损伤发生、发展机制的关键。定期进行中等强度的体育锻炼可以改善轻度炎症,但极限力竭运动或者剧烈运动会使血液循环中的促炎标记物显著增加。BERNECKER等[15]表明运动员马拉松赛后血浆中的TNF-α和IL-6显著上升,在ZALDIVAR等[16]的研究中,30 min的剧烈循环运动即可显著增加血浆中TNF-α的表达。越来越多的研究表明:促炎因子的过度分泌是出现一系列炎症反应、细胞凋亡等肾损伤表现的基础[17-18]。为进一步探究力竭运动对肾组织炎症反应的影响,本研究采用SD大鼠作为研究对象,进行4周力竭跑台运动,研究结果表明:4周力竭运动后,大鼠肾组织炎症因子IL-1β和IL-18水平均显著升高,炎症因子TNF-α和IL-6也显著升高,表明力竭运动导致大鼠促炎性细胞因子的大量分泌,触发了机体的炎症级联反应。本研究结果与相关研究结果一致,在郭林[18]的研究中,大负荷训练使大鼠肾组织IL-1β、TNF-α、IL-6蛋白表达显著上调。IL-1家族驱动的炎症在炎性损伤中发挥着关键作用,IL-18和IL-1β作为IL-1细胞因子家族的成员,不仅是炎症性疾病的重要介质,还可以增加其他细胞因子如IL-6、TNF-α等,上调黏附分子的表达,并促进炎症细胞的渗出。本研究中,力竭运动大鼠肾组织炎症因子IL-1β、IL-18、TNF-α和IL-6均显著上升,结合大鼠肾组织病理学观察结果,即运动组大鼠肾组织HE染色表明小管空泡变性和管腔扩张出现,管腔出现各种管型,这进一步印证了研究结果,即4周力竭跑台运动造成肾脏炎症损伤。
作为炎症反应的核心,NLRP3炎性小体在多种疾病中都发挥关键作用[19]。NLRP3炎性小体是由感受器蛋白NLRP3、衔接蛋白即凋亡相关斑点样蛋白(ASC)和效应蛋白即半胱氨酸蛋白酶caspase-1组成[20]。NLRP3炎性小体介导促炎细胞因子IL-1β和IL-18的成熟和释放,并激活肾脏细胞上的受体,从而导致其他促炎细胞因子的释放,在肾脏内形成炎症环境,典型的NLRP3/ASC/caspase-1/IL-1β/IL-18轴通过调节肾脏炎症而促进多种肾脏疾病的发展[21]。研究表明NLRP3炎性小体与急性肾损伤、慢性肾病、糖尿病肾病和晶体相关肾病等肾脏疾病的发病机制有关[22],因此,本研究探讨力竭运动大鼠的肾脏炎性损伤是否也与NLRP3炎性小体的过度激活有关。研究结果显示:力竭运动大鼠的肾组织中NLRP3、ASC蛋白表达均显著上调,研究结果与LI等[23]研究中急性运动对心肌NLRP3的影响结果一致。此外,NLRP3和ASC在肾小管的共定位进一步表明NLRP3炎性小体/IL-1β/IL-18轴在力竭运动诱导的肾小管损伤的进展中具有重要作用,肾内细胞可能通过促进ROS和其他促炎因子的产生来响应循环中的促炎介质,肾小管上皮细胞表达炎性体通路的成分,进一步促进了肾脏炎症。
越来越多的研究表明:对NLRP3的药理学抑制可改善各种肾脏疾病动物模型中的肾损伤。LIU等[24]研究表明真武汤通过调节外泌体抑制NF-κB/NLRP3通路保护大鼠IgA肾病,SEO等[25]研究表明吉米列汀通过下调NLRP3炎性小体减轻肾纤维化,HAN等[26]研究表明黄葵胶囊通过抑制NLRP3炎性小体激活和TLR4/NF-κB信号通路缓解糖尿病肾病肾小管上皮间质转化,来自草药的各种植物化学物可以通过抑制NLRP3炎性小体来改善糖尿病和糖尿病并发症[27]。基于此,我们推测白藜芦醇可以通过下调NLRP3炎性小体减轻运动性肾脏炎性损伤。在本研究中,两组大鼠在相同条件下进行力竭跑台运动,相比于力竭运动组,力竭+白藜芦醇组大鼠肾小管损伤特异性敏感标志物KIM-1、NGAL显著下降,肾组织促炎细胞因子显著下降,且力竭运动致肾组织结构改变得到改善,表明白藜芦醇的补充逆转了4周的力竭运动对大鼠肾脏的影响,减轻力竭运动致大鼠肾脏炎症反应从而实现肾脏保护作用。为进一步探究白藜芦醇补充是否通过调节NLRP3炎性小体改善力竭运动大鼠肾脏炎症损伤,本研究比较了补充白藜芦醇的力竭运动组和单纯力竭运动组中大鼠肾组织NLRP3炎性小体的变化,结果表明:力竭+白藜芦醇组大鼠肾组织NLRP3、ASC和cleaved caspase-1表达均显著降低,进一步的免疫荧光双染结果表明:NLRP3和ASC在肾小管的共定位减少,说明白藜芦醇补充通过一系列调控反应,下调了NLRP3炎性小体的表达,并最终降低了炎症因子水平。
综上所述,4周力竭跑台运动造成大鼠肾组织炎症性损伤,补充白藜芦醇可在体内发挥抗炎作用。白藜芦醇补充可有效抑制力竭运动时大鼠肾脏NLRP3炎性小体的过度激活,可以作为防治力竭运动致肾脏炎症保健产品开发的备选物之一。
| [1] |
VAN WIJCK K, LENAERTS K, VAN LOON L J, et al. Exercise-induced splanchnic hypoperfusion results in gut dysfunction in healthy men[J]. PLoS One, 2011, 6(7): e22366. |
| [2] |
CARVOUNIS C P, NISAR S, GURO-RAZUMAN S. Significance of the fractional excretion of urea in the differential diagnosis of acute renal failure[J]. Kidney Int, 2002, 62(6): 2223-2229. |
| [3] |
WOŁYNIEC W, KASPROWICZ K, GIEBUŁTOWICZ J, et al. Changes in water soluble uremic toxins and urinary acute kidney injury biomarkers after 10-and 100-km runs[J]. Int J Environ Res Public Health, 2019, 16(21): E4153. |
| [4] |
JOUFFROY R, LEBRETON X, MANSENCAL N, et al. Acute kidney injury during an ultra-distance race[J]. PLoS One, 2019, 14(9): e0222544. |
| [5] |
CHAWLA L S, EGGERS P W, STAR R A, et al. Acute kidney injury and chronic kidney disease as interconnected syndromes[J]. N Engl J Med, 2014, 371(1): 58-66. |
| [6] |
WOŁYNIEC W, KASPROWICZ K, RITA-TKACHENKO P, et al. Biochemical markers of renal hypoperfusion, hemoconcentration, and proteinuria after extreme physical exercise[J]. Medicina (Kaunas), 2019, 55(5): E154. |
| [7] |
JANG M, CAI L, UDEANI G O, et al. Cancer chemopreventive activity of resveratrol, a natural product derived from grapes[J]. Science, 1997, 275(5297): 218-220. |
| [8] |
MENG T T, XIAO D F, MUHAMMED A, et al. Anti-inflammatory action and mechanisms of resveratrol[J]. Molecules, 2021, 26(1): E229. |
| [9] |
WANG N, MAO L, YANG L, et al. Resveratrol protects against early polymicrobial sepsis-induced acute kidney injury through inhibiting endoplasmic reticulum stress-activated NF-κB pathway[J]. Oncotarget, 2017, 8(22): 36449-36461. |
| [10] |
ZAHEDI H S, JAZAYERI S, GHIASVAND R, et al. Effects of Polygonum cuspidatum containing resveratrol on inflammation in male professional basketball players[J]. Int J Prev Med, 2013, 4(Suppl 1): S1-S4. |
| [11] |
MACEDO R C, VIEIRA A, MARIN D P, et al. Effects of chronic resveratrol supplementation in military firefighters undergo a physical fitness test: a placebo-controlled, double blind study[J]. Chem Biol Interact, 2015, 227: 89-95. |
| [12] |
林喜秀. 力竭运动致大鼠慢性肾损伤机制及促红细胞生成素干预研究[D]. 长沙: 湖南师范大学, 2011. DOI: 10.7666/d.y1919806. LIN X X. Research of exhaustive exercise-induced chronic kidney injury mechanism and erythropoietin intervention in rats[D]. Changsha: Hunan Normal University, 2011. DOI: 10.7666/d.y1919806 |
| [13] |
李方, 曹建民, 王传军, 等. 白藜芦醇通过调节SIRT1/NF-κB通路减轻力竭训练致大鼠肾的炎症反应[J]. 中国生物化学与分子生物学报, 2019, 35(7): 773-779. LI F, CAO J M, WANG C J, et al. Resveratrol reduces renal inflammatory response induced by exhaustive exercise in rats by regulating SIRT1/NF-κB pathway[J]. Chin J Biochem Mol Biol, 2019, 35(7): 773-779. |
| [14] |
王学龄. 白藜芦醇通过调节SIRT1缓解高糖刺激的肾小管上皮细胞损伤[D], 济南: 山东大学, 2017. WANG X L. Resveratrol relieves renal tubular epithelial cell damage stimulated by high glucose by regulating SIRT1[D], Jinan: Shandong University, 2017. |
| [15] |
BERNECKER C, SCHERR J, SCHINNER S, et al. Evidence for an exercise induced increase of TNF-α and IL-6 in marathon runners[J]. Scand J Med Sci Sports, 2013, 23(2): 207-214. |
| [16] |
ZALDIVAR F, WANG-RODRIGUEZ J, NEMET D, et al. Constitutive pro-and anti-inflammatory cytokine and growth factor response to exercise in leukocytes[J]. J Appl Physiol (1985), 2006, 100(4): 1124-1133. |
| [17] |
RONCAL-JIMENEZ C, LANASPA M A, JENSEN T, et al. Mechanisms by which dehydration may lead to chronic kidney disease[J]. Ann Nutr Metab, 2015, 66(Suppl 3): 10-13. |
| [18] |
郭林. 大负荷训练导致大鼠肾组织微细结构变化和分子调控机理的探讨[D]. 北京: 北京体育大学, 2005. GUO L. Change of renal tissue micro-structure in rats resulted from load training and mechanisms of molecule regulation[D]. Beijing: Beijing Sport University, 2005. |
| [19] |
LAMKANFI M, DIXIT V M. Mechanisms and functions of inflammasomes[J]. Cell, 2014, 157(5): 1013-1022. |
| [20] |
PELLEGRINI C, FORNAI M, ANTONIOLI L, et al. Phytochemicals as novel therapeutic strategies for NLRP3 inflammasome-related neurological, metabolic, and inflammatory diseases[J]. Int J Mol Sci, 2019, 20(12). |
| [21] |
XIONG W, MENG X F, ZHANG C. NLRP3 inflammasome in metabolic-associated kidney diseases: an update[J]. Front Immunol, 2021, 12: 714340. |
| [22] |
KIM Y G, KIM S M, KIM K P, et al. The role of inflammasome-dependent and inflammasome-independent NLRP3 in the kidney[J]. Cells, 2019, 8(11): E1389. |
| [23] |
LI H Y, MIAO W G, MA J F, et al. Acute exercise-induced mitochondrial stress triggers an inflammatory response in the myocardium via NLRP3 inflammasome activation with mitophagy[J]. Oxid Med Cell Longev, 2016, 2016: 1987149. |
| [24] |
LIU B H, LU R R, LI H L, et al. Zhen-wu-Tang ameliorates membranous nephropathy rats through inhibiting NF-κB pathway and NLRP3 inflammasome[J]. Phytomedicine, 2019, 59: 152913. |
| [25] |
SEO J B, CHOI Y K, WOO H I, et al. Gemigliptin attenuates renal fibrosis through down-regulation of the NLRP3 inflammasome[J]. Diabetes Metab J, 2019, 43(6): 830-839. |
| [26] |
HAN W B, MA Q, LIU Y L, et al. Huangkui capsule alleviates renal tubular epithelial-mesenchymal transition in diabetic nephropathy via inhibiting NLRP3 inflammasome activation and TLR4/NF-κB signaling[J]. Phytomedicine, 2019, 57: 203-214. |
| [27] |
BAI Y, MU Q Q, BAO X L, et al. Targeting NLRP3 inflammasome in the treatment of diabetes and diabetic complications: role of natural compounds from herbal medicine[J]. Aging Dis, 2021, 12(7): 1587-1604. |




