子宫内膜癌(endometrial carcinoma, EC)属于上皮性恶性肿瘤,发生于子宫内膜,通常在女性围绝经期和绝经后发生。随着现代女性肥胖率的升高,近年来子宫内膜癌的发病率在全球呈明显上升趋势,且发病人群逐渐年轻化[1]。
早期子宫内膜癌患者整体预后较好,但晚期以及高危早期的子宫内膜癌患者容易发生肿瘤转移和复发,晚期子宫内膜癌患者的5年生存率不到20%[2]。影响患者预后的主要因素是出现局部复发及远处转移[3], 子宫内膜癌患者一旦复发后,往往会导致预后不良[4]。因此,探讨子宫内膜癌复发及转移的调控机制,为子宫内膜癌患者提供新的治疗策略至关重要。
人类LIM-domain蛋白质家族在各种癌症中作为关键分子出现,特别是Limo-domain-only (LMO)蛋白的成员LMO1-4参与几种癌症的发病或进展,包括T细胞白血病[5]、乳腺癌[6]和神经母细胞瘤[7]。这些小蛋白包含两个蛋白质相互作用的LIM结构域,它们的功能似乎是通过形成新的转录复合物或通过破坏现有的转录复合物来调节肿瘤细胞的生物学功能。有研究表明,LMO3是p53的共同阻遏物,能够抑制p53转录调控[8],而p53的失活使肿瘤具有更高的分裂和增殖能力,有助于恶性肿瘤的形成。研究报道,p53抑制了细胞的上皮- 间质转化(epithelial-mesenchymal transition,EMT),p53突变导致细胞发生上皮-间质转化,增加了癌细胞的运动性和侵袭性,从而导致肿瘤的进展和转移[9]。p53介导的下游事件主要表现为对靶基因的调控从而引起细胞周期停滞及细胞凋亡[10],p53突变与子宫内膜癌的不良预后也密切相关[11]。通过这些活动,LMO蛋白在肿瘤的发展过程中发挥重要的细胞作用,如自我更新、细胞周期调节和转移,而这些功能对于靶向治疗癌症是一个关键的突破口[12]。LMO3在肝癌[13]、胃癌[14]、肺癌[15]等实体肿瘤中促进肿瘤细胞的侵袭和迁移,导致疾病的不良预后,进一步提示LMO3与肿瘤发展密切相关。然而,LMO3在子宫内膜癌中的表达情况及其相关机制的研究尚无报道。本研究通过生物信息学及免疫组织化学染色、细胞实验等方法探讨LMO3在子宫内膜癌中的表达情况及临床意义,分析其可能的作用机制。
1 资料与方法 1.1 生物信息学分析方法从肿瘤基因图谱(The Cancer Genome Atlas, TCGA)数据集官网下载,共纳入子宫内膜癌数据集的506例子宫内膜癌组织基因表达矩阵及临床信息,其中TP53突变组168例,TP53未发生突变组338例。通过TCGA分析LMO3与TP53突变的关系;利用GeneMANIA及STRING数据库分析与LMO3相互作用的基因。
1.2 数据集分析提取TCGA中506例子宫内膜癌数据集中的LMO3的mRNA表达量及临床信息,用SPSS绘制受试者工作曲线(ROC曲线),将约登指数最大值时所对应的表达量设置为截断点,将样本分为高表达组及低表达组,绘制生存曲线。
1.3 患者临床信息收集2011年3月至2014年12月在重庆医科大学附属第一医院妇科接受手术且组织病理学诊断为子宫内膜癌的51例住院患者的临床信息,既往合并有其他恶性肿瘤的患者排除在外。临床信息包括年龄、手术方式、入院诊断、手术时间、肿瘤直径、术后病理分型和分级、出院诊断、组织学类型、肌层浸润程度、淋巴结转移情况、雌激素受体(estrogen receptor,ER)及孕激素受体(progesterone receptor,PR)、手术时间、复发时间、死亡时间、随访时间。根据国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期标准进行肿瘤分期。肿瘤分级分为高分化(G1)、中分化(G2)、低分化(G3)。患者平均年龄58.4岁,随访中位时间为68个月。总生存期(overall survival,OS)定义为患者从手术到死亡/最后1次随访的时间。无病生存期(disease free survival,DFS)定义为从手术到疾病复发/最后1次随访日期。患者均签署知情同意书。本研究经重庆医科大学附属第一医院伦理委员会审查批准实施(2020-425)。
1.4 免疫组化染色将新鲜组织标本及时浸泡在4%中性福尔马林中,然后包埋于石蜡切片,切4 μm薄片。石蜡切片在65 ℃孵箱中孵育2 h,用二甲苯进行脱蜡并梯度酒精浸泡进行水化。PBS清洗3次后,将石蜡切片浸泡在10 mmol/L柠檬酸钠缓冲液中用微波加热进行抗原修复。3%过氧化氢用于内源性过氧化物酶的阻断,山羊血清进行封闭,用于减少非特异性结合。应用小鼠/兔链霉卵白素-生物素检测试剂盒进行下一步实验,孵育LMO3抗体(1 ∶50),4 ℃湿盒孵育过夜。PBS洗涤后,孵育鼠兔通用二抗,用DAB显色试剂盒显色,苏木精复染、酚化、脱水、透明、封片。LMO3多克隆抗体购自生工生物工程上海股份有限公司,通用S-P试剂盒购自北京中杉金桥生物技术有限公司。
1.5 免疫组化评分标准免疫组化染色后切片由2位副高职称以上的病理科医师进行双盲阅片。阳性细胞的判断是以免疫组化后细胞质和(或)细胞核中出现黄色或棕色颗粒为标准,同时采用半定量法,即染色细胞百分比及染色强度的乘积来判断。①阳性着色细胞数:每张切片上观察5个高倍镜视野(×200),计数阳性细胞百分比<5%为0分,5%~25%为1分,>25%~50%为2分,>50%~75%为3分,>75%~100%为4分。②阳性着色强度:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。两者计分相乘即为阳性等级:0分为阴性(-),1~4分为弱阳性(+),5~8分为阳性(++),9~12分为强阳性(+++)。
1.6 细胞实验主要材料:HEC-1-A(人子宫内膜腺癌细胞)购自武汉普诺赛生命科技有限公司;LMO3慢病毒购自北京擎科新业生物技术有限公司;LMO3多克隆抗体购自生工生物工程上海股份有限公司;E-cadherin抗体购自Proteintech公司。人子宫内膜腺癌细胞HEC-1-A采用含10%胎牛血清、DMEM高糖培养基,置于37 ℃、5% CO2培养箱中培养, 待细胞生长到80%后进行后续实验。将细胞传至6孔板中,分3组进行转染:空白对照组只加Polybrene,过表达LMO3组转染pLVX- IRES-ZsGreen1-LMO3,阴性对照组转染pLVX-IRES-ZsGreen1-Vector。根据慢病毒转染说明书转染慢病毒,72 h后于倒置显微镜下观察荧光变化,通过Western blot检测LMO3转染效率,重复3次。转染效率达到80%后进行细胞划痕实验及验证两组细胞间上皮间质转化标记物E-Cadherin的表达差异。
1.7 统计学分析采用SPSS 25.0统计软件进行分析。不同临床特征患者LMO3蛋白在子宫内膜癌组织中的表达情况采用χ2检验;采用Kaplan-Meier法和Log-rank检验进行生存分析。COX多因素回归分析用于筛选独立预后因素。检验水准α=0.05。
2 结果 2.1 生物信息学分析通过TCGA数据库子宫内膜癌组织基因表达矩阵分析,利用ROC曲线(图 1A)确定LMO3在子宫内膜癌组织中的截断值为17.39(P=0.003), 将样本分为高表达及低表达两组,其中高表达组253例,低表达组253例。LMO3高表达组在子宫内膜癌组织中的无病生存期及总生存期均显著低于LMO3低表达组(P=0.004;P=0.000 3,图 1B、C)。分析TCGA中LMO3在TP53突变中的表达情况,结果显示,LMO3在TP53突变型患者中的表达水平显著高于TP53野生型患者(P<0.05,图 1D)。分别通过GeneMANIA、STRING数据库分析与LMO3相互作用的基因,结果显示LDB2、NHLH2均表现出与LMO3较高的相互作用得分(图 1E、F)。
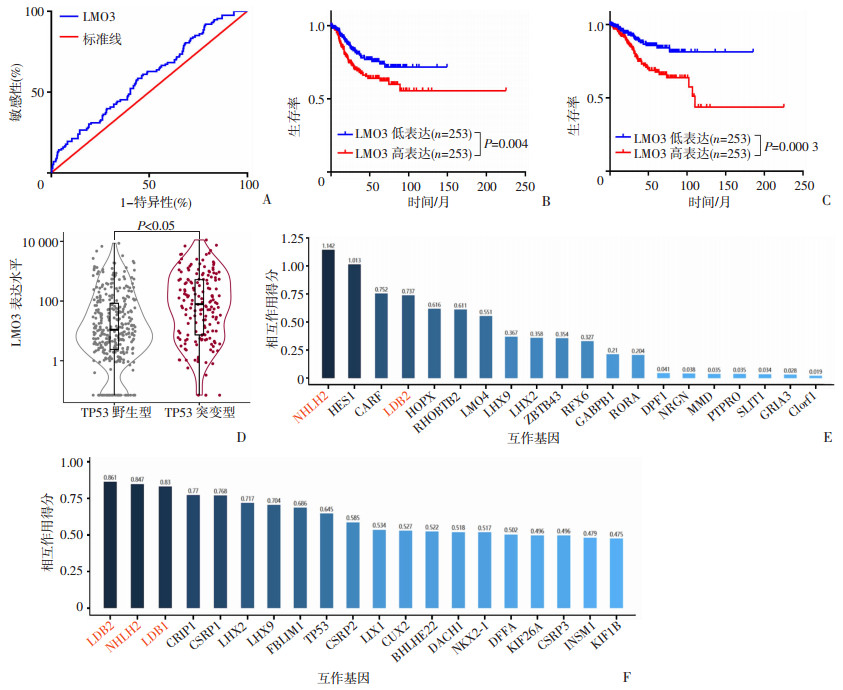
|
| A:TCGA数据集中子宫内膜癌的ROC曲线分析;B、C:LMO3在子宫内膜癌中不同表达对无病生存期(B)及总生存期(C)的影响;D:LMO3在TP53突变型和TP53野生型中的表达差异;E、F:在GeneMANIA(E)、STRING(F)数据库中与LMO3相互作用基因分析 图 1 基于TCGA数据库及GeneMANIA、STRING数据库分析LMO3不同表达在子宫内膜癌中的意义 |
2.2 免疫组化分析LMO3在内膜癌组织中的表达
免疫组织化学染色观察LMO3在子宫内膜癌组织中的表达情况(图 2)。结果显示,LMO3在51例子宫内膜癌组织中,复发组的子宫内膜癌多数呈阳性,其中≥5分的比例为90.0%;未复发组的子宫内膜癌多数呈弱阳性, ≥5分的比例为48.4%,显著低于复发组(P<0.05,表 1)。
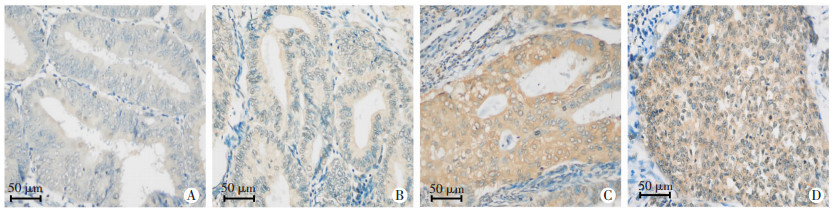
|
| A、B:LMO3在未复发的子宫内膜癌患者组织中呈弱阳性 A:子宫内膜样腺癌(高分化),DFS为73个月;B:子宫内膜样癌(中分化),DFS为70个月;C、D:LMO3在复发的子宫内膜癌患者组织中呈阳性 C:子宫内膜样腺癌(中-低分化),DFS为60个月;D:子宫内膜样腺癌(低分化),DFS为16个月 图 2 免疫组化染色观察子宫内膜癌组织中LMO3的表达 |
| 组别 | n | LMO3表达水平/例 | ≥1分(%) | ≥5分(%) | |||
| (-) | (+) | (++) | (+++) | ||||
| 复发组 | 20 | 1 | 1 | 14 | 4 | 95.0 | 90.0 |
| 未复发组 | 31 | 2 | 14 | 14 | 1 | 93.5 | 48.4 |
| P值 | 1.000 | 0.006 | |||||
2.3 LMO3基因与子宫内膜癌患者临床特征之间的关系
比较不同临床特征患者LMO3的表达情况,结果显示,LMO3免疫组化评分≥5分的比例在不同年龄、病理类型、病理分期及分化、肌层浸润情况、淋巴结转移情况、肿瘤直径、ER/PR表达情况的患者间差异无统计学意义(P>0.05,表 2)。
| 临床特征 | n | ≥5分 | <5分 | P值 |
| 年龄/岁 | ||||
| ≥60 | 23 | 15(65.2) | 8(34.8) | 0.945 |
| <60 | 28 | 18(64.3) | 10(35.7) | |
| 分型 | ||||
| Ⅰ | 42 | 27(64.3) | 15(35.7) | 0.892 |
| Ⅱ | 9 | 6(66.7) | 3(33.3) | |
| 分期 | ||||
| Ⅰ | 30 | 20(66.7) | 10(33.3) | |
| Ⅱ | 14 | 9(64.3) | 5(35.7) | 0.877 |
| Ⅲ | 7 | 4(57.1) | 3(42.9) | 0.972 |
| 分级 | ||||
| 1 | 2 | 1(50.0) | 1(50.0) | |
| 2 | 33 | 20(60.6) | 13(39.4) | 1.000 |
| 3 | 16 | 12(75.0) | 4(25.0) | 1.000 |
| 肌层浸润 | ||||
| 浅层 | 32 | 21(65.6) | 11(34.4) | 0.859 |
| 深层 | 19 | 12(63.2) | 7(36.8) | |
| 淋巴结转移 | ||||
| 阴性 | 47 | 31(66.0) | 16(34.0) | 0.923 |
| 阳性 | 4 | 2(50.0) | 2(50.0) | |
| 肿瘤直径/cm | ||||
| <2 | 24 | 16(66.7) | 8(33.3) | 0.782 |
| ≥2 | 27 | 17(63.0) | 10(37.0) | |
| 雌激素受体 | ||||
| 阴性 | 10 | 6(60.0) | 4(40.0) | 1.000 |
| 阳性 | 41 | 27(65.9) | 14(34.1) | |
| 孕激素受体 | ||||
| 阴性 | 11 | 7(63.6) | 4(36.4) | |
| 阳性 | 40 | 26(65.0) | 14(35.0) | 1.000 |
2.4 LMO3基因与子宫内膜癌患者预后的关系
根据免疫组化评分将子宫内膜癌患者分为两组,0~4分(阴性和弱阳性)为LMO3低表达组,5~12分(阳性和强阳性)为LMO3高表达组。通过Kaplan-Meier曲线分析结果显示,LMO3高表达组的子宫内膜癌患者的DFS低于低表达组(P=0.005,图 3)。通过COX多因素分析结果显示,LMO3的表达水平是子宫内膜癌患者无病生存期的影响因素(表 3)。
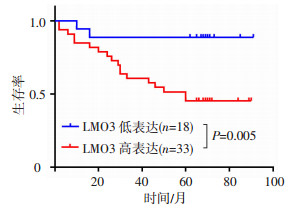
|
| 图 3 不同LMO3表达水平在子宫内膜癌患者中无病生存期的Kaplan-Meier曲线分析 |
| 因素 | 无病生存期 | 总生存期 | |||
| 风险比(95%置信区间) | P值 | 风险比(95%置信区间) | P值 | ||
| 分期 | |||||
| Ⅰ | 1.0 | 1.0 | |||
| Ⅱ | 2.921(0.826~10.330) | 0.096 | 5.215(0.726~37.437) | 0.101 | |
| Ⅲ | 30.854(5.641~168.555) | 0.000 | 41.830(4.957~352.995) | 0.001 | |
| 分级 | |||||
| 1 | 1.0 | 1.0 | |||
| 2 | 4 101.954(0.000~1.060E+85) | 0.931 | 1 045.750(0.000~3.699E+143) | 0.966 | |
| 3 | 3 227.644(0.000~8.352E+84) | 0.933 | 4 459.826(0.000~1.572E+144) | 0.959 | |
| 肿瘤直径/cm | |||||
| <2 | 1.0 | 1.0 | |||
| ≥2 | 1.502(0.512~4.405) | 0.459 | 1.800(0.315~10.295) | 0.509 | |
| 肌层浸润 | |||||
| 浅层 | 1.0 | 1.0 | |||
| 深层 | 2.005(0.639~6.289) | 0.233 | 3.530(0.684~18.201) | 0.132 | |
| LMO3评分 | |||||
| 0~4 | 1.0 | 1.0 | |||
| 5~12 | 17.601(2.857~108.446) | 0.002 | 10.260(0.867~121.464) | 0.065 | |
2.5 LMO3对子宫内膜癌细胞迁移的作用
通过在HEC-1-A(人子宫内膜腺癌细胞)中过表达LMO3,进行细胞划痕实验及Western blot检测上皮间质转化标记物钙黏附蛋白E(E-Cadherin)的表达水平。过表达LMO3后,HEC-1-A的上皮间质转化标记物E-Cadherin显著降低(图 4A、B),LMO3过表达组的迁移速率明显高于对照组(图 4C、D);提示LMO3的过表达可能影响子宫内膜癌细胞的迁移。

|
| A、B:Western blot检测与半定量分析结果;C、D: 细胞划痕实验检测过表达LMO3后子宫内膜癌细胞HEC-1-A迁移能力与统计分析结果 图 4 Western blot及细胞划痕实验检测LMO3过表达在HEC-1-A细胞中的迁移作用 |
3 讨论
尽管大多数子宫内膜癌患者可通过手术治愈,但仍有15%~20%的患者初次治疗时没有出现疾病晚期或转移的迹象,对治疗的反应有限,从而出现复发情况,复发后5年生存期低于20%[16-17]。因此,探究子宫内膜癌患者复发的机制对于子宫内膜癌的治疗十分重要。
研究表明,HE4[18]、CA125[19]等基因的高表达与子宫内膜癌的复发相关,更多促进复发的机制仍需要探索。本课题组首先利用GEPIA、The Human Protein Atlas数据库分析可能的不良预后因素,结果发现LMO3高表达是子宫内膜癌的不良预后因素,且其在携带TP53突变型的患者中高表达。为了验证上述生物信息学统计的结果,即验证LMO3的表达水平与子宫内膜癌患者的预后关系,收集本院子宫内膜癌患者的石蜡切片进行免疫组化验证,并重点关注LMO3与复发的关系,即无病生存期的长短。免疫组化结果显示,LMO3高表达组无病生存期显著低于LMO3低表达组,提示LMO3高表达时子宫内膜癌患者复发概率高于LMO3低表达组,与生物信息学分析结果一致。对于LMO3异常高表达导致子宫内膜癌患者易复发的机制我们开展了进一步的探究。首先,利用生物信息学方法,分析LMO3的相互作用蛋白网络,结果显示,在不同的数据库中,NHLH2、LDB2与LMO3的相互作用得分均排名靠前。有研究表明,小鼠模型中敲除NHLH2基因会致使小鼠活动度降低,进而导致小鼠肥胖发生率显著增高[20]。也有研究表明,内脏脂肪组织中的LMO3可以调节参与保持脂肪组织功能的多个途径,如糖代谢、胰岛素敏感性、线粒体功能和脂联素分泌[21-22],而肥胖同样也是子宫内膜癌预后不佳的高危因素[23]。因此,在子宫内膜癌中LMO3异常高表达可能抑制NHLH2的正常功能,从而引起机体代谢紊乱和肥胖发生,进而导致子宫内膜癌的复发和不良预后。LDB2,也被称为CLIM-1,包含LIM结构域,作为转录调节因子发挥作用, LDB2的异常表达可以通过增加肿瘤细胞的迁移能力促进肿瘤的进展[24-25]。结合LDB2的功能及其与LMO3的相互作用,本课题组猜测LMO3促进子宫内膜癌的复发与迁移有关。因此,在子宫内膜癌细胞中过表达LMO3后观察迁移相关分子指标。结果显示,上皮间质转化(EMT)标记物E-cadherin在过表达LMO3后明显减少,表明LMO3表达水平的升高显著增加了子宫内膜癌细胞的转移潜力,有可能进一步促进子宫内膜癌的复发和远处浸润[26]。LMO3影响子宫内膜癌的预后也许和LMO3在肺癌[27]、胃癌[14]中通过促进肿瘤细胞的迁移从而促进肿瘤的不良进展作用相似。此外,在体外实验体系中检测到LMO3与p53的直接相互作用。LMO3与p53的相互作用依赖p53的DNA结合结构域,从而可以抑制p53的转录调控活性[8]。本研究发现,LMO3在携带TP53突变型的患者中相比在携带TP53野生型的患者中高表达,结合文献报道,p53突变与子宫内膜癌的不良预后密切相关[11],我们猜测,LMO3异常高表达通过阻遏野生型TP53的转录活性,筛选到更多具有TP53突变型的肿瘤细胞,从而促进了肿瘤的发展。
本实验结果提示,LMO3异常高表达是子宫内膜癌患者预后不良的预测指标,可能与LMO3促进子宫内膜癌细胞的迁移有关。LMO3是否能成为新的子宫内膜癌预后指标以及精准治疗子宫内膜癌的药靶,有待进一步的体外实验及体内实验的探索。
| [1] |
AMANT F, MOERMAN P, NEVEN P, et al. Endometrial cancer[J]. Lancet, 2005, 366(9484): 491-505. |
| [2] |
NJOKU K, CHIASSERINI D, WHETTON A D, et al. Proteomic biomarkers for the detection of endometrial cancer[J]. Cancers, 2019, 11(10): 1572. |
| [3] |
CREUTZBERG C L, VAN PUTTEN W L J, KOPER P C, et al. Survival after relapse in patients with endometrial cancer: results from a randomized trial[J]. Gynecol Oncol, 2003, 89(2): 201-209. |
| [4] |
SHANG P, MENG F L, LIU Y D, et al. Overexpression of ANCCA/ATAD2 in endometrial carcinoma and its correlation with tumor progression and poor prognosis[J]. Tumor Biol, 2015, 36(6): 4479-4485. |
| [5] |
APLAN P D, JONES C A, CHERVINSKY D S, et al. An scl gene product lacking the transactivation domain induces bony abnormalities and cooperates with LMO1 to generate T-cell malignancies in transgenic mice[J]. EMBO J, 1997, 16(9): 2408-2419. |
| [6] |
SUM E Y, SEGARA D, DUSCIO B, et al. Overexpression of LMO4 induces mammary hyperplasia, promotes cell invasion, and is a predictor of poor outcome in breast cancer[J]. Proc Natl Acad Sci USA, 2005, 102(21): 7659-7664. |
| [7] |
AOYAMA M, OZAKI T, INUZUKA H, et al. LMO3 interacts with neuronal transcription factor, HEN2, and Acts as an oncogene in neuroblastoma[J]. Cancer Res, 2005, 65(11): 4587-4597. |
| [8] |
LARSEN S, YOKOCHI T, ISOGAI E, et al. LMO3 interacts with p53 and inhibits its transcriptional activity[J]. Biochem Biophys Res Commun, 2010, 392(3): 252-257. |
| [9] |
BOUTELLE A M, ATTARDI L D. p53 and tumor suppression: it takes a network[J]. Trends Cell Biol, 2021, 31(4): 298-310. |
| [10] |
何勇, 范士志, 蒋耀光. p53基因家族研究进展[J]. 第三军医大学学报, 2000, 22(12): 1215-1217. HE Y, FAN S Z, JIANG Y G. Progress of p53 gene family[J]. Acta Acad Med Mil Tertiae, 2000, 22(12): 1215-1217. |
| [11] |
LAX S F. Molecular genetic pathways in various types of endometrial carcinoma: from a phenotypical to a molecular-based classification[J]. Virchows Arch, 2004, 444(3): 213-223. |
| [12] |
MATTHEWS J M, LESTER K, JOSEPH S, et al. LIM-domain-only proteins in cancer[J]. Nat Rev Cancer, 2013, 13(2): 111-122. |
| [13] |
CHENG Y, HOU T L, PING J, et al. LMO3 promotes hepatocellular carcinoma invasion, metastasis and anoikis inhibition by directly interacting with LATS1 and suppressing Hippo signaling[J]. J Exp Clin Cancer Res, 2018, 37(1): 1-12. |
| [14] |
QIU Y S, JIANG N N, ZHOU Y, et al. LMO3 promotes gastric cancer cell invasion and proliferation through Akt-mTOR and Akt-GSK3β signaling[J]. Int J Mol Med, 2018, 41(5): 2755-2763. |
| [15] |
WATANABE H, FRANCIS J M, WOO M S, et al. Integrated cistromic and expression analysis of amplified NKX2-1 in lung adenocarcinoma identifies LMO3 as a functional transcriptional target[J]. Genes Dev, 2013, 27(2): 197-210. |
| [16] |
ENGELSEN I B, AKSLEN L A, SALVESEN H B. Biologic markers in endometrial cancer treatment[J]. APMIS, 2009, 117(10): 693-707. |
| [17] |
黄洁, 李聪, 李云云, 等. PDZK1在子宫内膜癌中的表达及临床意义[J]. 第三军医大学学报, 2019, 41(3): 259-264. HUANG J, LI C, LI YY, et al. Expression of PDZK1 in endometrial carcinoma and its clinical significance[J]. J Third Mil Med Univ, 2019, 41(3): 259-264. |
| [18] |
ANGIOLI R, CAPRIGLIONE S, SCALETTA G, et al. The role of HE4 in endometrial cancer recurrence: how to choose the optimal follow-up program[J]. Tumour Biol, 2016, 37(4): 4973-4978. |
| [19] |
LO S S, KHOO U S, CHENG D K, et al. Role of serial tumor markers in the surveillance for recurrence in endometrial cancer[J]. Cancer Detect Prev, 1999, 23(5): 397-400. |
| [20] |
GOOD D J, COYLE C A, FOX D L. Nhlh2: a basic helix-loop-helix transcription factor controlling physical activity[J]. Exerc Sport Sci Rev, 2008, 36(4): 187-192. |
| [21] |
WAGNER G, FENZL A, LINDROOS-CHRISTENSEN J, et al. LMO3 reprograms visceral adipocyte metabolism during obesity[J]. J Mol Med, 2021, 99(8): 1151-1171. |
| [22] |
LINDROOS J, HUSA J L, MITTERER G, et al. Human but not mouse adipogenesis is critically dependent on LMO3[J]. Cell Metab, 2013, 18(1): 62-74. |
| [23] |
AUSTIN H, AUSTIN JR J M, PARTRIDGE E E, et al. Endometrial cancer, obesity, and body fat distribution[J]. Cancer Res, 1991, 51(2): 568-572. |
| [24] |
YU H Y, JIA R C, ZHAO L, et al. LDB2 inhibits proliferation and migration in liver cancer cells by abrogating HEY1 expression[J]. Oncotarget, 2017, 8(55): 94440-94449. |
| [25] |
STORBECK C J, WAGNER S, O'REILLY P, et al. The Ldb1 and Ldb2 transcriptional cofactors interact with the Ste20-like kinase SLK and regulate cell migration[J]. MBoC, 2009, 20(19): 4174-4182. |
| [26] |
杨楠, 陈天翔, 刘润坤, 等. IFIT5在肝细胞癌中表达上调并促进肝癌细胞侵袭和迁移[J]. 第三军医大学学报, 2020, 42(21): 2093-2099. YANG N, CHEN T X, LIU R K, et al. Enhanced expression of interferon-induced protein with tetratricopeptide repeats 5 promotes migration and invasion of hepatocellular carcinoma cells[J]. J Third Mil Med Univ, 2020, 42(21): 2093-2099. |
| [27] |
XUAN Y W, LIAO M, ZHAI W L, et al. MicroRNA-381 inhibits lung adenocarcinoma cell biological progression by directly targeting LMO3 through regulation of the PI3K/Akt signaling pathway and epithelial-to-mesenchymal transition[J]. Eur Rev Med Pharmacol Sci, 2019, 23(19): 8411-8421. |






