坏死性小肠结肠炎(necrotizing enterocolitis,NEC)是早产儿常见的严重胃肠道疾病之一,其特征是伴有不同程度出血、坏死的全肠道炎症。NEC在极低出生体质量(<1 500 g)出生儿中发病率为7%[1],其病死率高达30%~50%[2]。NEC幸存儿常患有多种短期和长期并发症,不仅包括短肠综合征、肠道狭窄等肠道疾病,还会导致神经发育障碍[3]。研究报道,与未患NEC的同年龄早产儿相比,约45%的NEC患儿存在神经发育障碍[4]。一些使用大脑核磁共振成像(magnetic resonance imaging,MRI)研究显示,NEC患儿出现了髓鞘发育受损、脑容量减少的病理改变[5-7]。在NEC动物模型研究中发现,NEC小鼠脑中小胶质细胞由TLR通路激活,导致少突胶质细胞减少,髓鞘发育异常[8]。目前,关于NEC对大脑损伤的研究比较局限,其导致脑损伤的具体机制仍有待探索,且临床上尚缺乏针对NEC患儿神经保护的措施。
缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)被认为是机体在应激条件下起关键作用的转录因子,在机体炎症的发生、氧化应激、细胞凋亡等多个过程中都发挥着作用[9],且与NEC的病理过程中的炎症反应、缺血缺氧密切相关。一项临床试验发现,NEC患儿肠道HIF-1α表达明显升高[10]。在NEC小鼠模型中,肠道HIF-1α表达同样升高,并且进一步激活其表达可以提高NEC小鼠的生存率,减轻NEC肠道炎症[11]。在新生大鼠缺血缺氧性脑病中,HIF-1α高表达可改善脑部缺血,具有神经保护作用[12]。但目前缺乏有关HIF-1α是否能对NEC脑损伤产生神经保护的作用的相关研究。因此,本研究采用经典NEC小鼠模型,检测小鼠脑中少突胶质细胞的数量及神经炎症的情况,以期模拟临床NEC患儿脑损伤状况,并加以HIF-1α稳定剂和抑制剂干预,探讨HIF-1α在NEC脑损伤中的作用。
1 材料与方法 1.1 实验动物5日龄C57BL/6小鼠81只,购自重庆医科大学动物实验中心,雌雄不限,体质量2.0~3.0 g,饲养于重庆医科大学附属儿童医院动物实验中心,本研究已通过重庆医科大学附属儿童医院动物实验中心伦理审查委员会批准。
1.2 主要试剂Similac配方奶(Abbott Laboratories公司,美国);犬代乳奶粉(Pet-Ag公司,美国);脂多糖(lipopolysaccharide,LPS,Sigma公司,美国);全蛋白提取试剂盒、BCA蛋白含量检测试剂盒(江苏凯基生物技术股份有限公司);SDS-PAGE电泳凝胶配制试剂盒(上海雅酶生物医药科技有限公司);5×蛋白上样缓冲液(Biosharp公司);快速封闭液(上海碧云天生物科技有限公司);HIF-1α Rabbit pAb、GAPDH抗体(成都正能生物技术有限责任公司);0.22 μm PVDF膜(Millipore公司,德国);TRIzol(Invitrogen公司,美国);RT Master Mix for QPCR、SYBR(MCE公司);引物(上海生工生物工程股份有限公司);4%多聚甲醛、柠檬酸钠修复液(北京赛维尔公司);DAB显色试剂盒、兔二步法检测试剂盒(北京中杉金桥生物技术有限公司);Iba-1抗体(abcam公司,美国),GFAP抗体(Cell Signaling Technology公司,美国);少突胶质细胞转录因子-2(oligodendrocyte transcription factor 2,Olig2)抗体(GeneTex公司,美国);2-Methoxyestradiol(Selleck Chemicals公司,美国);Dimethyloxallyl Glycine(MCE公司)。
1.3 实验方法 1.3.1 动物分组与NEC模型建立SPF级新生5 d的C57BL/6小鼠采用随机数字表法分为4组:对照组(CON组,n=15),坏死性小肠结肠炎组(NEC组,n=24),HIF-1α稳定剂组(DMOG组,n=19)和HIF-1α抑制剂组(2ME2组,n=23)。
CON组小鼠与母鼠同笼,母乳喂养,不做任何处理。NEC组小鼠依照CHEN等[13]的方法建立NEC模型,饲养于恒温保育箱中[温度(36±1)℃,湿度45%~60%],配方奶(0.03~0.05 mL/g)灌胃喂养,每日5次;于缺氧箱(5%O2+95%N2)中缺氧处理10 min,每日3次;LPS灌胃(5 mg/kg),每日1次;连续建模4 d。DMOG组建模方法同NEC组,每日腹腔注射HIF-1α稳定剂DMOG溶液(40 mg/kg)[11]。2ME2组建模方法同NEC组,每日腹腔注射HIF-1α抑制剂2ME2溶液(5 mg/kg)[14]。
1.3.2 生存情况观察记录小鼠每日死亡情况。
1.3.3 组织取材和切片制备NEC建模结束后12 h,断头处死所有小鼠,获取胃端至直肠的整肠组织,观察肠道组织的大体形态后,取回肠部用4%多聚甲醛固定;在冰上迅速剥离出脑组织后沿着纵轴将其一分为二,随机取一半冻存于-80 ℃,另一半用4%的多聚甲醛固定。肠道和半脑经脱水和石蜡包埋后,进行切片,切片厚度为4 μm,烘干后备用。
1.3.4 Western blot检测脑组织中HIF-1α的表达从每组动物中随机选取3只小鼠进行Western blot检测。取-80 ℃冻存的脑组织,加入裂解缓冲液,组织匀浆,4 ℃离心15 min(12 000×g),收集上清液,用BCA法行蛋白浓度定量检测。取上清液加入5×蛋白上样缓冲液煮沸15 min,冻存备用。取50 μg总蛋白样品进行凝胶电泳,转膜至PVDF膜,封闭15 min,孵育一抗(HIF-1α抗体稀释浓度为1 ∶1 000,GAPDH抗体稀释浓度为1 ∶2 000),4 ℃孵育过夜,孵育二抗(稀释浓度为1 ∶ 10 000),ECL显影。分析软件采用Image J,目的蛋白相对表达量以目的蛋白与内参蛋白条带灰度值比值表示。
1.3.5 肠道组织HE染色取肠道组织石蜡切片于烤箱烘烤2 h,二甲苯脱蜡,HE染色后中性树脂封片,在光学显微镜下观察肠道组织病理形态学变化。采用双盲法行肠组织损伤评分,根据DRUCKER等[15]的评分标准,每个标本随机选取3个视野,取平均值作为该标本评分值,评分≥2分认定为NEC建模成功。
1.3.6 免疫组化染色检测Iba-1小胶质细胞、GFAP星形胶质细胞、Olig2少突胶质细胞的表达采用随机数字表法,从每组小鼠中选择5只小鼠的半脑石蜡切片进行免疫组化染色,每只小鼠选取3张切片。取切片常规脱蜡至水;自来水冲洗2 min;柠檬酸钠缓冲液(pH=6)修复20 min;内源性过氧化氢酶阻断剂,室温孵育10 min;PBS洗涤3次,每次5 min;孵育一抗(Iba-1、GFAP、OLIG2抗体,1 ∶200稀释),4 ℃过夜;PBS洗涤3次,每次5 min;滴加反应增强液,室温孵育20 min;PBS洗涤3次,每次5 min;滴加增强酶标山羊抗兔IgG聚合物,室温孵育20 min;PBS洗涤3次,每次5 min;滴加新鲜配制的DAB显色液,室温孵育7 min;自来水冲洗2 min;苏木精复染,透明,干燥后中性树胶封片观察。应用Image J软件进行图像分析。
1.3.7 荧光定量PCR检测脑组织IL-1β和TNF-α mRNA的表达水平采用随机数字表法,从每组动物中选取6只小鼠进行实时定量PCR分析。取冻存的脑组织,TRIzol法提取总RNA,分光光度计检测RNA浓度,将RNA反转录为cDNA,以cDNA为模板扩增IL-1β和TNF-α,GAPDH作为内参。反应条件设定为:95 ℃ 3 min,95 ℃ 30 s,55 ℃ 20 s,共40个循环。引物序列如下:IL-1β(175 bp)正义5′-CCAGCTTCAAATCTCACAGCAG-3′,反义5′-CTTCTTTGGGTATTGCTTGGGATC-3′;TNF-α(179 bp)正义5′-ATGTCTCAGCCTCTTCTCATTC-3′,反义5′-GCTTGTCACTCGA-ATTTTGAGA-3′;GAPDH (102 bp)正义5′-TGAAGCA-GGCATCTGAGGG-3′,反义5′-CGAAGGTGGAAGAGTG-GGAG-3′。
1.4 统计学分析分析和作图软件采用GraphPad Prism 7.0。采用正态性分布检验分类定量资料,用x±s表示正态分布且方差齐的定量资料,独立样本t检验比较两组间差异;多组间比较采用单因素方差分析。不符合正态性分布或方差不齐的定量资料,用Wilcoxon Mann-Whitney检验进行组间比较。生存分析采用Kaplan-Meier检验。P < 0.05表示差异有统计学意义。
2 结果 2.1 HIF-1α在小鼠脑组织中的表达水平Western blot结果显示,与CON组比较,NEC组小鼠脑中HIF-1α表达显著上升(P < 0.05);与NEC组比较,DMOG组HIF-1α表达升高,2ME2组HIF-1α表达降低(P < 0.05,图 1),说明成功稳定和抑制了HIF-1α的表达。
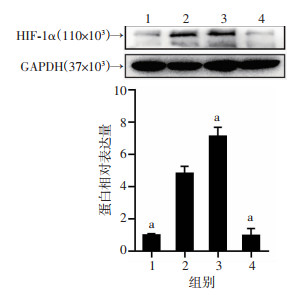
|
| 1:CON组;2:NEC组;3:DMOG组;4:2ME2组;a:P < 0.05,与NEC组比较 图 1 Western blot检测各组小鼠脑中HIF-1α的表达与定量分析 (x±s,n=3) |
2.2 HIF-1α对小鼠生存率的影响
观察4组小鼠96 h生存率发现,CON组小鼠无死亡,NEC组生存率为66.67%,差异具有统计学意义(P < 0.05);HIF-1α稳定剂DMOG组生存率为84.21%,与CON组差异无统计学意义;HIF-1α抑制后,生存率明显下降,2ME2组生存率为48.95%,2ME2组与DMOG组差异具有统计学意义(P < 0.05)。见图 2。

|
| a:P < 0.05,与CON组比较;b:P < 0.05,与DMOG组比较 图 2 各组小鼠生存率分析 |
2.3 HIF-1α对小鼠肠组织病理的影响
显微镜下观察肠道HE染色病理表现,CON组肠组织结构清晰完整,绒毛完整,固有层、黏膜下层和肌层结构连接紧密;NEC组肠组织结构紊乱,部分绒毛脱落,固有层及黏膜下层分离,肌层变薄;DMOG组结构较完整,少量绒毛脱落,固有层无分离,黏膜下层轻度分离;2ME2组肠组织结构完全破坏,绒毛坏死脱落,固有层及黏膜下层明显分离,肌层变薄甚至消失。见图 3A。病理学评分显示,NEC组小鼠肠组织评分较CON组显著升高(P < 0.01);与NEC组比较,DMOG组病理评分显著降低(P < 0.01),2ME2组病理评分则明显升高(P < 0.01),见图 3B。
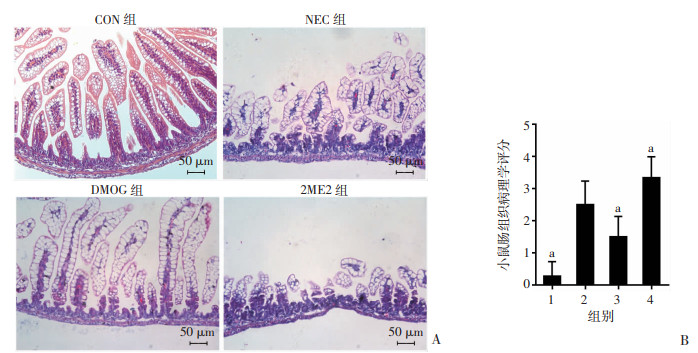
|
| A:光学显微镜观察各组小鼠肠组织病理学改变;B:各组小鼠肠组织病理学评分 1:CON组;2:NEC组;3:DMOG组;4:2ME2组;a:P < 0.01,与NEC组比较 图 3 HE染色观察各组小鼠肠道病理学改变 |
2.4 HIF-1α对小鼠海马小胶质细胞的影响
免疫组化结果显示,与CON组比较,NEC组小鼠海马区小胶质细胞增多(P < 0.05),且胞体较对照组变大,呈活化状态;与NEC组比较,DMOG组小胶质细胞减少(P < 0.05),2ME2组小胶质细胞则增加(P < 0.05)。见图 4。
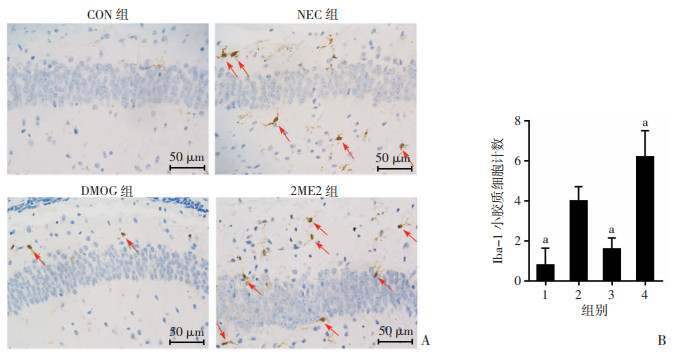
|
| A:免疫组化检测小鼠海马星形胶质细胞Iba-1的表达 ↑:示活化的小胶质细胞;B:各组海马活化Iba-1细胞计数 1:CON组;2:NEC组;3:DMOG组;4:2ME2组;a:P < 0.05,与NEC组比较 图 4 免疫组化检测各组小鼠海马Iba-1小胶质细胞表达情况 (x±s,n=5) |
2.5 HIF-1α对小鼠海马星形胶质细胞的影响
免疫组化结果显示,与CON组比较,NEC组海马区星形胶质细胞激活增加;给予HIF-1α稳定剂DMOG之后,抑制了海马区星形胶质细胞的激活;抑制HIF-1α后海马区活化的星形胶质细胞较NEC组增加。积分光密度半定量分析显示,差异均具有统计学意义(P < 0.05)。见图 5。
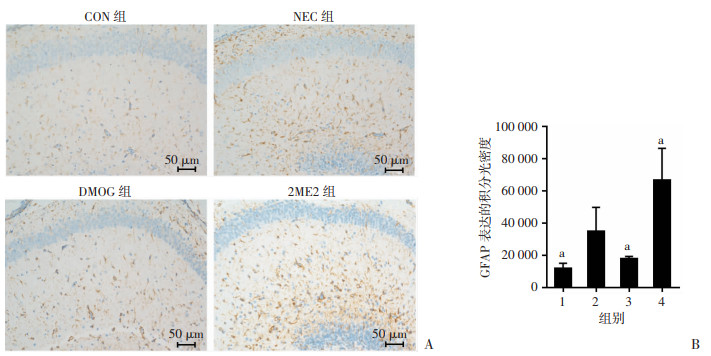
|
| A:免疫组化检测小鼠海马星形胶质细胞GFAP的表达;B:各组海马GFAP表达的积分光密度分析 1:CON组;2:NEC组;3:DMOG组;4:2ME2组;a:P < 0.05,与NEC组比较 图 5 免疫组化检测各组小鼠海马GFAP活化星形胶质细胞表达情况 (x±s,n=5) |
2.6 HIF-1α对小鼠脑组织中炎症因子的影响
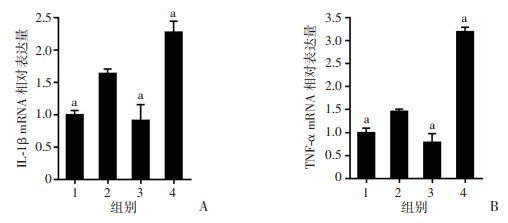
RT-qPCR结果显示,NEC组炎症因子IL-1β、TNF-α较CON组表达上升(P < 0.05);与NEC组比较,DMOG组IL-1β、TNF-α表达降低,2ME2组IL-1β、TNF-α表达升高(P < 0.05)。见图 6。
|
| a:P < 0.05,与NEC组比较; 1:CON组;2:NEC组;3:DMOG组;4:2ME2组 图 6 RT-qPCR检测各组小鼠脑组织炎症因子IL-1β(A)、TNF-α(B)的表达 (x±s,n=6) |
2.7 HIF-1α对小鼠海马少突胶质细胞的影响
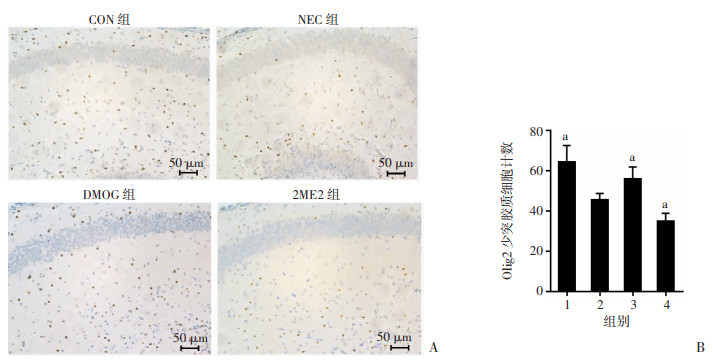
免疫组化结果显示(图 7),与CON组比较,NEC组小鼠海马区少突胶质细胞减少,差异具有统计学意义(P < 0.05);与NEC组比较,DMOG组小鼠海马区少突胶质细胞数量增加,2ME2组小鼠海马区少突胶质细胞数量减少,差异均有统计学意义(P < 0.05)。
|
| A:免疫组化检测小鼠海马少突胶质细胞Olig2的表达;B:各组海马Olig2少突胶质细胞计数 1:CON组;2:NEC组;3:DMOG组;4:2ME2组;a:P < 0.05,与NEC组比较 图 7 免疫组化检测各组小鼠海马Olig2少突胶质细胞表达情况 (x±s,n=5) |
3 讨论 3.1 NEC小鼠模型特点及建模成功
NEC多发生于早产儿中,此时大脑正处于神经发生与神经元成熟的关键神经发育时期,易受到缺血缺氧、营养不良、炎症等因素的影响,因此NEC患儿易出现神经发育障碍。啮齿类动物出生后1~7 d相当于人类胎龄32周前的脑组织发育程度[16]。为模拟早产儿脑部发育情况,本研究选用新生5 d的C57/BL小鼠进行建模。目前,多数学者认为NEC的发病由多因素所致,包括早产、炎症反应、缺氧缺血、喂养不当等[17]。因此,本研究采用配方奶喂养、LPS灌胃以及缺氧的经典NEC建模方法进行建模,以期更好地模拟NEC多因素发病的机制,探究NEC对神经发育的影响。结果显示NEC组小鼠生存率降低,肠道肿胀积气明显;病理学观察结果显示其肠道结构紊乱,绒毛部分脱落,肌层变薄甚至消失,表明成功建立了NEC小鼠模型。
3.2 NEC小鼠发生急性脑损伤小胶质细胞是中枢神经系统中重要的天然免疫细胞,在大脑发生感染、创伤、局部缺血时,迅速活化,发挥免疫监视和吞噬作用,是神经炎症的起始因素[18]。当外周的炎症因子进入大脑后,首先激活小胶质细胞,进而在炎症后期激活星形胶质细胞[19]。海马是大脑中负责学习和记忆的关键区域,在新生儿阶段受到损伤易影响长期认知功能。本研究发现,NEC小鼠海马区小胶质细胞、星形胶质细胞激活增加,脑组织中炎症因子IL-1β、TNF-α的表达水平增加,提示在NEC小鼠脑组织中发生了急性神经炎症。BIOUSS等[20]研究同样发现NEC组小鼠脑组织中多区域发生神经炎症。少突胶质细胞是中枢系统中的髓鞘生成细胞,它通过迁移至轴突周围,产生髓鞘包裹轴突[21]。本研究发现,NEC组小鼠海马区少突胶质细胞较对照组减少,说明NEC干扰了小鼠脑中髓鞘的正常发育,与临床NEC患儿后期大脑MRI所呈现出的髓鞘发育障碍的病变特征相符[6-8]。
3.3 HIF-1α对NEC小鼠脑损伤的保护作用缺氧被认为是NEC发病过程中的关键因素。临床研究发现,与未患NEC的对照组新生儿相比,NEC患儿脑氧合指数明显更低[22]。HIF-1是机体在缺氧环境下的关键调控因子,由α和β两个亚基构成,α亚基为HIF-1的主要活性亚基。HIF-1α在常氧状态下迅速被脯氨酸羟化结构域酶(prolyl hydroxylasedomains,PHDs)泛素化降解;而在缺氧状态下,PHDs被抑制,HIF-1α可在细胞内积累表达,进入细胞核与HIF-1β结合,调控炎症发生、细胞凋亡、能量代谢等功能[10]。DMOG和2ME2是HIF-1α常见的稳定剂和抑制剂:DMOG可抑制PHDs,导致HIF-1α的积聚;2ME2可抑制HIF-1α蛋白的表达。本研究显示,在NEC小鼠腹腔注射DMOG后,小鼠生存率上升,肠道损伤减轻,海马区神经炎症得以抑制,少突胶质细胞数量明显上升,而2ME2组则得到相反结果。研究结果提示在NEC小鼠中,HIF-1α的稳定高表达发挥着神经保护的作用。在NEG小鼠中,增加HIF-1α表达,可降低炎症因子IL-1β、IL-6、TNF-α的表达水平,增强机体的抗炎能力[23]。在创伤性脑损伤中,通过DMOG稳定HIF-1α的表达,可减少神经元和总细胞死亡,同时改善长期的记忆和运动功能[24]。在大鼠脑缺血模型的大脑表面转染HIF-1α发现,HIF-1α表达水平升高之后,脑中侧支循环的血管数量增加,大鼠脑缺血得以改善[13]。以上结果都证明,HIF-1α在炎症和创伤中发挥着保护作用。因此,我们推测HIF-1α的稳定高表达可减轻NEC小鼠神经炎症。
本研究发现NEC可致新生小鼠脑中海马区少突胶质细胞减少,发生严重的神经炎症。HIF-1α的稳定高表达可以减轻这一损伤,有望成为NEC神经保护的新靶点以改善NEC患儿神经发育结果,但其具体保护机制目前尚不清楚。此外,本研究仅观察HIF-1α对NEC小鼠急性脑损伤的作用,其是否能改善长期认知功能障碍还需进一步探索。
| [1] |
HACKAM D, CAPLAN M. Necrotizing enterocolitis: pathophysiology from a historical context[J]. Semin Pediatr Surg, 2018, 27(1): 11-18. |
| [2] |
JONES I H, HALL N J. Contemporary outcomes for infants with necrotizing enterocolitis——a systematic review[J]. J Pediatr, 2020, 220: 86-92.e3. |
| [3] |
MUTANEN A, PIERRO A, ZANI A. Perioperative complications following surgery for necrotizing enterocolitis[J]. Zeitschrift Fur Kinderchirurgie, 2018, 28(2): 148-151. |
| [4] |
REES C M, PIERRO A, EATON S. Neurodevelopmental outcomes of neonates with medically and surgically treated necrotizing enterocolitis[J]. Arch Dis Child Fetal Neonatal Ed, 2007, 92(3): F193-F198. |
| [5] |
SHAH D K, DOYLE L W, ANDERSON P J, et al. Adverse neurodevelopment in preterm infants with postnatal sepsis or necrotizing enterocolitis is mediated by white matter abnormalities on magnetic resonance imaging at term[J]. J Pediatr, 2008, 153(2): 170-175, 175.e1. |
| [6] |
MERHAR S L, RAMOS Y, MEINZEN-DERR J, et al. Brain magnetic resonance imaging in infants with surgical necrotizing enterocolitis or spontaneous intestinal perforation versus medical necrotizing enterocolitis[J]. J Pediatr, 2014, 164(2): 410-412.e1. |
| [7] |
SHIN S H, KIM E K, YOO H, et al. Surgical necrotizing enterocolitis versus spontaneous intestinal perforation in white matter injury on brain magnetic resonance imaging[J]. Neonatology, 2016, 110(2): 148-154. |
| [8] |
NIÑO D F, ZHOU Q J, YAMAGUCHI Y, et al. Cognitive impairments induced by necrotizing enterocolitis can be prevented by inhibiting microglial activation in mouse brain[J]. Sci Transl Med, 2018, 10(471): eaan0237. |
| [9] |
DENGLER V L, GALBRAITH M, ESPINOSA J M. Transcriptional regulation by hypoxia inducible factors[J]. Crit Rev Biochem Mol Biol, 2014, 49(1): 1-15. |
| [10] |
CHEN Y, CHANG K T, LIAN D W, et al. The role of ischemia in necrotizing enterocolitis[J]. J Pediatr Surg, 2016, 51(8): 1255-1261. |
| [11] |
BOWKER R M, YAN X C, MANAGLIA E, et al. Dimethyloxalylglycine preserves the intestinal microvasculature and protects against intestinal injury in a neonatal mouse NEC model: role of VEGF signaling[J]. Pediatr Res, 2018, 83(2): 545-553. |
| [12] |
MATSUDA T, ABE T, WU J L, et al. Hypoxia-inducible factor-1alpha DNA induced angiogenesis in a rat cerebral ischemia model[J]. Neurol Res, 2005, 27(5): 503-508. |
| [13] |
CHEN Y, KOIKE Y, MIYAKE H, et al. Formula feeding and systemic hypoxia synergistically induce intestinal hypoxia in experimental necrotizing enterocolitis[J]. Pediatr Surg Int, 2016, 32(12): 1115-1119. |
| [14] |
KHAN M, DHAMMU T S, BAARINE M, et al. GSNO promotes functional recovery in experimental TBI by stabilizing HIF-1α[J]. Behav Brain Res, 2018, 340: 63-70. |
| [15] |
DRUCKER N A, JENSEN A R, TE WINKEL J P, et al. Loss of endothelial nitric oxide synthase exacerbates intestinal and lung injury in experimental necrotizing enterocolitis[J]. J Pediatr Surg, 2018, 53(6): 1208-1214. |
| [16] |
OHMURA Y, KUNIYOSHI Y. A translational model to determine rodent's age from human foetal age[J]. Sci Rep, 2017, 7(1): 17248. |
| [17] |
马娜, Mohd Jaish Siddiqui, 夏斌. 新生儿坏死性小肠结肠炎发病机制的研究进展[J]. 中华妇幼临床医学杂志(电子版), 2020, 16(6): 739-744. MA N, SIDDIQUI M J, XIA B. Research progresses of pathogenesis of neonatal necrotizing enterocolitis[J]. Chin J Obstet Gynecol Pediatr Electron Ed, 2020, 16(6): 739-744. |
| [18] |
EYO U B, DAILEY M E. Microglia: key elements in neural development, plasticity, and pathology[J]. J Neuroimmune Pharmacol, 2013, 8(3): 494-509. |
| [19] |
LIDDELOW S A, GUTTENPLAN K A, CLARKE L E, et al. Neurotoxic reactive astrocytes are induced by activated microglia[J]. Nature, 2017, 541(7638): 481-487. |
| [20] |
BIOUSS G, ANTOUNIANS L, LI B, et al. Experimental necrotizing enterocolitis induces neuroinflammation in the neonatal brain[J]. J Neuroinflammation, 2019, 16(1): 97. |
| [21] |
BARKOVICH A J. Concepts of myelin and myelination in neuroradiology[J]. Am J Neuroradiol, 2000, 21(6): 1099-1109. |
| [22] |
HOWARTH C, BANERJEE J, LEUNG T, et al. Cerebral oxygenation in preterm infants with necrotizing enterocolitis[J]. Pediatrics, 2020, 146(3): e20200337. |
| [23] |
KEELY S, CAMPBELL E L, BAIRD A W, et al. Contribution of epithelial innate immunity to systemic protection afforded by prolyl hydroxylase inhibition in murine colitis[J]. Mucosal Immunol, 2014, 7(1): 114-123. |
| [24] |
SEN T, SEN N. Treatment with an activator of hypoxia-inducible factor 1, DMOG provides neuroprotection after traumatic brain injury[J]. Neuropharmacology, 2016, 107: 79-88. |






