2. 400016 重庆,重庆医科大学基础医学院干细胞与组织工程研究室;
3. 400016 重庆,重庆医科大学基础医学院生理学教研室;
4. 400016 重庆,重庆医科大学基础医学院病理生理学教研室;
5. 400016 重庆,重庆医科大学基础医学院实验教学管理中心
2. Laboratory of Stem Cells and Tissue Engineering, College of Basic Medical Sciences, Chongqing Medical University, Chongqing, 400016, China;
3. Department of Physiology, College of Basic Medical Sciences, Chongqing Medical University, Chongqing, 400016, China;
4. Department of Pathophysiology, College of Basic Medical Sciences, Chongqing Medical University, Chongqing, 400016, China;
5. Experimental Teaching and Management Center, College of Basic Medical Sciences, Chongqing Medical University, Chongqing, 400016, China
抑郁症是一种常见的精神疾病,其主要临床表现为快感缺失、疲惫、食欲不振等,严重时甚至有自杀倾向[1]。预计到2030年,抑郁症将成为致残主要的疾病之一[2]。因此,探讨抑郁症的发病机制,寻找有效的抑郁症治疗靶点成为神经科学领域基础与临床研究的热点。
海马是抑郁症病理改变的重要脑区之一[3]。大量证据表明,抑郁症患者和抑郁症动物模型的海马存在明显的结构和功能异常[4-5]。因此,研究抑郁症中海马改变的相关机制具有重要意义。过氧化物酶体增殖物激活受体γ辅激活因子1α(PPAR gamma coactivator 1 alpha,PGC-1α)是一种核转录辅助激活因子[6]。研究发现,抑郁症患者全血PGC-1α水平低于健康对照组[7]。动物研究发现,PGC-1α基因敲除小鼠的强迫游泳不动时间显著长于对照组,表现出明显的抑郁样行为[8]。本团队前期研究也发现,慢性不可预知性应激(chronic unpredictable stimulation,CUS)诱导的抑郁模型小鼠海马内PGC-1α表达下降, 定向沉默小鼠海马内的PGC-1α会导致小鼠出现抑郁样行为,并导致海马PV+中间神经元数量下降[9]。以上研究表明,海马PGC-1α表达下降可能与抑郁症的发生、发展密切相关。然而,海马PGC-1α表达升高是否会产生抗抑郁样行为的作用,目前尚不清楚。
星形胶质细胞分布于中枢神经系统,其不仅在维持中枢神经系统发挥正常功能过程中具有重要作用,其数量和功能改变也与包括抑郁症在内的多种大脑疾病有关[10-11]。研究发现,全长PGC-1α基因敲除(保留n端截断片段)促进了小鼠脑干和小脑核中星形胶质细胞的增生[12]。胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)是星形胶质细胞最广泛使用的标志物之一[13]。研究发现,PGC-1α基因敲除小鼠纹状体中,GFAP阳性(+)星形胶质细胞的数量显著多于对照组[14]。表明PGC-1α与星形胶质细胞的数量密切相关,但在海马中,PGC-1α是否参与调控星形胶质细胞的数量,目前尚不明确。在CUS抑郁模型小鼠海马中,PGC-1α表达下降[9],GFAP蛋白表达下降[15];在脂多糖(lipopolysaccharide,LPS)诱导的抑郁模型小鼠海马中,PGC-1α表达下降[16],而GFAP蛋白表达增加[17]。表明在抑郁症小鼠海马内,PGC-1α和星形胶质细胞均发生了明显的改变,但PGC-1α与星形胶质细胞的具体关系仍然存在争议。体视学是一种三维定量方法,可以对物体的大小、形状和数量进行严格、准确的定量分析,其不受被测物体的空间方向和分布的影响[18-19]。本研究采用海马立体定位注射技术和现代体视学技术相结合,探讨定向沉默/过表达小鼠海马PGC-1α对小鼠抑郁样行为和海马各亚区的GFAP+星形胶质细胞数量的影响,以期进一步揭示抑郁症发生、发展过程中海马的病理改变,为抗抑郁药物的研制提供新的思路。
1 材料与方法 1.1 材料 1.1.1 实验动物选取32只6~8周龄、体质量20~25 g的雄性C57BL/6小鼠(重庆医科大学实验动物中心),在恒温23 ℃,恒湿40%~50%和规律的昼夜交替环境下适应性饲养2周,接着进行2周的糖水偏好基线测试。随后按照简单随机抽样方法将小鼠分为空病毒组(n=14)、PGC-1α沉默组(n=11)和PGC-1α过表达组(n=7)。空病毒组小鼠双侧海马立体定位注射AAV-GFP(2 μL/侧,1.6×1012 vg/mL,汉恒生物,中国),PGC-1α沉默组小鼠双侧海马立体定位注射AAV-shPGC-1α(2 μL/侧,1.2×1012 vg/mL,汉恒生物,中国),PGC-1α过表达组小鼠双侧海马立体定位注射AAV-PGC-1α(2 μL/侧,1.2×1012 vg/mL,汉恒生物,中国)。AAV-GFP、AAV-shPGC-1α和AAV-PGC-1α血清型均为AAV2/9型。在各组注射相应的腺相关病毒4周后,检测其抑郁样行为。所有动物相关操作符合重庆医科大学关于实验动物使用的管理和伦理规定。
1.1.2 试剂与耗材兔抗PGC-1α多克隆抗体(货号ab54481,美国Abcam公司);兔抗胶质纤维酸性蛋白(GFAP)多克隆抗体(货号ab7260,美国Abcam公司);RIPA裂解缓冲液(中国碧云天生物技术有限公司),蛋白酶抑制剂(中国碧云天生物技术有限公司);BCA蛋白检测试剂盒(中国碧云天生物技术有限公司);PVDF膜(美国Millipore公司);化学发光底物检测试剂(中国白鲨生物科学有限公司)。
1.1.3 实验器材小动物麻醉系统(中国瑞沃德生命科技有限公司);单臂数显脑立体定位仪(中国瑞沃德生命科技有限公司);冰冻切片机(德国Leica公司);体视学测量分析系统(美国MBF Bioscience公司);ChemiDocTM成像系统(美国Bio-Rad公司);激光共聚焦显微镜(日本Nikon公司)。
1.2 方法 1.2.1 海马立体定位注射腺相关病毒用异氟烷麻醉小鼠后,将小鼠固定于立体定位注射仪。头部剃毛,从小鼠头部中缝处剪开皮肤,根据注射坐标(相对于小鼠前囟的坐标):正后2.30 mm;外侧1.80 mm,进针深度2 mm,用直径0.5 mm的钻头在注射部位颅骨上钻1个小孔,采用微量注射器以0.4 μL/min的速度进行注射。注射后留针5 min,随后缓慢取出。缝皮后撤离麻醉机,观察30 min。小鼠无异常后,1只/笼继续饲养。
1.2.2 糖水偏好实验糖水偏好是常用于检测快感缺失的主要指标[20]。在注射腺相关病毒4周后,对小鼠进行糖水偏好实验。在测试过程中,分别给予每只小鼠2瓶水∶1瓶白水和1瓶1%的蔗糖溶液,24 h后分别称量白水和1%蔗糖溶液的瓶质量,计算对应的摄入量。最后按照公式计算小鼠的糖水偏好百分比。
1.2.3 强迫游泳实验强迫游泳实验用于评价动物的绝望状态[21]。测试时,将小鼠单独放置在1个垂直的注有水的透明玻璃圆筒中(高30 cm,直径20 cm),玻璃圆筒中水温为(22 ± 1)℃,水深为20 cm。测试时间6 min,计数后5 min内小鼠的不动时间。不动时间的判断标准为小鼠直立漂浮在水中而不挣扎,头部仅稍稍高出水面的时间。所有小鼠的强迫游泳不动时间由一名不知道具体分组条件的研究者负责统计。
1.2.4 蛋白提取和蛋白免疫印迹实验每组采用简单随机抽样取3只小鼠,处死后冰上迅速剥离出脑组织,分离出海马组织。采用RIPA裂解缓冲液添加1%蛋白酶抑制剂制成裂解物,裂解后取上清。使用BCA蛋白检测试剂盒测定蛋白浓度。样品中添加SDS-PAGE上样缓冲液(5×)在100 ℃下变性10 min,将蛋白质量16 μg的样品置于10%丙烯酰胺凝胶上,进行电泳。然后,将蛋白电转到PVDF膜上。用含有5%奶粉的TBST溶液在室温摇床上封闭2 h。将膜放入一抗4 ℃孵育过夜,TBST洗涤2次×15 min,在室温下与辣根过氧化物酶(HRP)标记的IgG二抗孵育2 h。使用ChemiDocTM成像系统对条带进行化学发光检测。用Image J软件定量各目的条带的灰度值,用PGC-1α/β-actin来表示PGC-1α的相对蛋白表达量。
1.2.5 免疫组织化学染色每组采用简单随机抽样取4只小鼠。给予小鼠腹腔注射1%戊巴比妥钠深度麻醉,灌注生理盐水和4%多聚甲醛。剥离出大脑,沿纵轴分为两个半脑,在4%多聚甲醛中浸泡至少24 h。每只小鼠随机选取一侧半脑,将脑组织依次浸泡在梯度浓度的蔗糖水(10%、20%、30%,用0.1 mol/L PBS稀释)中脱水处理。用冰冻切片机连续切取50 μm厚度的冠状脑切片。在本研究中,按照1/5的抽样分数对含有海马组织的部分进行等距随机抽样,每侧半脑可得到5组脑组织切片。切片用0.01 mol/L PBS和75%乙醇漂洗后于75%乙醇内-20 ℃保存。
从上述切片样本中,每只小鼠随机选取1组脑组织切片。切片用0.01 mol/L PBS漂洗10 min×3次,用0.3% Triton溶液漂洗10 min×3次;随后用3%过氧化氢避光孵育30 min,枸橼酸盐溶液沸水浴修复30 min, 于封闭液(10%山羊血清SP-9001、1%胎牛血清、0.1% 鱼明胶)中37 ℃封闭2 h。用兔抗GFAP抗体(1 ∶2 000)4 ℃孵育72 h,然后用生物素标记羊抗兔IgG在4 ℃孵育24 h,再于辣根酶标记链霉卵白素中37 ℃孵育2 h。DAB避光显色10 min,漂洗后贴片固定,苏木精复染1 min,用过饱和磷酸氢二钠溶液反蓝1 min。最后,于梯度乙醇(75% 5 min,80% 5 min,95% 5 min,100% 5 min)脱水,并于二甲苯(10 min×3次)透明,中性树脂封片。
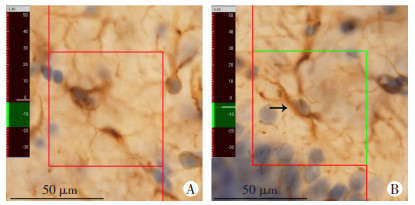
1.2.6 体视学定量分析使用光学分合法对1.2.5中选取的小鼠海马各亚区GFAP+星形胶质细胞的数量进行测算。根据海马的形态特征,5倍物镜放大后勾画出CA1、CA3和DG的轮廓(图 1)。设置面积抽样分数设为4%。光学体视框以系统随机的方式放置在划定区域内(图 2)。每个计数框的面积为3.6 μm2。体视框计数高度为15 μm,在每个切片的顶部边缘设置上表面保护高度3 μm。海马各亚区GFAP+星形胶质细胞的数量按公式(n=ΣQ-×1/ssf×1/asf×1/tsf×2)计算。公式中N为每只动物CA1、CA3和DG区GFAP+星形胶质细胞的总数;ΣQ-为每只小鼠单侧海马各亚区计数的GFAP+星形胶质细胞数量;1/ssf为切片抽样分数的倒数;1/asf为面积抽样分数的倒数;1/tsf为高度抽样分数的倒数。

|
| 绿色实线区域代表DG区,蓝色实线区域代表CA1区,红色实线区域代表CA3区 图 1 小鼠海马CA1、CA3和DG区的分区示意图 |
|
| A:将计数框的保护高度设置为3 μm,保护高度内的GFAP+星形胶质细胞不计数;B:从上表面3 μm开始,计数15 μm,即在3~18 μm,计数GFAP+星形胶质细胞;→示计数的GFAP+星形胶质细胞 图 2 体视框计数小鼠海马GFAP+星形胶质细胞示意图 |
1.3 统计学分析
采用SPSS 25.0统计软件,数据以x±s表示。所有数据符合正态分布,采用单因素方差分析,事后检验采用LSD检验。P < 0.05代表差异具有统计学意义。
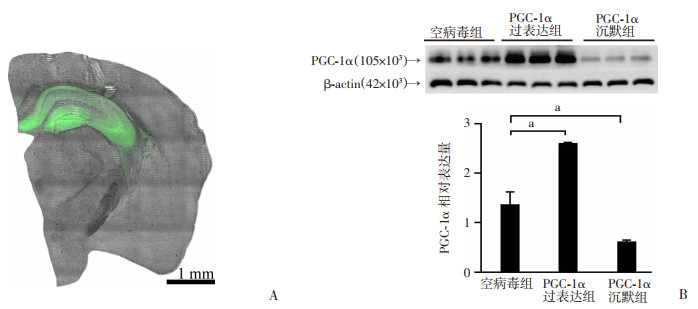
2 结果 2.1 腺相关病毒载体成功沉默/过表达海马PGC-1α基因激光共聚焦显微镜下观察脑组织切片,结果显示,自带绿色荧光的腺相关病毒成功感染小鼠的整个海马区域(图 3A)。Western blot结果显示,3组小鼠海马内PGC-1α蛋白的表达水平差异具有统计学意义(F=125.27,P < 0.01),其中,PGC-1α沉默组小鼠海马PGC-1α表达显著低于空病毒组(P < 0.01);PGC-1α过表达组小鼠海马PGC-1α表达显著高于空病毒组(P < 0.01, 图 3B)。结果表明,借助腺相关病毒载体成功沉默/过表达小鼠海马的PGC-1α基因。
|
| A:自带绿色荧光的腺相关病毒感染小鼠海马示意图;B:Western blot检测腺相关病毒注射4周后3组小鼠海马PGC-1α蛋白表达(n=3) a: P < 0.01 图 3 腺相关病毒感染范围及验证 |
2.2 沉默/过表达海马PGC-1α基因可诱导小鼠出现抑郁样行为/抗抑郁样行为
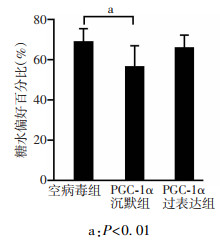
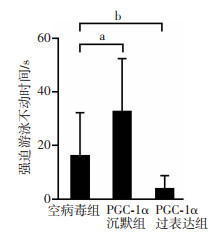
糖水偏好实验结果表明,空病毒组(n=14)、PGC-1α沉默组(n=11)和PGC-1α过表达组(n=7)小鼠的糖水偏好百分比在注射腺相关病毒前差异无统计学意义。注射腺相关病毒4周后,3组小鼠的糖水偏好百分比差异有统计学意义(F=7.53,P < 0.01)。其中,PGC-1α沉默组的糖水偏好百分比显著低于空病毒组(P < 0.01),而PGC-1α过表达组的糖水偏好百分比与空病毒组相比没有统计学意义(图 4)。强迫游泳实验结果表明,3组小鼠的强迫游泳不动时间差异有统计学意义(F=10.67,P < 0.01)。其中,PGC-1α沉默组的强迫游泳不动时间显著高于空病毒组(P < 0.05);PGC-1α过表达组的强迫游泳不动时间显著低于空病毒组(P < 0.01, 图 5)。结果提示沉默/过表达海马PGC-1α基因可诱导小鼠出现抑郁样行为/抗抑郁样行为。
|
| a:P < 0.01 图 4 3组小鼠病毒注射4周后糖水偏好百分比变化 |
|
| a:P < 0.05, b:P < 0.01 图 5 3组小鼠病毒注射4周后强迫游泳不动时间变化 |
2.3 海马PGC-1α介导了小鼠海马CA1和DG区GFAP+星形胶质细胞数量的改变
体视学结果显示,在小鼠海马CA1区中,3组小鼠海马内GFAP+星形胶质细胞数量差异具有统计学意义(F=20.39,P < 0.01)。其中,PGC-1α沉默组小鼠海马内的GFAP+星形胶质细胞的数量(142 703.10± 28 088.25)显著高于空病毒组(P < 0.05);PGC-1α过表达组小鼠海马内的GFAP+星形胶质细胞的数量(59 460.09±11 005.57)显著低于空病毒组(P < 0.01,图 6)。

|
| A:免疫组化观察3组小鼠海马各亚区GFAP+星形胶质细胞 绿色方框为DG区域视野,蓝色方框为CA1区域视野,红色方框为CA3区域视野; B:3组小鼠海马各亚区GFAP+星形胶质细胞数量(n=4, x±s) a: P < 0.05,b: P < 0.01 图 6 3组小鼠海马各亚区GFAP+星形胶质细胞免疫组化染色情况及数量的比较 |
在小鼠海马DG区中,3组小鼠海马内GFAP+星形胶质细胞数量差异有统计学意义(F=20.16,P < 0.01)。其中,PGC-1α沉默组星形胶质细胞的数量(104 116.49±14 389.03)显著高于空病毒组(P < 0.01);PGC-1α过表达组星形胶质细胞的数量(58 174.87±7 708.75)显著低于空病毒组(P < 0.05,图 6)。
在小鼠海马CA3区中,PGC-1α沉默组和PGC-1α过表达组星形胶质细胞的数量与空病毒组的差异无统计学意义。
3 讨论本研究对小鼠行为学的观察结果显示,在注射腺相关病毒4周后,PGC-1α沉默组小鼠的蔗糖偏好百分比显著低于空病毒组,强迫游泳不动时间显著长于空病毒组,即沉默海马PGC-1α可诱发小鼠的抑郁样行为,这与本团队前期的研究结果一致[9]。同时,本研究还显示,PGC-1α过表达组小鼠的强迫游泳不动时间显著短于空病毒组。既往研究发现,鸢尾素在增加海马中PGC-1α mRNA表达的同时,可诱导正常小鼠出现抗抑郁样作用[22]。CUNHA等[23]研究发现,口服肌酸灌胃可增加雌性瑞士小鼠海马中PGC-1α的基因表达,同时使小鼠产生抗抑郁样行为。这些研究仅说明抗抑郁样行为的发生伴随着海马中PGC-1α表达的增加,没有明确海马中PGC-1α表达增加是否能诱导抗抑郁样行为。本研究结果显示,PGC-1α过表达组的强迫游泳不动时间显著低于空病毒组,提示PGC-1α在海马中过表达可产生抗抑郁样行为的作用。然而,PGC-1α过表达组小鼠与空病毒组小鼠之间的糖水偏好百分比并没有差异。糖水偏好实验和强迫游泳实验都是检测啮齿类动物抑郁样行为的经典实验[24]。强迫游泳实验不仅可以反映动物的体力或运动能力的下降,还可以表示动物的精神运动活动水平,是一种评价动物绝望状态的方法,对抗抑郁治疗的效果具有很好的预测价值[25-26]。正常动物也具有强迫游泳不动时间基线,通过强迫游泳不动时间来评估正常啮齿动物的抗抑郁样行为,是诸多研究者常用的方法[23, 27]。而糖水偏好实验主要从快感缺失方面以糖水偏好百分比的方式评价啮齿类动物是否具有抑郁样行为或其抑郁样行为是否得到改善,其对正常动物抗抑郁样行为的检测不敏感[20]。因此,本研究对正常小鼠进行海马PGC-1α过表达,仅发现强迫游泳时间较正常小鼠显著缩短,而糖水偏好无显著差异。实验结果反映海马PGC-1α的增加与抗抑郁样行为之间的关系。但海马PGC-1α在抑郁模型小鼠中上调是否会产生与正常小鼠类似的行为学结果尚不清楚,需要进一步研究。本研究通过在正常小鼠中沉默和过表达海马PGC-1α来探究PGC-1α与抑郁样行为的关系,证明海马中PGC-1α表达的改变介导了小鼠的抑郁样行为/抗抑郁样行为。研究结果提示PGC-1α可能是抑郁症发病及治疗过程中的重要分子,也为抗抑郁药物的研发提供了重要靶点。
星形胶质细胞在大脑中发挥着重要的作用,是维持中枢神经系统稳态的关键角色[28]。研究发现,PGC-1α基因敲除小鼠的大脑皮质中星形胶质细胞增殖增加,但细胞成熟程度下降[29]。这表明PGC-1α参与大脑皮质中星形胶质细胞的调控,但在海马中,PGC-1α与星形胶质细胞的关系尚不清楚。本研究采用GFAP作为星形胶质细胞的特异性标记物,结合现代体视学方法来探讨海马PGC-1α与星形胶质细胞的关系。本研究结果显示,沉默海马PGC-1α可致小鼠海马CA1和DG区GFAP+星形胶质细胞的数量显著增加;过表达海马PGC-1α可使小鼠海马CA1和DG区GFAP+星形胶质细胞的数量显著降低。那么,为什么海马PGC-1α没有导致CA3区GFAP+星形胶质细胞的数量出现差异呢?在对抑郁症患者海马的研究中发现,海马不同亚区的GFAP+星形胶质细胞密度的变化是不同的[30]。在抑郁模型成年雌性食蟹猕猴海马中,只有CA1和DG区中星形胶质细胞密度降低[31]。以上研究说明,在抑郁症中,海马不同亚区星形胶质细胞的改变是不同的。从功能上来说,DG区主要负责海马的信息输入,CA1区主要负责与时间相关的信息处理,CA3区主要负责与空间相关的信息处理和短期记忆的形成[32]。因此,我们推测抑郁症对星形胶质细胞的影响以及海马亚区对外界刺激的敏感程度可能是沉默/过表达海马PGC-1α导致小鼠CA1和DG区GFAP+星形胶质细胞数量改变的原因,但具体原因尚需进一步研究。本研究结果表明,海马PGC-1α参与调控星形胶质细胞的数量,并且具有亚区特异性。本团队前期研究已经证实海马星形胶质细胞的数量改变参与抑郁症的发病[33]。那么,海马PGC-1α的改变导致小鼠出现抑郁样/抗抑郁样行为,是否与星形胶质细胞的数量有关呢?研究发现,在CUS抑郁模型小鼠海马中,PGC-1α表达下降[9],GFAP+星形胶质细胞数量下降[33];在高脂饮食诱导的抑郁模型小鼠以及LPS诱导的抑郁模型小鼠海马中,PGC-1α表达下降[34, 16],GFAP+星形胶质细胞表达升高[35, 17]。可见,在不同的抑郁模型动物海马中,PGC-1α的表达均显示下降,且均伴有GFAP+星形胶质细胞的数量变化。本研究发现,沉默海马PGC-1α使小鼠产生抑郁样行为的同时,其海马CA1和DG区中的GFAP+星形胶质细胞数量显著增加;而过表达海马PGC-1α使小鼠产生抗抑郁样行为的同时,其海马CA1和DG区中的GFAP+星形胶质细胞数量显著减少。这提示星形胶质细胞可能参与海马PGC-1α介导的抑郁样行为/抗抑郁样行为的发生。那么,PGC-1α参与星形胶质细胞数量调节的可能机制是什么呢?反应性星形胶质细胞是指中枢神经系统损伤或感染时发生形态和功能重塑的星形胶质细胞[13]。LIDDELOW等[36]认为,脑损伤或脑疾病会导致大脑出现反应性星形胶质细胞增多症,其中,正常星形胶质细胞在神经炎症条件下会增殖激活为反应性星形胶质细胞,其具有强烈的神经毒性。此外,研究发现,白介素-10(IL-10)是一种抗炎因子,降低大脑IL-10的表达会导致小鼠表现出显著的抑郁样行为,海马促炎因子水平升高,GFAP蛋白的免疫荧光水平增加,反应性星形胶质细胞的特异性转录因子显著增加,提示星形胶质细胞被激活[37]。另一项研究发现,自身免疫性前列腺炎诱导的抑郁模型小鼠海马中多种促炎细胞因子表达增加,GFAP蛋白的免疫荧光水平增加,星形胶质细胞内的细胞器数量显著增加,提示反应性星形胶质细胞增多[38]。同时,有研究发现,高脂饮食会导致雄性小鼠下丘脑和海马的PGC-1α表达下降,促进神经炎症[39]。体外研究也发现,提高人原代星形胶质细胞中的PGC-1α水平可显著减少促炎介质白介素-6和趋化因子配体2的产生和分泌[40]。以上研究表明,PGC-1α可能通过神经炎症参与星形胶质细胞数量的调节,但这需要更进一步的研究。尽管本研究使用了在星形胶质细胞研究中广泛使用的特异性标记物GFAP,但YU等[10]认为,GFAP作为普遍的星形胶质细胞标记物,其可能只能标记有限的星形胶质细胞。VERKHRATSKY等[41]也认为,GFAP抗体染色只能作用于部分的星形胶质细胞,并且GFAP的表达具有明显的区域特异性。因此,寻找新的更能广泛代表星形胶质细胞的特异性标志物具有重要意义。此外,还有研究表明PGC-1α基因敲除导致小鼠大脑皮质组织星形胶质细胞增殖增加,细胞的成熟程度下降[29]。这说明PGC-1α对星形胶质细胞数量和功能的影响可能不是平行关系,尚需进一步的研究。总的来说,本研究运用现代体视学方法精确定量了沉默/过表达海马PGC-1α后小鼠海马各亚区GFAP+星形胶质细胞数量,结果提示,海马中PGC-1α表达的改变可能通过调节CA1和DG区GFAP+星形胶质细胞的数量介导抑郁样行为的发生。
综上所述,本研究结果表明,沉默海马PGC-1α可诱发小鼠抑郁样行为的发生,而过表达海马PGC-1α导致小鼠强迫游泳不动时间显著降低,使小鼠产生抗抑郁样行为。本研究的另一发现是,沉默/过表达海马PGC-1α的表达水平导致小鼠产生抑郁样/抗抑郁样行为的同时,增加/减少了海马CA1和DG区GFAP+星形胶质细胞的数量,提示海马PGC-1α不仅参与调控抑郁样行为,也参与了GFAP+星形胶质细胞数量的调节。以上结果表明海马PGC-1α参与调控的GFAP+星形胶质细胞数量可能是抑郁症发病/治疗的重要结构基础,调控海马PGC-1α的表达可能是治疗抑郁症的重要靶点。
| [1] |
MALHI G S, MANN J J. Depression[J]. Lancet, 2018, 392(10161): 2299-2312. |
| [2] |
BARNETT R. Depression[J]. Lancet, 2019, 393(10186): 2113. |
| [3] |
BELLEAU E L, TREADWAY M T, PIZZAGALLI D A. The impact of stress and major depressive disorder on hippocampal and medial prefrontal cortex morphology[J]. Biol Psychiatry, 2019, 85(6): 443-453. |
| [4] |
HAO Z Y, ZHONG Y, MA Z J, et al. Abnormal resting-state functional connectivity of hippocampal subfields in patients with major depressive disorder[J]. BMC Psychiatry, 2020, 20(1): 71. |
| [5] |
TANG J, LIANG X, ZHANG Y, et al. The effects of running exercise on oligodendrocytes in the hippocampus of rats with depression induced by chronic unpredictable stress[J]. Brain Res Bull, 2019, 149: 1-10. |
| [6] |
WAN Z, ROOT-MCCAIG J, CASTELLANI L, et al. Evidence for the role of AMPK in regulating PGC-1 alpha expression and mitochondrial proteins in mouse epididymal adipose tissue[J]. Obesity (Silver Spring), 2014, 22(3): 730-738. |
| [7] |
RYAN K M, PATTERSON I, MCLOUGHLIN D M. Peroxisome proliferator-activated receptor gamma co-activator-1 alpha in depression and the response to electroconvulsive therapy[J]. Psychol Med, 2019, 49(11): 1859-1868. |
| [8] |
SZALARDY L, MOLNAR M F, ZADORI D, et al. Non-motor behavioral alterations of PGC-1α-deficient mice—a peculiar phenotype with slight male preponderance and no apparent progression[J]. Front Behav Neurosci, 2018, 12: 180. |
| [9] |
WANG J, TANG J, LIANG X, et al. Hippocampal PGC-1α-mediated positive effects on parvalbumin interneurons are required for the antidepressant effects of running exercise[J]. Transl Psychiatry, 2021, 11(1): 222. |
| [10] |
YU X Z, NAGAI N G, KHAKH B S. Improved tools to study astrocytes[J]. Nat Rev Neurosci, 2020, 21(3): 121-138. |
| [11] |
HAN R T, KIM R D, MOLOFSKY A V, et al. Astrocyte-immune cell interactions in physiology and pathology[J]. Immunity, 2021, 54(2): 211-224. |
| [12] |
SZALARDY L, ZADORI D, PLANGAR I, et al. Neuro-pathology of partial PGC-1α deficiency recapitulates features of mitochondrial encephalopathies but not of neurodegenerative diseases[J]. Neurodegener Dis, 2013, 12(4): 177-188. |
| [13] |
ESCARTIN C, GALEA E, LAKATOS A, et al. Reactive astrocyte nomenclature, definitions, and future directions[J]. Nat Neurosci, 2021, 24(3): 312-325. |
| [14] |
LIN J D, WU P H, TARR P T, et al. Defects in adaptive energy metabolism with CNS-linked hyperactivity in PGC-1alpha null mice[J]. Cell, 2004, 119(1): 121-135. |
| [15] |
HUANG R R, ZHANG Y, BAI Y, et al. N6-methyladenosine modification of fatty acid amide hydrolase messenger RNA in circular RNA STAG1-regulated astrocyte dysfunction and depressive-like behaviors[J]. Biol Psychiatry, 2020, 88(5): 392-404. |
| [16] |
FU X X, JIAO J, QIN T T, et al. A new perspective on ameliorating depression-like behaviors: suppressing neuroinflammation by upregulating PGC-1α[J]. Neurotox Res, 2021, 39(3): 872-885. |
| [17] |
WANG Y, NI J, ZHAI L Y, et al. Inhibition of activated astrocyte ameliorates lipopolysaccharide-induced depressive-like behaviors[J]. J Affect Disord, 2019, 242: 52-59. |
| [18] |
SCHMITZ C, HOF P R. Design-based stereology in neuroscience[J]. Neuroscience, 2005, 130(4): 813-831. |
| [19] |
ZHAO X, VAN PRAAG H. Steps towards standardized quantification of adult neurogenesis[J]. Nat Commun, 2020, 11(1): 4275. |
| [20] |
LIU M Y, YIN C Y, ZHU L J, et al. Sucrose preference test for measurement of stress-induced anhedonia in mice[J]. Nat Protoc, 2018, 13(7): 1686-1698. |
| [21] |
HARRO J. Animal models of depression: pros and cons[J]. Cell Tissue Res, 2019, 377(1): 5-20. |
| [22] |
SITENESKI A, CUNHA M P, LIEBERKNECHT V, et al. Central irisin administration affords antidepressant-like effect and modulates neuroplasticity-related genes in the hippocampus and prefrontal cortex of mice[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2018, 84(Pt A): 294-303. |
| [23] |
CUNHA M P, PAZINI F L, LIEBERKNECHT V, et al. Subchronic administration of creatine produces antidepressant-like effect by modulating hippocampal signaling pathway mediated by FNDC5/BDNF/Akt in mice[J]. J Psychiatr Res, 2018, 104: 78-87. |
| [24] |
GURURAJAN A, REIF A, CRYAN J F, et al. The future of rodent models in depression research[J]. Nat Rev Neurosci, 2019, 20(11): 686-701. |
| [25] |
UNAL G, CANBEYLI R. Psychomotor retardation in depression: a critical measure of the forced swim test[J]. Behav Brain Res, 2019, 372: 112047. |
| [26] |
AGUDELO L Z, FEMENÍA T, ORHAN F, et al. Skeletal muscle PGC-1α1 modulates kynurenine metabolism and mediates resilience to stress-induced depression[J]. Cell, 2014, 159(1): 33-45. |
| [27] |
WANG P, LI B, FAN J, et al. Additive antidepressant-like effects of fasting with β-estradiol in mice[J]. J Cell Mol Med, 2019, 23(8): 5508-5517. |
| [28] |
ALMAD A, MARAGAKIS N J. A stocked toolbox for understanding the role of astrocytes in disease[J]. Nat Rev Neurol, 2018, 14(6): 351-362. |
| [29] |
ZEHNDER T, PETRELLI F, ROMANOS J, et al. Mitochondrial biogenesis in developing astrocytes regulates astrocyte maturation and synapse formation[J]. Cell Rep, 2021, 35(2): 108952. |
| [30] |
COBB J A, O'NEILL K, MILNER J, et al. Density of GFAP-immunoreactive astrocytes is decreased in left hippocampi in major depressive disorder[J]. Neuroscience, 2016, 316: 209-220. |
| [31] |
WILLARD S L, RIDDLE D R, FORBES M E, et al. Cell number and neuropil alterations in subregions of the anterior hippocampus in a female monkey model of depression[J]. Biol Psychiatry, 2013, 74(12): 890-897. |
| [32] |
KESNER R P, LEE I, GILBERT P. A behavioral assessment of hippocampal function based on a subregional analysis[J]. Rev Neurosci, 2004, 15(5): 333-351. |
| [33] |
LI Y, LUO Y M, TANG J, et al. The positive effects of running exercise on hippocampal astrocytes in a rat model of depression[J]. Transl Psychiatry, 2021, 11(1): 83. |
| [34] |
YANG C X, SUI G H, LI D, et al. Exogenous IGF-1 alleviates depression-like behavior and hippocampal mitochondrial dysfunction in high-fat diet mice[J]. Physiol Behav, 2021, 229: 113236. |
| [35] |
SEGUELLA L, PESCE M, CAPUANO R, et al. High-fat diet impairs duodenal barrier function and elicits glia-dependent changes along the gut-brain axis that are required for anxiogenic and depressive-like behaviors[J]. J Neuroinflamm, 2021, 18(1): 115. |
| [36] |
LIDDELOW S A, GUTTENPLAN K A, CLARKE L E, et al. Neurotoxic reactive astrocytes are induced by activated microglia[J]. Nature, 2017, 541(7638): 481-487. |
| [37] |
ZHANG H Y, WANG Y, HE Y D, et al. A1 astrocytes contribute to murine depression-like behavior and cognitive dysfunction, which can be alleviated by IL-10 or fluorocitrate treatment[J]. J Neuroinflamm, 2020, 17(1): 200. |
| [38] |
DU H X, CHEN X G, ZHANG L, et al. Microglial activation and neurobiological alterations in experimental autoimmune prostatitis-induced depressive-like behavior in mice[J]. Neuropsychiatr Dis Treat, 2019, 15: 2231-2245. |
| [39] |
MORSELLI E, FUENTE-MARTIN E, FINAN B, et al. Hypothalamic PGC-1α protects against high-fat diet exposure by regulating ERα[J]. Cell Rep, 2014, 9(2): 633-645. |
| [40] |
NIJLAND P G, WITTE M E, VAN HET HOF B, et al. Astroglial PGC-1alpha increases mitochondrial antioxidant capacity and suppresses inflammation: implications for multiple sclerosis[J]. Acta Neuropathol Commun, 2014, 2: 170. |
| [41] |
VERKHRATSKY A, NEDERGAARD M. Physiology of astroglia[J]. Physiol Rev, 2018, 98(1): 239-389. |





