2020年全球癌症统计数据显示,肺癌的发病率居第2位,死亡率位居首位[1]。肺鳞癌为肺癌第2高发亚型。肺鳞癌患者由于早期诊断困难,5年生存率较低,仅为12.4%[2]。晚期肺癌的治疗在经历了化学治疗、分子靶向治疗之后,目前已进入以免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)为代表的免疫治疗时代。但是当前免疫治疗取得重大突破的同时,仍旧存在诸多问题。纳武利尤单抗(PD-1单抗)的临床研究表明,单药用于未经选择的晚期非小细胞肺癌患者的有效率仅在20%左右。如何选择潜在获益人群,提高有效率是肺癌免疫治疗领域迫切需要解决的关键问题。
肿瘤微环境是由基质细胞、免疫细胞和血管等组成的局部病理环境。多项研究表明,肿瘤微环境生物标记物可预测晚期黑色素瘤患者的预后,免疫相关的肿瘤生物标志物的基线表达水平与免疫治疗的疗效密切相关[3-4]。进一步研究表明,免疫微环境中免疫基因的特征表达,可能是预测抗PD-1或抗PD-L1治疗效果的潜在生物标记物[5]。
ADAP2是具有ADP核糖基化因子(ARFs)GTP酶激活蛋白(GAP)结构域的蛋白质家族成员,该基因编码的蛋白质可与beta-微管蛋白结合,增加微管的稳定性,在免疫系统中已被证实是具有重要功能的干扰素刺激基因[6]。ADAP2基因表达在部分肿瘤中有预后价值。例如在原发性低分化的胶质瘤患者中,ADAP2基因具有预后预测价值[7]。ADAP2在肺鳞癌中作用的研究较少,目前尚不清楚其免疫治疗效果和预后预测中的价值。本研究利用公共数据库,分析ADAP2与肺鳞癌预后的关联,评估ADAP2基因表达与肿瘤免疫浸润的相关性,探讨其在肺鳞癌免疫微环境中的可能作用,为深入研究ADAP2基因在肺鳞癌发生、发展和免疫治疗中的作用机制提供理论依据。
1 资料与方法 1.1 公共数据库TCGA数据库:TCGA数据库是癌症基因组图谱数据库,在肺鳞癌相关研究中,TCGA数据库涵盖了Illumina RNA-seq基因表达数据,包括肿瘤分级和生存情况的临床数据等信息,我们根据是否涵盖表达谱数据和临床数据,最终筛选了501例肺鳞癌患者。
GEO数据库:是一个公共功能基因组学数据库。我们搜索了涵盖Illumina RNA-seq基因表达数据的肺鳞癌数据,最终纳入249例肺鳞癌患者进行分析(GSE157009)[8]。
1.2 肿瘤免疫浸润分析xCell算法是2017年研发的计算肿瘤微环境中各种细胞存在的量的评估方法。它通过各种细胞类型样品的RNA-seq测序和基因芯片数据,针对适应性和固有免疫细胞、造血祖细胞、上皮细胞和细胞外基质细胞在内的64种细胞亚型,以数字矩阵的方式展现了肿瘤微环境中的各个细胞表达情况。它是迄今为止最全面的细胞计数免疫表型的比较工具[9]。细胞评分即分别代表上述64种细胞在肿瘤微环境中的表达水平;肿瘤微环境评分代表上述64种细胞在肿瘤微环境中的整体表达水平;免疫评分代表肿瘤微环境中已知的35种免疫细胞的整体浸润水平[9]。
1.3 GSEA富集分析采用GSEA(4.1.0版本)进行基因富集分析,各参数均参照常规条件设置[10]。显著富集的基因集定义为多种检验校正(false discovery rate,FDR)<0.05,且P<0.05的基因集。
1.4 String蛋白网络分析String(11.0版本)数据库旨在整合蛋白质之间所有已知和预测的关联,包括物理相互作用和功能关联。证据主要来自于科学文献的自动文本挖掘、相互作用实验和带注释的复合物通路数据库[11]。参数选择为①“Protein Name: ADAP2”;②“Organism: Homo sapiens”。
1.5 预后分析首先将临床变量进行单因素Cox比例风险回归分析,以P<0.2筛选可能的协变量,而后将年龄、性别、吸烟史以及筛选出的协变量纳入后续的多因素Cox风险回归分析[12]。
X-tile软件可以将结局的界值优化,找到最佳的截断值[13],应用该软件将TCGA数据库中患者的ADAP2 mRNA表达量分为高水平组和低水平组。运用多因素Cox风险回归模型分析ADAP2 mRNA水平与总生存期(overall survival, OS)预后的关联[12],同时计算P值和风险率值(hazard ratio, HR)。使用SPSS 23.0统计软件进行预后分析,使用Graphpad Prism 8.0绘制Kaplan-Meier生存曲线。
1.6 免疫荧光双染选取2014年1-10月在陆军军医大学第二附属医院初次诊断并接受手术的5例肺鳞癌患者的石蜡标本,所有标本的非癌细胞含量均在40%左右。其中Ⅰa期、Ⅰb期、Ⅱa期、Ⅱb期和Ⅲa期分别取1例,分期标准按照中华医学会临床诊疗指南(2018版)界定。样本均为女性,平均年龄61岁(标准差3.5岁)。患者均签署知情同意书,本研究经陆军军医大学第二附属医院医学伦理委员会审批(伦审研第2015030号)。
选择含有40%肺鳞癌微环境的肺鳞癌石蜡组织样本进行切片,先后将切片放入二甲苯、乙醇、蒸馏中水洗,完成石蜡切片脱蜡过程。将组织切片修复后用组化笔在组织周围画圈并完成封闭。甩掉封闭液后在切片上滴加ADAP2抗体(圣克鲁斯生物技术公司)并孵育过夜。PBS脱色后滴加FITC抗体并孵育。滴加CD163抗体(圣克鲁斯生物技术公司)并孵育过夜。PBS脱色后滴加CY3抗体并孵育50 min。DAPI复染细胞核后最终采集图像。双染后的组织切片使用PANNORAMIC扫描仪进行全景扫描,采用CaseViewer2.4软件进行观察和图像采集,应用Halo v3.0.311.314分析软件中的Indica Labs - HighPlex FL v3.1.0模块,分别定量每张切片的阳性细胞数、共定位细胞数和总细胞数。
1.7 统计学分析采用单因素和多因素COX生存分析法分析ADAP2 mRNA表达与肺鳞癌患者临床预后的关系,采用Kaplan-Meier法绘制生存曲线。采用Spearman相关性分析评价ADAP2 mRNA表达与肿瘤免疫浸润的关系,相关性强度如下:0.00~0.19“非常弱”,0.20~ 0.39“弱”,0.40~0.59“中等”,0.60~0.79“强”,0.80~ 1.0“非常强”。P<0.05表示差异有统计学意义。
2 结果 2.1 ADAP2与肺鳞癌患者预后的关联分析TCGA数据集中肺鳞癌患者的人口学统计特征及一般临床信息见表 1。共有501例肺鳞癌患者,平均年龄67.2岁,中位随访时间660 d。
| 临床特征 | 患者(n=501) |
| 中位随访时间(四分位数)/d | 660(322, 1 268) |
| 年龄(x±s)/岁 | 67.2±8.6 |
| 性别[例(%)] | |
| 男性 | 371(74.1) |
| 女性 | 130(25.9) |
| 吸烟史[例(%)] | |
| 吸烟 | 471(94.0) |
| 不吸烟 | 18(3.6) |
| 缺失值 | 12(2.4) |
| 病理分期[例(%)] | |
| Ⅰ | 244(48.7) |
| Ⅱ | 165(32.9) |
| Ⅲ/Ⅳ | 92(18.4) |
| 放疗[例(%)] | |
| 是 | 65(13.0) |
| 否 | 436(87.0) |
| 化疗[例(%)] | |
| 是 | 142(28.3) |
| 否 | 359(71.7) |
将501例肺鳞癌患者分为ADAP2高表达组和ADAP2低表达组。其中高表达组189例,低表达组312例。Kaplan-Meier曲线表明,ADAP2高表达组肺鳞癌患者的预后较差(log-rank检验P=0.005,图 1)。
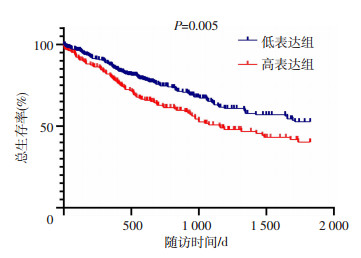
|
| 图 1 不同ADAP2基因表达肺鳞癌患者的Kaplan-Meier生存曲线 |
对肺鳞癌患者分别进行单因素和多因素Cox比例风险回归分析(表 2)。单因素Cox比例风险回归分析筛选出ADAP2表达水平(P=0.005)、病理分期(P=0.001)、放疗(P=0.052)、化疗(P=0.051)4个有统计学意义的协变量,考虑到性别、年龄和吸烟史与肺鳞癌预后密切相关,因而被共同列入多因素Cox模型分析的协变量。Cox多因素分析矫正上述协变量后,结果显示ADAP2 mRNA表达量是肺鳞癌OS的独立预后因素(HR=1.533,95%CI:1.139~2.064,P=0.005)。
| 协变量 | 单因素分析 | 多因素分析 | |||
| HR(95%CI) | P值 | HR(95%CI) | P值 | ||
| 年龄 | 1.010(0.993~1.028) | 0.249 | 1.012(0.994~1.030) | 0.203 | |
| 性别 | |||||
| 女性 | 参照 | 参照 | |||
| 男性 | 1.292(0.912~1.831) | 0.149 | 1.335(0.939~1.899) | 0.108 | |
| 分期 | |||||
| Ⅰ | 参照 | 参照 | |||
| Ⅱ | 1.242(0.883~1.746) | 0.213 | 1.484(1.041~2.115) | 0.029 | |
| Ⅲ/Ⅳ | 1.813(1.256~2.617) | 0.001 | 1.926(1.306~2.842) | 0.001 | |
| 吸烟史 | |||||
| 不吸烟 | 参照 | 参照 | |||
| 吸烟 | 1.824(0.583~5.714) | 0.302 | 1.749(0.556~5.506) | 0.339 | |
| 放疗 | |||||
| 否 | 参照 | 参照 | |||
| 是 | 0.690(0.475~1.003) | 0.052 | 0.655(0.436~0.984) | 0.042 | |
| 化疗 | |||||
| 否 | 参照 | 参照 | |||
| 是 | 0.713(0.507~1.001) | 0.051 | 0.536(0.368~0.782) | 0.001 | |
| ADAP2表达水平 | |||||
| 低表达 | 参照 | 参照 | |||
| 高表达 | 1.230(1.063~1.424) | 0.005 | 1.533(1.139~2.064) | 0.005 | |
2.2 ADAP2表达与肿瘤微环境评分的相关性分析
使用xCell分析ADAP2表达在肺鳞癌肿瘤微环境中的分布情况。将501例样本ADAP2表达数据同肺鳞癌微环境评分和免疫评分组合,而后应用GraphPad 8.0进行相关性分析。结果显示ADAP2基因表达与肺鳞癌微环境评分呈正相关(r=0.609,95%CI:0.550~0.661,P<0.001,图 2A)。ADAP2基因表达与肺鳞癌免疫评分同样为正相关(r=0.596,95%CI:0.536~0.649,P<0.001,图 2B)。

|
| A:ADAP2基因表达与肿瘤微环境评分相关性;B:ADAP2基因表达与免疫评分相关性 图 2 ADAP2基因表达与肺鳞癌组织免疫浸润丰度的关系 |
2.3 ADAP2表达与肺鳞癌肿瘤微环境免疫浸润细胞的关联
在xCell免疫细胞评分数据库中,检索TCGA免疫微环境数据,获取36种肿瘤免疫微环境细胞的富集分数,并与ADAP2基因表达进行匹配,而后进行相关性分析。结果显示ADAP2基因表达与巨噬细胞、巨噬细胞M1和M2、单核细胞、活化树突状细胞呈强正相关(相关系数r分别为0.737、0.718、0.603、0.631、0.630,P<0.001,图 3)。应用GEO数据库中的GSE157009数据集进行验证,结果同样显示ADAP2基因表达与巨噬细胞、巨噬细胞M1、巨噬细胞M2、单核细胞、活化树突状细胞呈强正相关(r分别为0.676、0.647、0.652、0.524、0.628,P<0.001,图 4)。
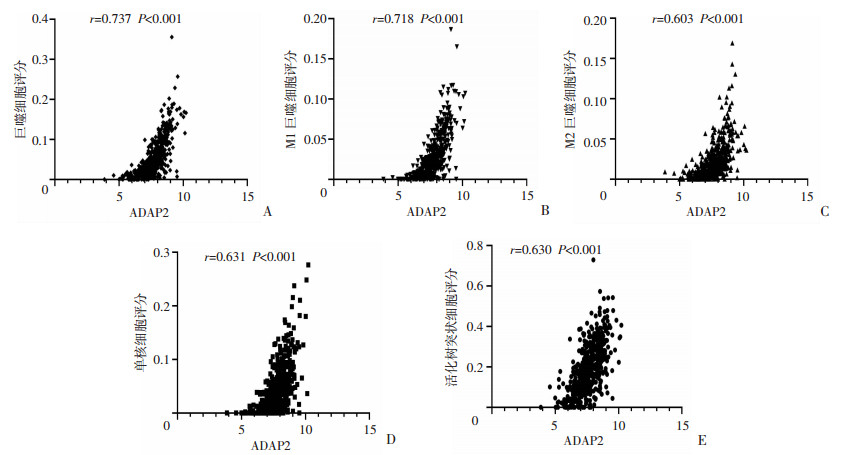
|
| A:ADAP2基因表达与巨噬细胞评分相关性分析;B:ADAP2基因表达与M1型巨噬细胞评分相关性分析;C:ADAP2基因表达与M2型巨噬细胞评分相关性分析;D:ADAP2基因表达与单核细胞评分相关性分析;E:ADAP2基因表达与活化树突状细胞评分相关性分析 图 3 TCGA样本中ADAP2基因表达与免疫细胞表达相关性分析 |
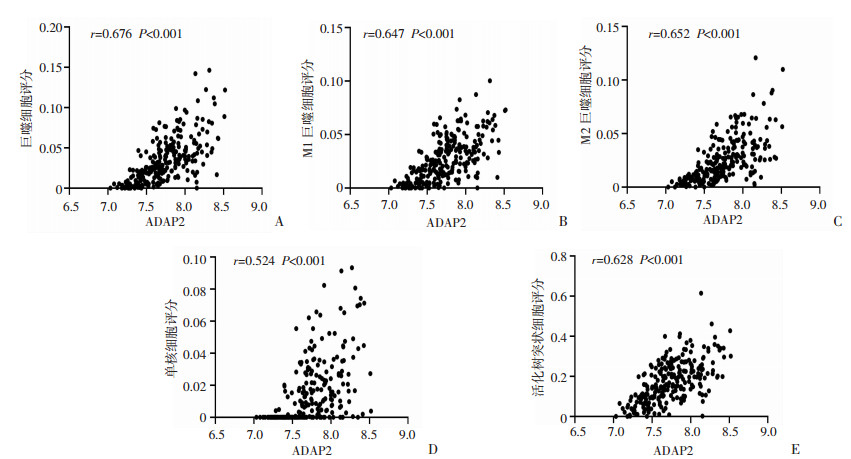
|
| A:ADAP2基因表达与巨噬细胞评分相关性分析;B:ADAP2基因表达与M1型巨噬细胞评分相关性分析;C:ADAP2基因表达与M2型巨噬细胞评分相关性分析;D:ADAP2基因表达与单核细胞评分相关性分析;E:ADAP2基因表达与活化树突状细胞评分相关性分析 图 4 GSE157009样本中ADAP2基因表达与免疫细胞表达相关性分析 |
2.4 富集分析
为了在信号通路层面探讨ADAP2基因在肺鳞癌免疫微环境中的可能作用机制,采用GSEA系统分析ADAP2基因在免疫方面的功能以及上、下游信号通路。结果显示,ADAP2表达与T细胞受体信号通路、B细胞受体信号通路、抗原处理和递呈通路、NOD样受体信号通路(免疫应答)、自然杀伤细胞介导的细胞毒性、TOLL样受体信号通路(抗原呈递)高度负相关(图 5)。提示ADAP2基因主要富集在免疫相关通路,且可能对免疫通路存在抑制作用。
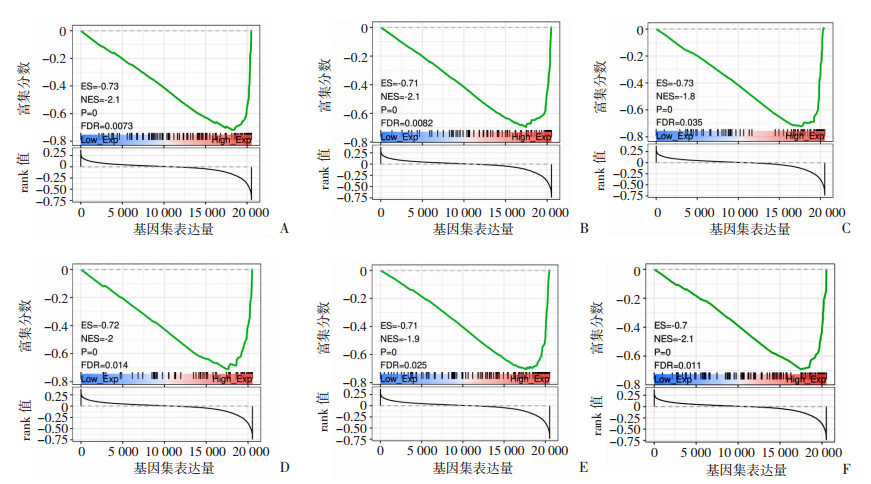
|
| A:T细胞受体信号通路;B:B细胞受体信号通路;C:抗原处理和递呈通路;D:NOD样受体信号通路;E:自然杀伤细胞介导的细胞毒性;F:TOLL样受体信号通路 图 5 ADAP2基因GSEA通路分析 |
应用String数据库探索ADAP2基因表达的蛋白互作情况,结果显示ADAP2蛋白与TEFM、C1QA、MS4A6A、ARF6、ATAD5、C1QB、CRLF3、CSF1R、TYROBP、UTP6十个蛋白可能有直接相互作用(图 6),提示其表达的蛋白有细胞代谢、免疫调节相关作用。
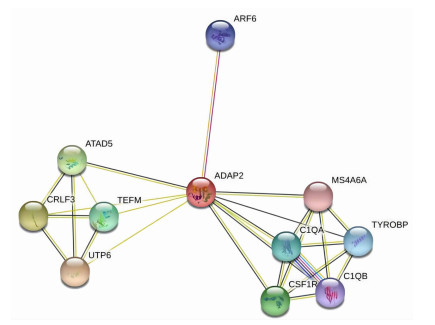
|
| 图 6 ADAP2基因String蛋白网络 |
2.5 肺鳞癌患者癌症组织切片中CD163和ADAP2共表达
免疫荧光双染结果显示,ADAP2在肺鳞癌环境中整体表达量较高(图 7A),ADAP2和CD163均表达在细胞膜上(图 7B、C),表达存在明显的共定位(图 7D)。5例样本的定量分析结果如表 3所示,ADAP2阳性细胞数量占比均高于CD163阳性细胞数量占比,提示不同临床分期的鳞癌组织局部微环境中,ADAP2存在较高的表达。

|
| 红色荧光标记CD163蛋白,绿色荧光标记ADAP2蛋白,DAPI荧光标记细胞核,红色箭头示图B、C、D放大区域,黄色箭头示特征细胞 A:ADAP2与CD163在肺鳞癌组织中的表达;B:CD163表达情况;C:ADAP2表达情况;D:ADAP2与CD163表达情况 图 7 免疫荧光染色观察ADAP2抗体和CD163抗体在肺鳞癌组织中的表达 |
| 标本编号 | 样本分期 | 总细胞数 | ADAP2阳性细胞数 | CD163阳性细胞数 | ADAP2与CD163共表达阳性细胞数 | ADAP2阳性细胞占总细胞数的比例 | CD163阳性细胞占总细胞数的比例 | ADAP2与CD163共表达细胞数占总细胞数的比例 |
| 1 | Ⅰa | 72 036 | 47 223 | 850 | 426 | 65.55% | 1.18% | 0.59% |
| 2 | Ⅰb | 70 975 | 62 476 | 121 | 121 | 88.03% | 0.17% | 0.17% |
| 3 | Ⅱa | 43 900 | 26 848 | 2 381 | 1 658 | 61.16% | 5.42% | 3.78% |
| 4 | Ⅱb | 82 917 | 80 902 | 10 288 | 10 228 | 97.57% | 12.41% | 12.34% |
| 5 | Ⅲa | 61 372 | 18 078 | 2 897 | 1 503 | 29.46% | 4.72% | 2.45% |
3 讨论
有研究表明,ADAP2基因是干扰素的刺激基因,它集成了RIG-Ⅰ信号的上游和下游模块,并促进Ⅰ型干扰素的产生[6]。进一步研究表明,ADAP2基因编码的蛋白能移位到细胞膜并结合磷脂酰肌醇3, 4, 5-三磷酸(PtdInsP3)和肌醇1, 3, 4, 5-四磷酸(InsP4)[14],即证明其在细胞膜表达并发挥作用。在成人低度神经胶质瘤中,该基因同样被发现具有预后价值[7],然而,ADAP2基因与肺鳞癌的相关分析暂无报道。鉴于此,本研究进一步在公共数据库中分析ADAP2基因对肺鳞癌预后有何影响,采用TCGA数据进行Cox多因素生存分析,结果显示,在包括年龄、肿瘤分期等协变量的影响下,ADAP2高表达仍旧是肺鳞癌患者OS的独立危险因素。
肿瘤免疫微环境主要包括基质细胞和免疫细胞,其中免疫细胞的浸润程度被认为与肿瘤的发生、发展高度相关,肿瘤中各个特定浸润免疫细胞亚群的量的改变同样影响患者的预后[15]。同时,随着包括CTLA4和PD-L1/PD-1免疫检查位点的发现和单抗的使用,免疫疗法已被证明是治疗多种癌症的有效方法[16],但真正有效的只有一小部分病例。当前,还没有研究证明ADAP2基因与肺鳞癌免疫浸润程度之间的关系。因此,本研究使用xCell数据库,全面分析ADAP2基因表达与肺鳞癌免疫微环境中各类免疫细胞浸润之间的相关性。结果显示,在肺鳞癌中,ADAP2表达与肿瘤微环境评分存在正相关,且ADAP2表达与免疫微环境评分存在正相关,提示ADAP2主要在肿瘤微环境中表达,并可能在免疫微环境中发生作用。
ADAP2表达与免疫浸润细胞相关性分析显示,ADAP2基因表达与巨噬细胞、巨噬细胞M1、巨噬细胞M2、单核细胞、活化树突状细胞在肺鳞癌免疫微环境中占比呈强正相关。多项流行病学及临床研究表明,实体肿瘤中巨噬细胞的高浸润水平预示着患者预后不良,在大多数癌症患者化疗过程中发现,巨噬细胞的浸润程度与耐药相关[17],例如肝癌[18]、肺癌[19]、肾癌[20]、霍奇金淋巴瘤[21]。巨噬细胞可以与肿瘤细胞进行异质性融合[22],尤其是M2巨噬细胞,可产生抑制性细胞因子,如IL-10、TGF-β、活性氧、一氧化氮合成酶和精氨酸酶,抑制细胞毒性T细胞功能,从而帮助肿瘤细胞进行免疫逃逸和远处转移[22-23]。据此我们推测,ADAP2可能通过促进干扰素的生成,影响单核吞噬细胞系统[24],尤其是影响M2巨噬细胞与肺鳞癌细胞之间的相互作用,进而调控肺鳞癌的进展。同时,也有研究表明,干扰素可以促进树突状细胞的激活[25],树突状细胞中的内质网应激同样促进癌症发生、发展[26]。提示ADAP2可能介导干扰素的生成,促进M2巨噬细胞的聚集和树突状细胞的活化,进而造成肺鳞癌不良预后。
那么,ADAP2还可能影响哪些通路,进而影响肺鳞癌预后,为此我们进行了富集分析。GSEA富集分析显示ADAP2表达主要抑制了T细胞受体信号通路、B细胞受体信号通路、抗原处理和递呈通路、NOD样受体信号通路(免疫应答)、自然杀伤细胞介导的细胞毒性、TOLL样受体信号通路(抗原呈递),这些通路的抑制均有利于肺鳞癌的发生、发展。String蛋白网络分析显示,该基因表达蛋白与TEFM、C1QA、MS4A6A、ARF6、ATAD5、C1QB、CRLF3、CSF1R、TYROBP、UTP6十个蛋白可能有直接相互作用,提示其表达的蛋白有细胞代谢、免疫调节相关作用。CTLA4和PD-L1/PD-1免疫检查位点单抗的应用已经有明确的临床意义,其表达蛋白均富集于细胞膜并发挥着免疫逃逸作用[27]。那么,ADAP2基因如果对免疫通路具有抑制作用,其表达的蛋白可能与CTLA4和PD-L1/PD-1一样高表达于细胞膜上。为此,我们在肺鳞癌组织切片中,对ADAP2蛋白和M2巨噬细胞特异表达膜蛋白CD163进行了免疫荧光双染,其染色结果证明,ADAP2与CD163共表达于细胞膜。
本研究还存在一定的不足,研究的结果主要是建立在生物信息学分析的基础上,为下一步研究提供了重要线索,但是ADAP2在肿瘤微环境中的免疫调节作用和机制需要进一步的试验验证;研究初步发现ADAP2与CD163存在共定位,但是两者的表达水平是否存在关联尚需要扩大样本量进行研究。
综上所述,ADAP2高表达与肺鳞癌不良预后相关。同时ADAP2在细胞膜高表达,并与肺鳞癌微环境的单核吞噬细胞系统浸润呈正相关。ADAP2有望成为肺鳞癌潜在的预后生物标志物,其在肺鳞癌肿瘤微环境中的作用和机制值得进一步研究。
| [1] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA A Cancer J Clin, 2021, 71(3): 209-249. |
| [2] |
THORSTEINSSON H, ALEXANDERSSON A, OSKARSDOTTIR G N, et al. Resection rate and outcome of pulmonary resections for non-small-cell lung cancer: a nationwide study from Iceland[J]. J Thorac Oncol, 2012, 7(7): 1164-1169. |
| [3] |
HAMID O, SCHMIDT H, NISSAN A, et al. A prospective phase Ⅱ trial exploring the association between tumor microenvironment biomarkers and clinical activity of ipilimumab in advanced melanoma[J]. J Transl Med, 2011, 9: 204. |
| [4] |
CHEN P L, ROH W, REUBEN A, et al. Analysis of immune signatures in longitudinal tumor samples yields insight into biomarkers of response and mechanisms of resistance to immune checkpoint blockade[J]. Cancer Discov, 2016, 6(8): 827-837. |
| [5] |
JOHNSON D B, ESTRADA M V, SALGADO R, et al. Melanoma-specific MHC-Ⅱ expression represents atumour-autonomous phenotype and predicts response to anti-PD-1/PD-L1 therapy[J]. Nat Commun, 2016, 7: 10582. |
| [6] |
BIST P, KIM S S Y, PULLOOR N K, et al. ArfGAP domain-containing protein 2 (ADAP2) integrates upstream and downstream modules of RIG-Ⅰ signaling and facilitates type Ⅰ interferon production[J]. Mol Cell Biol, 2017, 37(6): e00537-16. |
| [7] |
ZHANG M, WANG X, CHEN X, et al. Prognostic value of astemness index-associated signature in primary lower-grade glioma[J]. Front Genet, 2020, 11: 441. |
| [8] |
BUENO R, RICHARDS W G, HARPOLE D H, et al. Multi-institutional prospective validation of prognostic mRNA signatures in early stage squamous lung cancer (alliance)[J]. J Thorac Oncol, 2020, 15(11): 1748-1757. |
| [9] |
ARAN D, HU Z, BUTTE A J. xCell: digitally portraying the tissue cellular heterogeneity landscape[J]. Genome Biol, 2017, 18(1): 220. |
| [10] |
段怡平, 陈梁玥, 柳家翠, 等. 基于TCGA数据库分析PFKFB4在肝细胞癌的临床意义及分子机制[J]. 分子诊断与治疗杂志, 2021, 13(1): 25-29. DUAN Y P, CHEN L Y, LIU J C, et al. Analysis of the clinical significance and molecular mechanism of PFKFB4 in hepatocellular carcinoma based on the TCGA database[J]. J Mol Diagn Ther, 2021, 13(1): 25-29. |
| [11] |
SZKLARCZYK D, GABLEA L, NASTOU K C, et al. The STRING database in 2021: customizable protein-protein networks, and functional characterization of user-uploaded gene/measurement sets[J]. Nucleic Acids Res, 2021, 49(D1): D605-D612. |
| [12] |
陈梦雷, 袁帅, 周玫余, 等. 长链非编码RNA SFTA1P在肺腺癌中的表达及预后预测研究[J]. 第三军医大学学报, 2020, 42(21): 2075-2080, 2115. CHEN M L, YUAN S, ZHOU M Y, et al. Expression of long non-coding RNA SFTA1P in lung adenocarcinoma and its predictive value for prognosis[J]. J Third Mil Med Univ, 2020, 42(21): 2075-2080, 2115. |
| [13] |
CAMP R L, DOLLED-FILHART M, RIMM D L. X-tile: a new bio-informatics tool for biomarker assessment and outcome-based cut-pointoptimization[J]. Clin Cancer Res, 2004, 10(21): 7252-7259. |
| [14] |
SHU Q, LENNEMANN N J, SARKAR S N, et al. ADAP2 is an interferon stimulated gene that restricts RNA virus entry[J]. PLoS Pathog, 2015, 11(9): e1005150. |
| [15] |
LIU X, WU S, YANG Y, et al. The prognostic landscape of tumor-infiltrating immune cell and immunomodulators in lung cancer[J]. Biomed Pharmacother, 2017, 95: 55-61. |
| [16] |
CHEN D S, MELLMAN I. Elements of cancer immunity and the cancer-immune set point[J]. Nature, 2017, 541(7637): 321-330. |
| [17] |
BINGLE L, BROWN N J, LEWIS C E. The role of tumour-associated macrophages in tumour progression: implications for new anticancer therapies[J]. J Pathol, 2002, 196(3): 254-265. |
| [18] |
YEUNG O W, LO C M, LING C C, et al. Alternatively activated (M2) macrophages promote tumour growth and invasiveness in hepatocellular carcinoma[J]. J Hepatol, 2015, 62(3): 607-616. |
| [19] |
SCHMALL A, AL-TAMARI H M, HEROLD S, et al. Macrophage and cancer cell cross-talk via CCR2 and CX3CR1 is a fundamental mechanism driving lung cancer[J]. Am J Respir Crit Care Med, 2015, 191(4): 437-447. |
| [20] |
ROUMENINA L T, DAUGAN M V, NOÉ R, et al. Tumor cells hijack macrophage-produced complement C1q to promote tumor growth[J]. Cancer Immunol Res, 2019, 7(7): 1091-1105. |
| [21] |
STEIDL C, LEE T, SHAH S P, et al. Tumor-associated macrophages and survival in classic Hodgkin's lymphoma[J]. N Engl J Med, 2010, 362(10): 875-885. |
| [22] |
PAWELEK J M. Tumour-cell fusion as a source of myeloid traits in cancer[J]. Lancet Oncol, 2005, 6(12): 988-993. |
| [23] |
FRANCIAN A, MANN K, KULLBERG M. Complement C3-dependent uptake of targeted liposomes into human macrophages, B cells, dendritic cells, neutrophils, and MDSCs[J]. Int J Nanomed, 2017, 12: 5149-5161. |
| [24] |
YIN Z, ZHOU Y, MA T, et al. Down-regulated lncRNA SBF2-AS1 in M2 macrophage-derived exosomes elevates miR-122-5p to restrict XIAP, thereby limiting pancreatic cancer development[J]. J Cell Mol Med, 2020, 24(9): 5028-5038. |
| [25] |
LAMBERTI M J, MENTUCCI F M, ROSELLI E, et al. Photodynamic modulation of type 1 interferon pathway on melanoma cells promotes dendritic cell activation[J]. Front Immunol, 2019, 10: 2614. |
| [26] |
GARRIS C S, PITTET M J. ER stress in dendritic cells promotes cancer[J]. Cell, 2015, 161(7): 1492-1493. |
| [27] |
HOOS A. Development of immuno-oncology drugs—from CTLA4 to PD1 to the next generations[J]. Nat Rev Drug Discov, 2016, 15(4): 235-247. |




