2. 400014 重庆,重庆医科大学附属儿童医院儿童发育疾病教育部重点实验室
2. Institute of Pediatrics, Children's Hospital of Chongqing Medical University, Chongqing, 400014, China
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)具有多向分化能力和免疫调节能力,在组织工程和再生医学领域具有良好的应用前景[1-2]。BMSCs的成骨分化能力为自体骨移植替代或修复受损骨组织提供了一种新的途径。在骨折愈合的过程中,骨折端BMSCs的迁移和进行有效的成骨分化是骨折愈合的前提条件和细胞学基础[3-4]。一些机械信号,如细胞外基质(extracellular matrix,ECM)硬度、细胞形状和机械力等在BMSCs的谱系决定和分化中起着重要作用[5-6]。低强度脉冲超声(low intensity pulsed ultrasound,LIPUS)是一种特定类型的超声波,以低强度脉冲模式输出,具有最小的热效应和非侵入性物理刺激;已广泛应用在促进骨折愈合、软组织再生、炎症抑制和非侵入性神经调控以及BMSCs成骨分化等方面[7]。尽管一些研究发现LIPUS作用能调节BMSCs成骨相关信号通路分子表达的变化[8-9],但细胞如何接收LIPUS这一机械刺激作用的机制仍有待研究。
细胞骨架是细胞中的蛋白纤维网架体系,包括微管、微丝和中间纤维。微丝主要由肌动蛋白(actin)组成[10],分别以球状/单体肌动蛋白(globular/monomeric actin,G-actin)和丝状肌动蛋白(filamentous actin,F-actin)两种形式存在,其表现形式的动态变化与细胞的形态和细胞的生长、分化及凋亡等功能密切相关[11-12],对细胞的基因表达具有调控作用[13-14]。细胞外机械刺激能诱导细胞骨架动态组装的变化,导致细胞形态改变,调控信号级联和特定基因的转录活性[15]。LIPUS作为一种机械力,在BMSCs成骨分化过程中,促进微丝发生何种变化以及相关作用机制尚待研究。本研究将探讨微丝解聚在LIPUS促进BMSCs成骨分化时的作用,为LIPUS在骨组织疾病中的应用奠定理论基础。
1 材料与方法 1.1 主要试剂与仪器小鼠BMSCs由重庆医科大学生科院实验室保存;α-DMEM培养基购自Hyclone公司;胎牛血清购自美国Gibco公司;β-甘油磷酸钠、地塞米松、维生素C均购自Solarbio公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、Ⅰ型胶原(Collagen1)、骨桥蛋白(Osteopontin,OPN)、RUNX家族转录因子2(RUNX family transcription factor 2,RUNX2)一抗以及山羊抗兔二抗、兔抗鼠二抗均购自美国Singma aldrich公司;BCIP/NBT碱性磷酸酶显色试剂盒购自BD公司;F-actin免疫荧光染料、DNA免疫荧光染料均购自上海碧云天生物工程公司;F/G试剂盒购自美国Cytoskeleton公司;低频超声仪购自美国Chattanooga公司。
1.2 细胞培养及分组BMSC细胞使用含有10%胎牛血清的α-MEM完全培养基在37 ℃、5% CO2的条件下培养。将细胞接种于24孔板中,待密度在70%左右加入成骨培养基(200 mL普通培养基、1 mL β-甘油磷酸钠、100 μL维生素C、26 μL地塞米松)。实验分为4组:对照组、LIPUS组、LIPUS+DMSO组、LIPUS+CytoD组。DMSO及CytoD在成骨培养基作用的第2天开始使用,隔天1次,每次作用1 h(DMSO的浓度为0.1%,CytoD的浓度为1 μmol/L)(只作用3次)。LIPUS处理在细胞换为成骨培养基的第2天开始,3 MHz/(0.1 W·cm2)辐照10 min,每天处理一次。
1.3 碱性磷酸酶(Alkaline phosphatase,ALP)染色细胞在处理7天后,吸弃培养基并用PBS润洗,4%甲醛固定10 min,再用PBS润洗2次,最后按ALP显色试剂盒说明书加入染液,室温避光反应30 min后用PBS润洗去除染液,观察并拍照。
1.4 RUNX2及F-actin免疫荧光染色细胞在处理5天后,吸弃培养基,PBS清洗3遍,4%多聚甲醛固定20 min,再用PBS清洗3遍,0.5%tritonX-100(PBS配制)作用20 min,PBS清洗3遍,5%BSA(PBS配制)封闭1 h,一抗(RUNX2稀释比例1 ∶500,F-actin使用鬼笔环肽结合物染色)孵育过夜,第二天使用PBS清洗两遍,37 ℃孵育二抗(羊抗兔荧光二抗稀释比例1 ∶200)1.5 h,PBS清洗后用0.7%DAPI染色(双蒸水配制)5~7 min,PBS清洗3遍,50%抗荧光淬灭剂(PBS配制)处理后封片观察。
1.5 F-actin/G-actin蛋白提取细胞在处理5天后,吸弃培养基,用PBS清洗1遍,加入适量LAS2 buffer(1 mL LAS01 buffer ∶10 μL BSA04 ∶10 μL PIC02),用细胞刮刮下细胞后收集至1.5 mL EP管中,离心沉淀破碎的细胞组织,按照试剂盒说明书提取F-actin/G-actin蛋白,向每个上清液及沉淀中加入25 μL 5xSDS样品缓冲液,充分混匀,低温保存备用。
1.6 Western blot实验细胞在处理15天后,使用试剂盒配胶完成后按总蛋白量30 μg上样。使用70 V恒压待样品进入分离胶后加压至120 V恒压电泳全程,转膜按恒流250 mA 1 h后,使用5%脱脂奶粉封闭2 h。然后敷一抗(Collagen1、OPN、RUNX2一抗稀释比例为1 ∶500)4 ℃过夜,第2天使用TBST洗膜3次,每次10 min,敷二抗(山羊抗兔二抗稀释比例1 ∶4 000、兔抗鼠二抗稀释比例1 ∶10 000)室温2 h,再使用TBST洗膜3次,每次10 min,最后采集图像。
1.7 统计学分析采用Graphpad Prism 8.0进行统计分析。每个实验独立重复3次,数据用x±s表示。多组间比较采用单因素方差分析,两组间比较采用Student-t检验。P < 0.05被认为具有统计学意义。
2 结果 2.1 LIPUS促进BMSCs的成骨分化LIPUS处理7天后进行ALP染色,与对照组相比,LIPUS组细胞内蓝紫色阳性染色明显增多(图 1A)。LIPUS作用细胞15天后,提取蛋白进行Western blot实验,与对照组相比,LIPUS组成骨分化相关基因Collagen1、OPN、RUNX2的蛋白表达明显增高(P < 0.05,图 1B~E)。以上结果提示,LIPUS促进BMSCs向成骨方向分化。

|
|
a:P < 0.05,b:P < 0.01 A:ALP染色;B~E:Western blot检测成骨分化相关基因Collagen1、OPN、RUNX2的蛋白表达及定量分析(n=3,x±s) 图 1 LIPUS对BMSCs促成骨分化的影响 |
2.2 LIPUS促进BMSCs成骨分化时肌动蛋白的变化
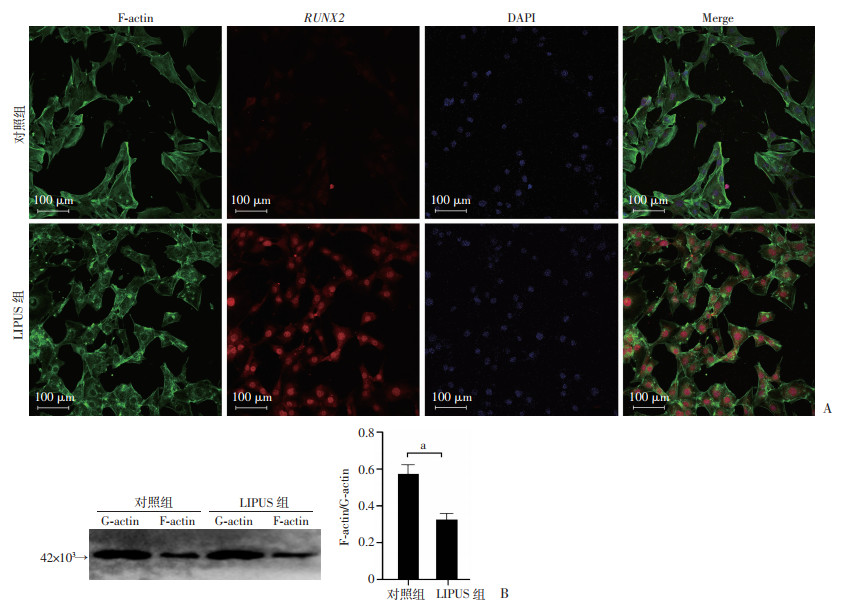
LIPUS处理5天后,荧光染色显示细胞中肌动蛋白的分布,与对照组相比,LIPUS处理组细胞形态趋于圆形,可见细胞质内点状G-actin的分布,对照组细胞形态趋于长梭形,细胞有明显的突起,胞浆内可见呈拉伸状态的肌动蛋白束(图 2A)。提取细胞的F-actin及G-actin蛋白,Western blot实验分析F-actin/G-actin的比值,LIPUS组明显小于对照组(P < 0.05,图 2B)。同时,与对照组相比,LIPUS处理组细胞中RUNX2的核内蛋白表达明显增加(图 2A)。以上结果提示LIPUS处理可以促进BMSCs中肌动蛋白的解聚,促进F-actin分解为单体G-actin的形式,同时LIPUS处理可以促进BMSCs的成骨分化。
|
|
a:P < 0.05 A:荧光染色观察细胞中肌动蛋白分布以及RUNX2表达;B:Western blot检测F-actin/G-actin的比值及定量分析(n=3,x±s) 图 2 LIPUS促进BMSCs成骨分化时对丝状肌动蛋白以及RUNX2的蛋白表达的影响 |
2.3 CytoD促进LIPUS诱导BMSCs的成骨分化
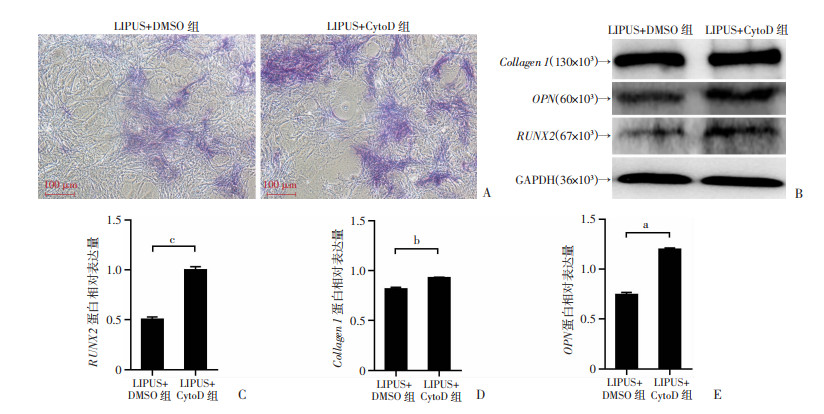
CytoD及LIPUS作用后,ALP染色结果显示,与LIPUS+DMSO组相比,LIPUS+CytoD组的细胞中蓝紫色阳性染色显著增多(图 3A)。提取蛋白进行Western blot实验,与LIUPS+DMSO组相比,LIPUS+CytoD组的细胞中成骨分化相关基因Collagen1、OPN、RUNX2的蛋白表达显著增加(P < 0.05.图 3B~E)。以上结果表示,CytoD在LIPUS诱导的BMSCs成骨分化中具有促进作用。
|
|
a:P < 0.05,b:P < 0.01,c:P < 0.001 A:ALP染色;B~E:Western blot检测成骨分化相关基因Collagen1、OPN、RUNX2的蛋白表达及定量分析(n=3,x±s) 图 3 CytoD促进LIPUS诱导的BMSCs细胞的成骨分化 |
2.4 CytoD促进LIPUS诱导的BMSCs成骨分化过程中肌动蛋白解聚
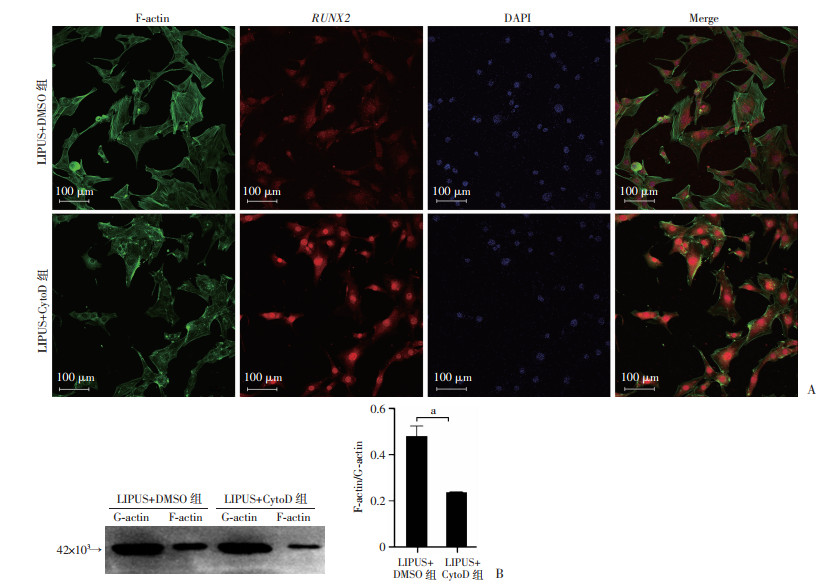
药物及LIPUS共同作用后,荧光染色显示细胞中肌动蛋白的分布,LIPUS+CytoD处理组细胞体积缩小,胞质内很少见到丝状肌动蛋白,呈无规律分布的点状、颗粒状。LIPUS+DMSO组细胞呈梭形,胞质内见充满张力的丝状肌动蛋白(图 4A)。同时,与LIPUS+DMSO组相比,LIPUS+CytoD处理组细胞中RUNX2的核内蛋白表达明显增加(图 4A),该结果表明,肌动蛋白解聚可以促进BMSCs中RUNX2表达的增加,在LIPUS促进BMSCs的成骨方向分化中发挥重要作用。此外,分别提取细胞的F-actin及G-actin蛋白,采用Western blot实验分析F-actin/G-actin的比值,结果发现,LIPUS+CytoD处理组的比值明显小于LIPUS+DMSO组(P < 0.05,图 4B)。以上结果显示,CytoD能促进LIPUS诱导的BMSCs成骨分化过程中肌动蛋白的解聚,进一步加强LIPUS诱导的成骨分化作用。
|
|
a:P < 0.05 A:荧光染色观察细胞中肌动蛋白分布以及RUNX2表达;B:Western blot检测F-actin/G-actin的比值及定量分析(n=3,x±s) 图 4 CytoD促进LIPUS诱导BMSCs成骨分化时对丝状肌动蛋白分布以及RUNX2的蛋白表达的影响 |
3 讨论
LIPUS是一种低强度的机械应力,在骨折愈合和促进BMSCs的成骨分化上具有潜在的应用价值,然而具体机制尚不清楚。有研究显示LIPUS可以通过增加碱性磷酸酶(ALP)[16]、Runt相关转录因子2 (RUNX2) [17]以及骨分化标记物Ⅰ型胶原(Collagen1)、骨桥蛋白(OPN)[18]等的表达来促进干细胞分化为成骨细胞。本研究使用LIPUS处理BMSCs,结果发现LIPUS促进BMSCs成骨分化,其机制可能与LIPUS通过作用于BMSCs的细胞骨架成分微丝的解聚参与促进成骨分化有关。
超声波的效应包括机械效应、热效应和空化效应等,而低强度超声的效应主要以机械效应为主。细胞受到环境中力的作用,产生反应以维持细胞的相对稳态[19]。机械力使细胞产生张力,引起细胞骨架变化,从而影响细胞功能[20-21]。作为细胞骨架主要成分的肌动蛋白(actin)是一种普遍存在的细丝形成蛋白,它通过组装和去组装过程改变自身结构以适应细胞的生理和病理变化。丝状肌动蛋白(F-actin)由球状肌动蛋白(G-actin)缠绕在一起形成右旋螺旋的两种原丝聚合物组成,并保持着G-actin与F-actin的动态平衡[22]。我们发现LIPUS作用于BMSCs后不仅促进BMSCs的成骨分化,同时促进肌动蛋白的解聚,促进F-actin分解为单体G-actin的形式。CytoD是一种肌动蛋白聚合抑制剂,通过与肌动蛋白纤维正端的结合来抑制亚基的聚合和解离,从而调节细胞的运动、生长及等多种细胞行为。本研究结果发现,CytoD作用后会导致BMSCs细胞内肌动蛋白聚合被抑制,以大量单体G-actin的形式存在。CytoD能增强LIPUS对BMSCs成骨分化的作用。说明LIPUS在促BMSCs成骨分化时,微丝的解聚发挥着重要作用。
细胞骨架的重组与细胞的代谢活性、形状修饰、增殖和分化密切相关[23-25]。丝状肌动蛋白(F-actin)与球状肌动蛋白单体(G-actin)的动态组装平衡调节干细胞谱系命运,并增强多种细胞过程,如随着细胞迁移,细胞黏附和伤口愈合。近年来有研究表明,肌动蛋白的动态改变及其下游效应在干细胞分化中起着至关重要的作用[26],在24小时内就可以通过细胞骨架的形态、强度、纹理和空间分布来预测干细胞的分化方向[27-28]。在施加机械应力的早期,很少检测到丝状肌动蛋白,主要以单体肌动蛋白为主,并且观察到异常形状的细胞核[29]。亦有研究表明,单体肌动蛋白迅速向细胞核转移,核内肌动蛋白诱导RUNX2依赖的成骨基因表达,并且核内肌动蛋白至使Yes-associated protein(YAP)从核内转移到细胞质,从而解除对RUNX2的抑制,促进成骨分化[30]。本研究发现LIPUS通过作用于BMSCs的细胞骨架成分微丝的解聚参与促进BMSCs的成骨分化。LIPUS能促进细胞核内RUNX2的表达增加,在LIPUS和CytoD协同作用下,RUNX2的蛋白表达明显高于单独的LIPUS处理;该结果表明,肌动蛋白解聚可以促进BMSCs中RUNX2表达的增加,即肌动蛋白解聚在LIPUS促进BMSCs的成骨方向分化中发挥重要作用。
综上所述,LIPUS在促进BMSCs向成骨细胞分化时,细胞骨架的主要成分肌动蛋白解聚为单体肌动蛋白,促进细胞核内RUNX2的表达,在促进成骨分化中发挥重要作用。本研究下一步拟通过更进一步的体外实验以及动物模型论证LIPUS在BMSCs成骨分化过程中的促进作用以及更深的机制,为LIPUS的临床应用奠定一定的理论基础。
| [1] |
ANGLE S R, SENA K, SUMNER D R, et al. Osteogenic differentiation of rat bone marrow stromal cells by various intensities of low-intensity pulsed ultrasound[J]. Ultrasonics, 2011, 51(3): 281-288. |
| [2] |
LI X, WANG M, JING X, et al. Bone marrow-and adipose tissue-derived mesenchymal stem cells: characterization, differentiation, and applications in cartilage tissue engineering[J]. Crit Rev Eukaryot Gene Expr, 2018, 28(4): 285-310. |
| [3] |
MARSELL R, EINHORN T A. The biology of fracture healing[J]. Injury, 2011, 42(6): 551-555. |
| [4] |
XIAO W, XU Q, ZHU Z, et al. Different performances of CXCR4, integrin-1β and CCR-2 in bone marrow stromal cells (BMSCs) migration by low-intensity pulsed ultrasound stimulation[J]. Biomed Tech (Berl), 2017, 62(1): 89-95. |
| [5] |
LIU X, HOU W Q, HE L, et al. AMOT130/YAP pathway in topography-induced BMSC osteoblastic differentiation[J]. Colloids Surf B Biointerfaces, 2019, 182: 110332. |
| [6] |
HE Y B, LIU S Y, DENG S Y, et al. Mechanical stretch promotes the osteogenic differentiation of bone mesenchymal stem cells induced by erythropoietin[J]. Stem Cells Int, 2019, 2019: 1839627. |
| [7] |
JIANG X X, SAVCHENKO O, LI Y F, et al. A review of low-intensity pulsed ultrasound for therapeutic applications[J]. IEEE Trans Biomed Eng, 2019, 66(10): 2704-2718. |
| [8] |
TABUCHI Y, HASEGAWA H, SUZUKI N, et al. Low-intensity pulsed ultrasound promotes the expression of immediate-early genes in mouse ST2 bone marrow stromal cells[J]. J Med Ultrason (2001), 2020, 47(2): 193-201. |
| [9] |
SENA K, ANGLE S R, KANAJI A, et al. Low-intensity pulsed ultrasound (LIPUS) and cell-to-cell communication in bone marrow stromal cells[J]. Ultrasonics, 2011, 51(5): 639-644. |
| [10] |
KABSCH W, MANNHERZ H G, SUCK D, et al. Atomic structure of the actin: DNase I complex[J]. Nature, 1990, 347(6288): 37-44. |
| [11] |
SINGHVI R, KUMAR A, LOPEZ G P, et al. Engineering cell shape and function[J]. Science, 1994, 264(5159): 696-698. |
| [12] |
PRASAD A, ALIZADEH E. Cell form and function: interpreting and controlling the shape of adherent cells[J]. Trends Biotechnol, 2019, 37(4): 347-357. |
| [13] |
VERSAEVEL M, GREVESSE T, GABRIELE S. Spatial coordination between cell and nuclear shape within micropatterned endothelial cells[J]. Nat Commun, 2012, 3: 671. |
| [14] |
UHLER C, SHIVASHANKAR G V. Geometric control and modeling of genome reprogramming[J]. Bioarchitecture, 2016, 6(4): 76-84. |
| [15] |
PEGORARO A F, JANMEY P, WEITZ D A. Mechanical properties of the cytoskeleton and cells[J]. Cold Spring Harb Perspect Biol, 2017, 9(11): a022038. |
| [16] |
LI L, YANG Z, ZHANG H, et al. Low-intensity pulsed ultrasound regulates proliferation and differentiation of osteoblasts through osteocytes[J]. Biochem Biophys Res Commun, 2012, 418(2): 296-300. |
| [17] |
RUTTEN S, NOLTE P A, KORSTJENS C M, et al. Low-intensity pulsed ultrasound affects RUNX2 immunopositive osteogenic cells in delayed clinical fracture healing[J]. Bone, 2009, 45(5): 862-869. |
| [18] |
MAEDA S, TSUDA E, MIZUKAMI H, et al. Histological evaluation of low-intensity pulsed ultrasound on osteochondritis dissecans of the humeral Capitellum[J]. Asia Pac J Sports Med Arthrosc Rehabilit Technol, 2015, 2(2): 56-62. |
| [19] |
LESSEY E C, GUILLUY C, BURRIDGE K. From mechanical force to RhoA activation[J]. Biochemistry, 2012, 51(38): 7420-7432. |
| [20] |
HEIDEMANN S R, KAECH S, BUXBAUM R E, et al. Direct observations of the mechanical behaviors of the cytoskeleton in living fibroblasts[J]. J Cell Biol, 1999, 145(1): 109-122. |
| [21] |
LECUIT T, LENNE P F. Cell surface mechanics and the control of cell shape, tissue patterns and morphogenesis[J]. Nat Rev Mol Cell Biol, 2007, 8(8): 633-644. |
| [22] |
WICKSTEAD B, GULL K. The evolution of the cytoskeleton[J]. J Cell Biol, 2011, 194(4): 513-525. |
| [23] |
YU H Y, TAY C Y, LEONG W S, et al. Mechanical behavior of human mesenchymal stem cells during adipogenic and osteogenic differentiation[J]. Biochem Biophys Res Commun, 2010, 393(1): 150-155. |
| [24] |
GONZÁLEZ-CRUZ R D, FONSECA V C, DARLING E M. Cellular mechanical properties reflect the differentiation potential of adipose-derived mesenchymal stem cells[J]. Proc Natl Acad Sci USA, 2012, 109(24): E1523-E1529. |
| [25] |
CHEN L, SHI K K, FRARY C E, et al. Inhibiting actin depolymerization enhances osteoblast differentiation and bone formation in human stromal stem cells[J]. Stem Cell Res, 2015, 15(2): 281-289. |
| [26] |
MISHRA P, MARTIN D C, ANDROULAKIS I P, et al. Fluorescence imaging of actin turnover parses early stem cell lineage divergence and senescence[J]. Sci Rep, 2019, 9: 10377. |
| [27] |
MATSUOKA F, TAKEUCHI I, AGATA H, et al. Morphology-based prediction of osteogenic differentiation potential of human mesenchymal stem cells[J]. PLoS One, 2013, 8(2): e55082. |
| [28] |
MARKLEIN R A, LO SURDO J L, BELLAYR I H, et al. High content imaging of early morphological signatures predicts long term mineralization capacity of human mesenchymal stem cells upon osteogenic induction[J]. Stem Cells, 2016, 34(4): 935-947. |
| [29] |
SAKAI D, KⅡ I, NAKAGAWA K, et al. Remodeling of actin cytoskeleton in mouse periosteal cells under mechanical loading induces periosteal cell proliferation during bone formation[J]. PLoS One, 2011, 6(9). |
| [30] |
SEN B E, XIE Z H, UZER G, et al. Intranuclear actin regulates osteogenesis[J]. Stem Cells, 2015, 33(10): 3065-3076. |




