肺动脉高压(pulmonary arterial hypertension, PAH)是一种罕见的恶性肺血管疾病,以肺动脉血管收缩和阻塞,肺血管阻力增高,最终导致右心衰竭为显著特征[1]。作为一种罕见病,尽管目前对PAH的认识已经有了显著提高,但通常由于患者临床症状不典型、诊断复杂,导致诊断延迟,临床上对PAH的诊断通常延迟2年[2]。在没有特殊治疗的情况下,平均生存时间仅为2.8年,5年生存率仅为34%[3]。右心导管术检测是确诊PAH的金标准,但该项检查具有侵入性。通过超声心动图测量肺动脉收缩压可以监测病程,但价格昂贵。因此,寻找简单、方便、成本低廉的血液测试生物标记物对于PAH的诊断和监测具有非常重要的意义。
CD248又被称为内皮唾液酸蛋白(endosialin)或肿瘤内皮标志蛋白1(tumor endothelial marker protein 1,TEM1),是一种包含C型凝集素样结构域的Ⅰ型跨膜蛋白,与CD93和血栓调节蛋白同属于血栓调节素家族[4]。CD248最初被认为是肿瘤内皮细胞的标志,但后来研究发现CD248在内皮细胞中并不表达,而是在周细胞、基质成纤维细胞及血管平滑肌细胞等间充质谱系细胞中表达[5-6]。CD248在特发性肺纤维化、大肠癌等疾病中差异表达,可作为生物标记物[7-8]。
PAH病理特征包括肺血管内皮功能障碍、肺动脉平滑肌细胞(pulmonary artery smooth muscle cells,PASMCs)增殖和迁移、炎症和原位血栓形成所致的丛状病变等[9]。最近,BAROZZI等[10]研究表明CD248可能是参与肺血管重塑的新的候选基因。最新研究表明:CD248参与调节肺动脉平滑肌细胞的增殖和迁移,并在疾病进程中调节PASMCs向合成表型转换,被认为是PAH肺血管重塑中的新分子[11]。但目前尚少有CD248作为PAH疾病生物标记物的研究。因此,本研究拟在PAH患者中检测分析CD248蛋白水平,评估CD248在PAH中有无差异表达。并检测PAH动物血浆中CD248蛋白水平,探索CD248表达与PAH的关联以及CD248是否可以成为PAH的新的生物标记物。
1 资料与方法 1.1 研究对象特发性肺动脉高压(idiopathic pulmonary arterial hypertension, IPAH)和慢性肺栓塞型肺动脉高压(chronic thromboembolic pulmonary hypertension, CTEPH) 是PAH重要的分类亚组,具有相似的血流动力学和病理特征[12],因此,本研究将IPAH和CTEPH患者纳为PAH组。共纳入本科2016年3月至2019年6月经右心导管检查明确诊断的PAH患者30例(IPAH 14例,CTEPH 16例)和健康对照者(2016年3月至2019年6月于我院体检排除重要脏器疾病)12例,IPAH和CTEPH诊断基于2018年中国肺高血压诊断和治疗指南[13]。PAH的血流动力学诊断标准为右心导管测量平均肺动脉压(mean pulmonary artery pressure,mPAP)≥25 mmHg,同时肺小动脉楔压(pulmonary artery wedge pressure, PAWP) ≤15 mmHg及肺血管阻力(pulmonary vascular resistance, PVR) >3 Wood。IPAH定义为无明确病因的PAH,CTEPH诊断需满足经充分抗凝治疗至少3个月、CT肺动脉造影/肺通气灌注显像/直接肺动脉造影提示存在肺栓塞征象且右心导管测定肺循环血流动力学参数符合PAH诊断标准。已获得所有患者知情同意并签署知情同意书,本研究获本院伦理委员会批准(2020-404)。
1.2 ELISA分析用含有EDTA的抗凝管在患者和健康对照者空腹时,于静息状态下采取静脉血样5 mL,3 000 r/min离心10 min后,分离出血浆,冻存于-80 ℃。采用ELISA试剂盒(上海酶联生物科技有限公司)检测所有样本血浆中CD248表达水平,检验步骤按说明要求进行。
使用野百合碱(monocrotaline, MCT)诱导大鼠建立动物PAH模型,MCT是一种吡咯里西啶生物碱,可以在动物体内与肺组织相互作用,并导致肺血管内皮细胞损伤,在数周内进展为PAH[14-15]。将20只体质量为180~200 g的Spregue-Dawley雄性大鼠(重庆医科大学实验动物中心)随机分为4组:正常对照组,MCT处理7、14、21 d组。实验组各组单次腹腔注射50 mg/kg MCT(蒙博生物有限公司),对照组以相同方法注射等量生理盐水。用含有EDTA的抗凝管从大鼠颈外静脉采集静脉血3 mL,3 000 r/min离心10 min后,分离血浆及血细胞,冻存于-80 ℃。采用ELISA试剂盒(江苏酶标生物有限公司)检测大鼠血浆中CD248蛋白表达水平,检验步骤按说明书要求进行。
1.3 细胞培养及qPCR检测按照文献[16-17]的方法提取大鼠PASMCs细胞并进行鉴定,5~7代的大鼠PASMCs使用含有10%胎牛血清(PAN,德国)的DMEM/F-12培养基(Hyclone,美国)在37 ℃、5%CO2培养箱中进行培养,至细胞密度达80%左右时,加入10 ng/mL肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)(R & D system,美国)或20 ng/mL血小板源生长因子BB(platelet-derived growth factor-BB, PDGF-BB)(R & D system,美国)干预24 h。另1组细胞加入20 ng/mL的PDGF-BB分别干预4、8、12、24 h。TRIzol法提取细胞总RNA,逆转录为cDNA后进行qPCR扩增,操作步骤按说明书要求进行。引物序列为CD248: 上游5′-TCCCATACGCCCAACAAGC-3′,下游5′-GGTATCTGCACTCCATCACAC-3′,147 bp;GAPDH:上游5′-TGTGACTTCAACAGCAACTCCC-3′,下游5′-CTCTCTTGCTCTCAGTATCCTTG-3′,206 bp。
1.4 统计学分析使用SPSS 20.0进行统计学分析,GraphPad Prism 8.0进行作图。采用Kolmogorov-Smirnov进行正态性检验,符合正态分布的计量资料用x±s表示,不符合正态分布的连续型变量采用中位数及四分位间距表示M(Q1,Q3),计数资料用频数表示。连续型变量采用独立样本t检验,计数资料采用卡方检验。受试者工作特征曲线(receiver operating characteristic curve,ROC)用于评估CD248在检查PAH中的特异度及敏感度。检验水准:α=0.05。
2 结果 2.1 PAH患者血浆CD248表达水平较低PAH组患者年龄较对照组高,两组间性别差异无统计学意义。IPAH组患者中女性比例更高(P < 0.05),CTEPH组患者年龄更大(P < 0.01),但IPAH组和CTEPH组患者的血流动力学指标差异无统计学意义,见表 1。
| 组别 | n | 女性 | 年龄/岁 | 肺动脉收缩压/mmHg | 平均肺动脉压/mmHg | 肺小动脉楔压/mmHg | 心输出量/L·min-1 | 肺血管阻力(Wood) | CD248/ng·mL-1 |
| 健康对照组 | 12 | 7(58.3) | 27.83±7.78 | 7.92±1.75 | |||||
| PAH组 | 30 | 19(63.3) | 44.67±16.93 | 66.17±18.42 | 48.57±13.19 | 10.86±7.90 | 4.43±1.96 | 10.20±7.36 | 6.07±1.84 |
| IPAH组 | 14 | 12(85.7) | 31.50±8.79 | 69.71±17.37 | 52.50±13.14 | 8.39±6.59 | 4.28±1.74 | 11.94±7.42 | 5.63±1.87 |
| CTEPH组 | 16 | 7(43.8) | 56.19±13.56 | 63.06±19.30 | 45.13±12.63 | 13.00±8.51 | 4.56±2.18 | 8.70±7.22 | 6.45±1.78 |
| P值1 | 0.763 | 0.002 | 0.005 | ||||||
| P值2 | 0.017 | <0.001 | 0.332 | 0.129 | 0.125 | 0.701 | 0.253 | ||
| P值3 | 0.004 | ||||||||
| P值4 | 0.040 | ||||||||
| P值1:健康对照组与PAH组比较;P值2:IPAH组与CTEPH组比较; P值3:健康对照组与IPAH组比较;P值4:健康对照组与CTEPH组比较 | |||||||||
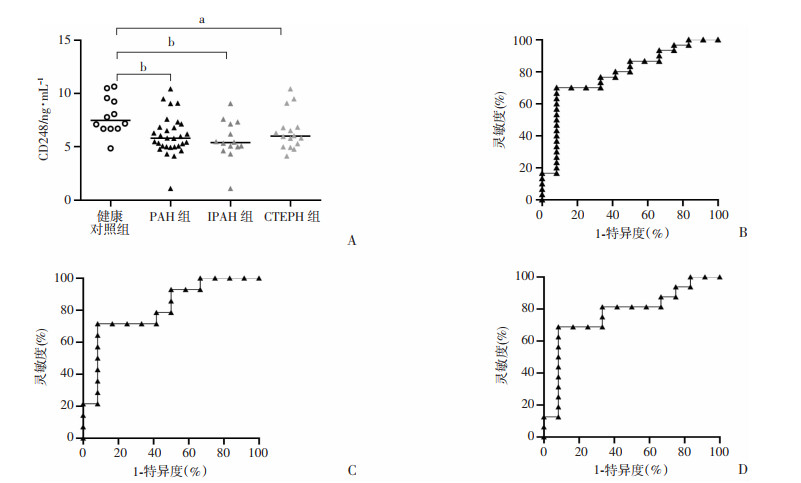
PAH组、IPAH组和CTEPH组患者血浆CD248蛋白表达均显著低于健康对照组(P < 0.01),而IPAH组与CTEPH组之间无明显差异(图 1A)。
|
|
a:P < 0.05,b:P < 0.01 A:ELISA检测CD248在各组患者血浆中的表达; B:PAH组ROC曲线分析;C:IPAH组ROC曲线分析;D:CTEPH组ROC曲线分析 图 1 健康对照组、PAH组、IPAH组和CTEPH组患者血浆CD248表达水平检测与分析 |
ROC曲线分析结果显示:PAH组ROC曲线下面积为0.79(95%CI: 0.64~0.94, P < 0.01,图 1B),CD248的最佳界值为6.604 ng/mL,约登指数为0.617,灵敏度为0.7,特异度为0.917。IPAH组曲线下面积为0.81(95%CI: 0.64~0.98, P < 0.01,图 1C),CTEPH组曲线下面积为0.77(95%CI: 0.59~0.96, P < 0.05,图 1D)。
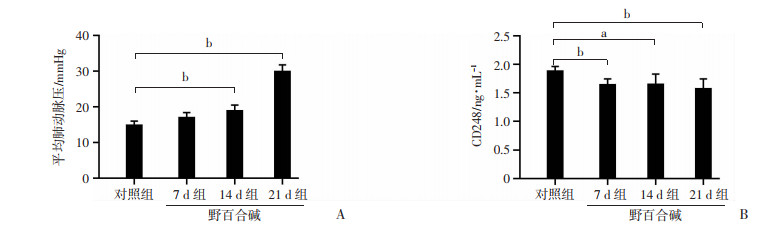
2.2 野百合碱处理组大鼠血浆中CD248表达水平降低右心导管测量大鼠肺动脉压力结果显示:注射野百合碱的大鼠平均肺动脉压随时间而升高,21 d组大鼠平均肺动脉压超过25 mmHg(P < 0.01,图 2A)。大鼠血浆ELISA检测结果显示:野百合碱处理7、14、21 d组CD248蛋白表达均显著低于正常对照组(P < 0.05,图 2B),而注射野百合碱的各组大鼠间的CD248水平并无明显差异。
|
|
a:P < 0.05;b:P < 0.01 A:各组大鼠平均肺动脉压比较;B:ELISA检测各组大鼠血浆中CD248表达 图 2 对照组和野百合碱处理7、14、21 d组大鼠平均肺动脉压和血浆中CD248表达水平 |
2.3 PDGF-BB影响大鼠PASMCs中CD248 mRNA表达
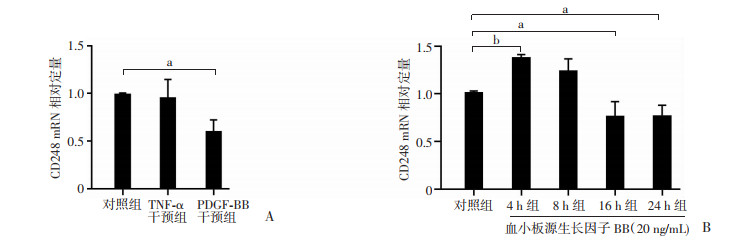
PDGF-BB干预24 h可以显著降低大鼠PASMCs中CD248的mRNA表达(P < 0.05),而TNF-α干预24 h则对CD248表达无明显影响(图 3A)。进一步研究表明:PDGF-BB干预对大鼠PASMCs中CD248表达的影响呈时间依赖性,即在干预早期CD248表达升高,在晚期表达降低,且差异具有统计学意义(P < 0.01,图 3B)。
|
|
a:P < 0.05;b:P < 0.01 A: 各组大鼠PASMCs中CD248 mRNA表达;B:PDGF-BB干预4、8、16、24 h时各组大鼠PASMCs中CD248 mRNA表达 图 3 qPCR检测TNF-α、PDGF-BB干预对大鼠PASMCs中CD248 mRNA表达的影响 |
3 讨论
此前,一些循环标记物已被证明与PAH有关,包括神经激素激活、炎症、氧化应激、血管损伤和重塑的生物标记物。然而它们都没有显示出理想生物标记物的所有特征,如非侵入性、易于测量、低成本以及高灵敏度及特异性等[18]。因此,有必要采用多参数的方法,而不仅仅依赖于单一参数。本研究结果提示,CD248或可作为PAH的潜在生物标记物。
本研究结果显示:PAH患者血浆中CD248蛋白表达显著低于健康对照者,ROC曲线分析表明CD248的最佳界值为6.604 ng/mL,约登指数为0.617,灵敏度为0.7,特异度为0.917,具有较高的特异性和一定的灵敏性。动物实验结果也与患者测试结果有一致的趋势。PDGF-BB被认为是PAH的关键介质,研究表明PAH患者血液中PDGF-BB水平显著升高,且在从PAH患者中分离的肺组织和PASMCs中发现:PDGF及PDGF受体(PDGF receptors,PDGFR),尤其是PDGF-BB和PDGFR-β表达上调,PDGF-BB可以诱导PASMCs增殖和迁移[19-21]。XU等[11]的研究显示PDGF-BB干预可以上调人PASMCs中CD248蛋白的表达。本研究发现PDGF-BB干预的大鼠PASMCs中CD248 mRNA表达先上调后下调。这似乎与我们在PAH患者血浆中发现CD248表达降低结果不同,然而机体是复杂的系统,单一分子的表达在疾病进展中往往受多种因子及因素的调控,且可能在随着疾病的进展而出现或升高或降低的动态变化。另外,同一分子在不同组织中的表达也可以呈现不同的趋势。因此,虽然本研究在细胞实验中发现了不同的趋势,但这些结果也证实了与PAH疾病进展相关的某些分子参与调控机体中CD248的表达。这也从侧面印证CD248有作为PAH生物标记物的潜力。
PAH作为一种罕见病,由于目前人们对该疾病的认识相对较少,因此本研究样本量有限。对于血浆CD248是否可用作PAH疾病的生物标记物,仍需在更大的样本中进一步验证,以及在其他疾病相关的PAH中进行验证,如先天性心脏病相关的PAH、结缔组织病相关的PAH、呼吸系统疾病相关的PAH以及左心疾病相关的PAH等。此外,由于临床上超过75%的PAH患者确诊时心功能已达Ⅲ或Ⅳ级,因此CD248在PAH更早期或其动态变化趋势,以及与预后之间的关系也需要进一步探究。
综上所述,本研究结果表明CD248在PAH的患者血浆中表达降低,其作为PAH的生物标记物具有一定的潜在价值。
| [1] |
MCLAUGHLIN V V. Looking to the future: a new decade of pulmonary arterial hypertension therapy[J]. Eur Respir Rev, 2011, 20(122): 262-269. |
| [2] |
PEACOCK A J. National Pulmonary Hypertension Services of UK and Ireland. Treatment of pulmonary hypertension[J]. BMJ, 2003, 326(7394): 835-836. |
| [3] |
D'ALONZO G E, BARST R J, AYRES S M, et al. Survival in patients with primary pulmonary hypertension. Results from a national prospective registry[J]. Ann Intern Med, 1991, 115(5): 343-349. |
| [4] |
KHAN K A, MCMURRAY J L, MOHAMMED F, et al. C-type lectin domain group 14 proteins in vascular biology, cancer and inflammation[J]. FEBS J, 2019, 286(17): 3299-3332. |
| [5] |
HASANOV Z, RUCKDESCHEL T, KÖNIG C, et al. Endosialin promotes atherosclerosis through phenotypic remodeling of vascular smooth muscle cells[J]. Arterioscler Thromb Vasc Biol, 2017, 37(3): 495-505. |
| [6] |
SURESH BABU S, VALDEZ Y, XU A, et al. TGFβ-mediated suppression of CD248 in non-cancer cells via canonical Smad-dependent signaling pathways is uncoupled in cancer cells[J]. BMC Cancer, 2014, 14: 113. |
| [7] |
BARTIS D, CROWLEY L E, D'SOUZA V K, et al. Role of CD248 as a potential severity marker in idiopathic pulmonary fibrosis[J]. BMC Pulm Med, 2016, 16(1): 51. |
| [8] |
PIETRZYKŁ, WDOWIAK P. Endosialin (TEM1) as a diagnostic, progression, and prognostic serum marker for patients with colorectal cancer-A preliminary study[J]. Cancer Control, 2020, 27(1): 1073274820903351. |
| [9] |
GUIGNABERT C, DORFMULLER P. Pathology and patho-biology of pulmonary hypertension[J]. Semin Respir Crit Care Med, 2013, 34(5): 551-559. |
| [10] |
BAROZZI C, GALLETTI M, TOMASI L, et al. A combined targeted and whole exome sequencing approach identified novel candidate genes involved in heritable pulmonary arterial hypertension[J]. Sci Rep, 2019, 9(1): 753. |
| [11] |
XU T, SHAO L, WANG A M, et al. CD248 as a novel therapeutic target in pulmonary arterial hypertension[J]. Clin Transl Med, 2020, 10(5): e175. |
| [12] |
TSAI C H, MA H P, LIN Y T, et al. Heart rhythm complexity impairment in patients with pulmonary hypertension[J]. Sci Rep, 2019, 9(1): 10710. |
| [13] |
中华医学会心血管病学分会肺血管病学组, 中华心血管病杂志编辑委员会. 中国肺高血压诊断和治疗指南2018[J]. 中华心血管病杂志, 2018, 46(12): 933-964. Working Group on Pulmonary Vascular Diseases of Chinese Society of Cardiology of Chinese Medical Association, Editorial Board of Chinese Journal of Cardiology. Chinese guidelines for the diagnosis and treatment of pulmonary hypertension 2018[J]. Chin J Cardiol, 2018, 46(12): 933-964. |
| [14] |
NOGUEIRA-FERREIRA R, VITORINO R, FERREIRA R, et al. Exploring the monocrotaline animal model for the study of pulmonary arterial hypertension: a network approach[J]. Pulm Pharmacol Ther, 2015, 35: 8-16. |
| [15] |
DUMITRASCU R, KOEBRICH S, DONY E, et al. Characterization of a murine model of monocrotaline pyrrole-induced acute lung injury[J]. BMC Pulm Med, 2008, 8: 25. |
| [16] |
柯蕊, 肖雪, 和平, 等. apelin抑制肺动脉平滑肌细胞增殖的分子机制研究[J]. 中国医学创新, 2021, 18(16): 25-29. KE R, XIAO X, HE P, et al. Molecular mechanism of apelin inhibiting proliferation of pulmonary arterial smooth muscle cells[J]. Med Innov China, 2021, 18(16): 25-29. |
| [17] |
CHEN M, CAI H, YU C, et al. Salidroside exerts protective effects against chronic hypoxia-induced pulmonary arterial hypertension via AMPKα1-dependent pathways[J]. Am J Transl Res, 2016, 8(1): 12-27. |
| [18] |
PEZZUTO B, BADAGLIACCA R, POSCIA R, et al. Circulating biomarkers in pulmonary arterial hypertension: update and future direction[J]. J Heart Lung Transplant, 2015, 34(3): 282-305. |
| [19] |
SELIMOVIC N, BERGH C H, ANDERSSON B, et al. Growth factors and interleukin-6 across the lung circulation in pulmonary hypertension[J]. Eur Respir J, 2009, 34(3): 662-668. |
| [20] |
ZHAO Y, LV W T, PIAO H Y, et al. Role of platelet-derived growth factor-BB (PDGF-BB) in human pulmonary artery smooth muscle cell proliferation[J]. J Recept Signal Transduct Res, 2014, 34(4): 254-260. |
| [21] |
PERROS F, MONTANI D, DORFMVLLER P, et al. Platelet-derived growth factor expression and function in idiopathic pulmonary arterial hypertension[J]. Am J Respir Crit Care Med, 2008, 178(1): 81-88. |




