心血管相关疾病患病率与病死率在我国逐年上升。其中,动脉粥样硬化(atherosclerosis,AS)是导致患者入院、死亡的重要诱因。在动脉粥样硬化发展过程中,以大量泡沫细胞与大量脂质沉积为特征的粥样斑块的形成是贯穿AS进程的标志性现象[1-2]。固醇调控元件结合蛋白裂解活化蛋白(sterol regulatory element binding proteins cleavage activating protein,SCAP)是脂质代谢关键的调节因子,参与维护胞内外脂质代谢稳态,与动脉粥样硬化密切相关[3]。既往研究显示,SCAP的异常表达可促进巨噬细胞向泡沫细胞的转化和巨噬细胞内的胆固醇的堆积,加快粥样斑块的形成[4-5]。虽然巨噬细胞已经被证明是动脉粥样斑块内的泡沫细胞的主要来源,但近年来越来越多的研究发现,血管平滑肌细胞(vascular smooth muscle cells,VSMCs)也可以参与泡沫细胞的形成[6],而VSMCs源性泡沫细胞的形成途径尚不明确。本研究构建了SCAP过表达血管平滑肌细胞株,旨在观察SCAP是否可以影响VSMCs向泡沫细胞转化的进程,并初步探讨其参与调控的信号通路和机制。
1 材料与方法 1.1 试剂与仪器鼠血管平滑肌细胞株由北京中原公司代购于ATCC细胞库。LV-SCAPD443N慢病毒购自美国GeneCopoeia公司;细胞培养所需的DMEM-F12培养基、胎牛血清及青-链霉素购自美国Hyclone公司;慢病毒筛选所用的嘌呤霉素购自上海生工生物公司;培养皿以及24孔板玻片购自美国NEST公司;油红O检测试剂盒购自北京索莱宝科技有限公司;TC、TG检测试剂盒购自南京建成科技有限公司;MDC染色检测试剂盒购自北京索莱宝科技有限公司;SCAP抗体,SREBP2抗体购自美国Abcam公司;p-AMPK抗体,AMPK抗体,p-mTOR抗体,mTOR抗体购自美国Cell Signaling Technology公司;LC3b抗体,P62抗体与β-actin抗体购自武汉三鹰生物技术有限公司;全自动酶标仪购自芬兰雷勃公司;荧光共聚焦显微镜购自德国Leica;全能蛋白转印系统及凝胶扫描成像系统购自美国Bio-Bad公司;正置光学显微镜购自日本Nikon公司;超声破碎仪购自德国Bandelin。
1.2 细胞培养及LV-SCAP血管平滑肌细胞构建VSMCs采用DMEM/F-12+10%胎牛血清+100 U/mL青霉素+100 μg/mL链霉素完全培养基培养,置于37 ℃、5%CO2培养箱中。在慢病毒干扰前接种至24孔板保证感染时密度介于30%~40%,第2天将病毒加入250 μL预热的无血清培养基中(同时向另一孔中加入LV-Control病毒作为LV-Control组),与25 μL促转染剂一同加入24孔板中,2 h后补加250 μL含10%FBS的DMEM/F-12培养基,在扩大培养后用含3.0 μg/mL嘌呤霉素的完全培养基筛选,之后采用含1.0 μg/mL嘌呤霉素的完全培养基稳定扩大培养。
1.3 Western blot检测目的蛋白表达水平将VSMCs种入细胞培养皿中,PBS洗涤细胞3遍。每10 cm皿中加300 μL RIPA裂解液(含蛋白酶抑制剂和磷酸酶抑制剂)提取蛋白,按照BCA蛋白分析试剂盒测定蛋白浓度,SDS-PAGE电泳,根据目的蛋白分子量,调定电转时间,3% BSA溶液封闭1 h。用3%BSA稀释一抗孵育过夜,TBST清洗3遍后选取对应二抗室温孵育2 h,以目标蛋白与β-actin条带的光密度值比值计算相对表达含量。
1.4 细胞油红O染色将细胞种于24孔板爬片,4%多聚甲醛室温固定20 min,PBS清洗2次,1,2-丙二醇孵育2 min后加入油红O染液染色30 min,苏木精染细胞核10 min,甘油明胶封片,高倍(630×)显微镜下观察拍摄。拍摄后随机选取5个视野,Image J分析油红O染色面积进行统计分析,实验重复3次。
1.5 细胞内TC、TG检测将细胞接种在10 cm细胞培养皿中,提取细胞悬液,4 ℃、1 000×g离心10 min,取沉淀用遇冷的PBS清洗2~3遍,将沉淀用200 μL裂解液混匀,4 ℃超声破碎,将匀浆液置于冰上用检测试剂盒检测细胞内TC、TG含量。
1.6 自噬小泡(Monodansylcadaverine,MDC)染色将细胞种植于共聚焦皿中,用PBS清洗3遍细胞,向培养皿中加入500 μL MDC测试工作液,避光染色20 min后洗涤液清洗细胞,封片后在共聚焦显微镜(630×)下观察检测。拍摄后随机选取5个视野,采取Image J分析自噬小泡的相对荧光强度进行统计分析,实验重复3次。
1.7 雷帕霉素(Rapamycin,Rapa)处理平滑肌细胞将转染了LV-SCAP的血管平滑肌细胞种于6孔板中,待细胞贴壁后饥饿过夜,第2天加入LDL (200 μg/mL)处理24 h,以不加Rapa处理的单纯LV-SCAP处理细胞作为对照组,向实验组中加入10 μmol/mL Rapa处理24 h,收集对照组与Rapa组的细胞提取蛋白。
1.8 统计学处理采用SPSS 18.0统计学软件分析数据,结果用x±s表示,两组之内比较使用t检验。GraphPad Prism 4进行统计及绘图,以P < 0.05为差异有统计学意义。
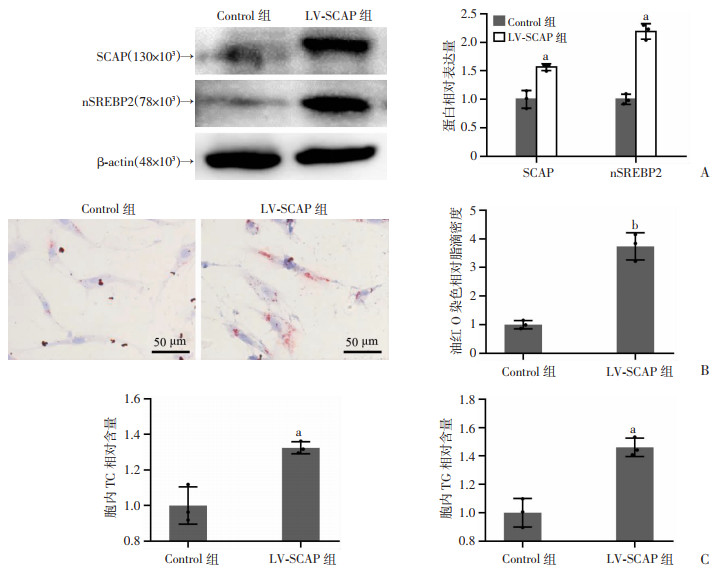
2 结果 2.1 血管平滑肌细胞SCAP过表达后对细胞脂质积聚的影响LV-SCAPD443N慢病毒处理VSMC细胞构建LV-SCAP细胞系,Western blot结果显示LV-SCAP组SCAP与nSREBP2的蛋白表达水平明显上调(图 1A)。负荷LDL(200 μg/mL)处理24 h,油红O染色后两组均有明显的红染颗粒,但LV-SCAP组红染颗粒明显的增多,体积变大(图 1B)。酶标仪检测两组细胞内TC、TG水平,发现LV-SCAP组细胞内TC、TG水平较对照组明显增高(图 1C)。提示SCAP过表达可促进细胞内的脂质集聚,从而诱导血管平滑肌泡沫化。
|
|
a: P < 0.05,b: P < 0.01,与Control组比较 A:Western blot检测SCAP与nSREBP2蛋白表达水平;B:油红O染色细胞脂滴积聚情况;C:检测细胞内TC、TG的相对含量 图 1 血管平滑肌细胞SCAP过表达对细胞脂质积聚的影响(n=3,x±s) |
2.2 血管平滑肌细胞SCAP过表达对细胞自噬水平的影响
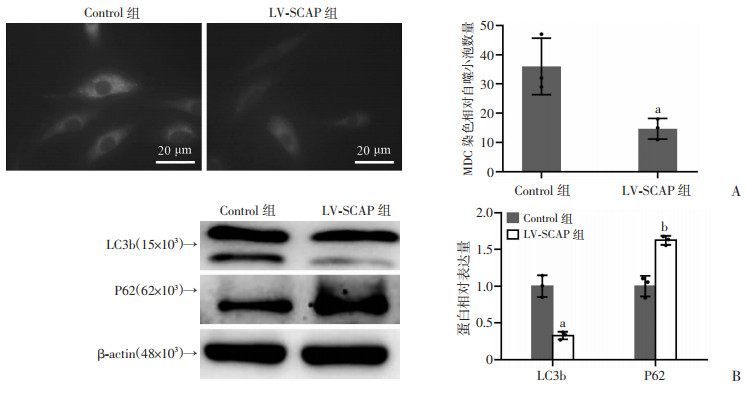
MDC染色检测在负荷LDL后两组细胞内自噬小泡的聚集情况。与对照组相比,LV-SCAP组点状荧光强度减弱,提示自噬小泡生成减少(图 2A)。Western blot检测LDL负荷后自噬相关蛋白LC3b、P62的表达水平,结果显示SCAP过表达可显著降低细胞LC3b表达,促进P62表达(图 2B)。提示SCAP过表达可引起自噬相关蛋白表达异常,进而抑制细胞自噬小泡的生成。
|
|
a: P < 0.05,b: P < 0.01,与Control组比较 A:MDC检测胞内自噬小泡的聚集情况;B:Western blot检测自噬相关蛋白LC3b与P62的蛋白表达水平 图 2 血管平滑肌细胞SCAP过表达对细胞自噬水平的影响(n=3,x±s) |
2.3 血管平滑肌细胞SCAP过表达对AMPK-mTOR信号通路的影响
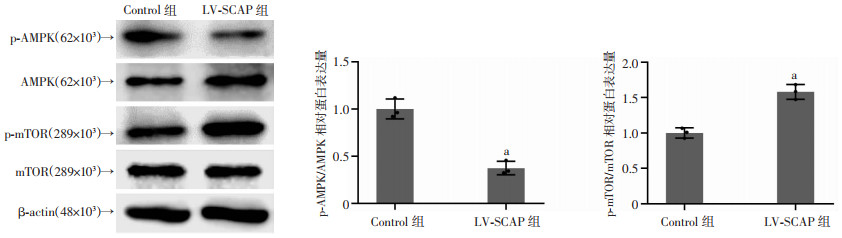
Western blot结果显示:较之对照组,在LDL负荷下LV-SCAP组p-AMPK/AMPK相对表达量降低,p-mTOR/mTOR相对表达量增加(P < 0.05,图 3)。提示SCAP可能通过影响AMPK-mTOR信号通路进而抑制细胞自噬。
|
| a: P < 0.05,与Control组比较 图 3 血管平滑肌细胞SCAP过表达对AMPK-mTOR信号通路的影响(n=3,x±s) |
2.4 雷帕霉素处理SCAP过表达血管平滑肌细胞后细胞自噬及脂质积聚的变化
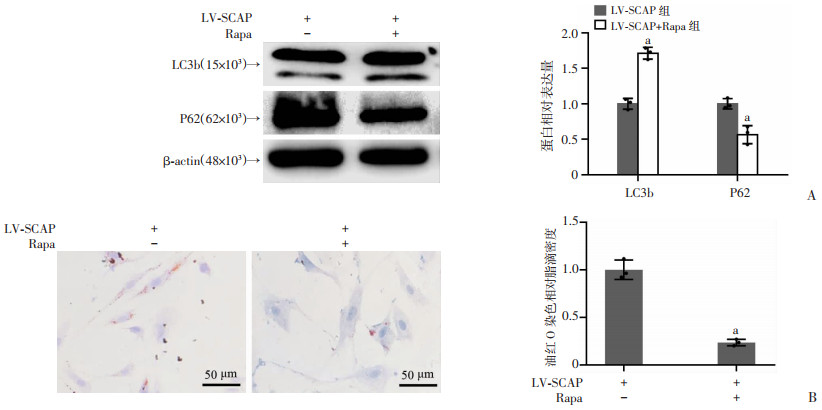
应用mTOR抑制剂雷帕霉素(10 μmol/mL)处理LDL负荷后的LV-SCAP血管平滑肌细胞系,可以观察到:相比于单纯LV-SCAP组,Rapa处理组LC3b蛋白表达水平显著上升而P62表达明显下调(图 4A)。油红O染色显示Rapa处理组胞内脂滴积聚水平明显减弱(图 4B)。提示mTOR抑制剂可改善SCAP过表达导致的自噬受抑进而改善胞内脂滴积聚。
|
|
a: P < 0.05,与LV-SCAP组比较 A:Western blot LC3b、P62的相对蛋白表达量;B:油红O染色检测细胞在LDL诱导下的脂质积聚情况 图 4 雷帕霉素处理SCAP过表达血管后细胞自噬及脂质积聚的变化(n=3,x±s) |
3 讨论
心血管相关疾病是世界上发病率与病死率高的疾病之一,防控形势十分严峻。动脉粥样硬化是引发心血管相关疾病的重要诱因,它起始于富含胆固醇酯的载脂蛋白在血流阻塞后在血管内皮下的聚集。当脂蛋白大量在内膜下积聚后会和内皮下的蛋白聚糖结合,脂蛋白的蛋白、脂类成分可迅速的氧化或水解,并在血管内膜下大量滞留[1, 7]。氧化后的脂蛋白可引发内皮细胞内大量炎症因子的释放和黏附因子的表达,这样的炎症反应促进细胞在内膜下的募集,加快泡沫细胞的产生。细胞内外异常堆积的胆固醇酯是泡沫细胞的形成基础,泡沫细胞是一类富含脂滴的巨噬细胞或平滑肌细胞的总称。前期实验主要关注巨噬细胞源泡沫细胞[8-9],但近年来,大量研究证实在冠状动脉粥样硬化的斑块内,血管平滑肌细胞源性的泡沫细胞占比可达50%[10]。因此,探究血管平滑肌细胞转化成为泡沫细胞的机制对动脉粥样硬化的防治十分重要。
SCAP是定位于内质网膜上的胆固醇调节器,它与SREBP形成聚合体协助它由内质网向高尔基体转运[11],本课题组前期已发现SCAP的异常表达与AS相关,且SCAP参与巨噬细胞源泡沫细胞生成过程。因此提出假设SCAP可能参与血管平滑肌源泡沫细胞的生成进而影响AS的发展。有研究指出,SCAP的443位点突变可引发SCAP不受限制的运载SREBP2入核,引发胞内脂质异常蓄积与SCAP的过表达[12]。在本研究中,采用LV-SCAPD443N诱导血管平滑肌细胞构建SCAP过表达细胞系,致使SCAP与nSREBP2蛋白水平明显上调,且LDL诱导产生的脂滴明显增多,胞内TC、TG水平较对照组显著增高。提示血管平滑肌细胞内SCAP表达影响胞内脂质蓄积,对血管平滑肌细胞泡沫化形成有重要意义。
自噬是一类广泛存在于真核细胞内的自我保护机制,细胞可通过自噬消除外来危险因素以及内生代谢产物对细胞的影响。有研究[13-14]指出,自噬参与泡沫细胞的形成,胞内胆固醇还可通过自噬途径进行逆向转运。本研究检测SCAP过表达处理后自噬小泡生成水平以及部分自噬蛋白的表达水平,发现SCAP过表达后自噬小泡聚集明显减弱,LC3b作为参与自噬小泡膜结构形成的自噬激活产物的蛋白水平明显下调,而P62作为自噬小泡降解标记物则明显上调[15]。证实血管平滑肌细胞内SCAP过表达可以抑制自噬小泡的生成,促进其降解,抑制自噬活性。
自噬是一个精细的分解代谢过程,不仅存在复杂的分子机制,还有各种不同的信号通路参与调控其发生发展[16]。常见的参与自噬的信号通路有AMPK-mTOR、PI3K-Akt-mTOR、CAMP-PRKA -AMPK-SIRT1等,而在其中AMPK-mTOR信号通路的研究最为广泛[17-18]。AMPK是细胞内关键的能量感受器,是一种高度保守的丝氨酸/苏氨酸蛋白激酶;它可以参与细胞内部代谢的调控,还可以参与细胞内能量代谢物的生成与分解;是细胞生物过程中不可或缺的一类分子[19-20]。AMPK的磷酸化可以抑制mTOR的活性促进自噬的发展,主要参与方式有两种:一是激活TSC2(tuberous sclerosis complex 2)的磷酸化,促进TSC1/TSC2二聚体的形成进一步抑制mTORC1活性;二是AMPK直接通过磷酸化RAPTOR(regulatory-associated protein of mTOR)的活性末端来降低mTORC1的活性[20-21]。哺乳动物mTOR靶蛋白是一类丝氨酸/苏氨酸蛋白激酶,是调控细胞代谢、增殖、死亡以及自噬的中心因子,也是细胞自噬的主要上游控制因子[22]。本课题组前期研究发现,SCAP敲低可一定程度上改变胞内AMPK的活性[23]。本研究探讨SCAP过表达后对AMPK-mTOR信号通路的影响,发现p-AMPK活性明显降低而p-mTOR活性明显上调,即自噬受到抑制。后续采用mTOR抑制剂雷帕霉素处理LV-SCAP细胞株时发现它在一定程度上可以逆转SCAP过表达引发的自噬功能受损以及脂质积聚增高。这些结果表明血管平滑肌SCAP过表达使AMPK的磷酸化激活受损、mTOR活性增强,进而抑制细胞的自噬,最终导致细胞内的脂质外排受阻,这可能是SCAP促进血管平滑肌细胞向泡沫细胞发展的重要分子机制。
| [1] |
LIBBY P, BURING J E, BADIMON L, et al. Atherosclerosis[J]. Nat Rev Dis Primers, 2019, 5(1): 56. |
| [2] |
BENTZON J F, OTSUKA F, VIRMANI R, et al. Mechanisms of plaque formation and rupture[J]. Circ Res, 2014, 114(12): 1852-1866. |
| [3] |
GOLDSTEIN J L, BROWN M S. A century of cholesterol and coronaries: from plaques to genes to statins[J]. Cell, 2015, 161(1): 161-172. |
| [4] |
JOHNSTON J M, ANGYAL A, BAUER R C, et al. Myeloid Tribbles 1 induces early atherosclerosis via enhanced foam cell expansion[J]. Sci Adv, 2019, 5(10): eaax9183. |
| [5] |
MENG X D, YAO H H, WANG L M, et al. Knockdown of GAS5 inhibits atherosclerosis progression via reducing EZH2-mediated ABCA1 transcription in ApoE-/- mice[J]. Mol Ther Nucleic Acids, 2020, 19: 84-96. |
| [6] |
GROOTAERT M O J, MOULIS M, ROTH L, et al. Vascular smooth muscle cell death, autophagy and senescence in atherosclerosis[J]. Cardiovasc Res, 2018, 114(4): 622-634. |
| [7] |
GUERRINI V, GENNARO M L. Foam cells: one size doesn't fit all[J]. Trends Immunol, 2019, 40(12): 1163-1179. |
| [8] |
LIU Z Y, ZHU H P, DAI X Y, et al. Macrophage liver kinase B1 inhibits foam cell formation and atherosclerosis[J]. Circ Res, 2017, 121(9): 1047-1057. |
| [9] |
CANFRÁN-DUQUE A, ROTLLAN N, ZHANG X B, et al. Macrophage deficiency of miR-21 promotes apoptosis, plaque necrosis, and vascular inflammation during atherogenesis[J]. EMBO Mol Med, 2017, 9(9): 1244-1262. |
| [10] |
ALLAHVERDIAN S, CHEHROUDI A C, MCMANUS B M, et al. Contribution of intimal smooth muscle cells to cholesterol accumulation and macrophage-like cells in human atherosclerosis[J]. Circulation, 2014, 129(15): 1551-1559. |
| [11] |
BROWN M S, RADHAKRISHNAN A, GOLDSTEIN J L. Retrospective on cholesterol homeostasis: the central role of scap[J]. Annu Rev Biochem, 2018, 87: 783-807. |
| [12] |
YABE D, XIA Z P, ADAMS C M, et al. Three mutations in sterol-sensing domain of SCAP block interaction with insig and render SREBP cleavage insensitive to sterols[J]. Proc Natl Acad Sci USA, 2002, 99(26): 16672-16677. |
| [13] |
LIU X P, TANG Y, CUI Y C, et al. Autophagy is associated with cell fate in the process of macrophage-derived foam cells formation and progress[J]. J Biomed Sci, 2016, 23(1): 57. |
| [14] |
HE J P, ZHANG G Y, PANG Q, et al. SIRT6 reduces macrophage foam cell formation by inducing autophagy and cholesterol efflux under ox-LDL condition[J]. FEBS J, 2017, 284(9): 1324-1337. |
| [15] |
GÓMEZ-SÁNCHEZ R, YAKHINE-DIOP S M, RODRÍGUEZ-ARRIBAS M, et al. mRNA and protein dataset of autophagy markers (LC3 and p62) in several cell lines[J]. Data Brief, 2016, 7: 641-647. |
| [16] |
CHEN M L, YI L, JIN X, et al. Resveratrol attenuates vascular endothelial inflammation by inducing autophagy through the cAMP signaling pathway[J]. Autophagy, 2013, 9(12): 2033-2045. |
| [17] |
LI G, SCULL C, OZCAN L, et al. NADPH oxidase links endoplasmic Reticulum stress, oxidative stress, and PKR activation to induce apoptosis[J]. J Cell Biol, 2010, 191(6): 1113-1125. |
| [18] |
HAN X B, LI H X, JIANG Y Q, et al. Upconversion nanoparticle-mediated photodynamic therapy induces autophagy and cholesterol efflux of macrophage-derived foam cells via ROS generation[J]. Cell Death Dis, 2017, 8(6): e2864. |
| [19] |
TAMARGO-GÓMEZ I, MARIÑO G. AMPK: regulation of metabolic dynamics in the context of autophagy[J]. Int J Mol Sci, 2018, 19(12): E3812. |
| [20] |
KIM J, KUNDU M, VIOLLET B, et al. AMPK and mTOR regulate autophagy through direct phosphorylation of Ulk1[J]. Nat Cell Biol, 2011, 13(2): 132-141. |
| [21] |
CHEN H, JI Y S, YAN X, et al. Berberine attenuates apoptosis in rat retinal Müller cells stimulated with high glucose via enhancing autophagy and the AMPK/mTOR signaling[J]. Biomed Pharmacother, 2018, 108: 1201-1207. |
| [22] |
KIM Y C, GUAN K L. mTOR: a pharmacologic target for autophagy regulation[J]. J Clin Invest, 2015, 125(1): 25-32. |
| [23] |
LI D Y, CHEN A M, LAN T, et al. SCAP knockdown in vascular smooth muscle cells alleviates atherosclerosis plaque formation via up-regulating autophagy in ApoE-/- mice[J]. FASEB J, 2019, 33(3): 3437-3450. |




