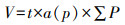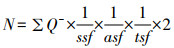阿尔茨海默症(Alzheimer′s disease,AD)是一种起病隐匿、慢性进行性加重的神经系统退行性疾病,是最常见的痴呆症类型。随着人口老龄化加剧,AD发病形势严峻,对家庭和社会造成了极大的负担[1]。作为全社会公共卫生问题之一,AD一直是神经科学研究的重点和难点[1]。
近年来,跑步运动作为一种改善AD的多靶点非药物手段受到广泛关注[2-3]。越来越多的证据[4-7]表明,运动对改善AD具有积极的作用,然而其机制尚未阐明。小胶质细胞作为中枢神经系统的先天免疫细胞承担着清除淀粉样β蛋白(amyloid beta protein,Aβ)的责任,有研究[8-9]表明AD脑内小胶质细胞清除Aβ的功能受到损害,导致Aβ的积聚;有研究表明跑步运动可有效减轻AD模型小鼠海马内Aβ的沉积,增加老年大鼠皮层和海马区域小胶质细胞的数量[4],促进小胶质细胞向Aβ斑块聚集[10]。也有研究[11]表明6周的自主跑步运动对AD模型小鼠海马中Aβ沉积和小胶质细胞的数量没有影响。可见,跑步运动对AD脑内小胶质细胞的作用目前还存有争议。
值得注意的是,以往关于AD及跑步运动对AD作用的研究,多聚焦于海马。然而,除海马外,内侧前额叶皮质(medial prefrontal cortex,mPFC)也是AD的主要受累区域[12-13]。研究发现,mPFC控制学习和记忆等高阶执行任务[14-16],而且AD患者中有异常的PFC活动,如执行功能和工作记忆受损[17]。本课题组前期的研究发现,APP/PS1小鼠内侧前额叶皮质存在体积萎缩及AD特征性的病理改变[18]。然而跑步运动对AD内侧前额叶皮质的作用仍有待研究。因此,本研究以APP/PS1转基因AD小鼠为研究对象,进行为期4个月的主动跑步运动干预,运用体视学三维定量和激光共聚焦相结合的方法研究跑步运动对AD小鼠内侧前额叶皮质的体积、Aβ和小胶质细胞的作用,为探讨跑步运动改善AD的细胞机制提供理论依据。
1 材料与方法 1.1 动物分组和干预方法 1.1.1 动物分组选取购自南京大学模式动物研究所的AD(B6C3-Tg(APPswe, PSEN1dE9)85Dbo/NJU)小鼠[SCXK(苏)2010-0001],在重庆医科大学SPF级实验动物中心进行繁殖,将出生1月龄的小鼠进行基因鉴定,基因鉴定的引物序列为:
Tg(APPswe): 转基因表达量≈350 bp
oIMR1597: 5′-GACTGACCACTCGACCAGGTTCTG-3′
oIMR1598: 3′-CTTGTAAGTTGGATTCTCATATCCG-5′
Tg (PSEN1): 转基因表达量≈608 bp
oIMR1644: 5′-AATAGAGAACGGCAGGAGCA-3′
oIMR1645: 3′-GCCATGAGGGCACTAATCAT-5′
其中,同时表达APP、PS1基因的小鼠为APP/PS1小鼠;APP、PS1基因均不表达的小鼠为正常对照组小鼠。
选取30只10月龄雄性APP/PS1小鼠,体质量(36.6±4.7) g,采取简单随机法分为AD跑步组和AD对照组(n=15),同时选取相同月龄的雄性非转基因小鼠作为正常对照组(n=15)。各组小鼠在重庆医科大学独立通气笼盒(Individually ventilated cage,IVC)系统实验动物房饲养[19]。
1.1.2 动物干预措施AD跑步组给予主动跑步运动干预[10, 20]:将小鼠饲养于含有跑轮(直径12 cm;宽7 cm)的笼子(29 cm长×18 cm宽×16 cm高)里,当小鼠主动爬上跑轮时,跑轮旋转,每隔一周通过采集器采集每只小鼠每日平均跑步量(4.66±2.30 km/d),剔除极端值的动物,确保小鼠跑步量大致相同,持续饲养4个月。对照组小鼠则正常饲养,不做任何特殊处理。以上所有操作符合重庆医科大学实验动物伦理规范。
1.2 Morris水迷宫检测空间学习和记忆能力跑步干预结束后,剔除跑步组的极端值以及各组体质较差的小鼠,对每组剩余的12只小鼠进行Morris水迷宫测试[21]。水桶内的水加牛奶染成乳白色,将水桶平均分为4个象限,标记每个象限。实验过程水温保持22~25 ℃,且固定平台位置。实验第1天为可见平台实验,平台高于水平面1~2 cm;第2~6天为隐藏平台实验,平台低于水平面1~2 cm。每次实验先将小鼠放入平台10 s熟悉环境,后将小鼠头朝桶壁放入水中,记录小鼠轨迹及找到平台并停留于平台3 s所需时间;若小鼠60 s内未找到平台,则引导小鼠找到平台,且记录时间为60 s。以上实验每天需按照简单随机抽样的方式选择象限顺序,且每个象限都需进行1次,每只小鼠每天共进行4次。实验第7天为空间探索实验,将平台撤除,随机选择两个非平台象限进行测试,记录60 s内小鼠的游泳路径,目标象限(平台象限)的游泳时间以及平台所在位置的穿越次数。整个实验过程由摄像机监控且由相关水迷宫软件(SLY-WMS,北京桑尼仪器有限公司)记录。
1.3 Y迷宫检测工作记忆及参考记忆能力Morris水迷宫测试结束后对各组小鼠进行Y迷宫测试,Y迷宫设备由医用有机板组成,共3个臂,每个臂夹角为120°,大小为30 cm×10 cm×15 cm,3个臂随机分为新异臂、起始臂及其他手臂。实验开始前3天给予小鼠固定食物数量以进行食物控制,使小鼠体质量达到原有体质量的85%~90%。第1~4天进行交替训练,首先将小鼠放于空的Y迷宫中,让其探索5 min,然后将新异臂贴上黑色标志,并在其内放入颗粒性食物,将小鼠放于起始臂,记录小鼠准确找到食物的时间及选择食物所在臂的正确率。小鼠每天需进行左右交替实验5次。在第5天,进行自发交替实验,移除食物,于相应目标臂贴上黑色标志,记录小鼠5 min内探索每个臂的次数及时间,此实验需进行左右交替1次[21]。
1.4 取材和标本制备每只小鼠记录编号及体质量,每组取5只小鼠用1%的戊巴比妥钠麻醉,用生理盐水加肝素冲洗后用4%多聚甲醛固定。取脑并分离出左右大脑半球,于梯度蔗糖中各脱水24 h,包埋后用冷冻超微切片机(CM1950,Leica Microsystems,德国)沿冠状切面进行切片和体视学抽样[12],先随机选择一侧半脑切取厚度为60 μm的连续切片,并对含有mPFC的组织切片进行等距离抽样,抽样分数为1/4,用于组织化学染色;余下一侧半脑切取厚度为30 μm的连续切片,并对含有mPFC的组织切片进行等距离抽样,抽样分数为1/5,用于免疫荧光染色。以上标本储存于75%的乙醇中,-20 ℃冰箱保存。
1.5 甲苯胺蓝染色并估算mPFC的体积每组取5只小鼠,从每只小鼠中随机抽取1套60 μm的连续切片,复温后于0.01 mol/L PBS中漂洗10 min×2次,枕面朝上贴于载玻片中,室温晾干;将切片放入3% TritonX-100中37 ℃打孔2 h;于0.01 mol/L PBS中漂洗10 min×3次后,将切片放入预热1 h的0.04%甲苯胺蓝溶液中,57 ℃染色5 min;自来水终止染色;用95%乙醇分色、无水乙醇脱水、二甲苯透明,最后中性树胶封片。
在光学显微镜4倍物镜下,拍摄每张组织切片的照片,利用体视学分析系统(NewCAST,Glostrup公司,丹麦)在照片上勾画出mPFC的边界[22],然后随机叠加等距测试点,计数落在内侧前额叶皮质区内的点数并利用卡瓦列里原理计算mPFC的总体积V[21-23]:
式中t为每组中相邻两张切片的距离即0.24 mm;a(p)为每一个叠加的点所代表的面积即0.009 39 mm2;∑P为落在每组切片中mPFC内的测试点数的总和。
1.6 免疫组织化学染色并计数mPFC内IBA+细胞的总数在用于甲苯胺蓝染色的5只小鼠连续切片中,从每只小鼠中抽取1套60 μm的连续切片,复温后于0.01 mol/L PBS中清洗10 min×3次,后放入0.3% Tween-20漂洗10 min×6次;用内源性过氧化物阻断剂H2O2处理30 min;用0.3% Tween-20漂洗10 min×3次,后将脑片放入枸橼酸盐溶液中,热水浴修复30 min;将脑片放入0.3% Tween-20、1%胎牛血清以及0.1%鱼明胶混合液中,37 ℃水浴2 h;4 ℃冰箱孵育一抗抗IBA1抗体(兔来源;ab178847,Abcam公司,美国;稀释比例为1 ∶1 000)48 h。室温复温1 h后,0.3% Tween-20漂洗10 min×6次;37 ℃孵育二抗(生物素标记羊抗兔IgG;SP-9001,北京中杉金桥公司;稀释比例为1 ∶10)3 h,用0.3% Tween-20漂洗10 min×6次,37 ℃孵育三抗(辣根过氧化酶)2 h后,0.01 mol/L PBS漂洗10 min×6次,并于4 ℃冰箱过夜。DAB(ZLI-9018,北京中杉金桥公司)显色1 min后,蒸馏水漂洗5 min×4次,0.01 mol/L PBS洗10 min×2次;贴片,风干后复染、用饱和Na2HPO4溶液返蓝10 s,梯度乙醇脱水后放入二甲苯透明10 min×3次;最后中性树胶封片。
在体视学系统中利用光学分合法计数mPFC内的IBA+细胞的总数。参考甲苯胺蓝染色切片上mPFC的分区,在40倍物镜下描绘mPFC的分界,然后在100倍物镜下分别进行体视学面积和高度抽样、切片厚度测量并按照体视框的计数原则对抽样高度内细胞核清晰聚焦的阳性细胞进行计数,最后根据光学分合法的公式获得mPFC内的IBA+细胞的总数[21, 23]:
式中N为计算得出的小鼠mPFC中IBA1+细胞的总数;ΣQ-为计数的IBA1+细胞的数量;ssf为每组切片的抽样分数即1/4;asf为面积抽样分数即15%;tsf为厚度抽样分数即为计数框的高度(15 μm)与每组组织切片实际测得的平均厚度的比值;2代表双侧大脑。
1.7 免疫荧光染色并分析mPFC内Aβ斑块和小胶质细胞每组取3只小鼠,从每只小鼠中抽取1套30 μm的连续切片,复温后于0.01 mol/L PBS中清洗10 min× 3次,后放入0.3% Tween-20漂洗10 min×6次;将脑片放入枸橼酸盐溶液中,热水浴修复30 min;脑片放入0.3% Tween-20、1%胎牛血清以及0.1%鱼明胶混合液中,37 ℃水浴2 h;4 ℃冰箱孵育一抗抗IBA1抗体(稀释比例为1 ∶1 000)和抗CD68抗体(小鼠来源;ab955,Abcam公司,美国;稀释比例为1 ∶500)48 h。室温复温1 h后,0.3% Tween-20漂洗10 min×6次;37 ℃孵育荧光二抗Goat Anti-Mouse IgG(DyLight 549;A23310,Abbkine公司,中国,稀释比例为1 ∶500)、Goat Anti-Rabbit IgG(DyLight 649;A23620,Abbkine公司,中国;稀释比例为1 ∶800)2 h,用0.01 mol/L PBS漂洗10 min×3次;贴片后,用硫磺素染色8 min,50%乙醇5 min×2次,放入PBS中,用抗荧光猝灭剂封片。
在激光共聚焦显微镜(Nikon,日本)下获取图片并运用Image J的自动分析工具Analyze Paticles计数mPFC内面积为10 μm2以上的Aβ斑块的数量,并把每个Aβ斑块最大半径以外扩展的25 μm范围定义为Aβ的周围区域,计数mPFC区域内Aβ斑块、CD68+/IBA1+细胞以及Aβ斑块周围小胶质细胞的数量;同时对mPFC内小胶质细胞胞体及突起的面积进行定量分析,并计算单个小胶质细胞的平均面积(包括胞体及突起)和活化小胶质细胞(CD68+/IBA1+)胞体的面积;然后运用Image J的插件工具Skeleton对单个小胶质细胞进行骨架分析,并计数活化小胶质细胞突起的数量[24];最后对小胶质细胞内Aβ斑块的面积进行分析,并计算小胶质细胞内Aβ斑块面积占总的Aβ斑块面积的比例[25]。
1.8 统计学分析数据均用x±s表示,采用SPSS 20.0进行统计分析,对数据进行正态性检验后,运用重复测量方差分析的方法分析小鼠的逃避潜伏期;运用非参数检验分析小鼠的穿台次数、目标象限游泳时间百分比、距离百分比;其他3组之间的数据运用单因素方差分析的方法进行分析,两组之间的数据则运用独立样本t检验进行分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 APP/PS1转基因小鼠基因鉴定结果将出生1个月的小鼠进行鼠尾鉴定,经过PCR扩增及琼脂糖凝胶电泳后,APP和PS1基因位点均出现条带的为APP/PS1双转基因AD小鼠,APP和PS1基因位点均没有出现条带的为正常对照组小鼠,见图 1。

|
| 1、3、4、5、7、8、15、19~22号为正常对照组小鼠(绿色框),小鼠APP、PS1基因位点均没有出现条带;2、6、9~14、16、17、18、23、24号为APP/PS1双转基因AD小鼠(红色框),小鼠APP、PS1基因位点均出现条带。蓝色框示DNA Marker 图 1 APP/PS1双转基因小鼠基因鉴定 |
2.2 跑步运动改善APP/PS1小鼠学习和记忆能力
在Morris水迷宫定位航行实验和空间探索实验中,AD对照组小鼠的表现明显差于正常对照组,而AD跑步组中小鼠的表现明显优于AD对照组(图 2A)。其中,定位航行实验的逃避潜伏期结果显示,AD对照组较正常对照组显著性延长(P < 0.05),而AD跑步组较AD对照组显著性缩短(P < 0.05;图 2B);空间探索实验中的穿台次数结果显示,AD对照组较正常对照组显著性减少(P < 0.05),而AD跑步组较AD对照组显著性增多(P < 0.01;图 2C);空间探索实验中目标象限游泳时间比和距离比的结果显示,AD对照组较正常对照组显著性减小(P < 0.05),而AD跑步组均较AD对照组显著增大(P < 0.05图 2D、E)。

|
| A:3组小鼠在Morris水迷宫定位航行与空间探索实验中的轨迹;B:Morris水迷宫定位航行实验逃避潜伏期对比;C:Morris水迷宫空间探索实验中的穿台次数;D:Morris水迷宫空间探索实验目标象限游泳时间比;E:Morris水迷宫空间探索实验目标象限游泳距离比;F:Y迷宫实验自发交替实验正确率 a: P < 0.05,与正常对照组比较;b: P < 0.05,与AD对照组比较 图 2 跑步运动改善APP/PS1小鼠学习和记忆能力实验结果(n=12,x±s) |
在Y迷宫中,AD对照组中小鼠的表现明显差于正常对照组,而AD跑步组中小鼠的表现明显优于AD对照组。其中,自发交替实验正确率结果显示,AD对照组较正常对照组显著性减小(P < 0.05),而AD跑步组较AD对照组显著性增大(P < 0.05;图 2F)。
2.3 跑步运动延缓APP/PS1小鼠mPFC的萎缩甲苯胺蓝染色(图 3A)与体视学三维定量结果显示:AD对照组mPFC的体积较正常对照组显著减小(P < 0.05,图 3B),而AD跑步组mPFC的体积较AD对照组显著增大(P < 0.01,图 3B)。表明跑步运动可以延缓APP/PS1转基因AD小鼠mPFC的萎缩。

|
| A:计算mPFC体积方法的示意图;B:各组小鼠mPFC的体积(n=5,x±s) a: P < 0.05,与正常对照组比较;b: P < 0.05,与AD对照组比较 图 3 跑步运动延缓APP/PS1小鼠mPFC的萎缩 |
2.4 跑步运动增加APP/PS1小鼠mPFC内小胶质细胞(IBA1+)的数量
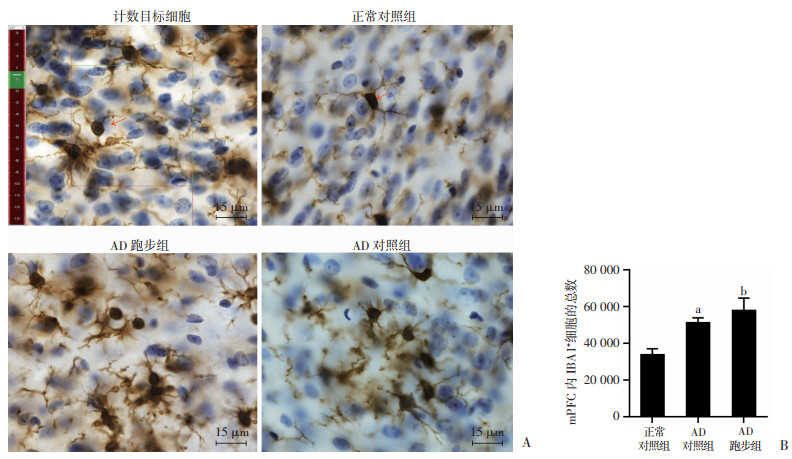
免疫组化(图 4A)与体视学三维定量实验结果显示:AD对照组mPFC内小胶质细胞的总数较正常对照组显著性增多(P < 0.05,图 4B),AD跑步组mPFC内小胶质细胞的总数较AD对照组显著性增多(P < 0.05, 图 4B)。以上结果表明,跑步运动增加了APP/PS1小鼠mPFC内小胶质细胞(IBA1+)的数量。
|
| A:根据禁线法则计数mPFC内IBA1+细胞的示意图和3组小鼠mPFC内IBA1+细胞示意图 绿色线为计数线,红色线为排除线,细胞核在体视框内且仅与计数线相交而不与排除线相交的细胞将被计数;↑:示IBA1+细胞;B:各组小鼠mPFC内IBA1+细胞的总数(n=5,x±s) a: P < 0.05,与正常对照组比较;b: P < 0.05,与AD对照组比较 图 4 跑步运动增加APP/PS1小鼠mPFC内小胶质细胞(IBA1+)的数量 |
2.5 跑步运动促进APP/PS1小鼠mPFC内小胶质细胞的活化并减少Aβ斑块的面积
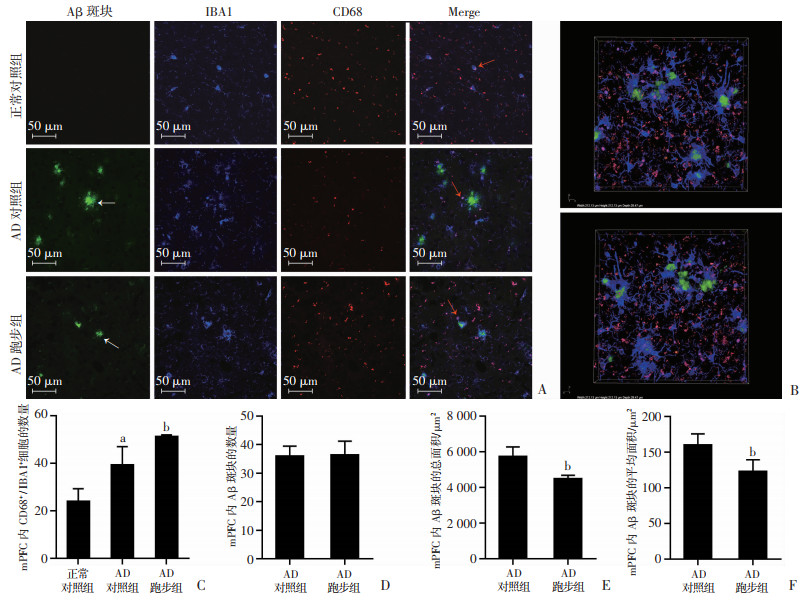
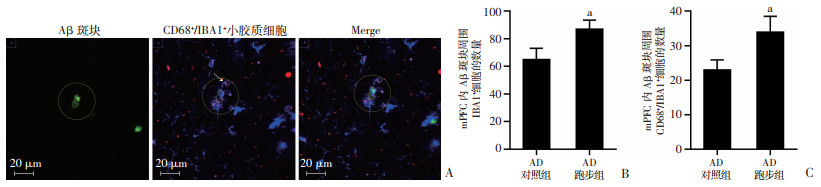
免疫荧光与激光共聚焦定量检测结果显示(图 5A、B,图 6A):AD对照组mPFC内CD68+/IBA1+细胞较正常对照组显著性增多(P < 0.05,图 5C),AD跑步组mPFC内CD68+/IBA1+细胞较AD对照组显著性增多(P < 0.05, 图 5C)。虽然AD跑步组和AD对照组mPFC内Aβ斑块的数量没有差异(图 5D),但是AD跑步组mPFC内Aβ斑块的总面积和平均面积较AD对照组显著性减小(P < 0.01, 图 5E、F);Aβ周围的IBA1+细胞和CD68+/IBA1+细胞较AD对照组显著性增多(P < 0.05;图 6B、C)。表明与AD对照组相比,跑步运动可以促进APP/PS1小鼠mPFC内小胶质细胞的活化并减少Aβ斑块的面积。
|
| A:免疫荧光多重标记的示意图 绿色为Aβ斑块,蓝色为IBA1,红色为CD68;白色箭头示Aβ斑块,红色箭头示CD68+/IBA1+细胞;B:免疫荧光层扫后三维合成示意图 层扫图片长度和宽度均为212.13 μm,厚度为28.47 μm;绿色为Aβ斑块,蓝色为IBA1,红色为CD68;C:各组小鼠mPFC内CD68+/IBA1+细胞的数量;D:各组小鼠mPFC内Aβ斑块的数量;E:各组小鼠mPFC内Aβ斑块的总面积;F:各组小鼠mPFC内Aβ斑块的平均面积 a: P < 0.05,与正常对照组比较;b: P < 0.05,与AD对照组比较 图 5 跑步运动促进APP/PS1小鼠mPFC内小胶质细胞的活化并减少Aβ斑块的面积(n=3,x±s) |
|
| A:Aβ斑块周围区域示意图 绿色为Aβ斑块,蓝色为IBA1,红色为CD68;↑:示CD68+/IBA1+细胞;B:各组小鼠mPFC内Aβ斑块周围IBA1+细胞的数量;C:各组小鼠mPFC内Aβ斑块周围CD68+/IBA1+细胞的数量 a: P < 0.05,与AD对照组比较 图 6 跑步运动促进APP/PS1小鼠mPFC内Aβ斑块周围小胶质细胞的活化(n=3,x±s) |
2.6 跑步运动增加APP/PS1小鼠mPFC小胶质细胞内Aβ斑块的面积及其与mPFC内Aβ斑块的面积比例
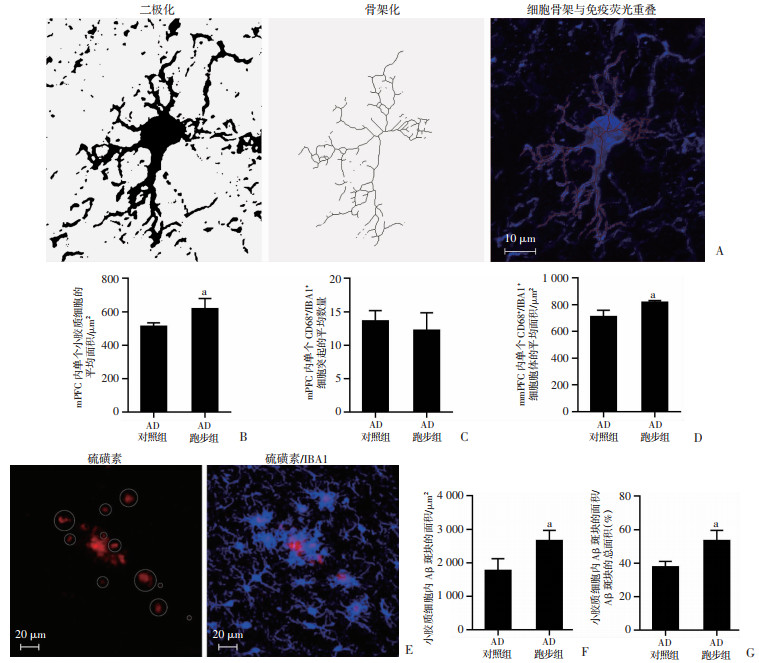
免疫荧光及Image J软件定量检测结果显示:AD跑步组mPFC内单个小胶质细胞的平均面积较AD对照组显著性增多(P < 0.05;图 7B)。两组小鼠进行骨架化分析(图 7A),发现虽然AD跑步组和AD对照组mPFC内单个CD68+/IBA1+细胞突起的数量没有差异(图 7C),但是AD跑步组mPFC内单个CD68+/IBA1+细胞胞体的平均面积较AD对照组显著性增多(P < 0.05,图 7D)。两组小鼠mPFC内小胶质细胞与Aβ斑块共定位后(图 7E),发现AD跑步组mPFC中小胶质细胞内Aβ斑块的面积及其与mPFC内Aβ斑块的面积比例较AD对照组显著性增多(P < 0.05,图 7F、G)。以上结果表明跑步运动可以增加小胶质细胞内Aβ斑块的面积及其与mPFC内Aβ斑块的面积比例。
|
| A:小胶质细胞骨架化分析示意图;B:小鼠mPFC内单个小胶质细胞的平均面积(包括胞体及突起);C:小鼠mPFC内单个CD68+/IBA1+细胞突起的平均数量(每组3只小鼠,每只小鼠计数12个细胞);D:小鼠mPFC内单个CD68+/IBA1+细胞胞体的平均面积(每组3只小鼠,每只小鼠计数30个细胞);E:小鼠小胶质细胞与Aβ斑块共定位示意图红色为Aβ斑块,蓝色为周围所有的小胶质细胞(包括IBA1+及CD68+/IBA1+细胞),圆圈内为小胶质细胞内的Aβ斑块;F:各组小鼠mPFC中小胶质细胞内Aβ斑块的面积;G:各组小鼠mPFC中小胶质细胞内Aβ斑块的面积/mPFC内Aβ斑块的总面积 a: P < 0.05,与AD对照组比较 图 7 跑步运动增加APP/PS1小鼠mPFC小胶质细胞内Aβ斑块的面积及其与mPFC内Aβ斑块的面积比例(n=3,x±s) |
3 讨论 3.1 跑步运动可以保护APP/PS1小鼠mPFC及其相关的工作记忆
作为全社会公共卫生问题之一,AD一直是神经科学研究的重点和难点[1]。随着AD药物三期临床实验的不断失败[26],运用多靶点的非药物干预手段改善AD受到研究者们的广泛关注。跑步运动作为一种简单易行的非药物干预手段,在临床研究和基础研究均证实能够有效延缓AD的发生和发展[2-4]。以往关于AD及跑步运动对AD作用的研究,多聚焦于海马。然而,多项研究表明,除海马外,mPFC也是AD患者的主要受累区域[12-13]。在AD疾病的早期,一定比例的AD患者存在明显的执行功能障碍[27]和相关的PFC萎缩[28]。我们前期研究也发现,APP/PS1小鼠mPFC存在体积萎缩及AD特征性的病理改变[18]。在本研究中我们以10月龄APP/PS1转基因AD小鼠为研究对象,并进行为期4个月的主动跑步运动干预。研究者认为,未来减缓或阻止AD进展和保护大脑功能的治疗在疾病的早期进行可能最有效[1]。本课题组曾运用Morris水迷宫分别对4、6、8、10月龄APP/PS1转基因小鼠及相同月龄的野生型小鼠的行为学进行检测,发现转基因AD小鼠的空间记忆和学习能力出现改变的时间为10月龄[29],而且后期曾再次证实在10月龄时APP/PS1转基因AD小鼠开始出现空间学习、记忆障碍[30-31]。因此,我们认为10月龄APP/PS1转基因AD小鼠相当于AD患者的早期。本研究发现AD跑步组在Morris水迷宫和Y迷宫中的表现均优于AD对照组。Morris水迷宫是公认的检测海马依赖的空间学习和记忆能力的行为学测试手段,而Y迷宫主要用于评价空间工作和参考记忆[32],PFC与工作记忆的形成密切相关[33]。因此,本研究表明跑步运动在有效改善海马依赖的空间学习和记忆能力的同时,也明显改善了PFC相关的空间工作和参考记忆。此后,运用体视学方法准确定量了小鼠mPFC的体积,观察到AD跑步组和正常对照组小鼠mPFC的体积均显著性大于AD对照组,提示APP/PS1小鼠mPFC存在萎缩,而为期4个月的跑步运动能够有效延缓mPFC的萎缩。结合行为学结果,可以看到跑步运动对APP/PS1小鼠mPFC及其相关的工作记忆均有积极地保护作用。那么,跑步运动如何保护APP/PS1小鼠mPFC及其相关的工作记忆?
以往研究显示Aβ的增加可引起AD神经炎症反应[34],在APP/PS1小鼠中,12周的跑步运动可以有效降低海马内Aβ斑块的面积[4]。本研究对Aβ斑块的数量和面积进行了定量,发现与AD对照组相比,AD跑步组mPFC内Aβ斑块的数量虽然没有减少,但是Aβ斑块的总面积和单个Aβ斑块的平均面积明显减小,这一结果提示跑步运动能够减少APP/PS1小鼠mPFC内Aβ斑块的沉积。小胶质细胞作为中枢神经系统的固有免疫细胞,在Aβ介导神经损伤过程中扮演着重要的角色[9, 35-36]。本研究运用体视学方法定量mPFC内小胶质细胞(IBA1+)的总数,发现APP/PS1小鼠mPFC内小胶质细胞总数较正常对照组显著性增加。研究表明小胶质细胞能够通过释放细胞因子、吞噬病原体以及蛋白聚集介导免疫反应,从而维持脑内稳态[37],但当机体受到外界刺激如神经损伤、缺血或感染等情况时,小胶质细胞迅速转变为活化状态并产生一系列变化,包括增殖,吞噬作用改变等[38]。因此,我们推测APP/PS1小鼠mPFC内小胶质细胞数量增加的原因可能是小胶质细胞受到了Aβ等毒性物质的刺激,过度活化所致。文献表明,活化的小胶质细胞可以分为M1型(经典激活型)和M2型(替代激活型),但是,随着研究的深入,这种分类方式存在着较多的争议,部分研究者认为,这是对活化小胶质细胞的一种简略区分[39]。多数研究在实验中使用单一标志物进行M1型、M2型的区分,但是不同的标记物标记的细胞具有不同的功能。CD68是一种指示具有吞噬作用的活化小胶质细胞的溶酶体标记物,常常被用来进行AD和Aβ有关的研究[25, 40]。为此,本研究通过荧光双标定量了活化的小胶质细胞(CD68+/IBA1+)的数量,结果显示APP/PS1小鼠mPFC内活化的小胶质细胞也是增多的,这也进一步证实了我们的推测。小胶质细胞在参与炎症和神经损伤的同时还承担着清除Aβ斑块的责任[35]。研究表明,在AD患者中,小胶质细胞的功能和生理状态都受到损害[8],小胶质细胞吞噬清除Aβ的能力在AD等神经退行性疾病进程中会逐渐减弱,当它们不能有效清除Aβ时,小胶质细胞还会继续释放促炎介质以进一步刺激免疫反应,从而产生恶性循环,导致活化的免疫细胞、炎症介质更多地向Aβ积聚,却不能有效清除Aβ[9]。那么跑步运动能否修复小胶质细胞的损伤,减少Aβ的沉积呢?
3.2 跑步运动促进了mPFC内小胶质细胞的活化,减少了Aβ的沉积以往研究表明,跑步运动能够增加老年大鼠皮层和海马区域小胶质细胞的数量,促进小胶质细胞向Aβ斑块聚集,并改善老年大鼠海马依赖的位置识别记忆的损伤[10]。为此,本研究通过体视学和免疫荧光定量了APP/PS1小鼠mPFC内小胶质细胞和活化小胶质细胞的数量,发现跑步运动能够增加APP/PS1小鼠mPFC内小胶质细胞和活化小胶质细胞的数量,这一结果提示跑步运动进一步刺激了APP/PS1小鼠mPFC内小胶质细胞的增殖和活化。此后,我们又对Aβ斑块附近的小胶质细胞进行了定量,发现AD跑步组Aβ斑块周围的小胶质细胞总数和CD68+小胶质细胞均较AD对照组显著性增多。研究表明,CD68在组织巨噬细胞的吞噬活动中发挥重要作用,CD68的表达增加反映了免疫激活[41-42]。本研究结果提示跑步运动的确增加了APP/PS1小鼠mPFC内Aβ斑块周围CD68+小胶质细胞的数量。以往研究表明,局灶性脑损伤后,受损组织会释放细胞外ATP,从而触发小胶质细胞的激活并将其转化为吞噬细胞,活化的小胶质细胞会向病灶部位定向延伸多个突起参与病变的清理,同时收缩其他方向的突起[43],因此,活化小胶质细胞的突起与其吞噬功能息息相关。然而,研究表明,当活化的小胶质细胞清理坏死细胞时,活化的小胶质细胞会向受损细胞延伸一个大的圆形并同时收缩其他部位使其变得具有吞噬性[43],在此种情况下,活化小胶质细胞的突起并未增加,甚至可能减少。本研究结果显示,AD跑步组和AD对照组mPFC内活化小胶质细胞突起的数量没有差异。但是,研究结果也提示,AD跑步组mPFC内单个小胶质细胞的平均面积(包括胞体与突起)较AD对照组显著性增大。以往研究表明,小胶质细胞的形态与功能密切相关,损伤或炎症刺激会诱导小胶质细胞从分枝形态转变为变形虫形态,此时,细胞胞体增大[44]。变形虫形态反映了与吞噬作用相关的高度活化状态,因此,我们对活化小胶质细胞的胞体面积进行定量分析,结果表明,AD跑步组mPFC内单个活化小胶质细胞胞体的平均面积较AD对照组显著性增大,表明AD跑步组mPFC内小胶质细胞平均面积的增大可能与胞体的面积增大有关,且跑步运动促进了小胶质细胞的活化状态。既然小胶质细胞形态与功能密切相关,那么跑步运动是否影响了小胶质细胞的功能呢?文献表明小胶质细胞可以吞噬AD小鼠脑内的Aβ斑块[45],基于这一结论,本研究运用免疫荧光将Aβ斑块与mPFC内所有小胶质细胞(包括IBA1+以及CD68+/IBA1+)共定位,并且定量分析mPFC中小胶质细胞内Aβ斑块的面积及其与mPFC内Aβ斑块的面积比例。结果显示,跑步运动后,mPFC中小胶质细胞内Aβ斑块的面积显著增大,且其与mPFC内所有Aβ斑块的面积比例同样显著性增大。以上实验结果都表明,跑步运动促进了mPFC内小胶质细胞的活化,减少了Aβ的沉积。
3.3 总结综上所述,跑步运动能够增加mPFC内小胶质细胞总数,促进小胶质细胞表达CD68,进而增加CD68+小胶质细胞的数量,减少Aβ斑块的沉积,延缓mPFC的萎缩,进而改善APP/PS1转基因AD小鼠学习和记忆能力。但本研究仍缺乏对于跑步运动促进AD小鼠mPFC内活化小胶质细胞对Aβ斑块吞噬能力的直接证据,这仍有待进一步的研究。
| [1] |
2021 Alzheimer′s disease facts and figures[J]. Alzheimers Dement, 2021, 17(3): 327-406. DOI: 10.1002/alz.12328.
|
| [2] |
NORTON S, MATTHEWS F E, BARNES D E, et al. Potential for primary prevention of Alzheimer's disease: an analysis of population-based data[J]. Lancet Neurol, 2014, 13(8): 788-794. |
| [3] |
MVLLER S, PREISCHE O, SOHRABI H R, et al. Relationship between physical activity, cognition, and Alzheimer pathology in autosomal dominant Alzheimer's disease[J]. Alzheimers Dement, 2018, 14(11): 1427-1437. |
| [4] |
ZHAO N, YAN Q W, XIA J, et al. Treadmill exercise attenuates aβ-induced mitochondrial dysfunction and enhances mitophagy activity in APP/PS1 transgenic mice[J]. Neurochem Res, 2020, 45(5): 1202-1214. |
| [5] |
TAPIA-ROJAS C, ARANGUIZ F, VARELA-NALLAR L, et al. Voluntary running attenuates memory loss, decreases neuropathological changes and induces neurogenesis in a mouse model of Alzheimer's disease[J]. Brain Pathol, 2016, 26(1): 62-74. |
| [6] |
HOFFMANN K, SOBOL N A, FREDERIKSEN K S, et al. Moderate-to-high intensity physical exercise in patients with Alzheimer's disease: a randomized controlled trial[J]. J Alzheimers Dis, 2016, 50(2): 443-453. |
| [7] |
HOLTHOFF V A, MARSCHNER K, SCHARF M, et al. Effects of physical activity training in patients with Alzheimer's dementia: results of a pilot RCT study[J]. PLoS One, 2015, 10(4): e0121478. |
| [8] |
BRAWEK B, SCHWENDELE B, RIESTER K, et al. Impairment of in vivo calcium signaling in amyloid plaque-associated microglia[J]. Acta Neuropathol, 2014, 127(4): 495-505. |
| [9] |
NEWCOMBE E A, CAMATS-PERNA J, SILVA M L, et al. Inflammation: the link between comorbidities, genetics, and Alzheimer's disease[J]. J Neuroinflamm, 2018, 15(1): 276. |
| [10] |
SIETTE J, WESTBROOK R F, COTMAN C, et al. Age-specific effects of voluntary exercise on memory and the older brain[J]. Biol Psychiatry, 2013, 73(5): 435-442. |
| [11] |
XU Z Q, ZHANG L Q, WANG Q, et al. Aerobic exercise combined with antioxidative treatment does not counteract moderate- or mid-stage alzheimer-like pathophysiology of APP/PS1 mice[J]. CNS Neurosci Ther, 2013, 19(10): 795-803. |
| [12] |
MAILLET D, RAJAH M N. Association between prefrontal activity and volume change in prefrontal and medial temporal lobes in aging and dementia: a review[J]. Ageing Res Rev, 2013, 12(2): 479-489. |
| [13] |
SALAT D H, KAYE J A, JANOWSKY J S. Selective preservation and degeneration within the prefrontal cortex in aging and Alzheimer disease[J]. Arch Neurol, 2001, 58(9): 1403-1408. |
| [14] |
ANTZOULATOS E G, MILLER E K. Differences between neural activity in prefrontal cortex and striatum during learning of novel abstract categories[J]. Neuron, 2011, 71(2): 243-249. |
| [15] |
GAGNEPAIN P, VALLÉE T, HEIDEN S, et al. Collective memory shapes the organization of individual memories in the medial prefrontal cortex[J]. Nat Hum Behav, 2020, 4(2): 189-200. |
| [16] |
EUSTON D R, GRUBER A J, MCNAUGHTON B L. The role of medial prefrontal cortex in memory and decision making[J]. Neuron, 2012, 76(6): 1057-1070. |
| [17] |
STOPFORD C L, THOMPSON J C, NEARY D, et al. Working memory, attention, and executive function in Alzheimer's disease and frontotemporal dementia[J]. Cortex, 2012, 48(4): 429-446. |
| [18] |
蒋林. 氟西汀对AD内侧前额叶皮质内神经元和突触病理改变的作用及作用机制研究[D]. 重庆: 重庆医科大学, 2019. JIANG L. Effects of fluoxetine on the neuronal and synaptic pathological changes in the medial prefrontal cortex of the transgenic AD mice[D]. Chongqing: Chongqing Medical University, 2019. |
| [19] |
Institute of Laboratory Animal Resources (US) Committee on Care and Use of Laboratory Animals. Guide for the care and use of Laboratory Animals[M]. 8th ed. Washingto (DC): National Academies Press (US), 2011.
|
| [20] |
YUEDE C M, ZIMMERMAN S D, DONG H, et al. Effects of voluntary and forced exercise on plaque deposition, hippocampal volume, and behavior in the Tg2576 mouse model of Alzheimer's disease[J]. Neurobiol Dis, 2009, 35(3): 426-32. |
| [21] |
HE Q, JIANG L, ZHANG Y, et al. Anti-LINGO-1 antibody ameliorates cognitive impairment, promotes adult hippocampal neurogenesis, and increases the abundance of CB1R-rich CCK-GABAergic interneurons in AD mice[J]. Neurobiol Dis, 2021, 156: 105406. |
| [22] |
VAN DE WERD H J, RAJKOWSKA G, EVERS P, et al. Cytoarchitectonic and chemoarchitectonic characterization of the prefrontal cortical areas in the mouse[J]. Brain Struct Funct, 2010, 214(4): 339-353. |
| [23] |
ZHANG L, TANG W, CHAO F L, et al. Four-month treadmill exercise prevents the decline in spatial learning and memory abilities and the loss of spinophilin-immunoreactive puncta in the Hippocampus of APP/PS1 transgenic mice[J]. Neurobiol Dis, 2020, 136: 104723. |
| [24] |
YOUNG K, MORRISON H. Quantifying microglia morphology from photomicrographs of immunohistochemistry prepared tissue using ImageJ[J]. J Vis Exp, 2018(136). |
| [25] |
BAIK S H, KANG S, LEE W, et al. A breakdown in metabolic reprogramming causes microglia dysfunction in Alzheimer's disease[J]. Cell Metab, 2019, 30(3): 493-507. |
| [26] |
CUMMINGS J, LEE G, ZHONG K, et al. Alzheimer's disease drug development pipeline: 2021[J]. Alzheimers Dement (N Y), 2021, 7(1): e12179. |
| [27] |
GODEFROY O, MARTINAUD O, VERNY M, et al. The dysexecutive syndrome of Alzheimer's disease: the GREFEX study[J]. J Alzheimers Dis, 2014, 42(4): 1203-1208. |
| [28] |
WOODWARD M C, ROWE C C, JONES G, et al. Differentiating the frontal presentation of Alzheimer's disease with FDG-PET[J]. J Alzheimers Dis, 2015, 44(1): 233-242. |
| [29] |
张蕾. AD早期行为学、Aβ和白质的改变及跑步锻炼能否延缓这些改变进程的探讨[D]. 重庆: 重庆医科大学, 2014. ZHANG L. The early changes of behavior and amyloid and the white matter in Alzheimer′s disease and the effects of exercise on the behavior and the white matter in Alzheimer′s disease[D]. Chongqing: Chongqing Medical University, 2014. |
| [30] |
蒋林. 跑步锻炼对早期APP/PS1转基因AD小鼠海马各亚区内神经元数量的影响[D]. 重庆: 重庆医科大学, 2015. JIANG L. Effects of exercrise on the neurons in the Hippocampus of early APP/PS1 transgenic mouse[D]. Chongqing: Chongqing Medical University, 2015. |
| [31] |
CHAO F L, ZHANG Y, ZHANG L, et al. Fluoxetine promotes hippocampal oligodendrocyte maturation and delays learning and memory decline in APP/PS1 mice[J]. Front Aging Neurosci, 2020, 12: 627362. |
| [32] |
KRAEUTER A K, GUEST P C, SARNYAI Z. The Y-maze for assessment of spatial working and reference memory in mice[J]. Methods Mol Biol, 2019, 1916: 105-111. |
| [33] |
MILLER E K, LUNDQVIST M, BASTOS A M. Working memory 2.0[J]. Neuron, 2018, 100(2): 463-475. |
| [34] |
ITTNER A, ITTNER L M. Dendritic tau in Alzheimer's disease[J]. Neuron, 2018, 99(1): 13-27. |
| [35] |
HICKMAN S, IZZY S, SEN P, et al. Microglia in neurodegeneration[J]. Nat Neurosci, 2018, 21(10): 1359-1369. |
| [36] |
VOGELS T, MURGOCI A N, HROMÁDKA T. Intersection of pathological tau and microglia at the synapse[J]. Acta Neuropathol Commun, 2019, 7(1): 109. |
| [37] |
SALTER M W, STEVENS B. Microglia emerge as central players in brain disease[J]. Nat Med, 2017, 23(9): 1018-1027. |
| [38] |
CONDELLO C, YUAN P, GRUTZENDLER J. Microglia-mediated neuroprotection, TREM2, and Alzheimer's disease: evidence from optical imaging[J]. Biol Psychiatry, 2018, 83(4): 377-387. |
| [39] |
RANSOHOFF R M. A polarizing question: do M1 and M2 microglia exist?[J]. Nat Neurosci, 2016, 19(8): 987-991. |
| [40] |
MATSUMURA A, SUZUKI S, IWAHARA N, et al. Temporal changes of CD68 and α7 nicotinic acetylcholine receptor expression in microglia in Alzheimer's disease-like mouse models[J]. J Alzheimers Dis, 2015, 44(2): 409-423. |
| [41] |
UNGER M S, SCHERNTHANER P, MARSCHALLINGER J, et al. Microglia prevent peripheral immune cell invasion and promote an anti-inflammatory environment in the brain of APP-PS1 transgenic mice[J]. J Neuroinflamm, 2018, 15(1): 274. |
| [42] |
HENDRICKX D A E, VAN EDEN C G, SCHUURMAN K G, et al. Staining of HLA-DR, Iba1 and CD68 in human microglia reveals partially overlapping expression depending on cellular morphology and pathology[J]. J Neuroimmunol, 2017, 309: 12-22. |
| [43] |
NAYAK D, ROTH T L, MCGAVERN D B. Microglia development and function[J]. Annu Rev Immunol, 2014, 32: 367-402. |
| [44] |
COLONNA M, BUTOVSKY O. Microglia function in the central nervous system during health and neurodegeneration[J]. Annu Rev Immunol, 2017, 35: 441-468. |
| [45] |
MANDREKAR S, JIANG Q, LEE C Y, et al. Microglia mediate the clearance of soluble Abeta through fluid phase macropinocytosis[J]. J Neurosci, 2009, 29(13): 4252-62. |