极低频电磁场(extremely low frequency electroma-gnetic field,ELF-EMF)指频率在300 Hz以下的交变电磁场,使用交流电的各类设备、输电线等都可以产生50 Hz的极低频电磁场, 可以说50 Hz电磁场遍布我们生活工作的每一个角落,给人们的健康产生潜在的危害。极低频电磁辐射暴露可引起动物和人群学习记忆功能下降等神经行为障碍、海马脑区氧化应激等[1-3]。特别是职业暴露于极低频电磁场中可出现头痛头昏、乏力疲劳、记忆力减退、睡眠障碍等精神症状,并且是促进痴呆和阿尔茨海默病(alzheimer’s disease,AD)发生的高危险因素[4]。
双酚A(bisphenol A,BPA),属于环境内分泌干扰素,其作为添加剂(如塑化剂等)的制品同样广泛存在于人们的日常生活中,如碳酸饮料瓶、矿泉水瓶、婴幼儿奶瓶、塑料桶、食品包装材料、口腔修补牙齿材料等[5]。BPA可通过渗入水和食物等过程主要经消化道进入人体内,职业环境中还可通过呼吸道和皮肤进入人体内。根据美国国家卫生和营养调查结果显示,几乎所有美国公民的尿液和血液中均可检测出BPA的代谢产物[6]。研究表明,BPA不仅可影响生殖系统、免疫系统、代谢功能,导致内分泌失调、性早熟、癌症发生、胚胎和子代的生长发育等,还可影响神经系统,是神经退行性疾病的高危险因素[6-9]。由此可知,极低频电磁辐射和BPA的联合暴露广泛存在于普通人群的日常生活和工作过程中,而且这两类因素均是神经退行性疾病的高危险因素。由于暴露的剂量有差异或比较低,还没有引起人们的高度关切。本实验初步研究了50 Hz磁场和BPA单独和联合暴露对在体和离体神经细胞Tau蛋白磷酸化的影响,为解释AD的分子机制提供基础研究支持。
1 材料与方法 1.1 实验动物与分组实验动物为24只SD雄性大鼠,购自陆军军医大学实验动物中心,体质量(150±10)g,分为对照组(SHAM组,生理盐水灌胃+50 Hz磁场假性暴露)、50 Hz磁场暴露组(50 Hz组,0.5 mT、4 h/d 50 Hz磁场暴露+生理盐水灌胃)、BPA组(BPA 20 μg·kg-1·d-1灌胃+50 Hz磁场假性暴露)、50 Hz磁场和BPA复合暴露组(50 Hz+BPA组,BPA 20 μg·kg-1·d-1灌胃+0.5 mT、4 h/d 50 Hz磁场暴露)4组,每组6只。上述处理1次/d,6 d/周,连续12周。50 Hz磁场动物暴露装置见图 1。

|
| 图 1 50 Hz磁场动物暴露装置 |
离体细胞实验采用神经母细胞瘤细胞株(Neuro-2a),分为对照组(SHAM组)、50 Hz磁场暴露组(50 Hz组,1 mT、48 h)、BPA组(100 μmol/L、24 h)、50 Hz磁场和BPA复合暴露组(50 Hz+BPA组,1 mT、48 h +100 μmol/L、24 h)4组。50 Hz磁场细胞暴露装置购自瑞典(IT’IS Foundation, Zurich, Switzerland)。
1.2 主要试剂和仪器DMEM培养基(Gibco美国),胎牛血清(PAN Biotech德国),SDS-PAGE配胶试剂盒、低荧光PVDF膜、蛋白电泳系统和蛋白转印系统(Bio-Rad,美国),RIPA裂解液、BCA蛋白浓度检测试剂盒、SDS-PAGE蛋白上样缓冲液、QuickBlock Western封闭液、QuickBlock Western一抗稀释液、QuickBlock Western二抗稀释液、HRP标记二抗、DAPI染色液、青霉素/链霉素溶液(碧云天,中国),蛋白酶抑制剂、磷酸酶抑制剂(Roche罗氏),Cell Counting Kit-8(Dojindo日本),Tunel试剂盒(Roche罗氏),Anti-Tau(phospho S404)(ab131338,abcam),Anti-Tau(phospho T231)(ab151559,abcam),Anti- capase-3(Sigma,美国),荧光二抗(A11034,ThermoFisher),HRP化学发光检测试剂盒(millipore),Tecan酶标仪、冰冻切片机、荧光显微镜(Leica),凝胶成像系统(Bio-Rad,美国)。
1.3 方法 1.3.1 细胞培养及处理Neuro-2a细胞使用含1%青-链霉素溶液及10%胎牛血清的DMEM高糖培养基培养。按照实验设计,在Neuro-2a细胞生长融合至80%左右的密度时,将4组细胞分别放于50 Hz磁场细胞暴露培养箱内的暴露盒(50 Hz磁场单独暴露组细胞、50 Hz磁场和BPA复合暴露组细胞)和假性暴露盒(对照组细胞、BPA单独暴露组细胞)内,50 Hz磁场暴露24 h后,在50 Hz磁场BPA复合暴露组细胞和BPA单独暴露组细胞培养基内添加BPA(终浓度100 μmol/L),之后继续在50 Hz磁场细胞暴露培养箱内暴露24 h。
1.3.2 细胞活力测定将Neuro-2a细胞接种于透明平底的96孔板中,每组接种3个复孔,同时另外设置3个空白对照孔。培养箱孵育12 h至18 h,按1.3.1处理细胞后,弃去培养基,按CCK-8试剂盒说明书操作,使用Tecan酶标仪在波长为450 nm处检测光密度D(450),细胞活力=[ D(450)处理组-D(450)空白组]/ [D(450)对照组-D(450)空白组]×100%。
1.3.3 细胞免疫荧光染色将Neuro-2a细胞接种于提前包被好的含细胞爬片的24孔板中,培养箱孵育12 ~18 h,按1.3.1处理细胞后,弃去培养基,按常规方法进行漂洗、固定、通透、封闭、抗体孵育(一抗稀释比例为1 ∶200,荧光二抗)、DAPI复染核、抗荧光猝灭剂封片,荧光显微镜进行图像采集,用Image J软件进行图像分析。
1.3.4 组织免疫荧光染色SD雄性大鼠经12周处理后,5%水合氯醛麻醉、4%多聚甲醛灌注固定、取大脑、4%多聚甲醛后固定、梯度蔗糖脱水(10%蔗糖12 h、20%蔗糖24 h、30%蔗糖48 h)、OCT包埋剂包埋、冰冻切片机切片(10 μm),切片按常规方法进行漂洗、通透、封闭、抗体孵育(一抗稀释比例为1 ∶100,荧光二抗)、DAPI复染核,将切片捞出贴附在载玻片上,滴加抗荧光猝灭剂封片,荧光显微镜进行图像采集。
1.3.5 组织细胞凋亡检测SD雄性大鼠脑组织冰冻切片(10 μm) 按常规方法进行漂洗、通透后将切片捞出贴附在载玻片上,按TUNEL试剂盒说明书每片滴加30 μL TUNEL(末端脱氧核苷酰基转移酶介导性dUTP切口末端标记, terminal deoxynucleotidyl transferase-mediated dUTP nick end labeling)反应混合液(TdT:荧光素标记的dUTP=1 ∶9,现用现配)湿盒内室温避光孵育2 h,之后PBS漂洗、DAPI复染核、滴加抗荧光淬灭剂封片,荧光显微镜进行图像采集。
1.3.6 Western blot检测按1.3.1处理培养在6孔板的细胞后,预冷PBS清洗、RIPA裂解液(含蛋白酶抑制剂和磷酸酶抑制剂)裂解、刮下细胞至1.5 mL EP管中、4 ℃ 20 000×g离心20 min、吸取上清、按BCA蛋白浓度测定试剂盒说明书测定蛋白浓度、分装并置-80 ℃冰箱保存备用或直接用于后续实验。用微量进样针取分装的蛋白50 μg上样进行SDS-PAGE电泳(5%浓缩胶、10%~12%分离胶、80~100 V恒压)、蛋白转印(250 mA恒流、≥1 h),PVDF膜按常规方法进行封闭、抗体孵育(一抗稀释比例为1 ∶500~1 ∶1 000,二抗稀释比例为1 ∶2 000)、TBST漂洗、HRP化学发光检测试剂盒显色、用凝胶成像系统成像并进行灰度值分析。
1.4 统计学分析采用SPSS 22.0统计软件进行分析,结果用x±s表示,两组间比较采用Student-t检验,检验水准α=0.05。
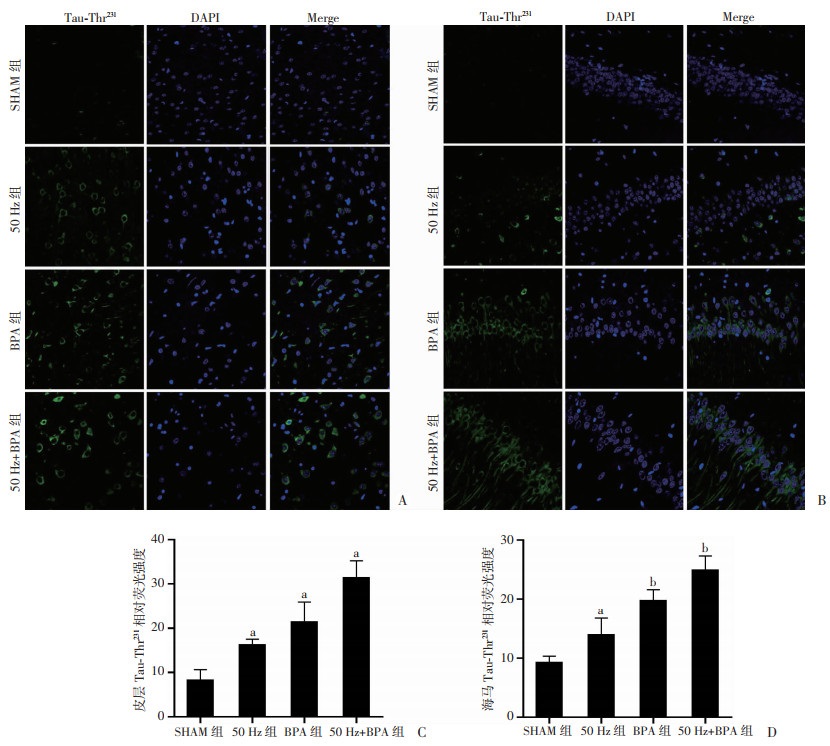
2 结果 2.1 50 Hz磁场和BPA暴露对大鼠脑组织Tau蛋白磷酸化和细胞凋亡的影响0.5 mT 50 Hz磁场暴露12周后,SD雄性大鼠皮层和海马脑组织Tau-Thr231位点磷酸化水平比对照组大鼠明显升高(P < 0.05);20 μg·kg-1·d-1 BPA灌胃暴露12周后,SD雄性大鼠皮层和海马脑组织Tau-Thr231位点磷酸化水平同样比对照组大鼠明显升高(P < 0.01),甚至比50 Hz磁场暴露组大鼠升高幅度更明显;50 Hz磁场和BPA联合暴露12周后,SD雄性大鼠皮层和海马脑组织Tau-Thr231位点磷酸化水平明显高于对照组(P < 0.01),比单独暴露组大鼠升高幅度更明显(图 2)。
|
| A: 免疫荧光观察大脑皮层(×100);B: 免疫荧光观察海马组织(×100);C: 大脑皮层组织免疫荧光相对荧光强度 a:P < 0.01, 与SHAM组比较;D:海马组织免疫荧光相对荧光强度 a:P < 0.05, b:P < 0.01, 与SHAM组比较 图 2 50 Hz磁场和BPA暴露对SD雄性大鼠脑组织Tau-Thr231表达的影响(n=3,x±s) |
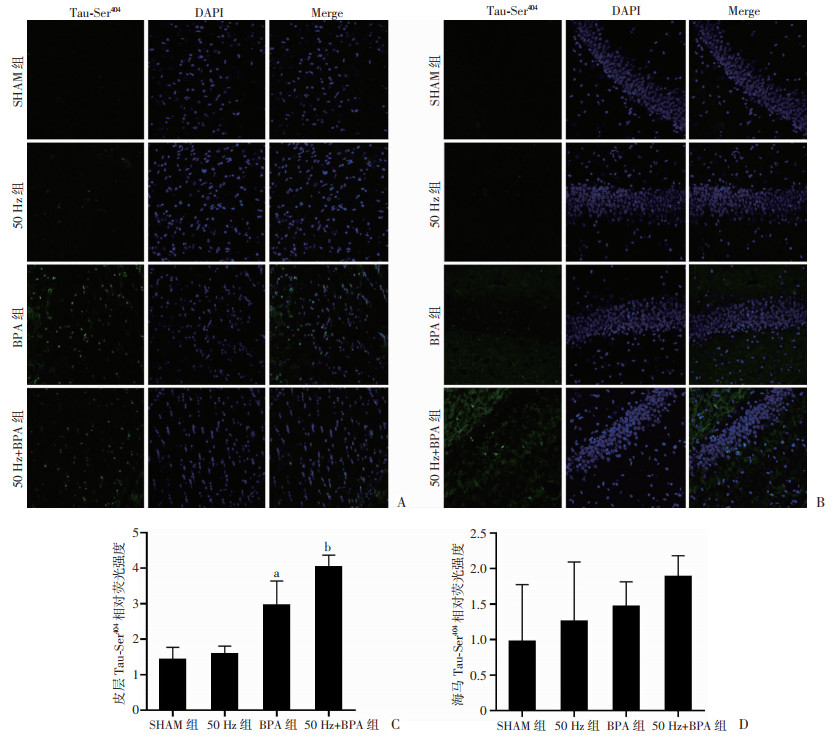
0.5 mT 50 Hz磁场暴露12周后,SD雄性大鼠皮层和海马脑组织Tau-Ser404位点磷酸化水平与对照组大鼠比无明显变化(P>0.05);20 μg·kg-1·d-1BPA灌胃暴露12周后,SD雄性大鼠皮层脑组织Tau-Thr404位点磷酸化水平明显高于对照组大鼠(P < 0.05),但海马脑组织Tau-Ser404位点磷酸化水平与对照组大鼠比变化不太明显(P>0.05);50 Hz磁场和BPA联合暴露12周后,SD雄性大鼠皮层脑组织Tau-Thr404位点磷酸化水平明显高于对照组大鼠(P < 0.01),但海马脑组织Tau-Thr404位点磷酸化水平升高不太明显(P>0.05,图 3)。
|
| A: 免疫荧光观察大脑皮层(×40);B: 免疫荧光观察海马组织(×40);C: 大脑皮层组织免疫荧光相对荧光强度 a:P < 0.05, b:P < 0.01, 与SHAM组比较;D:海马组织免疫荧光相对荧光强度 图 3 50 Hz磁场和BPA暴露对SD雄性大鼠脑组织Tau-Ser404表达的影响(n=3,x±s) |
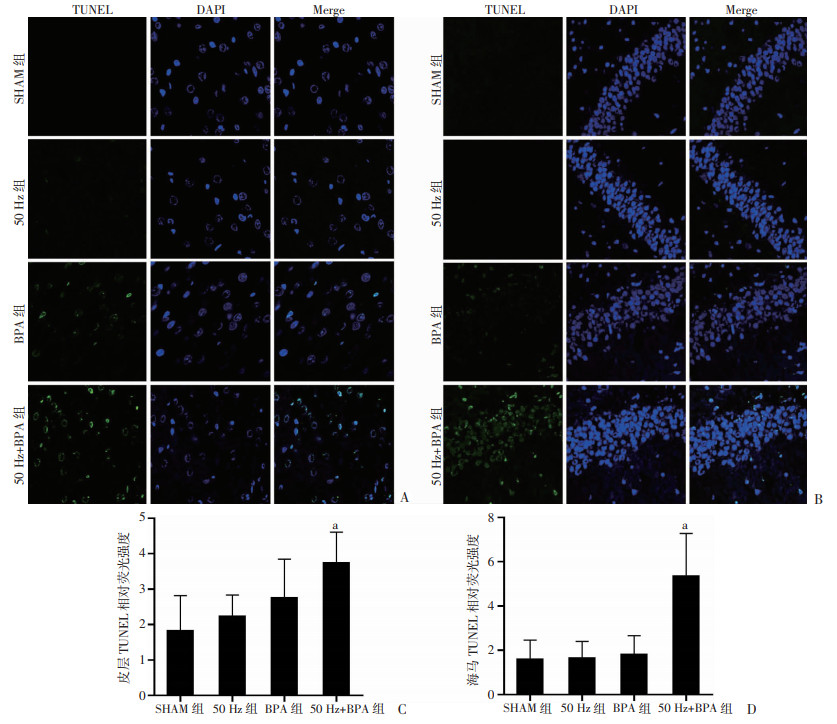
0.5 mT 50 Hz磁场和20 μg·kg-1·d-1BPA灌胃单独分别暴露12周后,SD雄性大鼠皮层和海马脑组织细胞凋亡水平与对照组大鼠比均无明显变化(P>0.05);50 Hz磁场和BPA联合暴露12周后,SD雄性大鼠皮层和海马脑组织细胞凋亡水平均明显高于对照组大鼠(P < 0.05,图 4)。
|
| A: 大脑皮层(TUNEL×100);B: 海马组织(TUNEL×100);C: 大脑皮层组织TUNEL染色相对荧光强度 a:P < 0.05, 与SHAM组比较;D:海马组织TUNEL染色相对荧光强度 a:P < 0.05, 与SHAM组比较 图 4 50 Hz磁场和BPA暴露对SD雄性大鼠脑组织细胞凋亡的影响(n=3,x±s) |
2.2 50 Hz磁场和BPA暴露对Neuro-2a细胞活力的影响
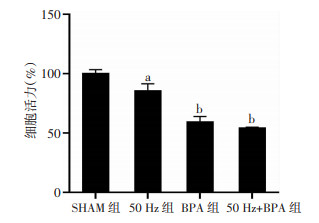
50 Hz磁场(1.0 mT、48 h)暴露后,Neuro-2a细胞活力明显低于对照组(P < 0.05);BPA单独暴露或与50 Hz磁场复合暴露Neuro-2a细胞活力均非常明显低于对照组(P < 0.001,图 5)。
|
| a:P < 0.05, b:P < 0.001, 与SHAM组比较 图 5 50 Hz磁场和BPA暴露对Neuro-2a细胞活力的影响(n=3,x±s) |
2.3 50 Hz磁场和BPA暴露对Neuro-2a细胞Tau蛋白磷酸化的影响
细胞免疫荧光和Western blot检测结果显示,50 Hz磁场(1.0 mT, 48 h)暴露后,Neuro-2a细胞Tau-Thr231位点磷酸化水平与对照组比差异均无统计学意义(P>0.05)。细胞免疫荧光检测结果显示,BPA单独暴露或与50 Hz磁场复合暴露,Neuro-2a细胞Tau-Thr231位点磷酸化水平均明显升高(P < 0.05),尤以复合暴露变化更明显;而Western blot检测结果显示,只有BPA与50 Hz磁场复合暴露后Neuro-2a细胞Tau-Thr231位点磷酸化水平明显高于对照组(P < 0.05),而BPA单独暴露后变化差异无统计学意义(图 6)。
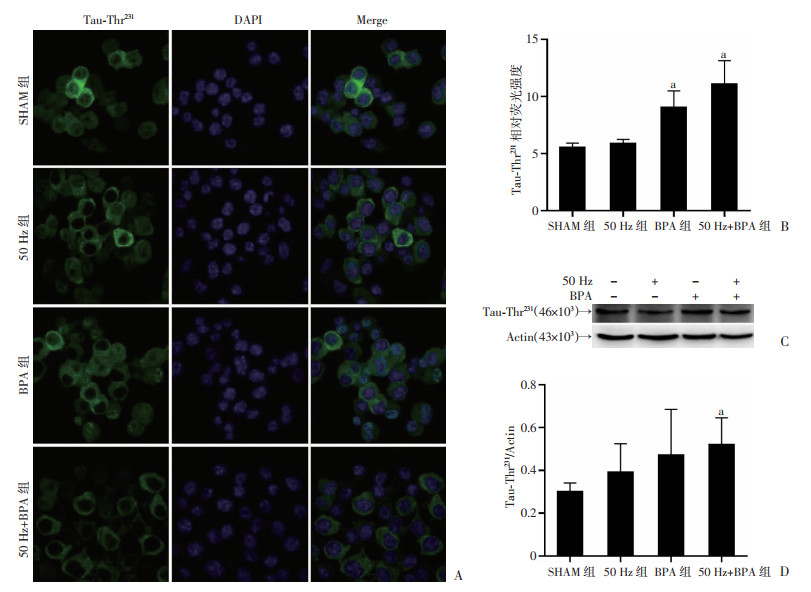
|
| A:免疫荧光观察Neuro-2a细胞变化(×200);B:细胞免疫荧光相对荧光强度 a:P < 0.05, 与SHAM组比较;C、D:Western blot检测结果及半定量分析结果 a:P < 0.05, 与SHAM组比较 图 6 50 Hz磁场和BPA暴露对Neuro-2a细胞Tau-Thr231表达的影响(n=3,x±s) |
细胞免疫荧光和Western blot检测结果显示,50 Hz磁场(1.0 mT, 48 h)暴露后,Neuro-2a细胞Tau-Ser404位点磷酸化水平均明显高于对照组(P < 0.05);BPA单独暴露或与50 Hz磁场复合暴露,Neuro-2a细胞Tau-Ser404位点磷酸化水平均明显高于对照组(P < 0.05),尤以复合暴露变化更明显(图 7)。
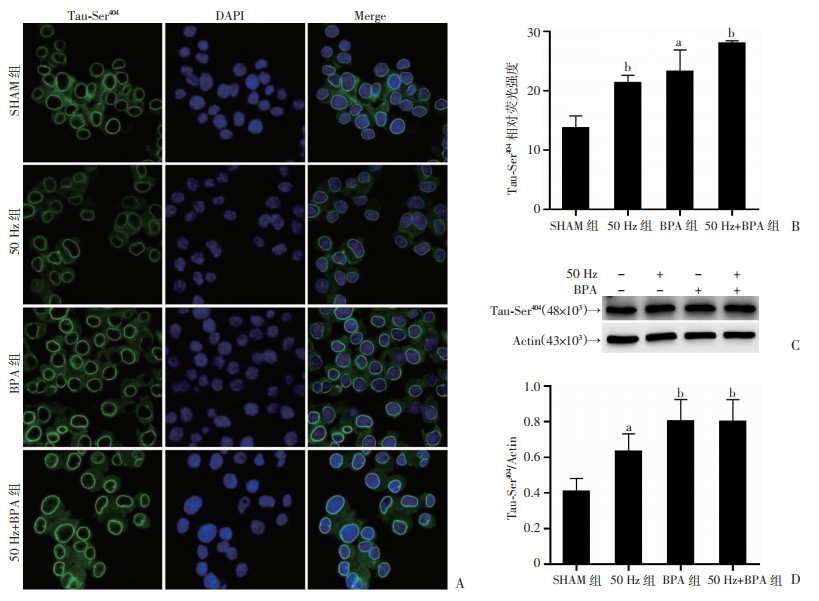
|
| A:免疫荧光观察Neuro-2a细胞变化(×200);B:细胞免疫荧光相对荧光强度 a:P < 0.05, b:P < 0.01, 与SHAM组比较;C、D:Western blot检测结果及半定量分析结果 a:P < 0.05, b:P < 0.01, 与SHAM组比较 图 7 50 Hz磁场和BPA暴露对Neuro-2a细胞Tau-Ser404表达的影响(n=3,x±s) |
2.4 50 Hz磁场和BPA暴露对Neuro-2a细胞Caspase-3表达的影响
细胞免疫荧光和Western blot检测结果显示,50 Hz磁场(1.0 mT, 48 h)暴露后,Neuro-2a细胞Caspase-3的表达水平与对照组比差异均无统计学意义(P>0.05);BPA单独暴露或与50 Hz磁场复合暴露,Neuro-2a细胞Caspase-3的表达水平只有Western blot检测结果明显升高(P < 0.05),细胞免疫荧光检测结果差异均无统计学意义(图 8)。
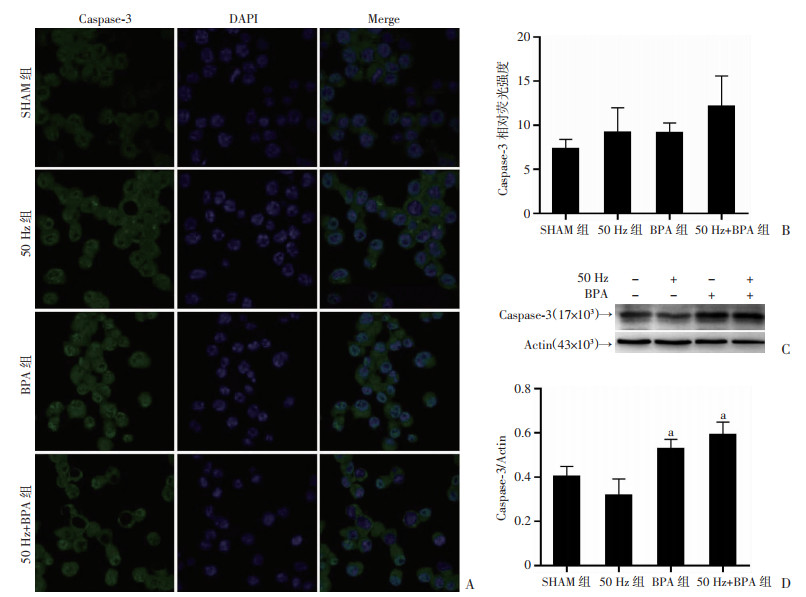
|
| A:免疫荧光观察Neuro-2a细胞变化(×200);B:细胞免疫荧光相对荧光强度;C、D:Western blot检测结果及半定量分析结果 a:P < 0.05, 与SHAM组比较 图 8 50 Hz磁场和BPA暴露对Neuro-2a细胞Caspase-3表达的影响(n=3,x±s) |
3 讨论
随着老龄化社会的到来,痴呆患病人数将会大幅增高。据世卫组织报告,2019年世界范围内罹患痴呆的人群已达到5 520万人,死亡160万(居第7位死因),相关费用达1.3万亿美元;预计到2030年罹患人数将达到7 800万人,相关费用将达1.7万亿美元;预计到2050年罹患人数将达到13 900万人,相关费用将达2.8万亿美元[10]。能导致痴呆的疾病很多,最主要是AD,占50%~75%。Aβ蛋白的沉积和神经原纤维缠结是AD的两大病理学重要特征,而神经原纤维缠结的主要成分就是过度磷酸化的Tau蛋白。Tau蛋白是一种微管相关蛋白,正常情况下能够促进微管的组装和稳定、轴突生长和运输等,过度磷酸化的Tau蛋白不仅丧失这些生物学活性,而且对蛋白水解酶的抵抗性增加,自聚集形成双螺旋丝,会导致神经元功能紊乱和退行性变[11]。从AD患者脑中分离的Tau蛋白大约有40个磷酸化位点,并且不同位点磷酸化的Tau蛋白有不同的生物学功能和病理学意义[12]。如前所述,早期研究显示极低频电磁辐射暴露不仅可影响学习记忆等神经行为,而且可能是促进AD发生的高危因素,但一直缺乏足够实验室研究数据的支持,并且近年来本就不多的研究结果还相互矛盾。意大利学者研究发现3.1 mT 50 Hz磁场整晚暴露后可影响H4神经胶质瘤细胞(H4/APPswe,转染人β-淀粉状蛋白前体蛋白)的淀粉样蛋白形成过程,表现为Aβ蛋白分泌明显增加,但不影响该细胞的活力[13]。我们前期的研究发现用50 Hz磁场辐照小鼠8周后(2 mT,4 h/d),可影响小鼠的学习记忆能力,同时小鼠皮层和海马组织Tau蛋白Ser404位点和Ser396位点磷酸化水平明显高于对照组[14]。但有研究表明50 Hz磁场(500 μT)暴露3个月却可改善3xTg小鼠[AD模型动物,转染了APP、PS1、Tau (P301L),6月龄后就可表现为认知缺陷]的认知缺陷,Tau蛋白磷酸化水平不增反降,作者认为50 Hz磁场可作为AD有效治疗的对策[15]。本研究发现,50 Hz磁场在体暴露(0.5 mT,4 h/d,6 d/周,12周)和离体暴露(1 mT,48 h)均可引起Tau蛋白磷酸化水平明显升高,但磷酸化位点有所不同,且均不足以导致细胞凋亡水平的明显变化,提示在本实验条件下50 Hz磁场暴露可能会对神经细胞的功能有一定影响,比如神经行为学的改变。但本研究未对动物的神经行为学进行评价,这是本研究的不足,今后需进一步研究Tau蛋白磷酸化的生理或病理学意义,明确Tau蛋白过度磷酸化与神经行为学之间的联系。
BPA作为环境内分泌干扰素,早期的研究主要关注对生殖健康、内分泌和代谢功能、生长发育等的影响。近年来随着研究的深入和延伸,发现BPA暴露对神经系统也有影响。BPA(>100 μmol/L,24 h)可通过影响细胞骨架蛋白和突触的完整性(比如MAP2、Tau蛋白和mRNA表达均明显下降等)抑制Neuro-2a细胞的增殖和发育[8]。BPA(>20 nmol/L,12 h)暴露可引起SH-SY5Y细胞AD样神经毒性,表现为BACE-1、淀粉状蛋白前体蛋白(amyloid precursor protein,APP)、Aβ1-42、不同位点磷酸化的tau蛋白(Ser199、Ser396、Thr205、Ser214和Ser404)等表达增加,并且与胰岛素信号通路明显紊乱有关[6]。另外怀孕小鼠围产期BPA暴露(2、10、100 μg·kg-1·d-1)可致其子代(3、6、9月龄)AD样神经毒性,表现为皮层和海马脑区tau蛋白不同位点(Thr205、Ser199、Ser396、Ser404和Ser214)磷酸化水平明显增加[9]。本研究发现BPA(20 μg·kg-1·d-1、6 d/周)灌胃12周可引起SD雄性大鼠皮层和海马脑组织Tau-Thr231位点以及皮层Tau-Ser404位点磷酸化水平明显升高,并可导致神经细胞凋亡数量增加;100 μmol/L BPA暴露24 h同样可致Neuro-2a细胞Tau-Thr231位点和Tau-Ser404位点磷酸化水平明显升高,细胞活力明显下降,Caspase-3表达水平明显升高;并且BPA暴露和50 Hz磁场暴露之间存在联合协同效应。进一步提示50 Hz磁场和BPA暴露可能是AD发生的高危因素。
Tau蛋白磷酸化水平受Tau蛋白激酶和Tau蛋白磷酸酶双重调节,激酶促使其磷酸化,磷酸酶促使其去磷酸化,蛋白激酶和蛋白磷酸酶的平衡紊乱可能是导致Tau蛋白过度磷酸化的重要原因。细胞周期素依赖的蛋白激酶5(cyclin dependent kinase 5, CDK5)和糖原合成酶激酶(glycogen-synthase kinase 3β, GSK3β) 是最明确的Tau蛋白激酶,最主要的Tau蛋白磷酸酶是蛋白磷酸酶1(protein phosphatases 1, PP1)和蛋白磷酸酶2A(protein phosphatases 2A, PP2A)。已有研究表明BPA暴露确实可激活GSK3β、CDK5活性、抑制PP2A活性[6, 9, 16],表明BPA暴露可通过影响蛋白激酶和蛋白磷酸酶的平衡导致Tau蛋白的过度磷酸化,促进AD的发生。但未见研究报道50 Hz磁场暴露也有类似的研究结果,而是有相反的结果,即50 Hz磁场暴露可抑制GSK3β、CDK5酶活性,激活PP2Ac,降低Tau蛋白磷酸化水平,改善AD模型动物的认知缺陷[15]。另外,在Tau蛋白的翻译后修饰中,糖基化和磷酸化可以竞争性的结合同一位点,Tau蛋白的磷酸化水平还要受到O-联-N-乙酰葡糖胺(O-linked N-acetylglucosamine,O-GlcNAc)糖基化修饰的负性调节[17]。因此,今后有必要进一步研究不同参数50 Hz磁场暴露对Tau蛋白更多位点磷酸化和糖基化的影响,以及CDK5、GSK3β、O-GlcNAc糖基化信号通路在其中的作用。
| [1] |
CUI Y, GE Z, RIZAK J D, et al. Deficits in water maze performance and oxidative stress in the Hippocampus and striatum induced by extremely low frequency magnetic field exposure[J]. PLoS One, 2012, 7(5): e32196. |
| [2] |
MANIKONDA P K, RAJENDRA P, DEVENDRANATH D, et al. Extremely low frequency magnetic fields induce oxidative stress in rat brain[J]. Gen Physiol Biophys, 2014, 33(1): 81-90. |
| [3] |
DAVANIPOUR Z, TSENG C C, LEE P J, et al. Severe cognitive dysfunction and occupational extremely low frequency magnetic field exposure among elderly Mexican Americans[J]. Br J Med Med Res, 2014, 4(8): 1641-1662. |
| [4] |
QIU C, FRATIGLIONI L, KARP A, et al. Occupational exposure to electromagnetic fields and risk of Alzheimer's disease[J]. Epidemiology, 2004, 15(6): 687-694. |
| [5] |
KUNDAKOVIC M, CHAMPAGNE F A. Epigenetic perspective on the developmental effects of bisphenol A[J]. Brain Behav Immun, 2011, 25(6): 1084-1093. |
| [6] |
WANG T W, XIE C W, YU P F, et al. Involvement of insulin signaling disturbances in bisphenol A-induced Alzheimer's disease-like neurotoxicity[J]. Sci Rep, 2017, 7: 7497. |
| [7] |
MA Y, LIU H, WU J, et al. The adverse health effects of bisphenol A and related toxicity mechanisms[J]. Environ Res, 2019, 176: 108575. |
| [8] |
YIN Z, HUA L, CHEN L, et al. Bisphenol-A exposure induced neurotoxicity and associated with synapse and cytoskeleton in Neuro-2a cells[J]. Toxicol in Vitro, 2020, 67: 104911. |
| [9] |
XUE J, ZHANG L, XIE X, et al. Prenatal bisphenol A exposure contributes to Tau pathology: Potential roles of CDK5/GSK3β/PP2A axis in BPA-induced neurotoxicity[J]. Toxicology, 2020, 438: 152442. |
| [10] |
World Health Organization. Global status report on the public health response to dementia[R/OL]. [2021-09-02]. https://www.who.int/health-topics/dementia.
|
| [11] |
STOOTHOFF W H, JOHNSON G V W. Tau phosphorylation: physiological and pathological consequences[J]. Biochim et Biophys Acta BBA Mol Basis Dis, 2005, 1739(2/3): 280-297. |
| [12] |
GONG C X, LIU F, GRUNDKE-IQBAL I, et al. Post-translational modifications of tau protein in Alzheimer's disease[J]. J Neural Transm (Vienna), 2005, 112(6): 813-838. |
| [13] |
DEL GIUDICE E, FACCHINETTI F, NOFRATE V, et al. Fifty Hertz electromagnetic field exposure stimulates secretion of beta-amyloid peptide in cultured human neuroglioma[J]. Neurosci Lett, 2007, 418(1): 9-12. |
| [14] |
DENG Y, ZHANG Y, JIA S, et al. Effects of aluminum and extremely low frequency electromagnetic radiation on oxidative stress and memory in brain of mice[J]. Biol Trace Elem Res, 2013, 156(1/2/3): 243-252. |
| [15] |
HU Y, LAI J, WAN B, et al. Long-term exposure to ELF-MF ameliorates cognitive deficits and attenuates tau hyperphosphorylation in 3xTg AD mice[J]. Neurotoxicology, 2016, 53: 290-300. |
| [16] |
LI J, WANG Y, FANG F, et al. Bisphenol A disrupts glucose transport and neurophysiological role of IR/IRS/AKT/GSK3β axis in the brain of male mice[J]. Environ Toxicol Pharmacol, 2016, 43: 7-12. |
| [17] |
GONG C X, LIU F, GRUNDKE-IQBAL I, et al. Impaired brain glucose metabolism leads to Alzheimer neurofibrillary degeneration through a decrease in tau O-GlcNAcylation[J]. J Alzheimers Dis, 2006, 9(1): 1-12. |




