2. 030001 太原,山西医科大学基础医学院:形态学实验室;
3. 030012 太原,山西医科大学附属人民医院
2. Laboratory of Morphology, School of Basic Medicine, Shanxi Medical University, Taiyuan, Shanxi Province, 030001;
3. Affiliated People′s Hospital, Shanxi Medical University, Taiyuan, Shanxi Province, 030012, China
心力衰竭(heart failure,HF)是各种心血管疾病发展的终末阶段。流行病学数据表明,全世界有6 430万人患有HF[1]。随着老龄化的日益加剧,我国HF患病率及病死率均呈明显升高趋势[2]。HF是当前社会的重大公共问题之一,且针对其发病机制的研究还有待明确。
越来越多的证据显示,心肌细胞死亡引起的细胞大量丢失是促进HF发生发展的重要原因之一[3]。临床数据表明,40%~60%的HF患者血清中存在持续激活β1-肾上腺素受体(β1-adrenergic receptor,β1-AR)的自身抗体(β1-adrenergic receptor autoantibodies, β1-AA)[4]。研究[5]证实,β1-AA可与心肌细胞膜表面的β1-AR结合促进心肌细胞死亡,参与HF的发生发展。然而β1-AA如何引起心肌细胞死亡目前尚不清楚。
人类发生心血管事件不良事件的风险在清晨时分最高,下午和傍晚降低,具有明显的时间变化规律[6],HF患者亦是如此[7]。“日常熬夜”“轮班倒”“睡眠障碍”“穿越时区”等涉及昼夜节律紊乱的生活方式可打乱心脏的修复周期导致心肌细胞受损甚至死亡,致使HF的风险增加或原有HF加重[8],提示HF的发生发展可能与昼夜节律息息相关。昼夜节律是由内部“时钟”驱动的24 h周期变化。在分子水平上,生物钟基因及其编码的蛋白质通过转录——翻译反馈环路实现24 h昼夜节律的调控作用。周期蛋白(period, per)作为转录翻译反馈环路中的负反馈元件,与隐花色素蛋白(crypto chrome, cry)相互结合抑制BMAL1/CLOCK异源二聚体对下游Per和Cry的转录活性。由此形成生物钟周期振荡的自身调控反馈环路,调节生物体的生理、生化和行为的昼夜节律。周期蛋白2(period 2,per2)是重要的时钟蛋白之一,可作为哺乳动物昼夜节律的起搏器[9],已被证明在心血管疾病发生发展过程中起着重要作用[10]。
研究表明,β1-肾上腺素受体激活可明显改变生物钟基因Per2的节律性表达[11],而蛋白质是基因的终产物和功能的执行者,作为激活β1-肾上腺素受体的自身抗体β1-AA,是否也可通过改变Per2蛋白的表达进而参与心肌细胞死亡目前尚不清楚。因此,本研究旨在探讨β1-AA是否通过影响Per2蛋白表达进而促进H9c2大鼠心肌细胞死亡,从调节昼夜节律蛋白的角度为心肌细胞死亡的发生提供靶点及实验依据。
1 材料与方法 1.1 材料 1.1.1 动物及细胞普通清洁级SD大鼠6~8周龄,雄性,体质量180~210 g/只,共16只,经山西医科大学动物中心批准[许可证号:SCXK(晋)2015-0001]提供。动物自由饮水进食,以标准颗粒饲料进行喂养,室温保持在18~23 ℃,相对湿度控制在40%~60%,在12 h光照: 12 h黑暗的循环光照环境中饲养,常规观察一周后进行实验。H9c2细胞购自中国科学院上海细胞库。
1.1.2 试剂与仪器本实验采用了β1-AR-EC Ⅱ肽段(吉尔生化上海有限公司);亲和纯化层析柱试剂盒(Cytiva公司);CCK-8检测试剂盒(日本,同仁化学研究所);地塞米松(索莱宝科技有限公司);DMEM(Gibico公司);标准血清SA311(Cellmax公司);胰蛋白酶(索莱宝科技有限公司);RIPA裂解液(武汉博士德生物工程有限公司);PMSF蛋白酶抑制剂(武汉博士德生物工程有限公司);蛋白质定量试剂盒(武汉博士德生物工程有限公司);SDS-PAGE凝胶配制试剂盒(Minibio公司);Anti-Per2抗体(Abcam);β-actin抗体(中杉金桥公司);辣根过氧化物酶标记羊抗兔IgG和羊抗鼠IgG(中杉金桥公司);ECL超敏发光液(大连美仑生物技术有限公司);RNAiso Plus(宝日医生物技术(北京)有限公司);PrimeScript RT Master Mix(宝日医生物技术(北京)有限公司);SYBR Premix Ex TaqTMII(宝日医生物技术(北京)有限公司);慢病毒LV-shPer2和LV-NC(汉恒生物科技(上海)有限公司),慢病毒LV-Per2和LV-NC(上海吉凯基因医学科技股份有限公司)。恒温细胞培养箱(Eppendorf,德国);低温高速离心机(ThermoFisher,美国);酶标仪(Molecular Devices,美国);电泳仪(BIO-RAD,美国);半干转膜仪(BIO-RAD,美国);ChemiDoc MP全能型成像系统(BIO-RAD,美国);热循环仪(MJ Research,中国);实时定量PCR仪(ThermoFisher,美国);激光共聚焦显微镜(Olympus Corporation,日本)。
1.2 方法 1.2.1 主动免疫大鼠模型建立按照随机数字表法将16只SD雄性大鼠分为主动免疫组(模型组)和溶剂对照组,每组8只。设计并合成β1肾上腺素受体细胞外第二环抗原肽段,参考文献[12]方法,对模型组大鼠进行主动免疫。首先称取适量β1-AR-EC Ⅱ抗原肽段置于Na2CO3溶液溶解,然后采用生理盐水将肽段溶液稀释成一定浓度,再按1 ∶1比例与完全弗氏佐剂混合制备成“油包水”乳状液。乳化后,按每只大鼠0.4 μg/g的剂量将肽段乳液在大鼠背部分多点进行皮下注射,即为首次免疫。随后每隔2周进行加强免疫,将稀释后的肽段溶液与不完全弗氏佐剂1 ∶1乳化,大鼠背部单点皮下注射。对照组大鼠则采用Na2CO3溶液等体积注射。8周后检测血清β1-AA并提纯,以备后续实验所需。
1.2.2 链霉亲和素-酶联免疫吸附测定(SA-ELISA)检测β1-AA使用人工合成的β1-AR-EC Ⅱ抗原肽段包被微孔板,制成固相抗原,往包被肽段的微孔中依次加入奶粉、大鼠血清、生物素标记的二抗和辣根过氧化物酶标记的链霉卵白素,形成抗原-抗体-生物素标记的抗体复合物,经过彻底洗涤后加底物缓冲液37 ℃水浴30 min显色。颜色的深浅和血清中β1-AA含量呈正相关。用酶标仪在405 nm波长下测定吸光度[D(405)],并记录数据。结果判定:P/N=[D(405)标本-D(405)空白对照]/[D(405)阴性对照-D(405)空白对照],P/N≥2.1为抗体阳性,1.5 < P/N < 2.1为可疑,P/N≤1.5为抗体阴性。
1.2.3 亲和层析法提纯β1-AA挑选出抗体阳性率高的大鼠血清样本进行β1-AA纯化。层析柱拼接好之后先加入适量三蒸水洗去原本保留在层析柱的乙醇,使用结合缓冲液清洗柱子,然后将含有β1-AA的血清上样到层析柱上。保存包含样品流通液的收集管,为了使柱子的结合能力最大化,可以将流通液重新装到同一层析柱上。使用洗涤缓冲液洗去非特异性结合,最后在层析柱加入一定量洗脱液,将其收集在含有中和缓冲液的新EP管中检测β1-AA含量,以备细胞实验所需。
1.2.4 细胞培养及加药处理H9c2细胞由中国科学院上海细胞库提供。将细胞复苏至75 cm2细胞培养瓶中,使用含有10%胎牛血清(FBS)、1%青-链霉素的DMEM培养液培养。培养箱设置温度37 ℃和5% CO2的生长条件。细胞随机分组并按照说明,H9c2细胞在达到70%~80%融合程度时加入地塞米松溶液使其终浓度为0.1 μmol/L,同步化处理4 h后标记时间为CT0、CT4、CT8、CT12、CT16、CT20依次进行收样,用于后续实验。
1.2.5 CCK-8法检测细胞存活率100 μL细胞悬液接种在96孔细胞培养板内,每孔细胞量控制在20%~30%。实验分为空白对照组(完全培养基)、阴性对照组、实验组。将培养板置于37 ℃、5% CO2培养箱预孵育24 h后,PBS清洗换液,向培养板加入一定体积待测药物培养24 h。最后,在每个孔中加入10 μL CCK-8试剂,在培养箱内孵育2 h后,使用多功能酶标仪测量在D(450)值。细胞相对活力=[D(450)实验组-D(450)空白对照组]/[D(450)阴性对照组-D(450)空白对照组]×100%。
1.2.6 Western blot预冷PBS清洗细胞,加入RIPA+PMSF裂解缓冲液冰上裂解40 min,收集裂解液,4 ℃、12 000 r/min离心10 min。取出并保留上清液。使用BCA蛋白测定试剂盒检测细胞蛋白的浓度并配成统一上样体系(40 μg)。制备10% SDS-PAGE以80 V转至120 V电泳条件分离蛋白质,然后通过半干转将其转移至PVDF膜进行5%奶粉封闭2 h。一抗4 ℃孵育下过夜,二抗孵育2 h, 期间TBST清洗,在凝胶成像系统下使用增强型化学发光试剂检测印迹。使用Image J软件进行分析。
1.2.7 RT-PCR检测敲低或过表达Per2慢病毒转染后心肌细胞Per2 mRNA表达细胞分为正常对照组,LV-NC组及LV-Per2/shPer2组。加入RNAiso plus充分裂解后收集细胞,提取总RNA进行琼脂糖凝胶电泳分析,RNA浓度测定并反转录为cDNA产物,然后在PCR反应体系中加入2 μL cDNA产物,上机设置程序开始扩增。引物设计:GAPDH上游5′-GGCACAG-TCAAGGCTGAGAATG-3′,下游5′-ATGGTGGTGAAGA- CGCCAGTA-3′;Per2上游5′-AGCAACACCACCTTTCAC- AA-3′,下游5′-CGTAGGCTTAGACCACCATC-3′。扩增所得数据经标化后,采用2-ΔΔCt法进行相对表达定量。
1.2.8 慢病毒感染及细胞筛选由上海汉恒生物科技有限公司协助构建RNA干扰Per2的慢病毒载体(包含3个序列:Per2-shRNA-Ⅰ,Per2-shRNA-Ⅱ,Per2-shRNA-Ⅲ),由上海吉凯基因医学科技股份有限公司协助构建过表达Per2的慢病毒载体。具体感染操作为:前一日进行细胞计数和传代,次日根据最佳感染复数(MOI)加入适宜体积的慢病毒,并加入适宜浓度的助转剂polybrene,感染12~16 h后,换为完全培养液,感染72 h后可置换含适宜浓度嘌呤霉素的完全培养液,进行稳转株的筛选。RNA有效干扰序列筛选实验分为4组:LV-NC组,LV-shPer2-Ⅰ, LV-shPer2-Ⅱ,LV-shPer2-Ⅲ;RNA过表达分为2组:LV-NC组和LV-Per2组。
1.3 统计学分析采用SPSS 16.0统计软件处理数据,结果以x±s表示。使用t检验分析对照和实验两组之间蛋白表达的差异,用单因素方差分析用于分析多组之间的差异,P < 0.05为差异有统计学意义。JTK_CYCLE是一种新的非参数统计算法,用于检测和描述大型数据集中的循环变量。利用Windows版-R 2.10.0软件包进行JTK_CYCLE算法,进而标准分析实验数据的循环变量,设置95%的期望置信区间,记录输出每一个循环变量中的ADJ.P值(校正后P < 0.05表示具有昼夜节律波动性)。
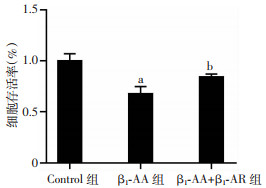
2 结果 2.1 β1-AA明显降低H9c2心肌细胞的存活率CCK-8数据分析(图 1)发现,与对照组相比,1 μmol/L β1-AA作用于H9c2心肌细胞24 h后,心肌细胞存活率显著降低(P < 0.01),β1-AR预处理中和β1-AA后可逆转心肌细胞死亡(P < 0.05)。
|
| a:P < 0.01,与Control组比较;b:P < 0.05,与β1-AA组比较 图 1 β1-AA降低H9c2心肌细胞的存活率(n=8,x±s) |
2.2 β1-AA显著抑制H9c2心肌细胞Per2蛋白的节律性表达
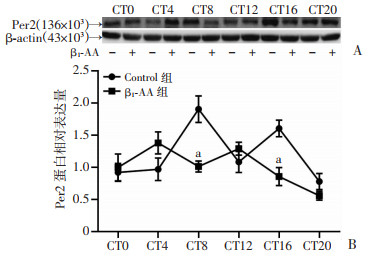
Western blot结果显示,对照组H9c2心肌细胞Per2的表达在CT4和CT12出现低谷,在CT8和CT16出现高峰,整体表达呈现两峰趋势。经JTK_CYCLE算法标准分析可知,对照组细胞Per2蛋白的昼夜节律参数为0.03(ADJ.P < 0.05),具有明显的昼夜节律波动。β1-AA干预H9c2心肌细胞可引起周期蛋白Per2的节律性表达显著抑制,尤其昼夜节律相位前移4 h(P < 0.01,图 2)。并且,经JTK_CYCLE算法标准分析可知,β1-AA作用后,Per2蛋白的昼夜节律参数为0.12(ADJ.P>0.05),表明Per2蛋白在β1-AA作用后不再具有明显的波动变化。
|
| A:Western blot检测心肌细胞Per2蛋白表达;B:定量分析a:P < 0.01,与Control组比较;“-”:未进行β1-AA处理,“+”:进行β1-AA处理 图 2 β1-AA显著抑制H9c2心肌细胞Per2的节律性表达(n=11,x±s) |
2.3 LV-shPer2成功感染H9c2心肌细胞,抑制Per2的表达
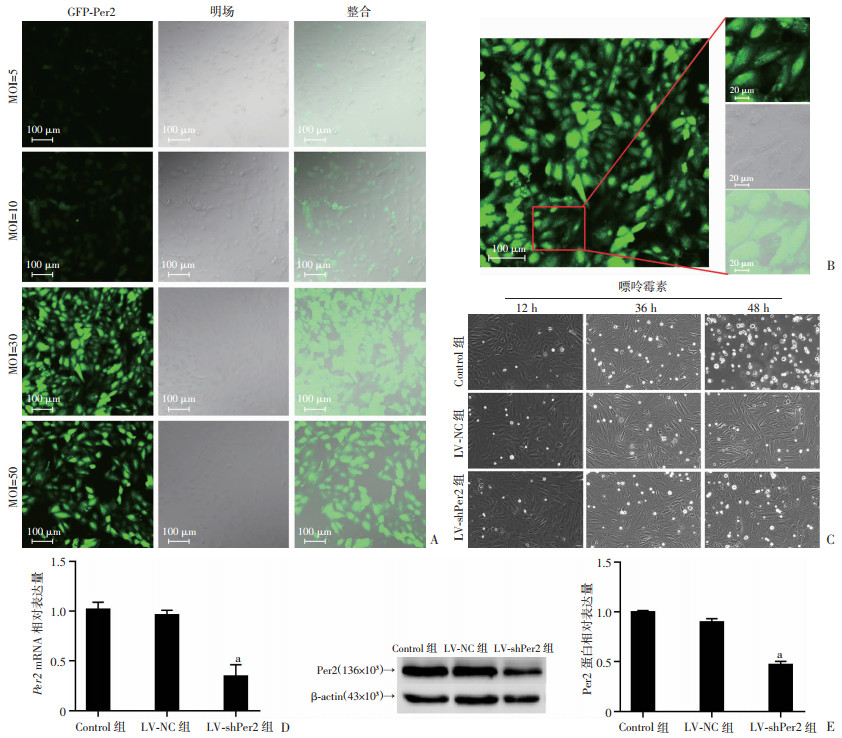
设置4个不同的MOI值(5、10、30、50),根据所计算出的病毒体积,逐孔添加慢病毒。感染完成后荧光显微镜下拍照检测GFP阳性率,观察结果显示,与MOI=5、10相比,当MOI=30时,GFP荧光强度和阳性细胞数量显著增加,且细胞状态佳。当MOI=50时,GFP荧光强度和阳性细胞数量无明显增加,且死亡细胞数量增多。最终筛选出慢病毒感染的最佳MOI=30(图 3A、B)。根据选定的最佳MOI=30与病毒滴度计算出病毒体积开始感染细胞。感染72 h后经嘌呤霉素筛选后获得成功感染的心肌细胞(图 3C)。然后进行RT-PCR和Western blot验证Per2是否敲低。RT-PCR结果显示,与Control组相比,空病毒组细胞的Per2 mRNA无明显变化(P>0.05)。LV-shPer2感染的心肌细胞的Per2 mRNA表达水平明显下调(P < 0.05,图 3D);Western blot结果显示,LV-shPer2感染的心肌细胞的Per2蛋白表达明显降低(P < 0.05,图 3E)。
|
| A:设置MOI=5、10、30、50,GFP荧光图像;B:图A中MOI=30图像放大观察GFP-Pre2荧光图像;C:嘌呤霉素筛选稳转株处理12、36、48 h,对比观察Control组的细胞死亡比例,挑选嘌呤霉素最佳作用时间为48 h;D:RT-PCR验证Per2 mRNA水平降低(n=8,x±s) a:P < 0.001,与Control组比较;E:Western blot验证Per2蛋白水平降低(n=6,x±s) a:P < 0.001,与Control组比较 图 3 采用慢病毒干扰H9c2心肌细胞,抑制Per2表达 |
2.4 抑制心肌细胞Per2的表达可进一步促进β1-AA诱导的心肌细胞死亡
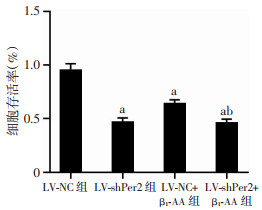
CCK-8结果(图 4)显示,与空病毒组相比,敲低Per2可引起心肌细胞存活率降低(P < 0.001)。在空病毒感染成功的基础上进行β1-AA处理,细胞存活率明显下降(P < 0.001)。对感染的细胞进行β1-AA处理,Per2敲低的细胞比空病毒感染的细胞存活率进一步降低(P < 0.001)。
|
| a:P < 0.001,与LV-NC组比较;b:P < 0.001,与LV-NC+β1-AA组比较 图 4 慢病毒shPer2成功敲低H9c2心肌细胞Per2的表达对细胞存活率的影响(n=8,x±s) |
2.5 LV-Per2成功感染大鼠H9c2心肌细胞,促进Per2的表达
按照不同MOI值比例的LV-Per2感染大鼠H9c2心肌细胞,结果发现,当MOI=20时,GFP荧光强度和阳性细胞数量显著增加,且细胞状态佳,即最佳MOI=20(图 5A)。加入5 mg/mL嘌呤霉素筛选稳定感染细胞(图 5B)。RT-PCR结果显示,与Control组相比,经LV-Per2感染的H9c2细胞Per2 mRNA表达水平明显上调(P < 0.05,图 5C);Western blot结果显示,与Control组相比,LV-Per2成功感染的心肌细胞Per2蛋白表达显著增加(P < 0.05,图 5D)。
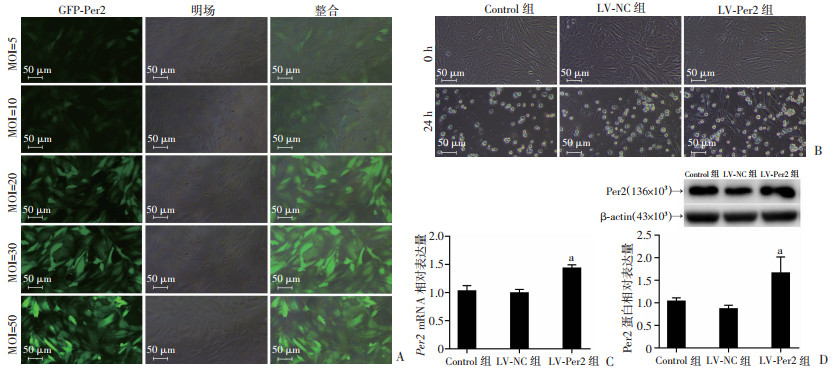
|
| A:设置MOI=5、10、20、30、50时GFP荧光图像,筛选最佳MOI为20;B:嘌呤霉素筛选稳转株处理0、24 h,对比观察Control组的细胞死亡比例,挑选嘌呤霉素最佳作用时间为12 h;C:RT-PCR验证Per2 mRNA升高(n=8,x±s) a:P < 0.05,与Control组比较;D:Western blot验证Per2蛋白水平升高(n=6,x±s) a:P < 0.05,与Control组比较 图 5 采用慢病毒LV-Per2促进大鼠H9c2心肌细胞Per2过表达 |
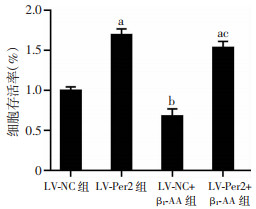
2.6 Per2过表达可逆转β1-AA诱导的心肌细胞死亡
CCK-8结果(图 6)显示,与空病毒组相比,LV-Per2成功感染的心肌细胞存活率明显增加(P < 0.001)。在空病毒感染的基础上进行β1-AA预处理发现心肌细胞存活率降低(P < 0.01)。与β1-AA干预的空病毒感染细胞相比,Per2过表达可明显逆转β1-AA诱导的心肌细胞存活率下降(P < 0.001)。
|
| a:P < 0.001,b:P < 0.01,与LV-NC组比较;c:P < 0.001,与LV-NC+β1-AA组比较 图 6 慢病毒Per2成功促进H9c2心肌细胞Per2过表达对细胞存活率的影响(n=10,x±s) |
3 讨论 3.1 心肌细胞死亡成为HF的主要原因
随着全球人口老龄化,HF患病率及死亡风险保持升高趋势[13]。HF俨然成为一个严重的临床和公共卫生问题,因此,针对HF发病机制的研究尤为重要。研究表明,心肌细胞死亡可能是HF逐年升高的关键因素之一。缺血、病毒感染等多种因素造成心肌细胞死亡会导致细胞大量丢失,收缩力下降,就有可能会导致HF[3]。但参与HF发生发展的具体分子机制尚未阐明。
3.2 β1-AA促进心肌细胞死亡临床数据表明,HF患者血清中存在持续激活的β1-AA[4]。研究报道,β1-AA作为G蛋白偶联受体自身抗体(GPCR-AAB)家族成员之一,在HF病程进展中发挥重要致病作用[14]。通过免疫吸附法清除HF患者血清中的β1-AA,其心功能大大改善[15],提示β1-AA与HF密切相关。研究表明,β1-AA与心肌细胞膜表面的β1-AR结合,激活Gs-AC-cAMP-PKA经典信号通路,引起心肌细胞死亡。外源性加入β1-AR-EC Ⅱ并没有整合在细胞膜上发挥激活下游信号的作用,而是利用抗原抗体中和法来中和β1-AA从而逆转β1-AA引发的后续效应[16]。本研究首先观察β1-AA对H9c2心肌细胞死亡的影响,结果发现,β1-AA可明显抑制心肌细胞的存活率,进一步采用β1-AR抗原肽段中和β1-AA的作用可有效逆转β1-AA诱导的心肌细胞死亡。这与本研究课题组之前的研究结果一致[17]。接下来,本研究进一步探究β1-AA诱导心肌细胞死亡的机制。
3.3 昼夜节律紊乱成为HF发生的危险因素之一流行病学研究表明,人类发生心血管事件不良反应的风险在清晨时分最高,下午和傍晚降低[6]。并且发生的每日节律至少受以生物钟基因为主的内源性昼夜节律系统调控。昼夜节律是指生命活动以24 h为周期的变动,心血管系统也受昼夜节律的影响[18]。当昼夜节律发生紊乱,原本受正常内源性节律系统调控的心脏修复周期被打乱了,心肌细胞的功能也无法正常维持,大大增加了HF风险,原有HF也会加重[8]。且有研究表明,下丘脑视交叉上核(superchiasmatic nucleus,SCN)是哺乳动物生理和行为的内源性节律主调控中枢,通过接收光信号可协调心肌细胞节律与环境同步化,进而维持心脏自身的昼夜变化[19]。尽管对心肌细胞中昼夜节律振荡的研究越来越多,但是昼夜节律影响HF的具体机制还有待阐明。
3.4 Per2在昼夜节律调控起关键作用在哺乳动物中,昼夜节律是由核心时钟基因协调表达产生和调节的,其分子机制是由一系列时钟基因调控的转录翻译反馈环路,包括CLOCK、BMAL1、Per和Cry等。有研究发现,钟基因Per2作为生物钟转录翻译反馈环路的核心元件,通过和其他钟基因协同调控心血管系统的昼夜节律活动[20]。细胞质生成的Per2蛋白不断积累成一定程度,再与Cry等其他蛋白形成复合物起作用,抑制BMAL1/CLOCK异二聚体的转录活性,从而负反馈抑制靶基因Per2的表达。最终在负反馈元件Per2的驱动下形成24 h左右的周期循环,进而维持机体昼夜节律的正常运转。
3.5 Per2参与β1-AA诱导的心肌细胞死亡有研究发现,G蛋白偶联受体自身抗体(GPCR-AAB)可以通过与各种信号分子相互作用,进而调节分子振荡器相关钟基因的表达以及时钟的相位、周期,最终将哺乳动物中内源性昼夜节律振荡器与外部时间同步[21]。也有研究发现,β-AR非选择性激动剂异丙肾上腺素可显著改变成骨细胞Per2的mRNA节律性表达[11]。而蛋白质是基因的终产物和功能的执行者,那么,同样作为β1-AR激动剂的β1-AA是否可以影响Per2蛋白的节律性表达进而影响昼夜节律,最终诱导心肌细胞死亡呢?在本研究中,首先采用地塞米松同步化心肌细胞4 h,再随机分为对照组和β1-AA处理组,按照CT0、CT4、CT8、CT12、CT16及CT20等6个时间点依次收样,最后通过Western blot检测H9c2心肌细胞Per2蛋白的节律性表达水平。实验结果发现,对照组H9c2心肌细胞Per2的表达在CT4和CT12出现低谷,在CT8和CT16出现高峰,整体表达呈现两峰趋势,并且JTK_CYCLE算法分析其具有明显昼夜节律波动。而β1-AA作用下心肌细胞Per2蛋白节律性表达明显被抑制,这种抑制作用在CT8和CT16最为明显。JTK_CYCLE算法分析P值大于0.05,Per2蛋白表达水平节律波动不显著。以上结果证实,β1-AA可明显抑制心肌细胞Per2蛋白的节律性表达。然而Per2蛋白节律性表达降低是否参与β1-AA诱导的H9c2心肌细胞死亡这一过程,还需要进一步探讨。因此,我们进一步采用Per2敲低和Per2过表达慢病毒分别感染H9c2心肌细胞,然后通过RT-PCR和Western blot实验证明慢病毒成功抑制心肌细胞Per2的表达。接下来,通过CCK-8法检测细胞存活率。结果发现,敲低细胞Per2的表达后,H9c2心肌细胞存活率出现明显下降,加速心肌细胞死亡。对感染的细胞进行β1-AA处理,与空病毒感染相比,Per2敲低的细胞存活率进一步降低。当Per2过表达成功感染心肌细胞时,CCK-8实验结果显示,与对照组相比,Per2过表达后心肌细胞存活率显著增加。与β1-AA干预的空病毒感染细胞相比,Per2过表达可明显逆转β1-AA诱导的心肌细胞存活率下降。有研究发现,当Per2过表达时能够改善心脏功能并减少心肌梗死区域,能够抑制心肌梗死后缺氧引起的心肌细胞凋亡[22],与本研究结果类似。这提示Per2蛋白的表达抑制在β1-AA诱导心肌细胞死亡这一过程中起关键作用。
时钟基因调控的昼夜节律与HF之间的紧密联系已成为近几年心血管疾病发病机制研究的焦点,本研究试图寻找β1-AA、昼夜节律变化及HF三者之间的联系,证实了β1-AA确实可以抑制Per2蛋白表达促进心肌细胞死亡,参与HF的发生发展。其研究意义在于将Per2作为一个靶点,从分子节律的角度出发为临床治疗心血管及其他疾病提供了希望。
| [1] |
MOSTERD A, HOES A W. Clinical epidemiology of heart failure[J]. Heart, 2007, 93(9): 1137-1146. |
| [2] |
中国心血管健康与疾病报告2019概要[J]. 中国循环杂志, 2020, 35(9): 833-854. DOI: CNKI: SUN:ZGXH.0.2020-09-001. The Writing Committee of the Report on Cardiovascular Health Diseases in China. Report on Cardiovascular Health and Diseases in China 2019: an updated summary[J]. Chin Circ J, 2020, 35(9): 833-854. DOI: CNKI: SUN:ZGXH.0.2020-09-001. |
| [3] |
NAKAYAMA H, CHEN X W, BAINES C P, et al. Ca2+- and mitochondrial-dependent cardiomyocyte necrosis as a primary mediator of heart failure[J]. J Clin Invest, 2007, 117(9): 2431-2444. |
| [4] |
李笑, 杜芸辉, 左骞, 等. β1肾上腺素受体自身抗体及其在心力衰竭发生发展中的作用[J]. 生理科学进展, 2013, 44(5): 385-389. DOI: CNKI:SUN:SLKI.0.2013-05-018. LI X, DU Y H, ZUO Q, et al. β1-adrenoceptor autoantibodies and their role in the occurrence and development of heart failure. [J]. Prog Physiol Sci, 2013, 44(5): 385-389. DOI: CNKI:SUN:SLKI.0.2013-05-018. |
| [5] |
LIU H R, ZHAO R R, JIAO X Y, et al. Relationship of myocardial remodeling to the genesis of serum autoantibodies to cardiac beta1-adrenoceptors and muscarinic type 2 acetylcholine receptors in rats[J]. J Am Coll Cardiol, 2002, 39(11): 1866-1873. |
| [6] |
BUURMA M, VAN DIEMEN J J K, THIJS A, et al. Circadian rhythm of cardiovascular disease: the potential of chronotherapy with aspirin[J]. Front Cardiovasc Med, 2019, 6: 84. |
| [7] |
LEWIS R, HACKFORT B T, SCHULTZ H D. Chronic heart failure abolishes circadian rhythms in resting and chemoreflex breathing[J]. Adv Exp Med Biol, 2018, 1071: 129-136. |
| [8] |
LI X, XUE Q C, WANG M Y, et al. Adherence to a healthy sleep pattern and incident heart failure: a prospective study of 408 802 UK biobank participants[J]. Circulation, 2021, 143(1): 97-99. |
| [9] |
WANG Q Q, AO Y R, YANG K, et al. Circadian clock gene Per2 plays an important role in cell proliferation, apoptosis and cell cycle progression in human oral squamous cell carcinoma[J]. Oncol Rep, 2016, 35(6): 3387-3394. |
| [10] |
ZHANG X Y, WANG L, YAN W J, et al. Period 2-induced activation of autophagy improves cardiac remodeling after myocardial infarction[J]. Hum Gene Ther, 2020, 31(1/2): 119-128. |
| [11] |
HIRAI T, TANAKA K, TOGARI A. β-adrenergic receptor signaling regulates Ptgs2 by driving circadian gene expression in osteoblasts[J]. J Cell Sci, 2014, 127(Pt 17): 3711-3719. |
| [12] |
孙聪, 郭帅, 宁娜, 等. 脂联素抑制β1-肾上腺素受体自身抗体诱导的大鼠H9c2心肌细胞自噬流下降[J]. 中国病理生理杂志, 2020, 36(5): 796-802. SUN C, GUO S, NING N, et al. Adiponectin inhibits decrease in autophagy of rat H9c2 cardiomyocytes induced by β1-adrenergic receptor autoantibodies[J]. Chin J Pathophysiol, 2020, 36(5): 796-802. |
| [13] |
殷伟贤. 全球心力衰竭现状[J]. 中国心血管杂志, 2018, 23(1): 11-14. YIN W X. Global status report on heart failure[J]. Chin J Cardiovasc Med, 2018, 23(1): 11-14. |
| [14] |
WALLUKAT G, SCHIMKE I. Agonistic autoantibodies directed against G-protein-coupled receptors and their relationship to cardiovascular diseases[J]. Semin Immunopathol, 2014, 36(3): 351-363. |
| [15] |
BABA A, AKAISHI M, SHIMADA M, et al. Complete elimination of cardiodepressant IgG3 autoantibodies by immunoadsorption in patients with severe heart failure[J]. Circ J, 2010, 74(7): 1372-1378. |
| [16] |
HABERLAND A, WALLUKAT G, BERG S, et al. Neutralization of pathogenic beta1-receptor autoantibodies by aptamers in vivo: the first successful proof of principle in spontaneously hypertensive rats[J]. Mol Cell Biochem, 2014, 393(1/2): 177-180. |
| [17] |
贾微微, 宁娜, 孙聪, 等. 自噬标志物LC3的节律表达破坏参与β1-AA诱导的H9c2大鼠心肌细胞死亡[J]. 中国病理生理杂志, 2021, 37(1): 10-17. JIA W W, NING N, SUN C, et al. Destruction of autophagy marker LC3 rhythm is involved in β1-AA-induced H9c2 rat cardiomyocyte death[J]. Chin J Pathophysiol, 2021, 37(1): 10-17. |
| [18] |
DURGAN D J, YOUNG M E. The cardiomyocyte circadian clock: emerging roles in health and disease[J]. Circ Res, 2010, 106(4): 647-658. |
| [19] |
FONG C K, HEARN T, WEBB S E, et al. Daily rhythms in heartbeat rate are intrinsic to the zebrafish heart[J]. Curr Biol, 2021, 31(5): R239-R240. |
| [20] |
VUKOLIC A, ANTIC V, VAN VLIET B N, et al. Role of mutation of the circadian clock gene Per2 in cardiovascular circadian rhythms[J]. Am J Physiol Regul Integr Comp Physiol, 2010, 298(3): R627-R634. |
| [21] |
BAILES H J, MILOSAVLJEVIC N, ZHUANG L Y, et al. Optogenetic interrogation reveals separable G-protein-dependent and-independent signalling linking G-protein-coupled receptors to the circadian oscillator[J]. BMC Biol, 2017, 15: 40. |
| [22] |
ZHANG X Y, WANG L, YAN W J, et al. Period 2-induced activation of autophagy improves cardiac remodeling after myocardial infarction[J]. Hum Gene Ther, 2020, 31(1/2): 119-128. |




