2. 400038 重庆 陆军军医大学(第三军医大学) 医学心理系军事认知心理学教研室;
3. 646099 四川 泸州, 西南医科大学:基础医学院生理学教研室
2. Department of Military Cognitive Psychology, Faculty of Medical Psychology, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. Department of Physiology, School of Basic Medical Sciences, Southwest Medical University, Luzhou, Sichuan Province, 646099; China
自闭症谱系障碍(autism spectrum disorder,ASD)是影响社交能力、认知和感觉运动功能的神经发育障碍综合征,具有学习记忆功能障碍、重复刻板样行为等特征[1]。其确切病因目前仍不清楚,但越来越多的证据表明自闭症相关行为的异常与海马神经发生相关[2-3]。通过结构和功能磁共振成像(magnetic resonance imaging, MRI),观察到ASD患者大脑神经元生长延迟和神经元发育受限[4]。在哺乳动物中,海马齿状回的亚颗粒区(subgranular zone, SGZ)在成年后将继续保留一定数量的神经前体细胞(neural precursor cells,NPCs),具有终生保持生成神经元的能力。此外,无论是人类还是ASD小鼠模型中,海马神经发生缺陷都与ASD发病有关[5],促进海马神经发生的方法也能有效地缓解ASD样行为。因此,海马区神经发生缺陷可能是ASD关键病理基础,改善海马神经发生可能是治疗ASD的有效靶点。
《神农本草经》中记载的柴胡及其复方在临床被广泛应用于抑郁症的治疗。其提取物——柴胡总皂苷可提高小鼠海马BDNF及TrkB的表达,提示柴胡可能通过上述途经促进神经突触的发生,改善抑郁样行为及学习记忆障碍[6]。此外,柴胡可通过增加神经生长因子和脑源性神经营养因子改善抑郁症[7]。柴胡注射液可通过改善脑组织抗氧化能力提高小鼠学习记忆功能[8]。据此,我们推测柴胡口服液可能通过促进海马神经发生来改善自闭症模型小鼠BTBR的行为缺陷。尽管自闭症发于婴幼儿时期,但若未及时发现,其成年期生存能力仍很低。另外,由于缺乏有效治愈自闭症的药物或疗法,即使早期干预,成年自闭症患者仍有很多存在智力缺陷和行为异常的表现。因此,寻找成年期有效治疗自闭症的药物刻不容缓。本研究采用BTBR自闭症模型小鼠,验证柴胡口服液干预能否改善成年BTBR小鼠自闭样行为和海马神经发生障碍,为柴胡口服液临床应用于自闭症的治疗提供基础研究数据。
1 材料与方法 1.1 主要试剂柴胡口服液为单味药柴胡所制的中药制品产自洛阳顺势药业有限公司(批号:20190102,规格:10 mL/支) 抗体购自英国Abcam公司,DCX抗体购自美国Santa Cruz Biotechnol-ogy公司,SOX2抗体购自英国Abcam公司,GFAP抗体购自美国Millipore公司,荧光二抗购自美国Jackson公司。
1.2 实验动物及分组BTBR自闭症小鼠模型BTBR T+ Itpr3tf/J[编号002282,7~8周龄,体质量(27.7±1.42)g,购于美国杰克逊实验室],是一种通过对Disc1、Itpr3、T+ 3个基因进行编辑得到的特发性自闭症模型鼠,不仅表现出学习记忆障碍、社交能力障碍和增加的重复刻板行为,而且在新生和成年期间海马神经发生显著减少[1]。C57BL/6小鼠,7~8周龄,体质量(24.72±1.35)g,购买于陆军军医大学实验动物中心。所有实验动物饲养于陆军军医大学实验动物中心标准清洁动物房,昼夜交替,温度恒定(18-22℃),保证自由充分取食及饮水。
为避免产仔数的影响,实验均使用雄性小鼠,利用随机数字表法将每窝最多2只雄鼠用以实验分组,分为4组(每组4只) : C57对照组(C57SAL)、C57药物处理组(C57CHOL)、BTBR对照组(BTBRSAL)、BTBR药物处理组(BTBRCHOL)。药物处理组小鼠均予以柴胡口服液(10 μL/g) 灌胃给药,1次/d,共计7 d;对照组灌胃给予等体积的生理盐水。所有实验程序按照陆军军医大学伦理审批要求和实验动物保护原则进行。
1.3 行为学检测 1.3.1 理毛实验将每只小鼠单独置于干净透明的标准鼠笼中,距离鼠笼20 cm处用摄像机记录20 min视频。前10 min为小鼠适应阶段,最后10 min为统计时间,由经验丰富的实验员在不知道分组的情况下统计每只小鼠重复理毛(小鼠用手梳理头部、身体、尾巴)时间。
1.3.2 埋珠实验实验在27 cm×16.5 cm×12.5 cm的标准鼠笼中进行。笼子里放入2 cm深的山杨木屑,用20颗直径为15 mm的黑色玻璃弹珠以4×5的网格状轻放在表面,并统计30 min内小鼠的埋珠数量(以埋掉体积的3/4为标准)。
1.3.3 开场实验实验在灰色树脂装置(40 cm×40 cm×40 cm)中进行,用以检测小鼠的一般运动能力。先将小鼠置于开场的中央区域,然后在整个装置中自由探索30 min。使用Ethovision 11.0记录小鼠30 min的活动,并分析其运动路程。
1.3.4 新物体识别在实验前1 d, 将小鼠放置于灰色树脂装置中适应30 min。考虑到小鼠的避光性,实验所用新旧物品均放置在避光处。实验分为两个阶段:第1个10 min的习得阶段为第一阶段,两个几乎相同的对象(旧物体O)分别放置在箱子一侧两个角落, 小鼠可自由探索;间隔2 h后进行第2次10 min的测试,将其中一个旧物体O更换为新物体N(大小与O相似,但形状、颜色和纹理均不同)以确定小鼠的目标记忆能力。用诺达斯软件Ethovision 11.0记录小鼠探索熟悉物体(tO)和新物体(tN)的时间,计算识别指数(discrimination index,DI),DI=tN/(tN+tO)×100%。
1.4 免疫荧光染色行为学检测结束后, 小鼠经心灌注取脑。将脑组织置于4%多聚甲醛(4%PFA)中固定48 h后转移至蔗糖PFA(30%蔗糖+4%PFA) 中充分脱水48 h。收取30 μm厚度的脑组织切片于防冻液中,-20 ℃保存备用。选取适当脑组织切片,用0.01 mol/L PBS漂洗3次, 5 min/次,后置于0.3% Triton X-100, 37 ℃处理1 h。分别加入一抗: 兔来源NeuN(1 ∶200),兔来源DCX(1∶200),鼠来源GFAP(1 ∶500),兔来源SOX2(1 ∶500),37 ℃温箱孵育2 h,4℃孵育过夜。二抗分别为488抗小鼠、cy3抗兔(1 ∶500),37 ℃孵育2 h后,DAPI复染10 s,晾干后荧光封片剂封片。每组各3只小鼠,每只小鼠选取海马位置相似的3张大脑切片。
1.5 统计学分析采用SPSS 24.0统计软件,体质量检测结果采用重复测量方差分析,其余实验结果采用双因素方差分析(ANOVA),以基因型和药物处理作为被试之间的两个因素,组间两两比较采用LSD t检验。检验水准: α=0.05。
2 结果 2.1 柴胡口服液治疗对成年期小鼠运动能力和体质量变化的影响运动探索行为和体质量变化可能会混淆重复刻板行为。因此,用开场实验检测小鼠运动能力,并在给药期间记录小鼠每天的体质量变化。在30 min总测试的时间中,用开场实验药物处理后,各组间总运动距离无药物效应和基因型药物交互效应,然而却有显著的基因型效应[F(1, 12) = 14.995, P < 0.05,图 1A、B]。LSD事后检验显示,与C57对照组比较,BTBR对照组的总运动距离更长,差异有统计学意义(P < 0.05),而BTBR药物处理组小鼠的运动状态有向C57对照组改变的趋势,但差异无统计学意义(图 1A、B)。体质量分析结果(图 1C)显示,在给药期间BTBR小鼠组间差异无统计学意义;不同基因型给药的第1~5天体重变化差异为(P < 0.05),6~7天为(P < 0.01)。且同龄的BTBR对照组小鼠体质量都高于C57对照组。提示柴胡口服液治疗对成年期BTBR小鼠运动能力和体质量变化无显著影响。
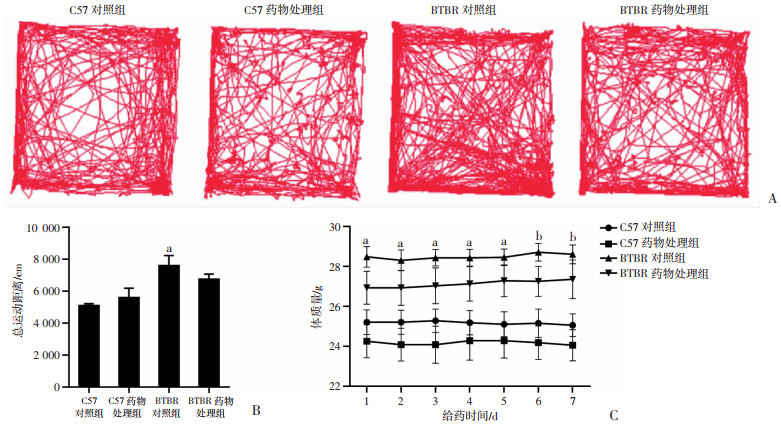
|
|
a:P < 0.05,b: P < 0.01,与C57对照组比较 A:开场实验代表性运动轨迹图(30 min社交时间内小鼠运动路线);B、C分别为运动总路程与体质量变化统计图(n=4,x±s) 图 1 柴胡口服液治疗对BTBR小鼠运动能力和体质量的影响 |
2.2 柴胡口服液治疗可改善成年期BTBR小鼠短期记忆缺陷
新物体识别实验用于检测柴胡口服液治疗对成年期BTBR小鼠短时学习记忆的作用(图 2A)。双因素方差分析结果显示, 双因素方差分析揭示各组的识别指数间无基因型药物交互效应[F(1, 12)=2.516, P=0.139],但存在显著的药物效应[F(1, 12)=7.277, P < 0.05]和基因型效应[F(1, 12)=100.418, P < 0.05]。LSD事后检验显示(图 2B),与BTBR对照组相比, 柴胡口服液治疗后成年期BTBR药物处理组降低的新物体识别指数得到提升(P < 0.05),提示BTBR小鼠受损的认知能力得到恢复。
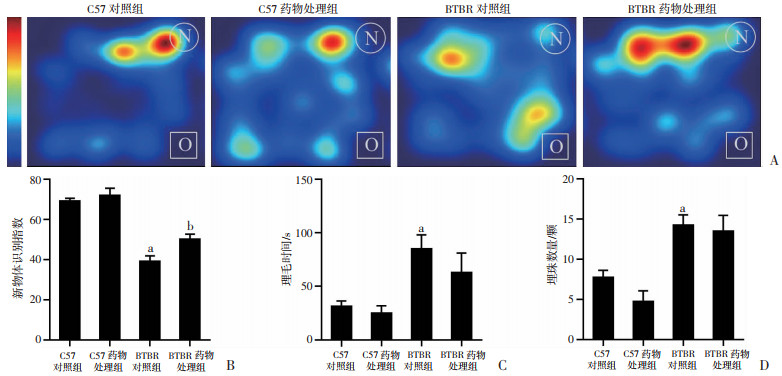
|
|
a: P < 0.01, 与C57对照组比较;b: P < 0.05,与BTBR对照组比较 A:新物体识别代表性热图10 min时间内受试小鼠所处位置和持续时间,N和O分别代表新物体和旧物体;B、C、D分别为新物体识别系数、理毛时间、埋珠数量统计图(n=4,x±s) 图 2 柴胡口服液对各组小鼠短期记忆缺陷的影响 |
理毛(图 2C)和埋珠(图 2D)实验用于检测BTBR小鼠自闭症样重复刻板行为。双因素方差分析显示, 各组的理毛时间和埋珠数量基因型效应差异具有统计学意义[F(1, 12)=14.715, P < 0.05;F(1, 12)=29.928, P < 0.05],而药物效应和基因型药物交互效应差异均无统计学意义,LSD事后检验显示,理毛实验(图 2C)中BTBR药物处理组有改善趋势但差异无统计学意义,而埋珠实验(图 2D)则无改善趋势。提示柴胡口服液治疗对成年期BTBR小鼠异常重复刻板行为无显著改善作用。
2.3 柴胡口服液治疗后成年BTBR小鼠海马齿状回神经元阳性细胞数量增加NeuN抗体特异性地与神经元细胞核的抗原结合(图 3A),且只在趋于成熟的神经元中表达。如图 3B中结果显示:双因素方差分析揭示了各组的神经元阳性细胞数存在显著的药物效应[F(1, 72)=4.962, P < 0.05]和基因型效应[F(1, 72)=43.58, P < 0.01]。LSD事后检验显示(图 3B),与BTBR对照组相比柴胡口服液治疗后成年期BTBR小鼠降低的神经元阳性细胞数得到提升(P < 0.01),提示柴胡口服液治疗后能提高成年期BTBR小鼠海马成熟神经元数量。
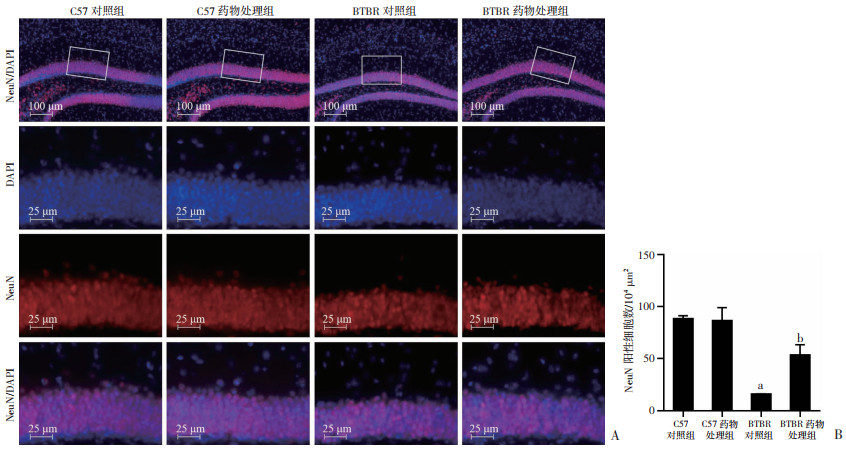
|
| A: 免疫荧光染色检测小鼠海马齿状回成熟神经细胞表达; B: 小鼠海马齿状回NeuN阳性细胞密度(n=3,x±s) a: P < 0.01,与C57对照组比较; b: P < 0.01,与BTBR对照组比较 图 3 柴胡口服液治疗后BTBR小鼠海马成熟神经元数量提高 |
2.4 柴胡口服液治疗后BTBR小鼠海马齿状回颗粒下区DCX阳性细胞数量增加
DCX是一种早期的神经元标记物,能检测海马DG区新生神经元数量。经观察各组DCX阳性细胞(图 4A)主要分布在海马齿状回颗粒下区(SGZ),C57小鼠DCX横贯海马齿状回颗粒细胞层。双因素方差分析结果显示(图 4B),各组的新生神经元阳性细胞数量存在显著的药物效应[F(1, 32)=5.935, P < 0.05]和基因型效应[F(1, 32)=11.599, P < 0.05],而无显著基因型药物交互效应。LSD事后检验显示(图 4B),与BTBR对照组相比成年期柴胡口服液治疗后BTBR小鼠降低的新生神经元得到改善(P < 0.05),提示柴胡注射液治疗促进成年期BTBR海马齿状回颗粒下区新生神经细胞增殖。
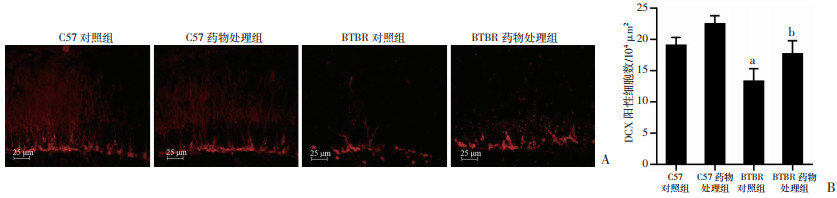
|
| A: 免疫荧光染色检测小鼠海马齿状回新生神经细胞增殖能力; B: 小鼠海马齿状回DCX阳性细胞密度(n=3,x±s) a: P < 0.01,与C57对照组比较; b: P < 0.05,与BTBR对照组比较 图 4 柴胡注射液治疗促进BTBR小鼠海马齿状回颗粒下区新生神经细胞增殖 |
2.5 成年期柴胡口服液治疗有利于BTBR小鼠海马神经干细胞增殖
SOX2是诱导人类和小鼠多能干细胞的初始因子。在干细胞和前体细胞中都有表达,在成年海马中,海马齿状回颗粒下区(SGZ)的细胞增殖减少可能是由于神经干细胞(NSCs)的减少。NSCs主要包括2种类型: SOX2和GFAP双阳性(SOX2+/GFAP+)细胞1型,SOX2阳性和GFAP阴性(SOX2+/GFAP-)细胞2型(图 5A)。为了探讨对多能NPCs的治疗效果,采用了SOX2和GFAP双标记,结果表明,各组(SOX2+/GFAP+)细胞1型存在显著的药物效应[F(1, 68)=6.203, P < 0.05]、基因型效应[F(1, 68)=18.209, P < 0.05]和基因型药物交互效应[F(1, 68)=7.074, P < 0.05,图 5B]。LSD事后检验显示,与BTBR对照组相比,BTBR药物处理组小鼠细胞1型的降低得到改善(P < 0.05,图 5B);同时,各组的(SOX2+/GFAP-)细胞2型(图 5C)无基因型药物交互效应和药物效应,但存在显著的基因型效应[F(1, 68)=21.577, P < 0.01]。LSD事后检验显示(图 5C),与BTBR对照组相比成年期柴胡口服液治疗后BTBR小鼠降低的细胞2型得到改善(P < 0.05);柴胡口服液治疗显著增加了成年BTBR小鼠海马SGZ区SOX2和GFAP共同标记的神经干细胞数量以及SOX2阳性细胞数量。结果提示柴胡口服液治疗有利于成年期BTBR小鼠海马神经干细胞增殖。
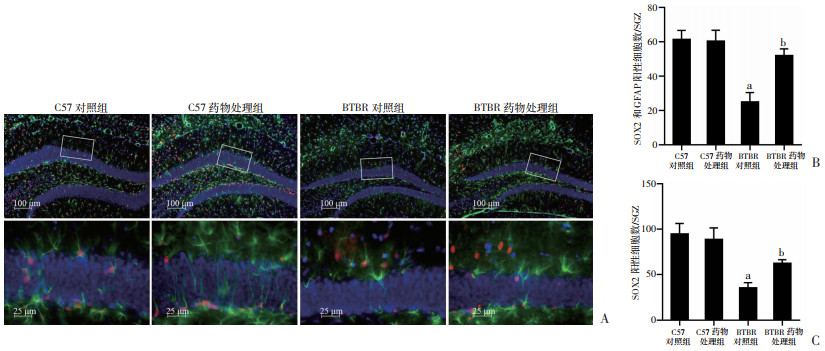
|
|
a:P < 0.01,与C57对照组比较; b: P < 0.05,与BTBR对照组比较 A: 免疫荧光染色检测各组海马齿状回神经干细胞分布;B:各组海马齿状回SOX2和GFAP共同标记的阳性细胞数量;C:各组海马齿状回SOX2阳性细胞数量 图 5 柴胡口服液治疗促进成年BTBR小鼠海马神经干细胞增殖(n=3,x±s) |
3 讨论
随着自闭症患病率的逐年升高,自闭症给社会、家庭及患者自身均带来了沉重的负担。临床上自闭症的治疗主要以行为干预为主。在美国,自闭症患者成年时将从特殊教育过渡到社区护理,但整个过程依然缺乏有效的药物治疗方法[10]。因此,探究ASD的药物防治措施探索刻不容缓。
许多研究表明,海马是ASD治疗的重要靶点。MRI证据显示,自闭症患者和成年健康对照组相比在海马体DG区域存在明显的解剖异常[11]。此外,尸检报告显示,ASD患者脑内神经发生和成熟异常,神经细胞迁移异常[14]。成年海马神经发生受损不仅导致社交能力异常,还增加了自闭症特有的重复刻板样行为[12],而海马神经发生的提高往往伴有自闭症行为改善[13]。柴胡是中医临床上常用于治疗神经系统疾病的草药之一,尽管前期研究结果并未直接表明柴胡能够改善海马的神经发生,但柴胡注射液通过改善脑组织抗氧化能力可提高小鼠学习记忆功能,以及通过增加神经生长因子和脑源性神经营养因子改善抑郁症[7]。因此本文旨在探究柴胡能否改善自闭症海马的神经发生和自闭症样行为。
本研究使用BTBR自闭症模型小鼠,探究柴胡口服液能否通过促进BTBR小鼠海马神经发生,从而改善BTBR小鼠自闭样行为。结果显示,柴胡口服液能够显著提高新物体识别实验中BTBR小鼠的短期记忆功能,增加海马齿状回DCX、NeuN标记的新生及成熟神经元数量,以及Sox2和GFAP共标的神经干细胞数量。研究结果与国内外研究结论具有一致性,海马神经元数量的提高同时伴随着自闭症样学习记忆能力的改善。而柴胡口服液对于BTBR小鼠重复刻板行为、运动功能障碍的改善及体质量无明显影响。理毛实验中BTBR药物处理组有改善趋势但差异无统计学意义,而埋珠实验则无改善趋势。提示药物处理对自闭症样重复刻板行为改善不显著。开场实验中,BTBR药物处理组的运动距离与BTBR处理组相比也无显著差异。给药期间对小鼠体质量的检测结果显示,BTBR药物处理后相比BTBR对照组无显著差异。但其中值得注意的是成年期在相同年龄下BTBR组相比C57组体质量显著增加,与前期研究结论类似[9, 15]。
前期研究表明,在免疫系统被感染或损伤以及严重或慢性应激条件强烈激活的情况下,胶质细胞和其他大脑免疫细胞改变其形态和功能,并分泌高水平的促炎细胞因子和前列腺素。这些炎性物质的产生打破了免疫过程中神经生理活动所需的平衡,并对学习记忆、神经发生和神经可塑性产生直接或间接的有害影响[16]。自闭症患者常处于慢性脑炎的状态[17-19],而柴胡口服液能够降低这些炎症介质的表达水平[20],这可能是柴胡口服液改善学习记忆的原因之一。但尚无直接证据证明柴胡介导炎症改善自闭症的神经发生与短期记忆,因此后期将就这一点进行深入探究。
柴胡是中医临床上常用于治疗神经系统疾病的草药之一,安全性高,成本低,转化难度低,但目前尚无用于自闭症的临床实验研究。若能明确柴胡治疗自闭症的作用机制及毒副作用,则可以为自闭症患者提供一种安全有效的治疗方案,提高患者的生存能力,减轻家庭和国家的负担。
| [1] |
CURRAIS A, FARROKHI C, DARGUSCH R, et al. Dietary glycemic index modulates the behavioral and biochemical abnormalities associated with autism spectrum disorder[J]. Mol Psychiatry, 2016, 21(3): 426-436. |
| [2] |
SCHALLMO M P, KOLODNY T, KALE A M, et al. Weaker neural suppression in autism[J]. Nat Commun, 2020, 11(1): 2675. |
| [3] |
ZHANG R Y, CAI Y L, XIAO R, et al. Human amniotic epithelial cell transplantation promotes neurogenesis and ameliorates social deficits in BTBR mice[J]. Stem Cell Res Ther, 2019, 10(1): 153. |
| [4] |
CANITANO R, PALLAGROSI M. Autism spectrum disorders and schizophrenia spectrum disorders: excitation/inhibition imbalance and developmental trajectories[J]. Front Psychiatry, 2017, 8: 69. |
| [5] |
GILBERT J, MAN H Y. Fundamental elements in autism: from neurogenesis and neurite growth to synaptic plasticity[J]. Front Cell Neurosci, 2017, 11(359). |
| [6] |
杨久山, 张楠, 宋铭晶, 等. 柴胡总皂苷对小鼠抑郁样行为及学习记忆障碍的改善作用[J]. 中国实验方剂学杂志, 2016, 22(24): 134-139. YANG J S, ZHANG N, SONG M J, et al. Effect of total saponins from bupleuri Radix on improvement in depression-like behavior and learning and memory ability in mice[J]. Chin J Exp Tradit Med Formulae, 2016, 22(24): 134-139. |
| [7] |
WANG X, FENG Q, XIAO Y, et al. Radix Bupleuri ameliorates depression by increasing nerve growth factor and brain-derived neurotrophic factor[J]. Int J Clin Exp Med, 2015, 8(6): 9205-9217. |
| [8] |
季吉, 董榕. 柴胡注射液对小鼠学习记忆功能的影响[J]. 南京医科大学学报(自然科学版), 2006, 26(12): 1183-1186. JI J, DONG R. Influence of Chaihu on learning and memory of mice[J]. J Nanjing Med Univ (Natural Sci), 2006, 26(12): 1183-1186. |
| [9] |
RESHETNIKOV V V, AYRIYANTS K A, RYABUSHKINA Y A, et al. Sex-specific behavioral and structural alterations caused by early-life stress in C57BL/6 and BTBR mice[J]. Behav Brain Res, 2021, 414: 113489. |
| [10] |
ANDERSON K A, ROUX A M, KUO A, et al. Social-ecological correlates in adult autism outcome studies: a scoping review[J]. Pediatrics, 2018, 141(Suppl 4): S306-S317. |
| [11] |
RUSSO F B, FREITAS B C, PIGNATARI G C, et al. Modeling the interplay between neurons and astrocytes in autism using human induced pluripotent stem cells[J]. Biol Psychiatry, 2018, 83(7): 569-578. |
| [12] |
RUSZNÁK K, CSEKÖ K, VARGA Z, et al. Long-term stress and concomitant marijuana smoke exposure affect physiology, behavior and adult hippocampal neurogenesis[J]. Front Pharmacol, 2018, 9: 786. |
| [13] |
STRAUSS K A, PUFFENBERGER E G, HUENTELMAN M J, et al. Recessive symptomatic focal epilepsy and mutant contactin-associated protein-like 2[J]. N Engl J Med, 2006, 354(13): 1370-1377. |
| [14] |
WEGIEL J, KUCHNA I, NOWICKI K, et al. The neuropathology of autism: defects of neurogenesis and neuronal migration, and dysplastic changes[J]. Acta Neuropathol, 2010, 119(6): 755-770. |
| [15] |
WANG L, CAI Y L, FAN X T. Metformin administration during early postnatal life rescues autistic-like behaviors in the BTBR T+ Itpr3tf/J mouse model of autism[J]. Front Behav Neurosci, 2018, 12: 290. |
| [16] |
YIRMIYA R, GOSHEN I. Immune modulation of learning, memory, neural plasticity and neurogenesis[J]. Brain Behav Immun, 2011, 25(2): 181-213. |
| [17] |
AHMAD S F, ANSARI M A, NADEEM A, et al. Toll-like receptors, NF-κB, and IL-27 mediate adenosine A2A receptor signaling in BTBR T + Itpr3 tf/J mice[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2017, 79(Pt B): 184-191. |
| [18] |
HEO Y, ZHANG Y B, GAO D H, et al. Aberrant immune responses in a mouse with behavioral disorders[J]. PLoS One, 2011, 6(7): e20912. |
| [19] |
TOSCANO C V A, BARROS L, LIMA A B, et al. Neuroinflammation in autism spectrum disorders: exercise as a "pharmacological" tool[J]. Neurosci Biobehav Rev, 2021, 129: 63-74. |
| [20] |
GUAN X F, WANG X Y, YAN K J, et al. UFLC-MS/MS determination and pharmacokinetic studies of six Saikosaponins in rat plasma after oral administration of Bupleurum Dropping Pills[J]. J Pharm Biomed Anal, 2016, 124: 288-293. |




