慢性乙型肝炎(chronic hepatitis B, CHB)患者HBeAg阳性往往代表更高比例的肝硬化和肝癌的发生率,其原因与HBeAg阳性的CHB患者肝内共价闭合环状DNA(cccDNA)复制及转录更活跃密切相关[1-2]。CHB的治疗目标是减少或延缓肝硬化失代偿、肝功能衰竭和肝细胞癌的发生率,从而改善患者生活质量,延长生存时间。HBeAg阴转是HBeAg阳性患者治疗的首要目标,实现HBeAg阴转后患者肝组织学可获得明显改善,肝硬化和肝癌的发生率明显降低[3]。因此,临床上针对此类患者应首先实现HBeAg的清除,然后进一步追求HBsAg血清学转换,进而实现临床功能治愈[4]。核苷(酸)类抗病毒药物(NAs)是目前应用最为广泛的抗病毒药物,尽管长期NAs治疗能够使肝内HBV DNA逐渐下降并持续低于检测下限,但HBeAg转阴率不足20%,大部分患者经治疗后处于HBeAg低定量水平的持续阳性状态[4-5]。与NAs相比,干扰素(interferon, IFN)能够有效抑制HBV转录并减少HBsAg和HBeAg等病毒蛋白的表达,同时还可以通过增强机体免疫细胞功能、促进细胞因子的表达以及诱导干扰素刺激基因(ISGs)的产生并经干扰素信号通路编码多种抗病毒蛋白等环节作用于HBV复制、转录等生物学过程,进而发挥抗病毒和免疫调节的双重作用[6-7]。
相关研究表明,采用IFN治疗的HBeAg阳性CHB患者,其治疗后HBeAg转阴率可达30%~40%,因此,相比于NAs,IFN的治疗价值更大[6-8]。然而IFN价格昂贵,不良反应众多,因此,在治疗前识别优势人群尤为重要。目前,临床已报道的IFN疗效预测指标包括HBsAg、HBV DNA、ALT等,这些指标在高病毒载量的患者中表现出较好的应用价值,但对经长期抗病毒治疗或处于低HBeAg定量的HBeAg阳性人群可能并不适用。血清前基因组RNA(pgRNA)和乙型肝炎核心相关抗原(HBcrAg)是两种HBV感染的新型血清标志物,与肝内cccDNA的相关性更强。最新的研究证实pgRNA和HBcrAg可作为预测指标用于CHB患者抗病毒治疗过程中疗效的评估,尤其对于HBeAg阳性且定量处于较低水平的CHB患者可能更具价值[9-10]。基于此,本研究旨在探讨pgRNA、HBcrAg在聚乙二醇干扰素-α(polyethylene glycol interferon-alfa, PEG-IFN-α)治疗的HBeAg阳性低水平的CHB患者中HBeAg清除的预测意义,由此筛选该人群的基线预测指标,从而指导临床HBeAg阳性低定量水平患者的抗病毒治疗。
1 资料与方法 1.1 病例资料选择就诊于本科门诊且接受聚乙二醇干扰素-α(polyethylene glycol interferon-alfa, PEG-IFN-α)治疗的HBeAg阳性低定量水平的CHB患者进行前瞻性研究。本项目已在中国临床试验注册中心注册,注册号:ChiCTR-ROC-16008735。本研究通过本院伦理委员会审查批准(2015年科研第28号)。纳入标准:①年龄18~65岁;②HBsAg持续阳性6个月以上,服用或未服用核苷(酸)类抗病毒药物,基线HBsAg<2 000 U/mL,HBV DNA<500 U/mL,基线HBeAg阳性且定量<50 S/CO,ALT≤2倍正常值上限;③患者及家属对本研究知情同意。排除标准:①临床医师认为存在合并PEG-IFN-α使用禁忌,如自身免疫性疾病等;②人体免疫缺陷病毒、丙型肝炎病毒和丁型肝炎病毒感染;③合并肝硬化、肝细胞癌等;④6个月内曾行免疫调节治疗;⑤已妊娠或近2年有妊娠计划的妇女。入组患者中,正在口服NAs的患者,包括恩替卡韦、替诺福韦或阿德福韦酯,采用联合用药方案,即在原治疗的基础上加用PEG-IFN-α,采用PEG-IFN-α-2a或PEG-IFN-α-2b每周1次皮下注射进行治疗,初治患者仅采用PEG-IFN-α治疗。计划总疗程至少48周,最终疗程及药物剂量由门诊医师根据患者具体病情决定,但不超过96周,若患者HBsAg和(或)HBeAg连续24周无明显变化,则停止PEG-IFN-α治疗。停药后对患者进行随访,常规每3个月返院复查1次,停药后随访时间≥48周。
1.2 方法 1.2.1 常规血清指标监测采用美国Abbott公司生产的ARCHITECT i2000sr型全自动免疫发光分析仪测定血清HBsAg、HBsAb、HBeAg、HBeAb水平,若HBsAg定量>250 U/mL,则按照1∶500比例稀释后再次检测;采用乙型肝炎病毒DNA定量检测试剂盒(荧光PCR法)检测血清HBV DNA水平(检测下限为50 U/mL);采用日本HITACHI公司生产的7600-020型全自动生化仪检测血清ALT、AST、TBiL水平;采用日本Sysmex公司生产的XT-2000i型全自动五分类血液分析仪检测血清WBC、RBC、PLT水平。
1.2.2 血清pgRNA检测采用乙型肝炎病毒前基因组RNA定量检测试剂盒(PCR-荧光探针法,广州海力特生物科技有限公司提供)检测患者血清pgRNA水平。检测前首先用核酸提取或纯化试剂提取、纯化病毒RNA,然后用试剂盒检测pgRNA水平,线性检测范围为(5×10~1×108)copies/mL,最低检测限为15 copies/mL。
1.2.3 血清HBcrAg检测采用基于LUMIPULSE G系统的乙型肝炎病毒核心相关抗原(HBcrAg)检测试剂盒(化学发光法,重庆金域医学检验所提供)检测血清HBcrAg水平。将样本血清中的目标蛋白解离,暴露在洗涤剂溶液中,60 ℃下预处理30 min,将完成预处理的样本静置5 min左右使其恢复常温,然后用LUMIPULSE G HBcrAg检测配制好的样本,操作遵循LUMIPULSE G系统操作手册进行,将样本及检测所需试剂放置指定位置。检测范围为3.0~7.0 log10 U/mL(1~10 000 kU/mL),若样本中的HBcrAg浓度超过7.0 log10 U/mL(10 000 kU/mL),则用健康人群的血清对样本进行稀释,然后重新检测。
1.3 观察指标根据停药时或随访过程中HBeAg是否转阴将患者分为HBeAg转阴组(HBeAg定量<1.00 COI,n=13)和HBeAg未转阴组(HBeAg≥1.00 COI,n=12)。患者一般资料包括年龄、性别、既往用药、治疗时间及随访时间;基线检测指标包括治疗前pgRNA、HBcrAg、HBsAg、HBsAb、HBeAg、HBeAb、HBV DNA及肝功能指标;治疗第12、24周及停止PEG-IFN-α治疗时检测pgRNA、HBcrAg,治疗及随访过程中每12周检测HBsAg、HBsAb、HBeAg、HBeAb、HBV DNA及肝功能指标,对于不规则的时间点,采用回归拟合缺失值法将缺失数值进行补全。
1.4 统计学分析采用SPSS 23.0、GraphPad Prism 8统计软件对数据进行分析处理,计数资料以频数(百分比)的形式表示,组间比较采用χ2检验;偏态分布计量资料采用中位数(四分位数间距)的形式表示,组间比较采用非参数检验,采用多因素Logistic回归分析及受试者工作特征曲线(ROC)评价各指标对HBeAg清除的预测价值,并计算出最佳临界值、灵敏度、特异度等。双侧检验P < 0.05为差异有统计学意义。
2 结果 2.1 基线情况25例PEG-IFN-α治疗的HBeAg阳性患者中,治疗12、24周以及治疗终点(>24~89周)时分别有7例(28.00%)、11例(44.00%)和13例(52.00%)患者实现HBeAg转阴,治疗终点至随访终点期间无HBeAg复阳病例。基线时转阴组和未转阴组在年龄、性别、HBsAg、HBeAg、HBV DNA、ALT、AST以及TBiL水平差异均无统计学意义,但两组基线pgRNA、HBcrAg水平则存在明显差异(P < 0.05),见表 1。
| 指标 | HBeAg未转阴组(n=12) | HBeAg转阴组(n=13) | t/z值 | P值 |
| 年龄/岁 | 34(30.00~45.00) | 31(29.50~42.00) | 0.623 | 0.650 |
| 性别 | ||||
| 男 | 10(83.33) | 11(84.62) | 0.008 | 0.930 |
| 女 | 2(16.67) | 2(15.38) | ||
| 既往用药 | ||||
| 初治 | 7(58.33) | 6(36.15) | 0.371 | 0.543 |
| 经治 | 5(41.67) | 7(53.85) | ||
| PEG-IFN-α治疗及随访/周 | ||||
| 治疗周期 | 53.00(48.00~72.00) | 59.00(43.00~74.00) | 0.138 | 0.894 |
| 随访周期 | 52.50(43.25~74.25) | 60.00(35.50~76.50) | 0.326 | 0.769 |
| pgRNA(log10 copies/mL) | 3.59(2.58~4.37) | 2.24(1.38~3.05) | 2.348 | 0.028 |
| HBcrAg(log10U/mL) | 5.55(5.23~5.78) | 5.00(4.80~5.65) | 2.170 | 0.041 |
| HBsAg(log10U/mL) | 2.83(2.32~3.21) | 2.81(2.05~3.03) | 0.707 | 0.503 |
| HBeAg(log10 COI) | 0.64(0.39~1.14) | 0.32(0.18~0.77) | 1.958 | 0.052 |
| HBV DNA(log10U/mL) | 1.70(1.70~1.70) | 1.70(1.70~1.70) | 1.041 | 0.728 |
| ALT/U·L-1 | 24.85(16.58~34.83) | 30.00(18.85~47.45) | 1.088 | 0.295 |
| AST/U·L-1 | 17.65(17.10~27.78) | 23.30(19.60~31.55) | 1.088 | 0.295 |
| TBiL/μmol·L-1 | 11.44(9.05~13.87) | 9.95(7.52~13.51) | 0.160 | 0.874 |
2.2 基线血清pgRNA、HBcrAg水平与其他血清学指标的相关性
基线pgRNA与HBcrAg、HBeAg具有显著相关性,相关系数分别是r=0.575(P=0.003)、r=0.496(P=0.012),但与HBV DNA(r=0.340,P=0.096)、HBsAg(r=0.346,P=0.090)相关性较弱。另外,基线血清HBcrAg与HBeAg(r=0.888,P < 0.001)及HBsAg(r=0.423,P=0.035)均呈现显著相关性,与HBV DNA(r=0.341,P=0.095)相关性较弱。
2.3 PEG-IFN-α治疗后部分血清学指标的动力学变化特点PEG-IFN-α治疗过程中,25例患者HBeAg整体水平较之基线水平呈下降趋势,不同时间点转阴组HBeAg水平下降幅度均高于未转阴组(P < 0.05)。基线至12周,pgRNA、HBsAg水平下降明显,其中转阴组pgRNA下降幅度高于未转阴组,差异有统计学意义(P < 0.05),12周后两指标下降速度趋于平缓。在整个治疗过程中,HBcrAg水平呈现缓慢下降趋势,仅在12~24周时转阴组表现出较大幅度的下降(P < 0.05),其他时间点均未见显著性变化,见图 1。
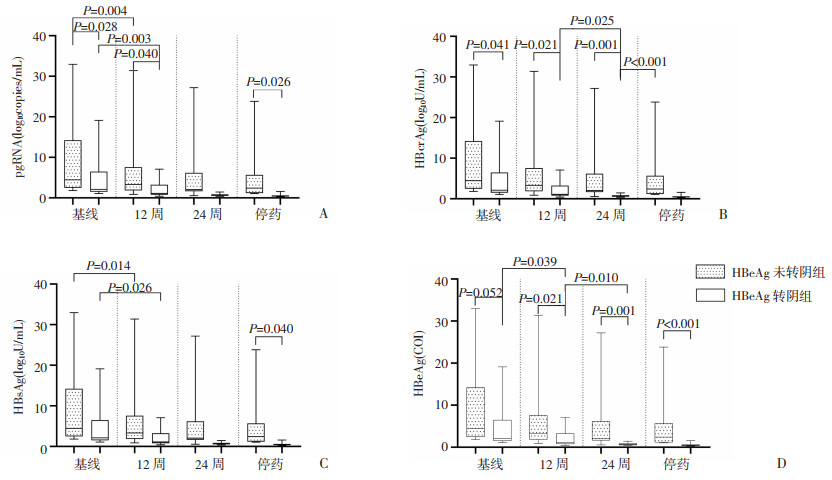
|
| A:pgRNA;B:HBcrAg;C:HBsAg;D:HBeAg 图 1 PEG-IFN-α治疗CHB过程中血清学指标的动力学变化 |
2.4 基线各病毒学指标预测HBeAg清除的单因素分析
将基线pgRNA、HBcrAg、HBsAg进行单因素Logistic回归分析,pgRNA与HBcrAg对治疗后HBeAg清除具有较好的预测价值,而HBsAg不是显著影响因素。见图 2、表 2。
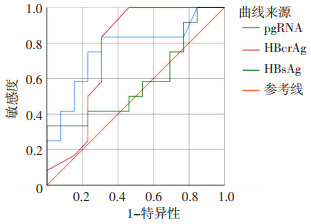
|
| 图 2 基线各指标预测HBeAg清除的ROC曲线 |
| 指标 | AUC | Cut off值 | 灵敏度(%) | 特异度(%) | 标准误 | 显著性 | 95%CI | |
| 下限 | 上限 | |||||||
| pgRNA(log10 copies/mL) | 0.763 | 2.42 | 69.23 | 83.33 | 0.102 | 0.010 | 0.552 | 0.908 |
| HBcrAg(log10U/mL) | 0.756 | 5.00 | 53.85 | 100.00 | 0.107 | 0.016 | 0.545 | 0.904 |
| HBsAg(log10U/mL) | 0.580 | 3.12 | 100.00 | 33.33 | 0.123 | 0.514 | 0.368 | 0.773 |
2.5 基线各病毒学指标预测HBeAg清除的多因素二元Logistic回归分析
将单因素分析有意义的指标pgRNA、HBcrAg以及文献报道中可能对HBeAg清除有预测价值的指标如HBsAg、ALT、性别等进行多因素二元Logistic回归分析,评价其对HBeAg清除的影响,结果显示,基线pgRNA水平是治疗后HBeAg清除的独立预测因素(P < 0.05),Exp(B)=0.448,AUC=0.763,截断值为2.42 log10 copies/mL。见表 3。
| 项目 | B | 标准误 | 瓦尔德 | 显著性 | Exp(B) | 95%CI | |
| 下限 | 上限 | ||||||
| pgRNA | -0.803 | 0.395 | 4.129 | 0.042 | 0.448 | 0.207 | 0.972 |
| 常量 | 2.318 | 1.207 | 3.688 | 0.055 | 10.159 | ||
3 讨论
在本研究中,25例接受PEG-IFN-α治疗的CHB患者达治疗终点时HBeAg清除率约为52.00%,这一数值略高于XU等[11]报道的35.80%和以亚裔为主的CHUANG等[8]研究报道的48%,可能与本研究中入组患者基线HBeAg处于较低水平且大部分患者采用了NAs序贯PEG-IFN-α的治疗策略有关。由此可见,约有一半的HBeAg阳性CHB患者接受抗病毒治疗后仍然不能实现HBeAg清除。因此,为提高经济社会效益,在PEG-IFN-α治疗前通过某些指标筛选优势人群具有至关重要的意义。
根据患者某些基线特征可有效识别PEG-IFN-α治疗的优势人群,既往已报道的基线特征包括:相对年轻(包括青少年)、A或B基因型、基线高ALT水平(2~10倍正常值上限)、低HBV DNA滴度、低HBsAg水平等[12-13]。经过长期的临床研究发现,上述指标在具体应用过程中仍存在一定局限性,表现在针对本研究所关注的人群并不适用,因此,临床上亟需探索新的预测应答的标志物,以提高PEG-IFN-α治疗的疗效[14]。理论上讲,肝内cccDNA的定量水平及活性可能与HBeAg水平及治疗后状态有关,但临床定量检测cccDNA需行肝活检,难以广泛开展,需要寻求其他血清学标志物间接反映cccDNA活性。
血清pgRNA和HBcrAg是两种目前关于CHB研究的新型血清学标志物。鲁凤民等[15-16]研究表明,在接受NAs治疗的患者中,虽然HBV DNA已降低至不可检测的水平,但这些患者的肝脏组织仍然有炎症和纤维化表现;进一步研究发现,血清pgRNA与肝脏炎症评分及纤维化评分均明显相关。本研究中几乎所有患者在治疗过程中HBV DNA均处于较低水平(低于检测下限),而基线pgRNA仍处于较高水平,且随着治疗疗程的延长,pgRNA水平逐渐降低,由此说明相比于HBV DNA,pgRNA作为反映cccDNA活性的替代指标价值更大[17-18]。HBcrAg由HBeAg、HBcAg和p22cr 3个蛋白组成,HBcrAg与HBeAg、HBV DNA相关性较强,在抗病毒治疗中下降更为缓慢,且与肝细胞内cccDNA转录活性密切相关,在疾病分期、预测NAs和PEG-IFN-α疗效、停药后复发以及预测HCC发生风险等方面均有相关研究[19]。本研究中,HBeAg转阴组与未转阴组在治疗前pgRNA、HBcrAg两项指标表现出显著区分价值,且两指标具有一定相关关系,Logistic回归分析证实基线血清pgRNA和HBcrAg对治疗结局具有预测价值,截断值分别为2.42 log10 copies/mL、5.00 log10 U/mL,AUC分别为0.763、0.756,其中基线pgRNA水平是治疗后HBeAg清除的最优预测因素(P < 0.05)。本研究中通过对治疗过程中两指标动力学研究发现,基线至12周,所有患者pgRNA水平明显下降,其中转阴组下降幅度高于未转阴组(P < 0.05),12周后pgRNA下降速度开始减慢,在整个治疗过程中,HBcrAg水平呈现平缓的下降趋势,仅转阴组在12~24周时表现出较大幅度的下降(P < 0.05),相比于pgRNA的早期快速下降,HBcrAg的下降较为平缓,这与MA等[20]的研究结果相符。由于本研究中治疗12、24周时已分别有7例(28.00%)和11例(44.00%)患者实现了HBeAg转阴,因此将12、24周HBcrAg水平作为治疗后HBeAg清除的预测因子价值有限。
本研究尚存在不足之处,首先,由于PEG-IFN-α价格昂贵、不良反应较多,应用人群有限,且能够完成既定疗程的患者较少,导致研究中可供观察的病例数较少;其次,未转阴组治疗过程中HBeAg明显下降的病例如继续延长疗程可能获得HBeAg清除,造成PEG-IFN-α疗效被低估。因此,下一步我们将继续扩大样本量,采用延长疗程、脉冲治疗等多种治疗方案,观察pgRNA、HBcrAg两指标的差异及变化特点验证其疗效预测价值。
综上所述,治疗前血清pgRNA在PEG-IFN-α治疗低HBeAg阳性CHB患者中具有较好的疗效预测价值,可作为干扰素治疗应答优势人群的筛选指标,而HBcrAg作为一项有潜力的研究指标,其预测价值需进一步扩大样本量进行论证。
| [1] |
中华医学会肝病学分会. 慢性乙型肝炎防治指南(2015年版)[J]. 中华实验和临床感染病杂志(电子版), 2015, 9(5): 570-589. Hepatology Branch of Chinese Medical Association. The guideline of prevention and treatment for chronic hepatitis B: a 2015 update[J]. Chin J Exp Clin Infect Dis(Electr Ed), 2015, 9(5): 570-589. |
| [2] |
LIN S M, YU M L, LEE C M, et al. Interferon therapy in HBeAg positive chronic hepatitis reduces progression to cirrhosis and hepatocellular carcinoma[J]. J Hepatol, 2007, 46(1): 45-52. |
| [3] |
中华医学会感染病学分会. 慢性乙型肝炎临床治愈(功能性治愈)专家共识[J]. 中华临床感染病杂志, 2019(4): 241-252. Infectious Diseases Branch of Chinese Medical Association. The expert consensus on clinical cure (functional cure) of chronic hepatitis B[J]. Chin J Clin Infest Dis, 2019(4): 241-252. |
| [4] |
TANG L S Y, COVERT E, WILSON E, et al. Chronic hepatitis B infection: a review[J]. JAMA, 2018, 319(17): 1802-1813. |
| [5] |
LAU G K, WANG F S. Uncover the immune biomarkers underlying hepatitis B e antigen (HBeAg) seroconversion: a need for more translational study[J]. J Hepatol, 2012, 56(4): 753-755. |
| [6] |
LIAW Y F, JIA J D, CHAN H L Y, et al. Shorter durations and lower doses of peginterferon Alfa-2a are associated with inferior hepatitis B e antigen seroconversion rates in hepatitis B virus genotypes B or C[J]. Hepatology, 2011, 54(5): 1591-1599. |
| [7] |
张文宏, 张大志, 窦晓光, 等. 聚乙二醇干扰素α治疗慢性乙型肝炎专家共识[J]. 中华肝脏病杂志, 2017, 25(9): 678-686. ZHANG W H, ZHANG D Z, DOU X G, et al. Consensus on pegylated interferon alpha in treatment of chronic hepatitis B[J]. Chin J Hepatol, 2017, 25(9): 678-686. |
| [8] |
CHUANG W L, JIA J, CHAN H L Y, et al. HBeAg seroconversion rates after five years of follow-up in patients treated with peginterferon Alfa-2a (40kd) in Neptune: final results of the son of Neptune long-term follow-up study[J]. J Hepatol, 2016, 64(2): S604. |
| [9] |
鲁凤民, 窦晓光, 张文宏, 等. 慢性乙型肝炎患者血清HBV RNA检测的临床意义[J]. 临床肝胆病杂志, 2018, 34(5): 934-938. LU F M, DOU X G, ZHANG W H, et al. Clinical significance of serum HBV RNA measurement in chronic hepatitis B patients[J]. J Clin Hepatol, 2018, 34(5): 934-938. |
| [10] |
WONG D K, SETO W K, CHEUNG K S, et al. Hepatitis B virus core-related antigen as a surrogate marker for covalently closed circular DNA[J]. Liver Int, 2017, 37(7): 995-1001. |
| [11] |
XU W, LI Q, HUANG C L, et al. Efficacy of peg-interferon-nucleoside analog sequential optimization therapy in HBeAg-positive patients with CHB[J]. Hepatol Int, 2021, 15(1): 51-59. |
| [12] |
WANG Y C, YANG S S, SU C W, et al. Predictors of response to pegylated interferon in chronic hepatitis B: a real-world hospital-based analysis[J]. Sci Rep, 2016, 6: 29605. |
| [13] |
LAMPERTICO P, MESSINGER D, CORNBERG M, et al. A genotype-specific baseline score predicts post-treatment response to peginterferon Alfa-2a in hepatitis B e antigen-negative chronic hepatitis B[J]. Ann Gastroenterol, 2018, 31(6): 712-721. |
| [14] |
RIJCKBORST V, HANSEN B E, CAKALOGLU Y, et al. Early on-treatment prediction of response to peginterferon Alfa-2a for HBeAg-negative chronic hepatitis B using HBsAg and HBV DNA levels[J]. Hepatol Baltim Md, 2010, 52(2): 454-461. |
| [15] |
鲁凤民, 王杰, 庄辉. HBV RNA病毒样颗粒的潜在临床意义[J]. 中华肝脏病杂志, 2016, 24(9): 641-642. LU F M, WANG J, ZHUANG H. Potential clinical significance of serum HBV RNA virus-like particles[J]. Chin J Hepatol, 2016, 24(9): 641-642. |
| [16] |
鲁凤民, 王杰, 陈香梅, 等. 乙型肝炎病毒RNA病毒样颗粒的发现及其对抗病毒治疗临床实践的潜在影响[J]. 中华肝脏病杂志, 2017, 25(2): 105-110. LU F M, WANG J, CHEN X M, et al. The potential use of serum HBV RNA to guide the functional cure of chronic hepatitis B[J]. Chin J Hepatol, 2017, 25(2): 105-110. |
| [17] |
VAN BÖMMEL F, VAN BÖMMEL A, KRAUEL A, et al. Serum HBV RNA as a predictor of peginterferon Alfa-2a response in patients with HBeAg-positive chronic hepatitis B[J]. J Infect Dis, 2018, 218(7): 1066-1074. |
| [18] |
刘明琛, 杨兴雯, 鲁凤民. 新发现, 大用途: 慢性乙型肝炎患者血清HBV RNA检测的应用[J]. 中国生物化学与分子生物学报, 2020, 36(8): 865-871. LIU M C, YANG X W, LU F M. New discovery, wide use — application of serum HBV RNA detection in patients with chronic hepatitis B[J]. Chin J Biochem Mol Biol, 2020, 36(8): 865-871. |
| [19] |
MARTINOT-PEIGNOUX M, LAPALUS M, MAYLIN S, et al. Baseline HBsAg and HBcrAg titres allow peginterferon-based 'precision medicine' in HBeAg-negative chronic hepatitis B patients[J]. J Viral Hepat, 2016, 23(11): 905-911. |
| [20] |
MA G H, LOU B, LV F, et al. HBcrAg and pg RNA and the therapeutic effect in HBeAg-positive patients receiving anti-viral therapy, baseline serum HBV-RNA is a powerful predictor of response[J]. J Viral Hepat, 2020, 27(8): 837-846. |




