2. 402760 重庆,重庆市璧山区人民医院眼科
2. Department of Ophthalmology, People's Hospital of Bishan District, Chongqing, 402760, China
小胶质细胞是视网膜中的一类常驻免疫细胞,在正常的静息状态下,主要分布于视网膜外丛状层至视网膜神经纤维层,动态监视周围组织微环境的变化。视网膜微环境的细微变化即可触发小胶质细胞的激活。小胶质细胞激活后向视网膜下间隙迁移,召集周围炎性细胞进入视网膜,加剧视网膜的损伤,可引发自身免疫性葡萄膜炎等多种视网膜疾病[1]。激活的小胶质细胞可以表现出不同类型,其中一种是经典激活状态(M1型),这种表型分泌大量促炎细胞因子和毒性物质,在组织间主要发挥促进炎症和清除异物的作用[2]。阐明小胶质细胞激活的调控机制也许是治疗葡萄膜炎等自身免疫性疾病的潜在突破口。
N6-甲基腺苷(m6A)修饰作为哺乳动物细胞中最丰富的mRNA转录后修饰,其由一系列“writers” “erasers”和“readers”动态调节,从mRNA加工、核输出、mRNA翻译和衰变等方面影响mRNA代谢,进而参与许多细胞生物过程[3]。Wilms肿瘤抑制因子1相关蛋白(WTAP)是m6A修饰甲基转移酶复合物的重要组成部分,与METTL3-METTL14异二聚体相互作用,共同参与m6A修饰的调控[4]。本研究以HMC3小胶质细胞为研究对象,旨在探讨RNA甲基化酶WTAP在小胶质细胞M1极化中的表达和生物学功能,为调控小胶质细胞极化,乃至为治疗葡萄膜炎等自身免疫性疾病提供新的靶点。
1 材料与方法 1.1 主要材料与试剂细胞株:HMC3(人源小胶质细胞)与EMEM培养基购自美国模式培养物集存库(ATCC)。胎牛血清与0.25%胰蛋白酶购自美国Gibco公司, TRIzol购自美国Roche公司,RNA逆转录试剂盒购自日本TaKaRa公司,iTaqTM Universal SYBR? Green Supermix购自美国Bio-Rad公司, 脂多糖(LPS)购自美国Sigma公司,重组人γ干扰素蛋白(IFN-γ)购自美国Peprotech公司,化学发光液(ECL)购自四正柏生物科技公司,RIPA裂解液、BCA蛋白检测试剂盒购自上海碧云天生物研究所,PVDF膜购自德国Millipore公司,兔抗IL-6、兔抗IL-1β、兔抗TNF-α、兔抗WTAP、兔抗STAT3、兔抗p-STAT3、兔抗TLR4与兔抗NF-κB抗体购自英国Abcam公司,兔抗SIRT1与兔抗c/EBPβ抗体购自美国CST公司,兔抗USP18抗体与兔抗GAPDH购自美国Immunoway公司,鼠抗EP4与鼠抗EGR1抗体购自美国Santa Cruz公司,兔抗COP1抗体购自美国Bethyl公司,HRP标记山羊抗兔IgG与HRP标记山羊抗鼠IgG抗体购自中国武汉Proteintech公司,SIRT1激动剂SRT1720购自美国Selleck公司,SIRT1抑制剂EX527购自上海陶素生物科技公司。
1.2 细胞培养将HMC3细胞培养于含10%胎牛血清、1%青霉素-链霉素的EMEM培养基中,在温度37 ℃、5% CO2的细胞培养箱中进行培养,每隔2~3 d更换1次培养液。待细胞融合度达到80%左右时,PBS缓冲液洗涤细胞后,用0.25%胰蛋白酶消化细胞,离心并用EMEM培养基按1∶3的比例重悬后传代培养。
1.3 细胞分组与处理使用终浓度为100 ng/mL的IFNγ联合1 μg/mL的LPS处理HMC3细胞24 h作为实验组(IFNγ+LPS组),以不含IFN-γ及LPS培养基处理的细胞作为空白对照组(Control组),检测各组细胞炎症因子表达。使用慢病毒敲低WTAP,具体分组包括:NC组(使用空载慢病毒处理细胞),ShWTAP组(使用WTAP-RNAi处理细胞)。为探讨WTAP对小胶质细胞极化的作用,实验分组包括:NC组(空载病毒处理,不含IFNγ及LPS),NC+IFNγ+LPS组(空载病毒处理,100 ng/mL IFNγ联合1 μg/mL的LPS处理细胞),ShWTAP组(使用WTAP-RNAi处理细胞,不含IFNγ及LPS),ShWTAP+IFNγ+LPS组(使用WTAP-RNAi处理细胞,100 ng/mL IFNγ联合1 μg/mL LPS处理细胞)。为研究SIRT1对c/EBPβ的作用,具体分组包括,溶剂组:NC+Vehicle组(空载病毒+DMSO溶剂处理细胞),ShWTAP+Vehicle组(WTAP-RNAi处理细胞+DMSO溶剂处理细胞);处理组:NC+SRT1720组(空载病毒+2.5 μmol/L SRT1720处理细胞),ShWTAP+SRT1720组(WTAP-RNAi+2.5 μmol/L SRT1720处理细胞),NC+EX527组(空载病毒+10 μmol/L EX527处理细胞),ShWTAP+EX527组(WTAP-RNAi+10 μmol/L EX527处理细胞)。
1.4 实时荧光定量PCR检测将生长良好的HMC3细胞接种于6孔细胞培养板,按照实验需求分组及药物干预,实验结束后收集细胞,用TRIzol试剂按照制造商说明提取和纯化细胞总RNA。接着使用逆转录试剂盒从等量的RNA中逆转录cDNA。利用SYBR Green在美国Applied Biosystems公司7500 PCR系统上检测RNA转录水平。将管家基因β-actin作为内参基因,采用2-ΔΔCt法计算目标基因的相对表达量。所有引物序列见表 1。
| 引物名称 | 引物序列(5′→3′) | 产物长度/bp |
| β-actin | 上游:CTGGCACCCAGCACAATG 下游:GCCGATCCACACGGAGTACT |
69 |
| IL-6 | 上游:AGTGAGGAACAAGCCAGAGC 下游:CATTTGTGGTTGGGTCAGG |
112 |
| TNF-α | 上游:CTTCTCCTTCCTGATCGTGG 下游:GCTGGTTATCTCTCAGCTCCA |
266 |
| IL-1β | 上游:ATGATGGCTTATTACAGTGGCAA 下游:GTCGGAGATTCGTAGCTGGA |
132 |
| WTAP | 上游:ACCTCTTCCCAAGAAGGTTCG 下游:GATCTGTGTACTTGCCCTCCA |
125 |
| eIF3 | 上游:ACAGGCAGTGTTTGGACCTT 下游:TACGCGTGTATTGGAGGCAG |
102 |
| RBM15 | 上游:GATGCTTTTGGACATCGGGC 下游:GTGGCACCCAATCAGAGTCA |
115 |
| HNRNPC | 上游:ACAGCCTGATGTTTGGGACC 下游:AGAGGTTTTGTGGAGGACGC |
152 |
| ELAVL1 | 上游:CGCCAACTTGTACATCAGCG 下游:TAAACGCAACCCCTCTGGAC |
140 |
| METTL3 | 上游:TTGTCTCCAACCTTCCGTAGT 下游:CCAGATCAGAGAGGTGGTGTAG |
145 |
| METTL14 | 上游:AGTGCCGACAGCATTGGTG 下游:GGAGCAGAGGTATCATAGGAAGC |
101 |
| METTL4 | 上游:TCTGTGGTACACCAGTTGTCA 下游:CCTTTTTACGGCAACAAGGTTCA |
109 |
| FTO | 上游:CCAGGGTTGGGATGGGTTCA 下游:CGCTGACCTGTCCACCAGAT |
194 |
| ALKBH5 | 上游:CGCTGCCGCCGAACCTTAC 下游:GGATGCCGCTCTTCACCTTGC |
134 |
| HNRNPA2B1 | 上游:TCGGACCAGGACCAGGAAGTAAC 下游:GTCCTCCACCACCATATCCTCCTC |
165 |
| YTHDF1 | 上游:AGCACAGAGCACGGCAACAAG 下游:CCATTGACGCTGAAGAGCAGGTAG |
89 |
| YTHDF2 | 上游:CAGACACAGCCATTGCCTCCAC 下游:AGAACCAGCCTGAGACTGTCCTAC |
162 |
| YTHDF3 | 上游:TCCAGCAGCCTCAGCCATTAATTC 下游:TGCTGTGGTTGTGGTGGTTGAG |
88 |
| HNRNPG | 上游:CTTCAGGACCAGTTCGCAGTA 下游:TCACGACCACTTGAGTAGAGAT |
520 |
1.5 Western blot检测
将不同实验分组细胞进行药物干预后,用含1 mmol/L PMSF的RIPA裂解液提取细胞总蛋白。将收集的细胞裂解液放置在冰上裂解30 min后,于设置转速14 000×g、温度4 ℃的离心机离心15 min后收集上清。按BCA蛋白检测试剂盒步骤测定蛋白浓度。将等量的蛋白(15 μg)用8%~15% SDS-PAGE胶分离,切胶后将蛋白转移到PVDF膜上。在室温下用含5%脱脂奶粉的TBST缓冲液封闭PVDF膜2 h。分别加兔抗IL-6(1∶1 000)、兔抗IL-1β(1∶1 000)、兔抗TNF-α(1∶500)、兔抗WTAP(1∶1 000)、兔抗STAT3(1∶1 000)、兔抗p-STAT3(1∶2 000)、兔抗TLR4(1∶500)、兔抗NF-κB(1∶1 000)、兔抗SIRT1(1∶1 000)、兔抗c/EBPβ(1∶1 000)、兔抗USP18(1∶500)、鼠抗EP4(1∶200)、鼠抗EGR1(1∶200)、兔抗COP1(1∶1 000)抗体,兔抗GAPDH(1∶5 000),在4 ℃下孵育过夜。次日,用TBST缓冲液洗涤膜3次后,加HRP标记的山羊抗兔IgG抗体(1∶5 000)或HRP标记的山羊抗鼠IgG抗体(1∶5 000),在室温下孵育1 h。TBST缓冲液洗膜3次后,滴加化学发光液ECL后在VILBER成像系统下显影。用Image J分析蛋白质的灰度值。
1.6 慢病毒转染本实验所用慢病毒购自上海吉凯基因化学技术有限公司,将生长状态良好对数期的HMC3细胞,按5×105/孔接种于6孔细胞培养板中常规培养过夜。实验组分为NC组(转染空载病毒,靶标序列为TTCTCCG-AACGTGTCACGT)和ShWTAP组(转染WTAP-RNAi慢病毒,靶标序列为CAAGTACACAGATCTTAAC)。根据吉凯公司提供的说明书按MOI=50进行HMC3细胞慢病毒感染实验,转染10 h后更换新鲜培养基,培养72 h后收集细胞进行后续实验。
1.7 统计学分析采用SPSS 26.0统计软件进行分析,采用GraphPad Prism 8.0软件制图。除另有说明,实验均重复3次或3次以上。实验数据均以x±s表示。为了进行统计比较,首先评估数据是否正态分布,然后评估正态分布数据之间的方差齐性。具有正态分布且方差齐的数据采用Student's t检验进行比较。P < 0.05被认为差异具有统计学意义。
2 结果 2.1 IFN-γ联合LPS诱导HMC3小胶质细胞M1极化按分组处理HMC3细胞24 h后,实时荧光定量PCR结果显示:与空白对照组比较,100 ng/mL IFNγ联合1 μg/mL LPS处理可显著升高HMC3小胶质细胞促炎细胞因子IL-6、IL-1β和TNF-α mRNA表达(P < 0.05,图 1A)。Western blot检测结果显示:与空白对照组相比较,100 ng/mL IFNγ联合1 μg/mL LPS处理可显著升高HMC3小胶质细胞促炎细胞因子IL-6、IL-1β和TNF-α的蛋白表达(P < 0.05,图 1B)。
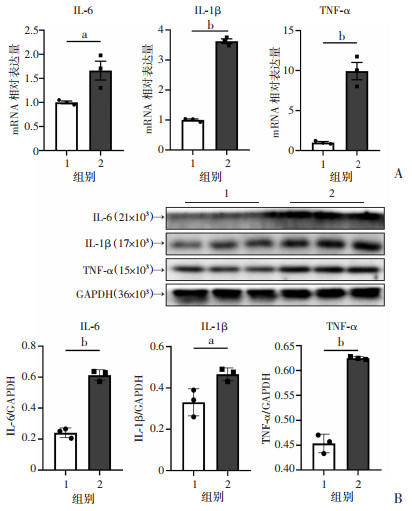
|
|
1:空白对照组;2:IFNγ+LPS组;a: P < 0.05, b: P < 0.01 A:实时荧光定量PCR检测2组细胞IL-6、IL-1β和TNF-α的mRNA表达;B:Western blot检测2组细胞IL-6、IL-1β和TNF-α的蛋白表达 图 1 HMC3小胶质细胞M1极化表型 |
2.2 WTAP在M1极化的HMC3小胶质细胞中高表达
运用实时荧光定量PCR检测空白对照组和实验组m6A修饰相关基因(METTL3,METTL4,METTL14,WTAP,RBM15,FTO,ALKBH5,YTHDF1,YTHDF2,YTHDF3,ELAVL1,eIF3,HNRNPC,HNRNPA2B,HNRNPG)的表达。与空白对照组比较,WTAP mRNA水平在M1极化的HMC3小胶质细胞中显著升高(P < 0.05,图 2A)。Western blot检测结果显示:与空白对照组比较,WTAP蛋白水平在M1极化的HMC3小胶质细胞中也显著升高(P < 0.05,图 2B)。
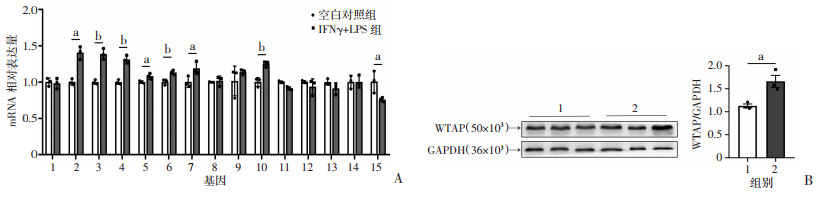
|
|
a: P < 0.05, b: P < 0.01 A:实时荧光定量PCR检测2组细胞m6A相关基因的mRNA表达1:METTL3;2:METTL4;3:METTL14;4:WTAP;5:RBM15;6:FTO;7:ALKBH5;8:YTHDF1;9:YTHDF2;10:YTHDF3;11:ELAVL1;12:eIF3;13:HNRNPC;14:HNRNPA2B;15:HNRNPG;B:Western blot检测2组细胞WTAP蛋白的表达 1:空白对照组;2:IFNγ+LPS组 图 2 M1极化的HMC3小胶质细胞高表达WTAP |
2.3 敲低HMC3小胶质细胞WTAP的表达
利用慢病毒转染HMC3小胶质细胞72 h,空载病毒组(NC组)和WTAP-RNAi组(ShWTAP组)可见明显较多的GFP+细胞(图 3A)。使用实时荧光定量PCR和Western blot检测转染WTAP-RNAi的细胞的敲低效率,结果显示:WTAP在HMC3细胞中mRNA水平成功敲低(P < 0.01,图 3B),蛋白水平也成功敲低(P < 0.01,图 3C)。
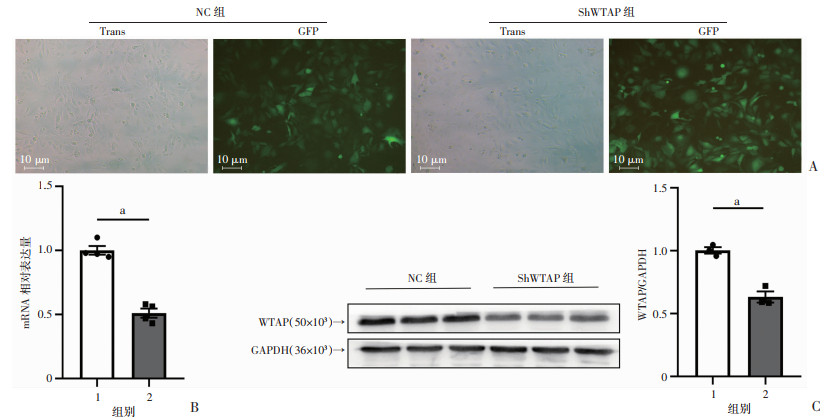
|
|
1:NC组;2:ShWTAP组;a: P < 0.01 A:荧光显微镜观察HMC3细胞转染病毒72 h后的变化;B:实时荧光定量PCR检测NC组与ShWTAP组WTAP的mRNA表达;C:Western blot检测NC组与ShWTAP组WTAP蛋白的表达 图 3 敲低HMC3小胶质细胞WTAP表达的验证 |
2.4 WTAP影响HMC3小胶质细胞M1激活
在HMC3小胶质细胞中敲低WTAP,采用实时荧光定量PCR检测敲低WTAP基因后HMC3小胶质细胞的M1型极化相关炎症因子mRNA表达的变化,结果显示:ShWTAP组IL-6、IL-1β和TNF-α mRNA水平显著低于NC组,ShWTAP+IFNγ+LPS组IL-6、IL-1β和TNF-α mRNA水平显著低于NC+IFNγ+LPS组(P < 0.05,图 4A)。采用Western blot检测敲低WTAP基因后HMC3小胶质细胞M1型极化相关炎症因子蛋白表达的变化,结果显示:ShWTAP组IL-6、IL-1β和TNF-α的蛋白水平显著低于NC组,ShWTAP+IFNγ+LPS组IL-6、IL-1β和TNF-α的蛋白水平显著低于NC+IFNγ+LPS组(P < 0.05,图 4B)。上述结果表明敲低WTAP显著抑制了HMC3小胶质细胞M1极化。
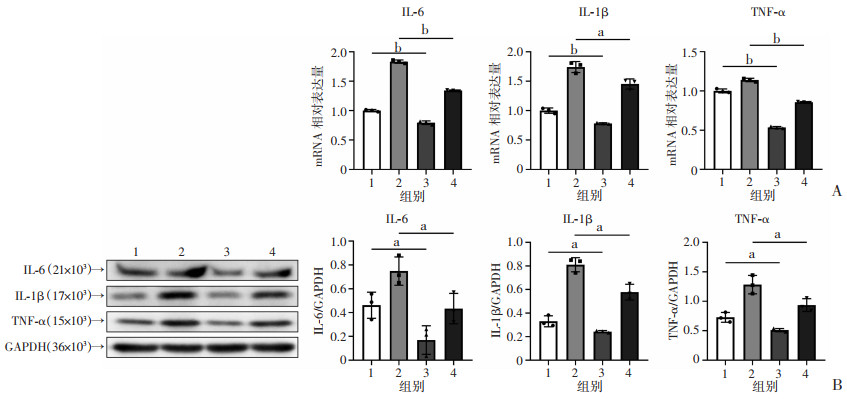
|
|
1:NC组;2:NC+IFNγ+LPS组;3:ShWTAP组;4:ShWTAP+IFNγ+LPS组;a: P < 0.05, b: P < 0.01 A:实时荧光定量PCR检测各组细胞IL-6、IL-1β和TNF-α的mRNA表达;B:Western blot检测各组细胞IL-6、IL-1β和TNF-α的蛋白表达 图 4 WTAP影响HMC3小胶质细胞M1激活 |
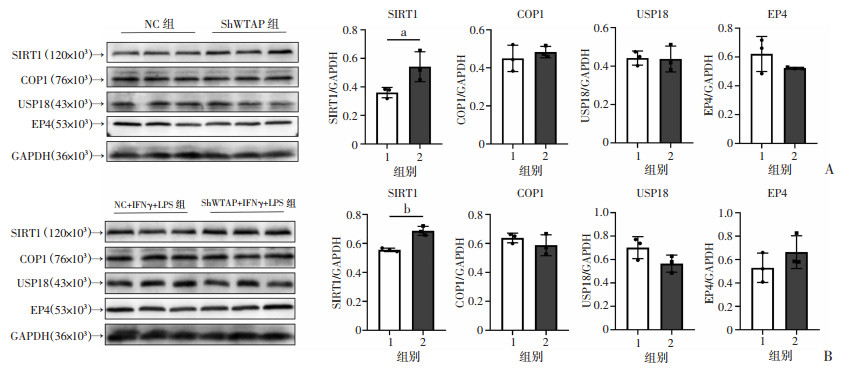
2.5 敲低WTAP使HMC3小胶质细胞高表达SIRT1
为了探究WTAP调控HMC3小胶质细M1极化的机制,采用Western blot检测具有抑制小胶质细胞炎症的相关基因(SIRT1、COP1、USP18和EP4)的表达,结果显示:ShWTAP组的SIRT1蛋白水平显著高于NC组(P < 0.05),而ShWTAP组的COP1、USP18和EP4的蛋白水平与NC组比较差异无统计学意义(图 5A),ShWTAP+IFNγ+LPS组的SIRT1蛋白水平显著高于NC+IFNγ+LPS组(P < 0.01),而ShWTAP+IFNγ+LPS组的COP1、USP18和EP4的蛋白水平与NC+IFNγ+LPS组比较差异无统计学意义(图 5B)。
|
|
a: P < 0.05, b: P < 0.01 A:Western blot检测各组细胞SIRT1、COP1、USP18和EP4的蛋白表达 1:NC组;2:ShWTAP组;B:Western blot检测各组细胞SIRT1、COP1、USP18和EP4的蛋白表达 1:NC+IFNγ+LPS组;2:ShWTAP+IFNγ+LPS组 图 5 HMC3细胞敲低WTAP后高表达SIRT1 |
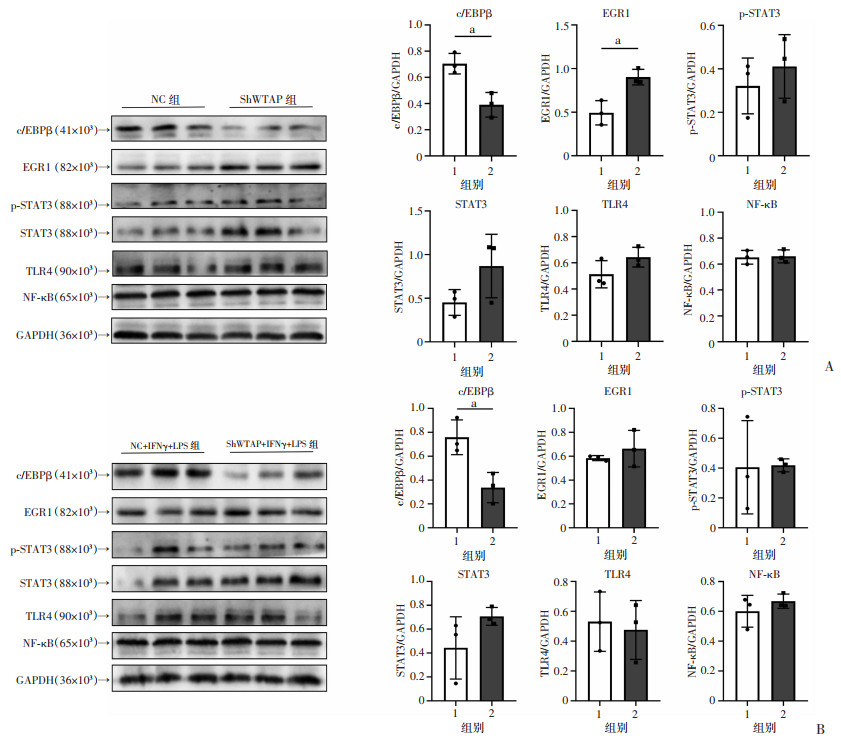
2.6 敲低WTAP使HMC3小胶质细胞低表达c/EBPβ
上述实验结果显示:敲低WTAP促进了HMC3小胶质细胞SIRT1的表达,考虑到小胶质细胞M1极化需要激活促炎转录因子和炎症相关通路受体,因此采用Western blot检测部分促炎转录因子和炎症相关通路受体的表达变化。结果显示:ShWTAP组的c/EBPβ蛋白水平显著低于NC组(P < 0.05),而ShWTAP组的STAT3、p-STAT3、TLR4和NF-κB的蛋白水平与NC组比较差异无统计学意义(图 6A),ShWTAP+IFNγ+LPS组的c/EBPβ蛋白水平显著低于NC+IFNγ+LPS组(P < 0.05),而ShWTAP+IFNγ+LPS组的STAT3、p-STAT3、TLR4和NF-κB的蛋白水平与NC+IFNγ+LPS组比较差异无统计学意义(图 6B)。虽然ShWTAP组的EGR1蛋白水平显著高于NC组(P < 0.05,图 6A),但ShWTAP+IFNγ+LPS组的EGR1蛋白水平与NC+IFNγ+LPS组的差异无统计学意义(图 6B)。
|
|
a: P < 0.05 A:Western blot检测各组细胞c/EBPβ、EGR1、p-STAT3、STAT3、TLR4和NF-κB的蛋白表达 1:NC组;2:ShWTAP组;B:Western blot检测各组细胞c/EBPβ、EGR1、p-STAT3、STAT3、TLR4和NF-κB的蛋白表达 1:NC+IFNγ+LPS组;2:ShWTAP+IFNγ+LPS组 图 6 HMC3细胞敲低WTAP后低表达c/EBPβ |
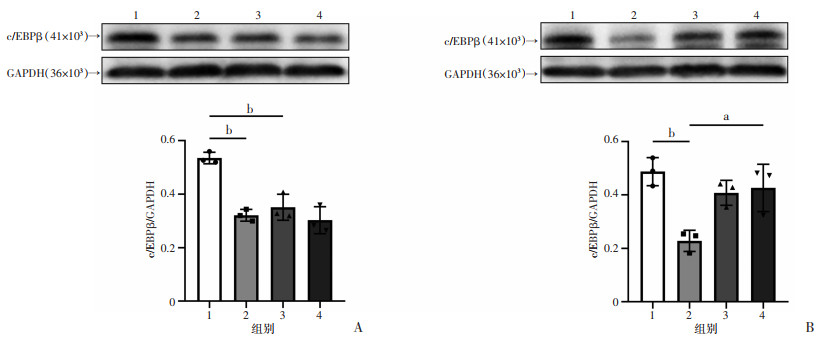
2.7 SIRT1通过调控c/EBPβ表达参与WTAP对HMC3小胶质细M1极化的影响
为了证明SIRT1是否调控转录因子c/EBPβ表达,对NC组和ShWTAP组细胞分别用SIRT1激动剂SRT1720/SIRT1抑制剂EX527促进SIRT1活性/抑制SIRT1活性,采用Western blot检测各组细胞c/EBPβ的蛋白表达,结果显示:与溶剂组相比较,SIRT1激动剂SRT1720能使NC组相较于ShWTAP组高表达的c/EBPβ表达显著降低(P < 0.01,图 7A),SIRT1抑制剂EX527能使ShWTAP组相较于NC组低表达的c/EBPβ表达显著升高(P < 0.05,图 7B)。表明在敲低WTAP的HMC3小胶质细胞中,SIRT1参与调控转录c/EBPβ的表达。
|
|
a: P < 0.05, b: P < 0.01 A:Western blot检测各组细胞在溶剂和SIRT1激动剂SRT1720的作用下c/EBPβ的蛋白表达 1:NC+Vehicle组;2:ShWTAP+Vehicle组;3:NC+SRT1720组;4:ShWTAP+SRT1720组;B:Western blot检测各组细胞在溶剂和SIRT1抑制剂EX527的作用下c/EBPβ的蛋白表达 1:NC+Vehicle组;2:ShWTAP+Vehicle组;3:NC+EX527组;4:ShWTAP+EX527组 图 7 WTAP通过SIRT1调控c/EBPβ在HMC3小胶质细胞中的表达 |
3 讨论
小胶质细胞是视网膜的一类固有免疫细胞,其对维持视网膜组织结构及其功能正常是必不可少的[5]。目前有研究证实:在自身免疫性葡萄膜炎中,小胶质细胞在启动免疫细胞浸润中起着至关重要的作用,清除视网膜小胶质细胞后,外周免疫细胞不能通过血视网膜屏障侵入视网膜,而不能诱发自身免疫性葡萄膜炎[6]。也有研究表明:在视网膜脱离中,小胶质细胞迁移到损伤部位保护感光细胞,并且参与调节局部的炎症反应[7]。因此,寻找调控小胶质细胞活化的新靶标,也许能为视网膜疾病,特别是为葡萄膜炎等自身免疫性疾病的治疗带来新的突破口。
在健康的视网膜中,小胶质细胞通常呈高度分支的形态,具有小细胞体和长细胞突起等典型特征[8],它们通过不断移动突起来扫描周围组织微环境。当周围组织微环境发生变化时,小胶质细胞就会被激活,激活的小胶质细胞胞体变大,水平突起会收缩,它们的形态变成“阿米巴样”[9]。我们在HMC3小胶质细胞系上也观察到类似的形态特征。在静息状态下,HMC3小胶质细胞胞体较小,呈“分支样”。使用IFNγ+LPS诱导M1极化后,HMC3小胶质细胞的胞体变大,呈“阿米巴样”的形态。而使用IFNγ+LPS诱导敲低WTAP的HMC3细胞时,我们发现“阿米巴样”的细胞明显减少,说明敲低WTAP可抑制HMC3细胞的M1型极化。
mRNA的转录后修饰主要包括m6A、5-甲基胞嘧啶(m5C)和假尿苷(ψ)。近年来,mRNA的表观遗传修饰受到越来越多的关注,尤其是m6A修饰。m6A修饰是哺乳动物细胞中最为丰富的mRNA转录后修饰形式[10],由甲基化酶、去甲基化酶和m6A修饰识别蛋白动态可逆调控[11]。研究表明m6A修饰在mRNA加工、核输出、mRNA翻译和衰变等方面影响mRNA代谢[3],参与了多种细胞生物过程,如迁移、侵袭、细胞周期、细胞黏附、分化和炎症等。这意味着m6A修饰与许多疾病相关,如卵巢癌发生、转移[12]和心肌梗死后的修复[13]等。此外,m6A修饰与免疫细胞的激活和免疫应答的关系也十分密切[14]。
WTAP是m6A修饰的一种重要的甲基转移酶,参与了许多疾病的发生、发展。如WTAP蛋白的增加可增强了Wnt信号的激活,促进胰腺癌的进展[15];WTAP的降解通过降低IRF3和IFNAR1 mRNA的m6A水平来阻断抗病毒反应[16];WTAP通过影响MYC mRNA的m6A水平调节MYC mRNA在急性髓系白血病细胞中的半衰期,WTAP的高表达预示着预后不良[17]。然而WTAP对小胶质细胞极化的调控,乃至在自身免疫性葡萄膜炎中的作用尚不明确。
本研究结果显示WTAP在M1极化的HMC3小胶质细胞中高表达,进一步研究发现WTAP在HMC3细胞M1极化的过程中具有重要的生物学功能,在体外发挥着促进HMC3小胶质细胞炎性细胞因子表达的作用,敲低WTAP可以抑制这一现象。提示WTAP可能是调控小胶质细胞M1极化的潜在作用靶点。本研究发现:敲低WTAP通过促进SIRT1的表达而降低c/EBPβ抑制HMC3小胶质细胞M1极化。SIRT1是一种烟酰胺腺苷二核苷酸(NAD+)依赖性酶,属于Sirtuin蛋白家族,是细胞调控相关蛋白去乙酰化的关键酶[18]。越来越多的证据显示:SIRT1参与机体许多生理和病理的过程,如细胞凋亡、衰老、调控炎症反应等。最近有研究表明:在创伤性脑损伤后,增加SIRT1活性,可促进小胶质细胞由M1型向M2型转变,并抑制了小胶质细胞的活化,从而减轻随后的神经炎症反应[19]。此外,AMPK-SIRT1轴通过介导下游途径的去乙酰化,抑制NF-κB活化,从而减少促炎细胞因子的分泌,减轻实验性自身免疫性脑脊髓炎小鼠的神经炎症[20]。由此可见,SIRT1降低促炎信号的强度,抑制小胶质细胞M1激活,这与我们的研究发现一致:敲低HMC3小胶质细胞WTAP后,SIRT1表达增加,降低了c/EBPβ的表达,进而抑制了小胶质细胞M1激活。
综上所述,本研究结果表明m6A甲基化酶WTAP可能是一种重要的转录后调控因子,参与了小胶质细胞M1极化。靶向WTAP可能为减轻免疫反应,降低视网膜损伤,保护视功能提供了一种潜在的治疗策略。结合目前已知的对WTAP的研究,WTAP有可能影响了SIRT1 mRNA的m6A水平,进而可能通过m6A识别蛋白以m6A依赖的方式对SIRT1 mRNA的加工、核输出、翻译甚至衰变等方面产生影响,从而可能影响SIRT1在小胶质细胞中的表达,参与小胶质细胞M1极化的调控过程。然而,WTAP如何通过m6A修饰发挥调控小胶质细胞M1极化的具体机制还需进行深入的研究和探讨。
| [1] |
RATHNASAMY G, FOULDS W S, LING E A, et al. Retinal microglia: a key player in healthy and diseased Retina[J]. Prog Neurobiol, 2019, 173: 18-40. |
| [2] |
ORIHUELA R, MCPHERSON C A, HARRY G J. Microglial M1/M2 polarization and metabolic states[J]. Br J Pharmacol, 2016, 173(4): 649-665. |
| [3] |
DOMINISSINI D, MOSHITCH-MOSHKOVITZ S, SCHWARTZ S, et al. Topology of the human and mouse m6A RNA methylomes revealed by m6A-seq[J]. Nature, 2012, 485(7397): 201-206. |
| [4] |
PING X L, SUN B F, WANG L, et al. Mammalian WTAP is a regulatory subunit of the RNA N6-methyladenosine methyltransferase[J]. Cell Res, 2014, 24(2): 177-189. |
| [5] |
GUO M, SCHWARTZ T D, DUNAIEF J L, et al. Myeloid cells in retinal and brain degeneration[J]. FEBS J, 2021. DOI: 10.1111/febs.16177.[Onlineaheadofprint].
|
| [6] |
OKUNUKI Y, MUKAI R, NAKAO T, et al. Retinal microglia initiate neuroinflammation in ocular autoimmunity[J]. Proc Natl Acad Sci USA, 2019, 116(20): 9989-9998. |
| [7] |
OKUNUKI Y, MUKAI R, PEARSALL E A, et al. Microglia inhibit photoreceptor cell death and regulate immune cell infiltration in response to retinal detachment[J]. Proc Natl Acad Sci USA, 2018, 115(27): E6264-E6273. |
| [8] |
CEBULLA C M, ZELINKA C P, SCOTT M A, et al. A chick model of retinal detachment: cone rich and novel[J]. PLoS One, 2012, 7(9): e44257. |
| [9] |
KARLSTETTER M, SCHOLZ R, RUTAR M, et al. Retinal microglia: just bystander or target for therapy?[J]. Prog Retin Eye Res, 2015, 45: 30-57. |
| [10] |
ZHANG Y, GENG X, LI Q, et al. m6A modification in RNA: biogenesis, functions and roles in gliomas[J]. J Exp Clin Cancer Res, 2020, 39(1): 192. |
| [11] |
ROBINSON M, SHAH P, CUI Y H, et al. The role of dynamic m6A RNA methylation in photobiology[J]. Photochem Photobiol, 2019, 95(1): 95-104. |
| [12] |
LIU T, WEI Q, JIN J, et al. The m6A reader YTHDF1 promotes ovarian cancer progression via augmenting EIF3C translation[J]. Nucleic Acids Res, 2020, 48(7): 3816-3831. |
| [13] |
GONG R, WANG X, LI H, et al. Loss of m6A methyltransferase METTL3 promotes heart regeneration and repair after myocardial injury[J]. Pharmacol Res, 2021, 105845. |
| [14] |
WANG H, HU X, HUANG M, et al. Mettl3-mediated mRNA m6A methylation promotes dendritic cell activation[J]. Nat Commun, 2019, 10(1): 1898. |
| [15] |
DENG J, ZHANG J, YE Y, et al. N6 -methyladenosine-mediated upregulation of WTAPP1 promotes WTAP translation and wnt signaling to facilitate pancreatic cancer progression[J]. Cancer Res, 2021, 81(20): 5268-5283. |
| [16] |
GE Y, LING T, WANG Y, et al. Degradation of WTAP blocks antiviral responses by reducing the m6 A levels of IRF3 and IFNAR1 mRNA[J]. EMBO Rep, 2021, e52101. |
| [17] |
NAREN D, YAN T, GONG Y, et al. High Wilms' tumor 1 associating protein expression predicts poor prognosis in acute myeloid leukemia and regulates m6A methylation of MYC mRNA[J]. J Cancer Res Clin Oncol, 2021, 147(1): 33-47. |
| [18] |
MELHEM H, HANSMANNEL F, BRESSENOT A, et al. Methyl-deficient diet promotes colitis and SIRT1-mediated endoplasmic Reticulum stress[J]. Gut, 2016, 65(4): 595-606. |
| [19] |
CHEN X, CHEN C, FAN S, et al. Omega-3 polyunsaturated fatty acid attenuates the inflammatory response by modulating microglia polarization through SIRT1-mediated deacetylation of the HMGB1/NF-κB pathway following experimental traumatic brain injury[J]. J Neuroinflammation, 2018, 15(1): 116. |
| [20] |
PARODI B, ROSSI S, MORANDO S, et al. Fumarates modulate microglia activation through a novel HCAR2 signaling pathway and rescue synaptic dysregulation in inflamed CNS[J]. Acta Neuropathol, 2015, 130(2): 279-295. |




