2. 210002 南京,南京大学医学院附属金陵医院内分泌科
2. Department of Endocrinology, Affiliated Jinling Hospital, Medical School of Nanjing University, Nanjing, Jiangsu Province, 210002, China
多囊卵巢综合征(polycystic ovary syndrome, PCOS)是一种受遗传和环境因素共同作用的内分泌紊乱综合征,是生育期妇女月经紊乱及不孕的常见原因,12%~18%的育龄女性受其影响[1-2]。PCOS的主要临床特征表现为持续性无排卵、雄激素过多和胰岛素抵抗,代谢异常也是PCOS患者的重要临床表现,包括超重、肥胖、糖耐量受损、血脂异常等[3]。研究显示,PCOS患者中,超重及肥胖、向心性肥胖的患者比例较高[4], 肥胖率为30%~70%。超重或肥胖PCOS患者糖耐量受损或患2型糖尿病(T2DM)的风险明显高于体重正常的PCOS患者[3, 5]。而肥胖,尤其是向心性肥胖会增加胰岛素抵抗, 恶化高雄激素血症[4],导致排卵功能障碍。因此,治疗超重或肥胖型PCOS患者具有较高的临床研究意义。目前对于PCOS尚未有根治性疗法,对症治疗仍是PCOS的主要治疗方式。有研究表明二甲双胍和胰高血糖素样肽-1受体激动剂(glucagon-like peptide-1 receptor agonist,GLP-1RA)都可减轻体重,改善胰岛素抵抗,降低雄激素浓度,恢复月经周期并诱导排卵[6-8]。因此,对于代谢异常明显的超重PCOS患者,GLP-1RA联合二甲双胍的治疗方式可能会有更好的临床治疗效果[8]。
微纤丝相关蛋白5(microfibrillar associated protein 5,MFAP5)位于许多组织的弹性蛋白网络微纤维中,参与微纤维组装、细胞存活以及维持血管壁完整性的多种细胞信号传导[9-11]。MFAP5蛋白在脂肪组织中高度表达[12],并参与了肥胖相关炎症反应的细胞外基质纤维化重塑,而细胞外基质在炎症因子作用下可诱导脂肪组织纤维化并导致代谢应激[13]。研究表明脂肪组织细胞外基质异常纤维化在肥胖的发生发展中具有重要作用[14],研究发现MFAP5的异常表达与癌症、主动脉瘤、炎症相关,同时可能与肥胖及代谢疾病相关[15]。脂肪炎症反应是超重PCOS患者的重要特征,而MFAP5参与脂肪相关炎症反应,调控机体脂肪组织含量。目前MFAP5与PCOS疾病的相关性尚未探明。本研究通过分析经二甲双胍联合GLP-1RA(利拉鲁肽)治疗23例PCOS患者的MFAP5水平与PCOS糖脂代谢指标的相关性,探讨MFAP5在PCOS发生发展中的作用,为疾病的治疗及预后提供新思路。
1 资料与方法 1.1 研究对象收集2019年12月至2021年2月于本科门诊收入的23例超重或肥胖(BMI≥24.0 kg/m2且腰围≥85 cm)的PCOS患者,年龄为(25.17±3.77)岁,纳入研究对象参照鹿特丹诊断标准[16]:①稀发、排卵或不排卵;②高雄激素临床和/或生化表现;③妇科超声卵巢多囊样改变:可见一侧或双侧卵巢≥12个直径为2~9 mm的卵泡,或卵巢体积大于10 cm3。同时排除其他病因引起的高雄激素血症及生殖障碍,包括肾上腺皮质增生、库欣综合征、雄激素分泌增多的肿瘤以及甲状腺功能减退症、中枢性闭经等疾病。所有受试者甲状腺功能和催乳素水平正常。根据中国成人超重和肥胖症预防和控制指南[17](超重:BMI为24.0~27.9 kg/m2,肥胖:BMI≥28.0 kg/m2),分成肥胖组(n=12)和超重组(n=11),所有研究对象接受为期12周的二甲双胍联合利拉鲁肽治疗,具体治疗方式为盐酸二甲双胍肠溶片0.5 g,口服,3次/d;利拉鲁肽注射液(丹麦诺和诺德有限公司)0.6 mg,皮下注射,1次/d,1周后增加至1.2 mg,1/d,最大剂量增至1.8 mg,1次/d。留取治疗前与治疗12周后的血液标本,采集治疗前后相关临床检验指标、月经周期和妇科彩超结果。该研究遵守赫尔辛基宣言,经本院伦理委员会批准(2017-研第020-01)。获得所有受试者知情同意并签署知情同意书。
1.2 指标测量 1.2.1 一般临床资料采集测量治疗前后身高、体质量、腰围、臀围、血压等临床数据,计算体质指数(BMI)=体质量/身高2(kg/m2),腰臀比=腰围/臀围。测定空腹血糖(FBG,氧化酶法)、胰岛素水平(化学发光免疫法)和糖化血红蛋白(HbA1c,高压液相法)。稳态模型评估的胰岛素抵抗指数(homeostasis model assessment insulin resistance index,HOMA-IR)=空腹胰岛素×空腹血糖/22.5,胰岛β细胞功能指数(HOMA-β)=20×空腹胰岛素/(空腹血糖-3.5)。生化自动分析仪检测血脂质谱,包括甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL)、低密度脂蛋白胆固醇(LDL)。采用IMMULITE 2000免疫测定系统测定性激素,包括睾酮(T)、黄体生成素(LH)、促卵泡激素(FSH),计算LH/FSH值、孕酮(P)、泌乳素(PRL)、雌二醇(E2)。采用免疫放射法测定硫酸脱氢表雄酮(DHEA-S)、性激素结合球蛋白(SHBG)。采用IMMULITE 1000免疫测定系统测定炎症标志物,包括C反应蛋白(CRP)、白介素-6 (IL-6)、肿瘤坏死因子-α(TNF-α)、白介素-8(IL-8)。胰岛素释放试验:受试者清晨空腹服下75 g无水葡萄糖,依次测取空腹胰岛素、30 min胰岛素、60 min胰岛素、120 min胰岛素、180 min胰岛素水平。以上血样均为研究对象于月经周期第3~5天或卵泡期清晨空腹采血。各个△临床指标=治疗后-治疗前,血浆△MFAP5=治疗后-治疗前。
1.2.2 血浆MFAP5浓度测定取研究对象的外周静脉血进行检测,将血液标本3 000 r/min,离心5 min,取血浆储存于-80℃的冰箱内。采用武汉云克隆科技有限公司(编号:SEF590Hu)的ELISA试剂盒进行血浆MFAP5浓度测定,批内变异系数 < 10%,批间变异系数 < 12%。
1.3 统计学分析采用SPSS 23.0软件进行统计学分析,计量资料符合正态分布用x±s表示,采用配对t检验,非正态分布用M(P25,P75)表示,采用Wilcoxon秩和检验,计数资料以百分比表示,采用χ2检验。血浆△MFAP5水平与各个△临床指标的关系采用Spearman相关性分析,P < 0.05为差异有统计学意义。
2 结果 2.1 治疗前后PCOS患者一般临床资料比较23例PCOS患者的年龄为(25.17±3.77)岁,其中肥胖组与超重组的年龄相比差异无统计学意义。通过二甲双胍联合利拉鲁肽治疗后,2组患者体质量、BMI、腰围、臀围均有下降(P < 0.05)。超重组腰臀比较前下降(P < 0.05)。治疗后2组HbA1c、空腹胰岛素、胰岛素释放试验60 min胰岛素、HOMA-IR、TG均有下降(P < 0.05)。肥胖组胰岛素释放试验60 min胰岛素、180 min胰岛素、HDL较前降低(P < 0.05),炎症标志物CRP、TNF-α水平较前降低(P < 0.05);性激素水平提示促黄体生成素较前水平降低(P < 0.05)。超重组患者的空腹血糖较前降低(P < 0.05),见表 1。
| 临床指标 | 肥胖组(n=12) | 超重组(n=11) | |||||
| 治疗前 | 治疗后 | P | 治疗前 | 治疗后 | P | ||
| 体质量/kg | 79.59±8.84 | 70.67±9.98 | < 0.001 | 66.30±6.39 | 58.95±7.93 | < 0.001 | |
| BMI/kg·m-2 | 31.22±2.52 | 27.75±3.73 | < 0.001 | 26.07±1.08 | 23.14±2.13 | < 0.001 | |
| 腰围/cm | 102.33±6.84 | 93.67±7.96 | < 0.001 | 87.95±7.82 | 81.00±7.50 | < 0.001 | |
| 臀围/cm | 109.33±4.87 | 102.25±5.82 | < 0.001 | 99.09±6.95 | 94.55±7.24 | 0.002 | |
| 腰臀比 | 0.94±0.05 | 0.92±0.06 | 0.388 | 0.89±0.10 | 0.86±0.07 | 0.041 | |
| 空腹血糖/mmol·L-1 | 6.15(5.68, 6.62) | 5.65(5.40, 6.10) | 0.109 | 5.95±0.71 | 5.34±0.55 | 0.018 | |
| HbA1c(%) | 5.34(4.85, 5.78) | 4.68(4.42, 5.30) | < 0.001 | 5.20(4.74, 5.98) | 4.91(4.42, 4.99) | < 0.001 | |
| 空腹胰岛素/μU·mL-1 | 18.79±6.91 | 7.14±2.46 | < 0.001 | 16.05±4.65 | 7.58±2.45 | 0.047 | |
| 60 min胰岛素/μU·mL-1 | 110.27±60.01 | 75.38±39.60 | 0.024 | 106.06±29.80 | 69.66±31.58 | 0.001 | |
| 180 min胰岛素/μU·mL-1 | 68.87±48.16 | 41.17±28.60 | 0.049 | 36.91±14.42 | 32.54±32.81 | 0.712 | |
| HOMA-IR | 4.09(3.26, 5.84) | 3.18(2.70, 3.50) | 0.030 | 3.93(3.37, 4.62) | 2.39(1.50, 3.12) | 0.019 | |
| TG/mmol·L-1 | 2.14±0.64 | 1.21±0.55 | 0.006 | 1.84±0.68 | 1. 38±0.62 | 0.003 | |
| HDL/mmol·L-1 | 2.93±0.72 | 2.26±0.54 | 0.037 | 2.84±0.90 | 2.28±0.66 | 0.157 | |
| CRP/mg·L-1 | 5.72±2.27 | 3.62±1.69 | 0.008 | 3.04±0.96 | 2.52±0.99 | 0.192 | |
| TNF-a/pg·mL-1 | 8.95 (7.92, 10.58) | 7.25(6.30, 9.30) | 0.011 | 8.00(5.50, 11.5) | 7.30(5.80, 8.05) | 0.333 | |
| 促黄体生成素/mIU·L-1 | 8.23±4.70 | 5.22±2.89 | 0.033 | 9.15±5.62 | 5.68±2.39 | 0.083 | |
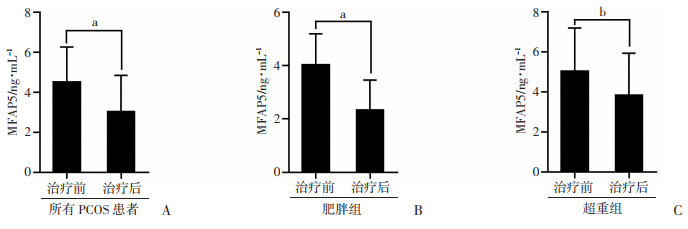
2.2 PCOS患者及两亚组治疗前后血浆MFAP5水平变化
与治疗前相比,所有患者血浆MFAP5水平下降,差异有统计学意义(P < 0.05,图 1A )。亚组分析提示,肥胖组及超重组血浆MFAP5水平较治疗前下降,差异有统计学意义(P < 0.05,图 1B、C)。
|
|
a: P < 0.001;b: P=0.003 A:所有PCOS患者MFAP5水平变化;B:肥胖组MFAP5水平变化;C:超重组MFAP5水平变化 图 1 PCOS患者及两亚组治疗前后血浆MFAP5水平的变化 |
2.3 治疗前后的月经周期、排卵及妊娠情况
治疗后两组患者均出现优势卵泡恢复、月经规律的趋势(表 2)。治疗时长超过3个月后,后期追踪6~8个月发现,有7名患者怀孕,1例为超重组患者,6例为肥胖组患者,其中5例为自然受孕,1例通过体外受精(IVF)受孕。
| 时间点 | 规律月经 | 优势卵泡 |
| 治疗前 | 9(39.13) | 0 |
| 治疗后 | 18(78.26) | 4(17.39) |
| P | 0.016 | 0.009 |
2.4 血浆MFAP5水平与代谢指标及性激素相关性分析
相关性分析显示,所有PCOS患者血浆MFAP5水平变化值与体质量(r= 0.520,P=0.011)、BMI(r=0.469,P=0.024)、腰围(r=0.634,P=0.001)、臀围(r=0.587,P=0.001)、空腹胰岛素(r=0.602,P=0.002)、TG(r=0.556,P=0.002)相关。亚组分析提示,超重组血浆MFAP5水平变化值与胰岛素释放试验60 min胰岛素(r=0.602,P=0.002)、TG(r=0.655,P=0.029)的变化值成正相关, 肥胖组患者血浆MFAP5水平变化值与腰围(r=0.495,P=0.002)、臀围(r=0.508,P=0.010)、空腹胰岛素(r=0.578, P=0.001)、胰岛素释放试验180 min胰岛素(r=0.656,P=0.021)、HOMA-IR(r=0.497,P=0.012)、TG(r=0.595,P=0.041)、促黄体生成素(r=0.468,P=0.042)的变化值呈显著性正相关(表 3)。
| 临床指标 | 超重组(n=12) | 肥胖组(n=11) | 所有患者(n=23) | |||||
| r | P | r | P | r | P | |||
| 体质量/kg | 0.018 | 0.959 | 0.481 | 0.114 | 0.520 | 0.011 | ||
| BMI/kg·m-2 | 0.009 | 0.978 | 0.452 | 0.140 | 0.469 | 0.024 | ||
| 腰围/cm | 0.480 | 0.136 | 0.495 | 0.002 | 0.634 | 0.001 | ||
| 臀围/cm | 0.461 | 0.153 | 0.508 | 0.010 | 0.587 | 0.001 | ||
| 腰臀比 | 0.030 | 0.230 | 0.416 | 0.179 | 0.282 | 0.193 | ||
| HbA1c(%) | 0.044 | 0.897 | 0.485 | 0.110 | -0.372 | 0.080 | ||
| 空腹血糖/mmol·L-1 | 0.146 | 0.668 | 0.067 | 0.836 | -0.017 | 0.939 | ||
| 空腹胰岛素/μU·mL-1 | 0.080 | 0.815 | 0.578 | 0.001 | 0.602 | 0.002 | ||
| 30 min胰岛素/μU·mL-1 | 0.139 | 0.683 | 0.389 | 0.212 | 0.319 | 0.148 | ||
| 60 min胰岛素/μU·mL-1 | 0.602 | 0.002 | 0.471 | 0.123 | 0.208 | 0.342 | ||
| 120 min胰岛素/μU·mL-1 | 0.171 | 0.614 | 0.391 | 0.208 | 0.139 | 0.526 | ||
| 180 min胰岛素/μU·mL-1 | 0.011 | 0.975 | 0.656 | 0.021 | 0.066 | 0.764 | ||
| HOMA-IR | 0.093 | 0.786 | 0.497 | 0.012 | 0.119 | 0.590 | ||
| HOMA-β | 0.079 | 0.817 | 0.390 | 0.210 | 0.084 | 0.703 | ||
| TG/mmol·L-1 | 0.655 | 0.029 | 0.595 | 0.041 | 0.556 | 0.002 | ||
| TC/mmol·L-1 | 0.267 | 0.427 | 0.200 | 0.533 | 0.005 | 0.982 | ||
| HDL/mmol·L-1 | 0.326 | 0.327 | 0.241 | 0.450 | -0.129 | 0.556 | ||
| LDL/mmol·L-1 | 0.140 | 0.682 | 0.282 | 0.374 | -0.019 | 0.932 | ||
| T/nmol·L-1 | 0.546 | 0.082 | 0.397 | 0.202 | 0.216 | 0.322 | ||
| FSH/mIU·L-1 | 0.514 | 0.106 | -0.288 | 0.365 | -0.118 | 0.593 | ||
| 促黄体生成素/mIU·L-1 | 0.124 | 0.715 | 0.468 | 0.042 | 0.278 | 0.200 | ||
| E2/pg·mL-1 | 0.083 | 0.807 | 0.158 | 0.625 | 0.160 | 0.465 | ||
| P/ng·mL-1 | 0.121 | 0.724 | 0.419 | 0.175 | 0.349 | 0.102 | ||
| PRL/ng·mL-1 | 0.126 | 0.713 | 0.014 | 0.965 | -0.032 | 0.886 | ||
| LH/FSH | 0.508 | 0.111 | 0.367 | 0.240 | 0.353 | 0.099 | ||
| SHBG/nmol·L-1 | -0.141 | 0.679 | -0.122 | 0.707 | -0.032 | 0.886 | ||
| DHEA-S/μg·dL-1 | 0.451 | 0.164 | 0.064 | 0.844 | -0.109 | 0.620 | ||
3 讨论
研究表明,超重PCOS患者代谢异常发生率明显高于健康人,传统的治疗方式多为降低雄激素水平、改善月经周期、促进排卵等对症疗法, 而此种治疗方法对于PCOS患者代谢异常的临床症状无明显疗效, GLP-1RA具有抑制食欲及摄食,延缓胃排空及减轻体重等多种生理作用[18]。当PCOS患者减重达5%~10%后,可有效改善代谢、促进排卵、增加妊娠及活产率[19-20]。本研究发现,经过二甲双胍联合利拉鲁肽治疗后,2组患者体质量明显降低,有效改善腹型肥胖,与既往研究[21]结果一致,有较为可观的减重效果。同时,我们发现2组患者经联合治疗后,糖脂代谢方面及性激素水平较前改善,优势卵泡恢复,整体呈规律月经趋势,后续随访发现部分患者成功受孕,生殖功能得到改善,与NIAFAR等[21]的研究结果类似。2组睾酮水平治疗前后无明显差异,可能与纳入患者治疗前本身无显著睾酮水平升高有关。另外,本研究发现与超重组相比,肥胖组性激素、胰岛素水平改善更为显著,提示对于肥胖的PCOS患者,二甲双胍联合利拉鲁肽的治疗方式可能作为优先选择的治疗方法。同时,相关性分析提示,肥胖组患者血浆MFAP5的变化值与较多临床指标的变化值相关,包括糖脂代谢指标、性激素水平等,而超重组患者及所有患者的MFAP5的变化值仅与部分临床指标显示相关,可能是由于肥胖组患者代谢异常表现较超重组更加明显,但仍可看出2组患者血浆MFAP5的变化值均与临床指标的改善存在潜在的相关性。
MFAP5作为MFAP蛋白家族成员之一,是细胞外基质相关纤维蛋白,参与微纤维组装,可维持细胞正常形态结构,通过Notch途径调节血管生成从而影响细胞信号传导[22]。在心血管、骨骼肌、肾脏、肺等组织中有表达[15],且在脂肪组织中高度表达[22],病理状态下,MFAP5的异常表达在癌症转移、主动脉瘤的发生、炎症代谢异常过程中发挥重要作用[15]。另有研究指出,脂肪组织中MFAP5的mRNA水平变化值与BMI以及一些代谢相关指标,如空腹血清脂联素及瘦素的变化相关,提示其在疾病代谢变化中发挥重要作用[12],而与脂联素和瘦素变化相关的MFAP5表达可能与肥胖发展过程中的血管生成和细胞外基质重塑有关[23],在PCOS患者,脂联素及瘦素与胰岛素抵抗密切相关[24]。同时,在糖耐量受损或代谢综合征患者中,脂肪组织MFAP5的表达与体重指数、空腹胰岛素等呈正相关[12, 25]。而与MFAP5结构类似的相关家族分子MAGP1,与代谢功能障碍、肥胖增加、糖尿病易感性相关[11],提示MFAP5可能通过多种病理途径参与了PCOS代谢紊乱的相关过程。而本研究中,所有PCOS患者血浆MFAP5水平变化与空腹胰岛素、甘油三酯及BMI相关指标变化值呈正相关;亚组分析提示,超重组血浆MFAP5水平变化与餐后胰岛素及甘油三酯相关,肥胖组患者血浆MFAP5水平变化值与空腹及餐后胰岛素、血脂、腰围、臀围的变化值呈正相关,这与上述研究结果[12]相似,提示血浆MFAP5可能参与了二甲双胍联合利拉鲁肽治疗PCOS的生殖功能及代谢改善的相关病理及生理过程。
本研究关注到在超重PCOS患者中,纤维化标志物MFAP5也是与代谢异常相关的。另有研究发现MFAP5在脂肪细胞外基质高表达,而异常增殖的细胞外基质成分抑制脂肪细胞的膨胀并诱导组织硬化,导致代谢应激[22]。同时,TNF-α和IL-6高表达的前脂肪细胞增加了脂肪组织细胞外基质MFAP5的mRNA表达水平,提示炎症因子可能通过某些机制调控MFAP5水平变化。另有研究表示,MFAP5可通过促进IL-10的分泌来减轻炎症[26],异常的炎症反应可能参与了疾病的代谢改变,而许多PCOS患者表现为以炎症标志物轻度增高的慢性炎症状态[27],MFAP5可能参与到PCOS患者异常炎症反应的相关过程中。有趣的是,本研究发现MFAP5与促性腺激素LH也呈正相关,目前尚未见有文献探讨MFAP5与性激素水平的相关性,而神经内分泌异常表现在PCOS病理生理过程发挥重要作用,当GnRH脉冲频率增加,短脉冲可促进LH水平升高,降低FSH水平,导致排卵障碍[28]。也有研究认为LH水平升高与肥胖密切相关[29],PCOS患者中,肥胖引起的代偿性高胰岛素血症可增加卵巢卵泡膜细胞对LH刺激敏感性[30],而MFAP5与PCOS患者糖脂代谢指标存在潜在相关性,可能通过外周脂肪增多进而影响GnRh分泌,导致高LH水平,这还需后续研究进一步证实。目前来看,MFAP5参与PCOS的疾病发生的相关机制尚未完全阐明,本研究为回顾性研究,样本量及来源有限,导致分组不完善,并缺乏前瞻性研究的进一步验证,所得结论可能存在片面性。后期将扩大样本量,完善不同分组,进一步对本研究结果予以验证。但本研究结果仍为超重PCOS的治疗和疗效评价提示了新的方向。
综上所述,二甲双胍联合利拉鲁肽治疗可改善超重PCOS患者的生殖障碍及糖脂代谢紊乱,降低MFAP5血浆水平可能参与了二甲双胍联合利拉鲁肽改善超重PCOS患者糖脂代谢及性激素紊乱的相关机制,MFAP5可能在治疗过程中发挥重要作用,可反映治疗效果及超重PCOS患者糖脂代谢、炎症水平潜在变化,可能作为超重PCOS治疗效果的可靠监测指标。
| [1] |
JOHAM A E, PALOMBA S, HART R. Polycystic ovary syndrome, obesity, and pregnancy[J]. Semin Reprod Med, 2016, 34(2): 93-101. |
| [2] |
MARCH W A, MOORE V M, WILLSON K J, et al. The prevalence of polycystic ovary syndrome in a community sample assessed under contrasting diagnostic criteria[J]. Hum Reprod, 2010, 25(2): 544-551. |
| [3] |
CHANTRAPANICHKUL P, INDHAVIVADHANA S, WONGWANANURUK T, et al. Prevalence of type 2 diabetes mellitus compared between lean and overweight/obese patients with polycystic ovarian syndrome: a 5-year follow-up study[J]. Arch Gynecol Obstet, 2020, 301(3): 809-816. |
| [4] |
LIM S S, DAVIES M J, NORMAN R J, et al. Overweight, obesity and central obesity in women with polycystic ovary syndrome: a systematic review and meta-analysis[J]. Hum Reprod Update, 2012, 18(6): 618-637. |
| [5] |
NADERPOOR N, SHORAKAE S, JOHAM A, et al. Obesity and polycystic ovary syndrome[J]. Minerva Endocrinol, 2015, 40(1): 37-51. |
| [6] |
SHPAKOV A O. Improvement effect of metformin on female and male reproduction in endocrine pathologies and its mechanisms[J]. Pharmaceuticals, 2021, 14(1): 42. |
| [7] |
LEGRO R S, ARSLANIAN S A, EHRMANN D A, et al. Diagnosis and treatment of polycystic ovary syndrome: an Endocrine Society clinical practice guideline[J]. J Clin Endocrinol Metab, 2013, 98(12): 4565-4592. |
| [8] |
LAMOS E M, MALEK R, DAVIS S N. GLP-1 receptor agonists in the treatment of polycystic ovary syndrome[J]. Expert Rev Clin Pharmacol, 2017, 10(4): 401-408. |
| [9] |
LEMAIRE R, BAYLE J, MECHAM R P, et al. Microfibril-associated MAGP-2 stimulates elastic fiber assembly[J]. J Biol Chem, 2007, 282(1): 800-808. |
| [10] |
LEMAIRE R, KORN J H, SHIPLEY J M, et al. Increased expression of type Ⅰ collagen induced by microfibril-associated glycoprotein 2: novel mechanistic insights into the molecular basis of dermal fibrosis in Scleroderma[J]. Arthritis Rheum, 2005, 52(6): 1812-1823. |
| [11] |
ALBIG A R, BECENTI D J, ROY T G, et al. Microfibril-associate glycoprotein-2 (MAGP-2) promotes angiogenic cell sprouting by blocking notch signaling in endothelial cells[J]. Microvasc Res, 2008, 76(1): 7-14. |
| [12] |
VAITTINEN M, KOLEHMAINEN M, SCHWAB U, et al. Microfibrillar-associated protein 5 is linked with markers of obesity-related extracellular matrix remodeling and inflammation[J]. Nutr Diabetes, 2011, 1: e15. |
| [13] |
HENEGAR C, TORDJMAN J, ACHARD V, et al. Adipose tissue transcriptomic signature highlights the pathological relevance of extracellular matrix in human obesity[J]. Genome Biol, 2008, 9(1): R14. |
| [14] |
KHAN T, MUISE E S, IYENGAR P, et al. Metabolic dysregulation and adipose tissue fibrosis: role of collagen Ⅵ[J]. Mol Cell Biol, 2009, 29(6): 1575-1591. |
| [15] |
CRAFT C S, BROEKELMANN T J, MECHAM R P. Microfibril-associated glycoproteins MAGP-1 and MAGP-2 in disease[J]. Matrix Biol, 2018, 71/72: 100-111. |
| [16] |
ROTTERDAM ESHRE/ASRM-SPONSORED PCOS CONSENSUS WORKSHOP GROUP. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome (PCOS)[J]. Hum Reprod, 2004, 19(1): 41-47. |
| [17] |
CHINA WORKING GROUP ON OBESITY. Guidelines for prevention and control of overweight and obesity in Chinese adults[J]. Acta Nutr Sin, 2004, 26(1): 1-4. |
| [18] |
ANDERSEN A, LUND A, KNOP F K, et al. Glucagon-like peptide 1 in health and disease[J]. Nat Rev Endocrinol, 2018, 14(7): 390-403. |
| [19] |
HOMBURG R. The management of infertility associated with polycystic ovary syndrome[J]. Reprod Biol Endocrinol, 2003, 1: 109. |
| [20] |
MORAN L J, PASQUALI R, TEEDE H J, et al. Treatment of obesity in polycystic ovary syndrome: a position statement of the Androgen Excess and Polycystic Ovary Syndrome Society[J]. Fertil Steril, 2009, 92(6): 1966-1982. |
| [21] |
NIAFAR M, POURAFKARI L, PORHOMAYON J, et al. A systematic review of GLP-1 agonists on the metabolic syndrome in women with polycystic ovaries[J]. Arch Gynecol Obstet, 2016, 293(3): 509-515. |
| [22] |
VAITTINEN M, KOLEHMAINEN M, RYDÉN M, et al. MFAP5 is related to obesity-associated adipose tissue and extracellular matrix remodeling and inflammation[J]. Obesity (Silver Spring), 2015, 23(7): 1371-1378. |
| [23] |
CHRISTIAENS V, LIJNEN H R. Angiogenesis and development of adipose tissue[J]. Mol Cell Endocrinol, 2010, 318(1/2): 2-9. |
| [24] |
POLAK K, CZYZYK A, SIMONCINI T, et al. New markers of insulin resistance in polycystic ovary syndrome[J]. J Endocrinol Invest, 2017, 40(1): 1-8. |
| [25] |
CRAFT C S, PIETKA T A, SCHAPPE T, et al. The extracellular matrix protein MAGP1 supports thermogenesis and protects against obesity and diabetes through regulation of TGF-β[J]. Diabetes, 2014, 63(6): 1920-1932. |
| [26] |
MILWID J M, ELMAN J S, LI M, et al. Enriched protein screening of human bone marrow mesenchymal stromal cell secretions reveals MFAP5 and PENK as novel IL-10 modulators[J]. Mol Ther, 2014, 22(5): 999-1007. |
| [27] |
MANCINI A, BRUNO C, VERGANI E, et al. Oxidative stress and low-grade inflammation in polycystic ovary syndrome: controversies and new insights[J]. Int J Mol Sci, 2021, 22(4): 1667. |
| [28] |
MOORE A M, CAMPBELL R E. Polycystic ovary syndrome: Understanding the role of the brain[J]. Front Neuroendocrinol, 2017, 46: 1-14. |
| [29] |
ROTH L W, ALLSHOUSE A A, BRADSHAW-PIERCE E L, et al. Luteal phase dynamics of follicle-stimulating and luteinizing hormones in obese and normal weight women[J]. Clin Endocrinol (Oxf), 2014, 81(3): 418-425. |
| [30] |
GLUECK C J, GOLDENBERG N. Characteristics of obesity in polycystic ovary syndrome: Etiology, treatment, and genetics[J]. Metabolism, 2019, 92: 108-120. |




