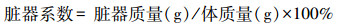2. 261053 山东 潍坊,潍坊医学院: 附属医院肾内科
2. Department of Nephrology, Affiliated Hospital, Weifang Medical University, Weifang, Shandong Province, 261053, China
系统性红斑狼疮(systemic lupus erythematosus, SLE)是在遗传、激素、感染、环境等综合因素作用下的一种自身免疫病,易导致机体多系统的损害[1-2]。目前,糖皮质激素、抗疟药、免疫抑制剂是SLE的主要治疗药物[3-5]。其中,免疫抑制药可更好地控制SLE活动,有利于减少SLE的暴发和激素的用量,但是免疫抑制剂对免疫系统作用缺乏选择性,长期使用会增加感染风险[6-7]。因此,筛选出更有效的具有免疫调控作用的药物,可为临床研发SLE治疗新药奠定基础。
信筒子醌(Embelin)是从白花酸藤果中提取的一种苯醌类化合物。研究证明,Embelin及其衍生物在中枢神经系统疾病、胰腺癌、乳腺癌、前列腺癌、结肠炎、皮炎中具有镇痛、抗炎、抗癌、抗菌、抗氧化、抗糖尿病等作用[8-9]。课题组前期研究发现,在实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)小鼠模型中,Embelin可通过降低Th1和Th17细胞的浸润抑制小鼠EAE的发病[10];在小鼠胰腺癌模型中,Embelin通过抑制IL-6的分泌而降低骨髓来源的抑制性细胞(myeloid-derived suppressor cells, MDSCs)、Treg、Th1和Th17细胞的浸润[11]。但目前Embelin对SLE的治疗作用及其机制尚不清楚。本研究构建降植烷(pristane)诱导的SLE小鼠模型,观察Embelin对Th1/Th2、Treg/Th17细胞平衡的调节和对Th细胞、B细胞活化的影响,以探讨Embelin对SLE的治疗作用。
1 材料与方法 1.1 材料6~8周龄SPF级近交系BALB/c雌性小鼠15只(No.1107262011002445,济南朋悦实验动物繁育有限公司),饲养于通风、温度(23±2)℃、相对湿度为(55±15)% 的环境内。实验按照潍坊医学院动物伦理要求进行。
主要试剂:Embelin(武汉凯威斯公司),pristane (Sigma公司),尿蛋白试纸(广州市花都高尔宝生物技术有限公司),小鼠淋巴细胞分离液(天津灏洋公司),大鼠抗小鼠流式抗体:PerCP偶联CD3单克隆抗体、APC-H7偶联CD4单克隆抗体、FITC偶联CD69单克隆抗体、APC偶联CD154(CD40L)单克隆抗体、APC偶联CD19单克隆抗体、PE偶联CD86单克隆抗体、FITC偶联CD69单克隆抗体、BV421偶联IA(b)(MHC-Ⅱ)单克隆抗体、PE-cy7偶联IL-4单克隆抗体、BV421偶联IL-17A单克隆抗体、FITC偶联IFN-γ单克隆抗体(BD公司),FITC偶联CD4单克隆抗体、APC偶联CD25单克隆抗体、PE偶联Foxp3单克隆抗体(eBioscience公司),小鼠抗dsDNA抗体ELISA试剂盒(Cusabio公司),小鼠抗ssDNA抗体ELISA试剂盒(Cusabio公司),小鼠IgG检测ELISA试剂盒(Cloud-Clone Corp公司)。
1.2 方法 1.2.1 pristane诱导SLE模型的建立按照文献[12]制作相关模型,15只小鼠单次腹腔注射0.5 mL pristane诱导SLE模型。每周用尿蛋白试纸测量并记录小鼠尿蛋白情况。
1.2.2 分组和Embelin治疗pristane诱导3个月后,将尿蛋白为++~+++的10只小鼠分为两组。Embelin组:小鼠给予Embelin(50 mg/kg)灌胃,对照组:小鼠给予溶剂(1% DMSO+PBS)灌胃;100 μL/次,每周3次。Embelin组剂量参照文献[9-11, 13]确定。每周称量小鼠体质量,用尿蛋白试纸检测小鼠尿蛋白水平。灌胃治疗1个月后,CO2窒息法处死小鼠,收集小鼠血液、脾脏、肾脏和主要淋巴结(包括腹部、肠系膜、腹股沟、颈部、腋窝淋巴结),并计算脏器系数。
1.2.3 肾脏组织学评估剥离肾脏,固定在4%的多聚甲醛中过夜,脱水嵌入石蜡,切片(4 μm),苏木精-伊红(HE)染色,封片。
1.2.4 免疫细胞比例检测将脾脏和淋巴结剪碎,40 μm筛网研磨过滤调整细胞数为1×106/mL, 每检测管分别加入100 μL细胞悬液。T、B细胞表面标志检测:分别加入CD3-PerCP、CD4-APC-H7、CD69-FITC、CD154-APC、CD19-APC、CD86-PE、CD69-FITC、IA(b)-BV421抗体,4 ℃避光孵育30 min,流式细胞仪检测。Treg细胞检测:加入CD4-FITC、CD25-APC抗体表染,4 ℃避光孵育30 min,洗涤,固定透膜,加入抗小鼠CD16/32抗体封闭15 min后加Foxp3-PE,4 ℃避光孵育30 min,流式细胞仪检测。Th细胞亚群检测:将分离的小鼠脾脏和淋巴结细胞加入Leukocyte Activation Cocktail(BD公司)刺激5 h后收集细胞,加入CD3-PerCP和CD4-APC-H7抗体进行表面标记染色,固定透膜,加抗小鼠CD16/32抗体封闭15 min后加IL-4-PE-cy7、IL-17A-BV421、IFN-γ-FITC抗体或同型对照抗体,4 ℃避光孵育30 min,流式细胞仪检测。
1.2.5 血清抗体浓度检测CO2窒息法处死小鼠后,心脏取血,分离血清,置于-20 ℃保存备用。按照ELISA说明书测定血清抗ds-DNA抗体、抗ss-DNA抗体、IgG抗体含量,测量450 nm处的光密度值D(450)。
1.3 统计学分析采用SPSS 13.0统计软件,治疗前后主要指标的比较以x±s表示, 组间比较用Student’s t检验。检验水准α=0.05。
2 结果 2.1 Pristane诱导的SLE小鼠模型情况如表 1所示,Pristane诱导小鼠1个月时,11只小鼠出现尿蛋白;3个月时,15只小鼠全部出现尿蛋白,其中尿蛋白++的小鼠4只,尿蛋白+++的小鼠7只。选择10只尿蛋白为++~+++的小鼠分为两组,每组包括2只尿蛋白++和3只尿蛋白+++的小鼠。
| 造模时间 | 小鼠/只 | 尿蛋白情况 | |||||
| - | + | +~++ | ++ | +++ | ++++ | ||
| 1个月 | 15 | 4 | 9 | 2 | |||
| 2个月 | 15 | 4 | 6 | 5 | |||
| 3个月 | 15 | 1 | 3 | 4 | 7 | ||
2.2 Embelin减轻SLE小鼠肾脏损伤情况
Embelin治疗1个月后,与对照组比较,肾小球肿大现象明显改善(图 1A),肾小球平均面积减小(P<0.01,图 1B),小鼠蛋白尿水平升高程度受到抑制(表 2)。
|
| A:HE染色观察肾组织病理学变化;B:平均肾小球面积分析 a:P<0.01,与对照组比较 图 1 信筒子醌对SLE小鼠肾组织病理学的改变 |
| 时间 | 组别 | n | 尿蛋白情况 | |||
| + | ++ | +++ | ++++ | |||
| 治疗前 | 对照组 | 5 | 2 | 3 | ||
| Embelin组 | 5 | 2 | 3 | |||
| 治疗1周后 | 对照组 | 5 | 2 | 3 | ||
| Embelin组 | 5 | 3 | 2 | |||
| 治疗2周后 | 对照组 | 5 | 2 | 3 | ||
| Embelin组 | 5 | 4 | 1 | |||
| 治疗3周后 | 对照组 | 5 | 1 | 4 | ||
| Embelin组 | 5 | 2 | 2 | 1 | ||
| 治疗4周后 | 对照组 | 5 | 1 | 3 | 1 | |
| Embelin组 | 5 | 2 | 3 | |||
2.3 Embelin减小SLE小鼠淋巴结、脾脏肿大情况
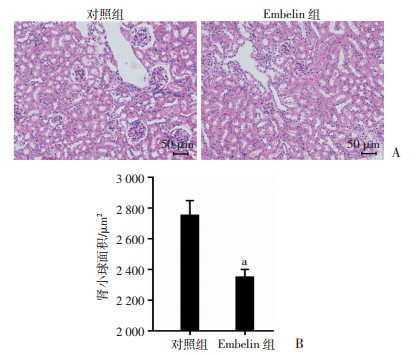
与对照组比较,Embelin治疗后小鼠淋巴结明显变小(图 2A);脾脏变小(图 2B),且其指数明显降低[Embelin组:(0.33± 0.05)%,对照组:(0.52±0.08)%,P<0.01];同时,肾脏指数也明显降低[Embelin组:(1.33±0.11)%,对照组:(1.59±0.09)%,P<0.01]。
|
| A:淋巴结;B:脾脏 图 2 SLE小鼠淋巴结和脾脏大体观 |
2.4 Embelin调控SLE小鼠Th1/Th2细胞平衡
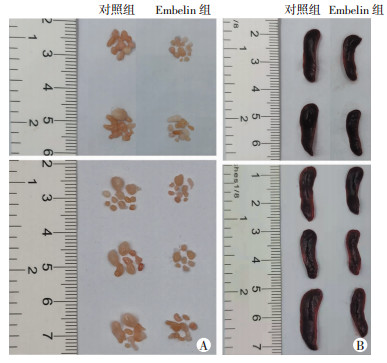
流式细胞仪检测Th1、Th2细胞比例变化(Th1:CD3+CD4+IFN-γ+;Th2:CD3+CD4+IL-4+)。与对照组比较,Embelin治疗后小鼠淋巴结和脾脏中Th1比例明显增加(P<0.05,图 3A、B);淋巴结和脾脏中Th2细胞比例差异无统计学意义(P>0.05,图 3C、D);但是淋巴结和脾脏中Th1/Th2均明显升高(P<0.05,图 3E、F)。
|
|
1: 对照组;2:Embelin组 A:小鼠淋巴结Th1细胞比例变化;B:小鼠脾脏Th1细胞比例变化;C:小鼠淋巴结Th2细胞比例变化;D:小鼠脾脏Th2细胞比例变化;E、F:小鼠淋巴结(E)和脾脏(F)中Th1/Th2细胞比率变化 a:P<0.05,与对照组比较 图 3 Embelin对小鼠淋巴结和脾脏中Th1、Th2细胞比例的影响 |
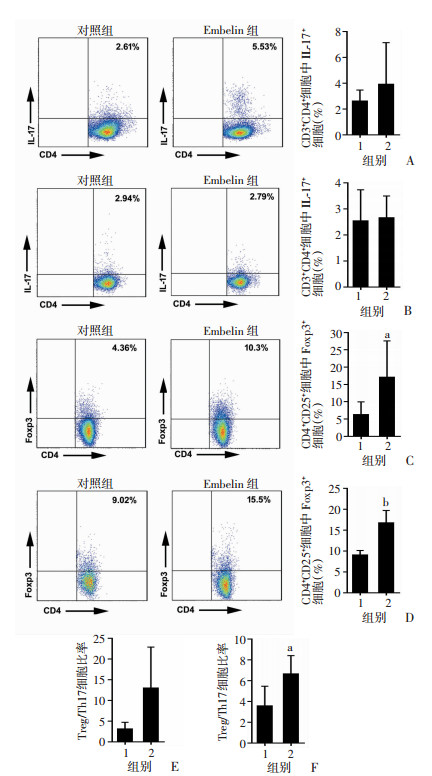
2.5 Embelin调控SLE小鼠Treg/Th17细胞平衡
流式细胞仪检测Th17、Treg细胞比例变化(Th17:CD3+CD4+IL-17+;Treg:CD4+CD25+Foxp3+)。与对照组比较,Embelin治疗后小鼠淋巴结和脾脏中的Th17细胞比例差异无统计学意义(P>0.05,图 4A、B);但是淋巴结和脾脏中的Treg细胞比例均明显增加(P<0.05,图 4C、D);淋巴结中Treg/Th17比率差异无统计学意义(P>0.05,图 4E);脾脏中Treg/Th17明显升高(P<0.05,图 4F)。
|
|
1: 对照组;2:Embelin组 A:小鼠淋巴结Th17细胞比例变化;B:小鼠脾脏Th17细胞比例变化;C:小鼠淋巴结Treg细胞比例变化;D:小鼠脾脏Treg细胞比例变化;E、F:小鼠淋巴结(E)和脾脏(F)中Treg/Th17细胞比率变化 a:P<0.05,b:P<0.01,与对照组比较 图 4 Embelin对小鼠淋巴结和脾脏中Th17、Treg细胞比例的影响 |
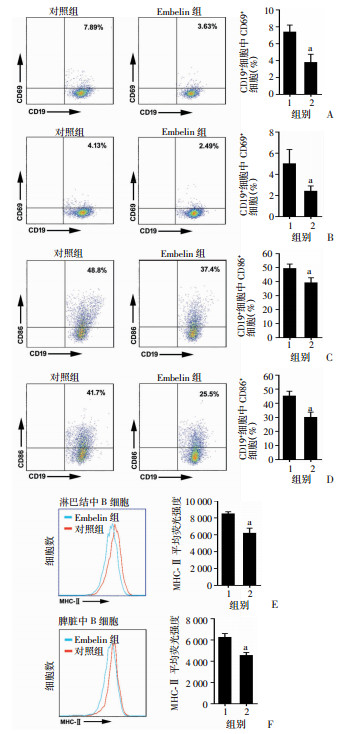
2.6 Embelin抑制B细胞的活化
流式细胞仪检测B细胞表面活化标志CD69、CD86、MHC-Ⅱ表达情况[CD19+CD69+;CD19+CD86+;CD19+ IA(b)+],以探讨Embelin对B细胞活化能力的影响。与对照组比较,Embelin组小鼠淋巴结和脾脏中B细胞表面的CD69表达水平明显降低(P<0.01,图 5A、B);CD86的表达水平也明显降低(P<0.01,图 5C、D);MHC-Ⅱ的平均荧光强度也明显降低(P<0.01,图 5E、F)。
|
|
1: 对照组;2:Embelin组 A:小鼠淋巴结B细胞表面CD69表达水平;B:小鼠脾脏B细胞表面CD69表达水平;C:小鼠淋巴结B细胞表面CD86表达水平;D:小鼠脾脏B细胞表面CD86表达水平;E:小鼠淋巴结B细胞表面MHC-Ⅱ表达水平;F:小鼠脾脏B细胞表面MHC-Ⅱ表达水平 a:P<0.01,与对照组比较 图 5 Embelin对小鼠淋巴结和脾脏中B细胞表面活化标志表达水平的影响 |
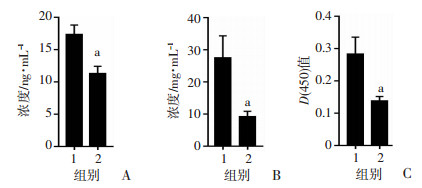
2.7 Embelin抑制B细胞分泌抗体功能
ELISA法检测血清中抗dsDNA抗体、抗ssDNA抗体和IgG含量的变化,以探讨Embelin对B细胞分泌自身抗体功能的影响。与对照组比较,Embelin治疗后小鼠血清中抗dsDNA抗体浓度降低(P<0.01,图 6A);IgG的浓度明显降低(P<0.01,图 6B);抗ssDNA抗体的光密度值也明显降低(P<0.01,图 6C)。
|
|
1: 对照组;2:Embelin组 A:小鼠血清dsDNA抗体含量变化;B:小鼠血清IgG抗体含量变化;C:小鼠血清ssDNA抗体含量变化 a:P<0.01,与对照组比较 图 6 Embelin对小鼠血清中抗体含量的影响 |
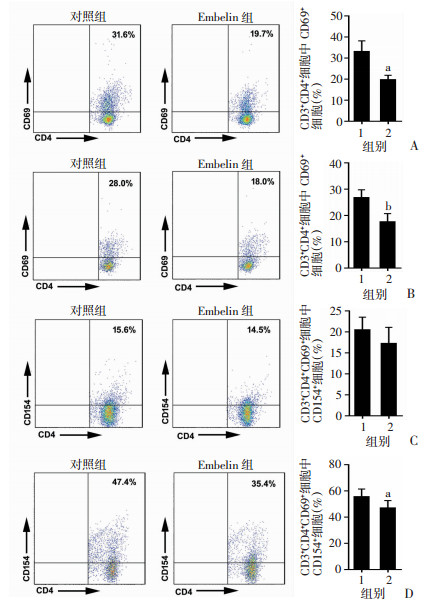
2.8 Embelin抑制Th细胞活化
流式细胞仪检测Th细胞表面活化标志CD69、CD154(CD40L)表达情况,以探讨Embelin对Th细胞活化能力的影响。与对照组比较,Embelin组淋巴结和脾脏中Th细胞表面CD69的表达水平明显降低(P<0.01,图 7A、B);淋巴结中CD69+Th细胞表面的CD154表达水平差异无统计学意义(P>0.05,图 7C);脾脏中CD69+Th细胞表面的CD154表达水平也明显降低(P<0.05,图 7D)。
|
|
1: 对照组;2:Embelin组 A:小鼠淋巴结T细胞表面CD69表达水平;B:小鼠脾脏T细胞表面CD69表达水平;C:小鼠淋巴结CD69+Th细胞表面CD154表达水平;D:小鼠脾脏CD69+Th细胞表面CD154表达水平 a:P<0.05,b:P<0.01,与对照组比较 图 7 Embelin对小鼠淋巴结和脾脏中T细胞表面活化标志表达水平的影响 |
3 讨论
SLE的突出表现为自身免疫耐受的破坏和血清中出现大量自身抗体。自身抗体与自身抗原结合后形成的免疫复合物沉积在组织中可通过激活补体,促进趋化因子等细胞因子的表达而募集炎症细胞浸润,引起组织炎症反应,最终导致器官受损,以病变累及肾脏为主要特点。目前,SLE小鼠模型基本可分为3类:自发性、诱发性和基因调控模型。自发性模型是在自然情况下发生的,虽然与人类SLE发病机制和临床症状更为相似,但由于其发病较晚,周期长,且不易控制实验过程等原因有其局限性;SLE基因调控小鼠模型是近年新应用的模型,但由于其价格较高且受品系限制等原因短期内无法普及;而诱发性模型由于其发病较早、实验过程易控制、经济适用等优点而应用最广泛。
国内外研究较多的诱发性SLE小鼠模型有多种,包括慢性移植物抗宿主病(chronic graft-versus-host disease,cGVHD)模型、肽诱发的模型、烃类化合物诱发的模型等。多种烃类化合物可以诱导小鼠自身抗体的产生,其中pristane是目前研究较多且最成功的一种,各品系小鼠均能诱导成功。该方法只需一次性腹腔注射0.5 mL pristane,1个月后小鼠可陆续出现各种自身抗体,如抗dsDNA、抗Sm等;6个月后大部分小鼠肾脏病变出现,表现为免疫复合物性肾小球肾炎、典型狼疮病变形成[14]。因此,本研究选用该模型探讨Embelin对SLE小鼠的免疫调节和治疗作用。结果显示,Embelin可明显改善SLE小鼠肾小球损伤情况(图 1),降低尿蛋白水平(表 2),缓解淋巴结、脾脏和肾脏肿大(图 2)。因此,可以确定Embelin对SLE小鼠有治疗作用。
SLE的发生与T、B淋巴细胞异常活化有关[15]。研究表明,活动期SLE患者外周血中的B细胞表面异常高表达CD40和B7(CD80/CD86)分子,与疾病的严重性及抗dsDNA水平的升高相关[16-17]。活化Th细胞通过其表面的CD40L与B细胞表面的CD40结合为B细胞的活化提供第二活化信号。活化后的B细胞分化为浆细胞,浆细胞可合成分泌抗体。本研究发现,Embelin治疗后,可明显抑制小鼠脾脏和淋巴结中Th细胞表面活化标志CD69、CD154(CD40L)的表达水平,同时B细胞表面活化标志CD69、CD86、MHC-Ⅱ的表达水平也明显下降。表明Embelin可抑制Th和B细胞的活化,可能是Embelin可改善SLE肾脏损伤情况的机制之一。
初始Th细胞在不同细胞因子的作用下可分化为Th1、Th2、Th17和Treg等亚群,不同Th细胞分泌的细胞因子和发挥的免疫作用不尽相同。Th细胞分泌细胞因子之间的失衡在SLE的发生、发展过程中起重要作用,其中Th1/Th2失衡在SLE中起着决定性的作用[18-20],与器官受累情况、疾病本身严重程度密切相关。Th1细胞主要分泌IL-2、IFN-γ,介导细胞免疫应答;Th2细胞主要分泌IL-4、IL-10,介导体液免疫应答。活化Th2细胞一方面可通过其表面的CD40L直接与B细胞表面的CD40结合而辅助B细胞活化,另一方面,Th2细胞通过产生细胞因子协助、促进B细胞增殖、分化为浆细胞产生抗体。活动性SLE表现为Th1细胞功能、数量的下降,并伴随Th2细胞数量、功能的亢进,从而出现B细胞过度活化,产生多种自身抗体[21]。研究表明,SLE小鼠Th1/Th2比例降低,而用甘草酸或地塞米松治疗后,Th1/Th2比例升高[22]。Th17主要分泌IL-17,在SLE和多发性硬化症等自身免疫性疾病的发病机制中起重要作用。在SLE中,IL-17与B细胞活化因子共同作用,可减少B细胞凋亡、增强B细胞增殖,并促进其转变为浆细胞[23]。研究表明Treg可下调Th17和分泌IL-17的滤泡辅助T细胞(Tfh)的比例[24-25]。而Tfh在生发中心发育和浆细胞形成过程中发挥关键作用。Treg也可抑制自身反应性T细胞的增殖来维持自身抗原的免疫耐受性,Treg细胞的缺失与SLE的发病密切相关[26-27]。研究表明,SLE患者的Th1/Th2/Th17/Treg细胞因子的失衡与SLE疾病的进程相关,其中Th1和Treg的相对减少伴随着Th17的相对升高[20]。因此,针对调控Th1/Th2/Th17/Treg细胞平衡的研究将成为SLE治疗的新方向。本研究显示,Embelin治疗后,SLE小鼠淋巴结和脾脏中Th1/Th2和Treg/Th17比例均明显升高。同时,小鼠血清中dsDNA、ssDNA和IgG浓度明显下降。提示Embelin可通过调节Th1/Th2和Treg/Th17平衡而改善SLE小鼠的疾病损伤情况,这也可能是Embelin治疗SLE小鼠有效的机制之一。但本实验结果显示,与对照组相比,Embelin组SLE小鼠淋巴结、脾脏中Th2和Th17细胞的比例差异无统计学意义。我们推测可能是因为每组小鼠数量有限导致,也可能是Embelin对Th2和Th17细胞没有直接调控作用,今后将进一步探讨。
综上所述,Embelin可通过抑制Th、B细胞的活化和调控Th1/Th2、Treg/Th17平衡而对SLE小鼠具有治疗作用。本研究可为临床SLE的治疗用药提供新的理论基础。而Embelin对SLE小鼠免疫调控的分子机制我们将进一步深入研究。
| [1] |
TSAI C Y, LI K J, HSIEH S C, et al. What's wrong with neutrophils in lupus?[J]. Clin Exp Rheumatol, 2019, 37(4): 684-693. |
| [2] |
TSAI C Y, HSIEH S C, LU C S, et al. Cross-talk between mitochondrial dysfunction-provoked oxidative stress and aberrant noncoding RNA expression in the pathogenesis and pathophysiology of SLE[J]. Int J Mol Sci, 2019, 20(20): 5183. |
| [3] |
LI M T, ZHAO Y, ZHANG Z Y, et al. 2020 Chinese guidelines for the diagnosis and treatment of systemic lupus erythematosus[J]. Rheumatol Immunol Res, 2020, 1(1): 5-23. |
| [4] |
BINDA V, TREZZI B, DEL PAPA N, et al. Belimumab may decrease flare rate and allow glucocorticoid withdrawal in lupus nephritis (including dialysis and transplanted patient)[J]. J Nephrol, 2020, 33(5): 1019-1025. |
| [5] |
CHEN H L, SHEN L J, HSU P N, et al. Cumulative burden of glucocorticoid-related adverse events in patients with systemic lupus erythematosus: findings from a 12-year longitudinal study[J]. J Rheumatol, 2018, 45(1): 83-89. |
| [6] |
FANOURIAKIS A, KOSTOPOULOU M, ALUNNO A, et al. 2019 update of the EULAR recommendations for the management of systemic lupus erythematosus[J]. Ann Rheum Dis, 2019, 78(6): 736-745. |
| [7] |
WANG Z, WANG Y, ZHU R, et al. Long-term survival and death causes of systemic lupus erythematosus in China: a systemic review of observational studies[J]. Medicine (Baltimore), 2015, 94(17): e794. |
| [8] |
SHENG Z, GE S, GAO M, et al. Synthesis and biological activity of embelin and its derivatives: an overview[J]. Mini Rev Med Chem, 2020, 20(5): 396-407. |
| [9] |
彭美玉, 王丽娜, 牟东珍. 信筒子醌升高小鼠胰腺癌CTL、NK、NKT和γδT细胞比例[J]. 基础医学与临床, 2017, 37(8): 1161-1162. PENG M Y, WANG L N, MOU D Z. Embelin increased CTL, NK, and ratio of NKT to γδ T cell in pancreatic cancer in mice[J]. Basic Clin Med, 2017, 37(8): 1161-1162. |
| [10] |
XUE Z, GE Z, ZHANG K, et al. Embelin suppresses dendritic cell functions and limits autoimmune encephalomyelitis through the TGF-β/β-catenin and STAT3 signaling pathways[J]. Mol Neurobiol, 2014, 49(2): 1087-1101. |
| [11] |
PENG M, HUANG B, ZHANG Q, et al. Embelin inhibits pancreatic cancer progression by directly inducing cancer cell apoptosis and indirectly restricting IL-6 associated inflammatory and immune suppressive cells[J]. Cancer Lett, 2014, 354(2): 407-416. |
| [12] |
FREITAS E C, DE OLIVEIRA M S, MONTICIELO O A. Pristane-induced lupus: considerations on this experimental model[J]. Clin Rheumatol, 2017, 36(11): 2403-2414. |
| [13] |
KO J H, LEE S G, YANG W, et al. The application of embelin for cancer prevention and therapy[J]. Molecules, 2018, 23(3): 621. |
| [14] |
李荣达, 董莉, 林玲. 诱发性系统性红斑狼疮小鼠模型研究进展[J]. 细胞与分子免疫学杂志, 2013, 29(6): 669-671. LI R D, DONG L, LIN L. Progress of mouse model of induced systemic lupus erythematosus[J]. Chin J Cell Mol Immunol, 2013, 29(6): 669-671. |
| [15] |
OSTER C, WILDE B, SPECKER C, et al. BTLA expression on Th1, Th2 and Th17 effector T-cells of patients with systemic lupus erythematosus is associated with active disease[J]. Int J Mol Sci, 2019, 20(18): 4505. |
| [16] |
GRAMMER A C, LIPSKY P E. B cell abnormalities in systemic lupus erythematosus[J]. Arthritis Res Ther, 2003, 5(Suppl 4): S22-S27. |
| [17] |
YAP D Y H, CHAN T M. B cell abnormalities in systemic lupus erythematosus and lupus nephritis—role in pathogenesis and effect of immunosuppressive treatments[J]. Int J Mol Sci, 2019, 20(24): 6231. |
| [18] |
DOLFF S, BIJL M, HUITEMA M G, et al. Disturbed Th1, Th2, Th17 and Treg balance in patients with systemic lupus erythematosus[J]. Clin Immunol, 2011, 141(2): 197-204. |
| [19] |
MUHAMMAD YUSOFF F, WONG K K, MOHD REDZWAN N. Th1, Th2, and Th17 cytokines in systemic lupus erythematosus[J]. Autoimmunity, 2020, 53(1): 8-20. |
| [20] |
TALAAT R M, MOHAMED S F, BASSYOUNI I H, et al. Th1/Th2/Th17/Treg cytokine imbalance in systemic lupus erythematosus (SLE) patients: Correlation with disease activity[J]. Cytokine, 2015, 72(2): 146-153. |
| [21] |
DATTA S K, ZHANG L, XU L T. T-helper cell intrinsic defects in lupus that break peripheral tolerance to nuclear autoantigens[J]. J Mol Med, 2005, 83(4): 267-278. |
| [22] |
王元元, 柴继侠, 孙美群, 等. 甘草酸调节MRL/lpr狼疮小鼠的免疫功能及机制[J]. 细胞与分子免疫学杂志, 2017, 33(3): 305-309. WANG Y Y, CHAI J X, SUN M Q, et al. Glycyrrhizinic acid modulates the immunity of MRL/lpr mice and related mechanism[J]. Chin J Cell Mol Immunol, 2017, 33(3): 305-309. |
| [23] |
DOREAU A, BELOT A, BASTID J, et al. Interleukin 17acts in synergy with B cell-activating factor to influence B cell biology and the pathophysiology of systemic lupus erythematosus[J]. Nat Immunol, 2009, 10(7): 778-785. |
| [24] |
WU H Y, QUINTANA F J, WEINER H L. Nasal anti-CD3 antibody ameliorates lupus by inducing an IL-10-secreting CD4+ CD25- LAP+ regulatory T cell and is associated with down-regulation of IL-17+ CD4+ ICOS+ CXCR5+ follicular helper T cells[J]. J Immunol, 2008, 181(9): 6038-6050. |
| [25] |
LAROSA M, ZEN M, GATTO M, et al. IL-12 and IL-23/Th17 axis in systemic lupus erythematosus[J]. Exp Biol Med (Maywood), 2019, 244(1): 42-51. |
| [26] |
OHL K, TENBROCK K. Regulatory T cells in systemic lupus erythematosus[J]. Eur J Immunol, 2015, 45(2): 344-355. |
| [27] |
SCHEINECKER C, GÖSCHL L, BONELLI M. Treg cells in health and autoimmune diseases: New insights from single cell analysis[J]. J Autoimmun, 2020, 110: 102376. |