2. 400016 重庆,重庆医科大学: 附属第一医院妇产科
2. Department of Obstetrics and Gynaecology, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China
间充质干细胞(mesenchymal stem cells, MSC)位于骨髓腔内血管周围,通过与局部血管内皮细胞相互作用从而促进血管化发生[1]。而在组织修复研究中,新生组织的成功血管化尤为重要,可保证局部氧气和营养物质的充足供应,提高修复效果[2]。同时,这种组织修复过程中MSC与内皮细胞间的合作与交互作用在更大程度上反映了细胞在生物体内的原生情况。MSC和内皮细胞之间的交互作用可通过多种途径实现,大致分为两类:①间接的细胞间交流方式,即通过分泌可扩散的细胞因子、趋化因子、外泌体等实现细胞间交流[3],研究者们已关注此类交流方式多年;②细胞间通过直接接触的方式交换彼此信息,对于细胞功能也至关重要[4]。
研究显示,细胞间直接交流可通过间隙连接(gap junction)[5]和隧道纳米管(tunneling nanotubes,TNTs)[6]等多种途径实现,其中探索基于TNTs的细胞间直接交流是一个相对新兴的研究领域。研究证实,多种哺乳动物细胞具备形成TNTs的能力[7],其中包括MSC和内皮细胞。TNTs主要由肌动蛋白(F-actin)和脂质膜组成,在不同细胞之间构建起一座由细胞膜和细胞质延续而来的沟通“桥梁”[8]。然而,以往TNTs多在二维贴壁培养中被验证,但是该模型并不能良好还原细胞在生物体内的生理状态,因此会出现体内实验难以还原体外实验结果的现象。与之相比,细胞球三维培养模型能提供更具生理代表性的细胞微环境[9],但TNTs在细胞球三维培养模型中的存在需要进一步的验证,尤其是在三维环境下的不同细胞间。
线粒体是细胞的动力工厂,同时在细胞间对话中也起着重要作用。在组织再生理论中,线粒体正在成为研究焦点。线粒体并不是作为孤立和静止的细胞器发挥其作用,它可以沿着细胞骨架运动,与其他细胞器互动从而调节细胞功能[10]。除此之外,线粒体可以通过TNTs在细胞之间进行转移,从而增强细胞的生物功能[11-13]。同时,β-catenin相关通路的激活也可改善内皮细胞的活性和增殖效率[14]。众所周知,内皮细胞的活性和增殖效率在血管生成中起至关重要的作用[15-16]。因此,线粒体可能作为“通讯员”经TNTs介导细胞间交流从而调控MSC和内皮细胞功能。
本研究首先证明三维共培养细胞球模型中MSC和脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)间存在TNTs;再验证TNTs介导的细胞间线粒体交流的发生;从而评价该过程对细胞球血管形成功能的影响,并初步探索潜在的作用机制。
1 材料与方法 1.1 实验动物与试剂4周龄雌性SD大鼠5只。RPMI1640完全培养基和胰蛋白酶购自Sigma公司,胎牛血清(FBS)购自AusGeneX公司,琼脂糖购自索莱宝公司,微丝解聚试剂CytoD购自MCE公司,鬼笔环肽染色液、Triton X-100、线粒体膜电位检测试剂盒、细胞膜绿色荧光染色试剂盒(DiO)、细胞膜红色荧光染色试剂盒(Dil)购自碧云天公司,小鼠抗CD31一抗购自美国Santa Cluz公司,驴抗兔荧光二抗、驴抗小鼠荧光二抗购自中杉金桥公司,细胞膜染色试剂盒(PKH26)购自赛默飞公司,mGFP-重组腺病毒、mRFP-重组腺病毒、pHBmTur-Mito重组腺病毒购自汉恒公司,兔抗β-catenin一抗购自美国CST公司,鼠抗GAPDH一抗购自义翘神州,Western blot抗小鼠二抗和抗兔二抗购自中杉金桥公司,Matrigel基质胶购自BD公司。本研究经重庆医科大学附属口腔医院伦理委员会批准[2020年伦审(063)号]。
1.2 细胞使用含有10% FBS的RPMI1640完全培养基分离、纯化、培养和传代大鼠骨髓间充质干细胞(MSC)。脐静脉内皮细胞(HUVEC)购自中国科学院细胞库(中国上海)。
1.3 分组情况MSC三维培养组和HUVEC三维培养组:96孔细胞培养板中每孔加入100 μL 1.5%(质量体积分数)的琼脂糖溶液,待其凝固。分别将MSC和HUVEC消化、重悬、计数,制备为0.75×104/mL的MSC细胞悬液和0.25×104/mL的HUVEC细胞悬液,然后分别将100 μL细胞悬液接种到琼脂糖细胞培养板中,培养48 h。
MSC/HUVEC成球共培养组(未处理组):制备1×104/mL的混合细胞悬液(MSC和HUVEC的细胞数量比为3 ∶1)。将100 μL混合细胞悬液接种到琼脂糖细胞培养板中,相同条件下培养48 h。
CytoD处理组:MSC/HUVEC混合细胞悬液中加入微丝解聚试剂CytoD(工作浓度为500 nmol/L),然后接种到琼脂糖细胞培养板中培养48 h。
1.4 共培养细胞球三维重建使用4%多聚甲醛溶液固定细胞球样品1 h后,浸润在PI染色工作液中,避光染色30 min,使用PBS溶液清洗3次,再使用DAPI溶液(以1 ∶1 000体积比稀释)避光染色细胞核15 min。使用PBS清洗3次后,使用激光共聚焦显微镜(LSCM,Leica,美国)对共培养细胞球进行三维重建。
1.5 细胞膜染色后共培养共培养前,使用细胞膜绿色荧光染色试剂盒(DiO)对MSC进行染色,使用细胞膜红色荧光染色试剂盒(DiI)对HUVEC进行染色,多次清洗去掉多余染料。按前述方法将染色后的细胞制备成MSC/HUVEC共培养细胞球,于LSCM下进行观察。同时,将100 μL相同混合细胞悬液接种到普通96孔细胞培养板中培养48 h,使用倒置荧光显微镜进行荧光观察。
1.6 TNTs的直接观察固定后的共培养细胞球使用鬼笔环肽染色试剂盒进行F-actin染色。只有满足以下条件的细胞间连接结构才能判定为TNTs:①主要组成成分为F-actin;②延长轴直径变化较小;③可允许细胞质成分(如线粒体、钙离子、蛋白质等)在细胞间转移[17]。
将共培养细胞球收集于1.5 mL EP管中,离心后将细胞球样品送至电镜室进行后续处理。使用场发射扫描电镜(SU8010 FE-SEM,Hitachi,日本)进行图像采集。
1.7 TNTs的定位固定后的共培养细胞球样品在0.2% Triton X-100中过夜处理。清洗后室温下封闭细胞2 h。样品用抗CD31一抗(以1 ∶300体积比用0.1% Triton X-100溶液稀释)在4 ℃下孵育过夜;随后用相应二抗(以1 ∶300体积比稀释在PBS溶液中)孵育样品2 h。最后进行鬼笔环肽染色,再使用DAPI溶液(以1 ∶1 000体积比稀释)染色15 min。
此外,在进行细胞球制备前,使用PKH26细胞膜染色试剂盒对MSC进行标记。同时,使用mGFP-腺病毒感染HUVEC。随后按前述方法制备共培养细胞球进行鬼笔环肽染色,最后使用LSCM进行观察。
1.8 线粒体的双向转移共培养前,使用pHBmTur-Mito腺病毒感染MSC,标记其胞内的线粒体;使用mGFP-腺病毒感染标记HUVEC。随后制备成共培养细胞球,观察线粒体的移动轨迹。
接着观察线粒体在细胞间能否反向运动。分别使用pHBmTur-Mito腺病毒感染HUVEC标记其胞内的线粒体,使用mGFP-腺病毒感染标记MSC。共培养细胞球制备方法同前,于LSCM下观察。
1.9 线粒体膜电位的检测根据说明书,使用线粒体膜电位检测试剂盒对未处理细胞球组和CytoD处理细胞球组进行JC-1染色,然后使用分光光度计进行光密度值(OD)检测。线粒体膜电位(相对OD值)=JC-1单体光密度值(激发波长488 nm)/JC-1聚合物光密度值(激发波长561 nm),当线粒体膜电位降低时,该比值增加。
1.10 小管形成实验收集三维培养的细胞,加入适量胰蛋白酶消化,随后接种到Matrigel基质胶涂层细胞培养板中(MSC/HUVEC成球共培养组和CytoD处理组每孔2×104个细胞,MSC三维培养组每孔1.5×104个细胞,HUVEC三维培养组每孔0.5×104个细胞),在37 ℃、5%CO2条件下继续培养。
制备密度和细胞比例同前的混合细胞悬液,将100 μL混合细胞悬液接种到普通96孔细胞培养板中培养48 h,随后消化、重悬、计数,接种到Matrigel基质胶涂层细胞培养板中(每孔2×104个细胞),相同条件下培养。
同时,将未经胰蛋白酶处理的共培养细胞球(未处理组、CytoD处理组)直接转移到Matrigel基质胶涂层细胞培养板中(每孔2个细胞球状体),在相同条件下继续培养。倒置显微镜下对小管形成进行观察,使用Image J软件对图片结果进行分析。
1.11 β-catenin蛋白免疫荧光染色将各组细胞样品进行固定,如前所述使用0.2% Triton X-100溶液处理后进行血清封闭。然后将各组样品与一抗(抗体稀释体积比为1 ∶200)在4 ℃下孵育过夜。清洗后将细胞球样品与对应二抗(抗体稀释体积比为1 ∶300)在室温下孵育2 h,然后用DAPI溶液染色15 min进行观察。
1.12 Western blot检测制备同前的混合细胞悬液,将2 mL混合细胞悬液接种到普通6孔细胞培养板中贴壁培养48 h。各组细胞球样品和贴壁培养细胞样品清洗后加入适量RIPA裂解液,随后转移至1.5 mL EP管中, 以400×g,离心15 min,收集上清液。加入适量上样缓冲液,金属浴100 ℃,加热10 min。使用试剂盒配胶完成后按各组上样量20 μL上样,进行SDS-PAGE蛋白电泳,使用5%脱脂奶粉封闭2 h。然后敷一抗(抗体稀释体积比为1 ∶1 000)4 ℃过夜,第2天使用TBST洗膜3次,每次10 min,敷二抗(抗体稀释体积比为1 ∶6 000)室温2 h,再使用TBST洗膜3次,每次10 min,最后采集图像。
1.13 统计学分析采用SPSS 19.0统计学软件进行分析。计量资料以x±s表示,组间比较采用t检验。P<0.05表示差异有统计学意义。使用Graphpad Prism5软件绘制统计图表。
2 结果 2.1 细胞球共培养体系的建立与共培养组比较,单独使用MSC或HUVEC成球培养,细胞无法聚集成球(图 1A)。三维重建结果显示MSC/HUVEC共培养细胞球的立体结构(图 1B)。细胞膜染色共培养结果显示,二维贴壁培养时,细胞各自增殖成团;在成球共培养组中可以观察到不同细胞间的膜性连接,彼此交流(图 1C)。
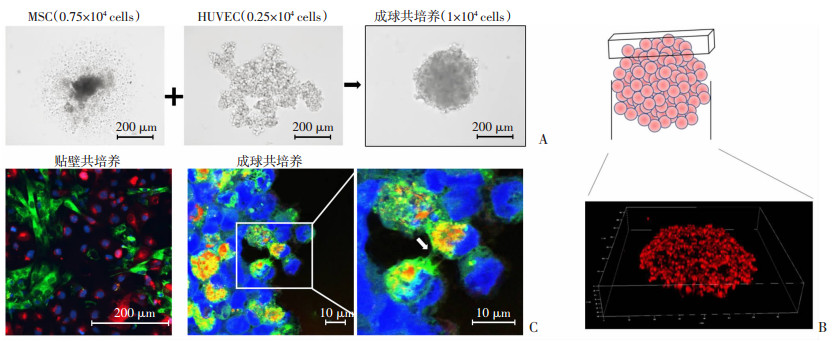
|
| A:细胞成球培养;B:共培养细胞球三维重建;C:细胞膜染色共培养 箭头示TNTs 图 1 细胞球共培养模型的建立 |
2.2 细胞球共培养体系细胞功能验证
图 2A所示,贴壁共培养组、成球共培养组、HUVEC三维培养组和MSC三维培养组在成管效果上有差异。对48 h小管成形实验数据分析显示,与成球共培养组比较,贴壁共培养组、HUVEC三维培养组和MSC三维培养组在管腔连接交叉点数(成球共培养组:83.00±4.16,贴壁共培养组:30.33±4.70,HUVEC三维培养组:42.67±8.41,MSC三维培养组:15.00±3.22;n=3)和小孔数(成球共培养组:19.67±1.20,贴壁共培养组:5.00±1.53,HUVEC三维培养组:6.67±1.33,MSC三维培养组:1.33±0.88;n=3)上均显著减少(P<0.05)。

|
| A:小管形成实验;B:β-catenin免疫荧光染色;C:Western blot检测β-catenin蛋白表达 图 2 细胞球共培养体系功能验证 |
免疫荧光结果显示,与贴壁共培养组比较,成球共培养组的荧光强度增强(图 2B)。考虑到三维条件下细胞重叠对荧光强度的影响,使用Western blot检测细胞内β-catenin的蛋白表达量(图 2C),结果显示,成球共培养组的蛋白表达量(1.432±0.088,n=3)较贴壁共培养组(1.143±0.064,n=3)显著增加(P<0.05)。
2.3 细胞球内TNTs的验证由于TNTs的主要成分为F-actin,因此采用鬼笔环肽染色的方法来确认细胞球内TNTs的存在。如图 3A所示,在LSCM下观察到共培养细胞球内存在鬼笔环肽染色呈阳性的结构,直接将两端细胞物理连接,这些细胞间突起的直径沿长轴变化较小,符合过往研究中总结的TNTs的特征。因此,可以推断MSC/HUVEC共培养细胞球中观察到的这些含有F-actin的细胞间突起结构为TNTs。扫描电镜的结果也显示球内细胞间存在不间断的连接结构,向两端延伸至细胞膜(图 3B)。
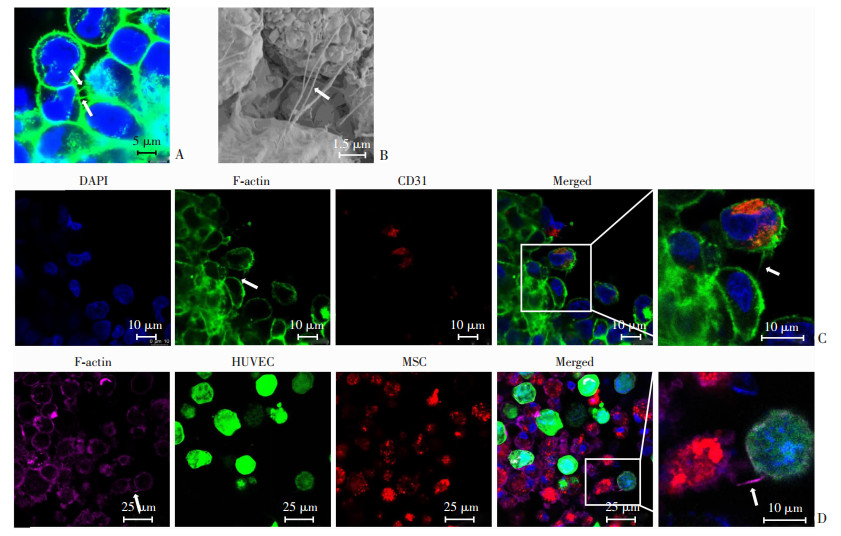
|
| A:细胞球内TNTs结构;B:场发射扫描电镜;C:CD31免疫荧光染色和鬼笔环肽染色;D:荧光标记的细胞及TNTs结构;箭头示TNTs 图 3 共培养细胞球中MSC和HUVEC间TNTs的观察 |
2.4 MSC和HUVEC之间由TNTs物理连接
使用CD31免疫荧光染色对细胞球中HUVEC进行特异性标记,结果显示MSC(CD31-)和HUVEC(CD31+)间存在TNTs结构(图 3C)。此外,共培养前将这两种细胞分别标记上不同荧光,球形共培养完成后结果显示MSC(红色)和HUVEC(绿色)之间有TNTs(紫色)存在(图 3D)。
2.5 MSC和HUVEC能通过TNTs进行线粒体交流光镜下观察显示,与共培养细胞球组相比,CytoD处理组细胞球半径增加(图 4A)。通过腺病毒感染,在绿色荧光蛋白(GFP)标记的MSC胞内观察到来源于HUVEC呈红色荧光的线粒体;CytoD处理组细胞球中MSC胞内的红色荧光减少(图 4B)。同时检测线粒体能否反向从MSC转移至HUVEC胞内。如图 4C所示,MSC胞内的线粒体标记为红色,共培养后在绿色荧光蛋白标记的HUVEC胞内观察到红色荧光,而CytoD处理组荧光共定位现象减弱。线粒体膜电位检测结果显示,与未处理组(0.632±0.048,n=5)比较,CytoD处理组细胞的线粒体膜电位(1.124± 0.132,n=5)显著下降(P<0.05)。
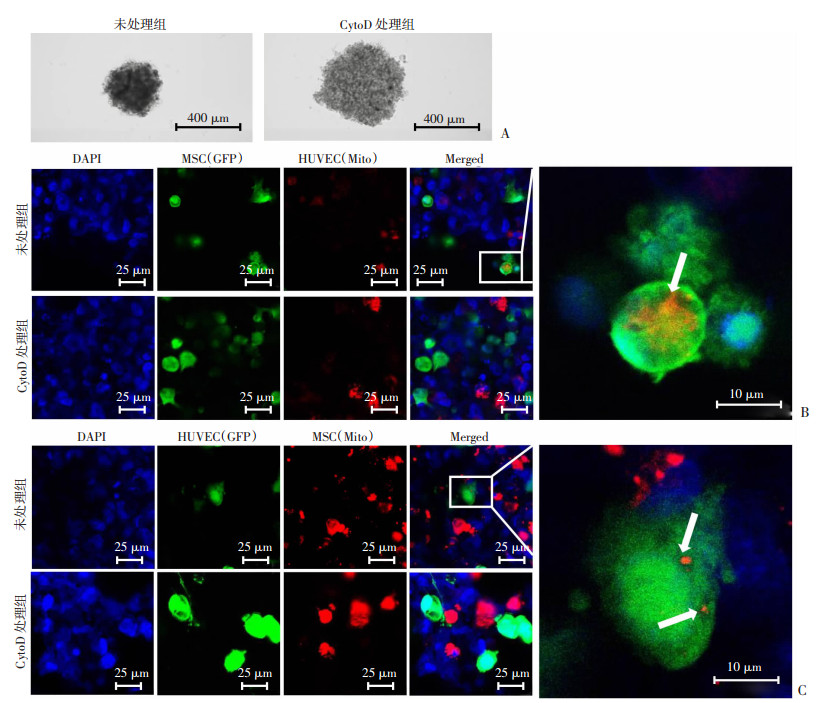
|
| A:光镜下细胞球对比;B:源自HUVEC的线粒体出现在MSC内 箭头示HUVEC线粒体;C:源自MSC的线粒体出现在HUVEC内 箭头示MSC线粒体 图 4 共培养细胞球中TNTs介导线粒体双向交流 |
2.6 细胞间线粒体交流对小管形成的影响
如图 5A所示,未经胰酶消化时,与CytoD处理组相比,未处理组细胞球内HUVEC向外迁移和增殖的速度更快、范围更广;而经胰酶消化后继续培养,与未处理组相比,CytoD处理组形成的小管密度较低。对48 h的小管成形实验数据分析显示,与未处理组比较,CytoD处理组在管腔连接交叉点数(未处理组:76.33±17.30,CytoD处理组:20.67±4.84,n=3)和小孔数(未处理组:19.67±6.23,CytoD处理组:1.00±16.17,n=3)均显著减少(P<0.05)。
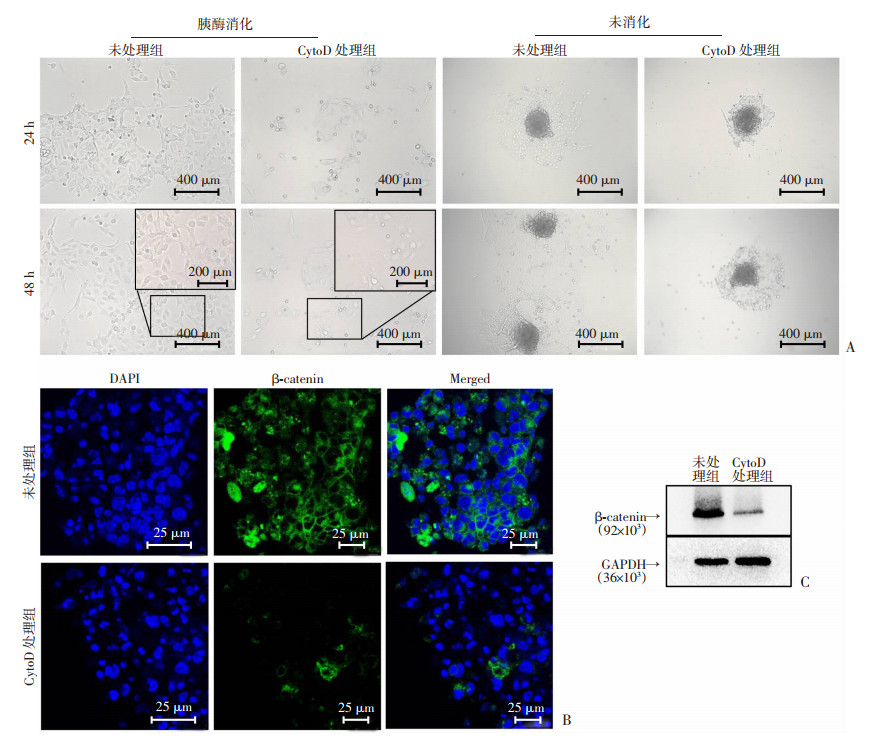
|
| A:HUVEC迁移、增殖和小管形成;B:β-catenin免疫荧光染色结果;C:Western blot检测β-catenin蛋白表达 图 5 TNTs介导的细胞间线粒体交流对HUVEC功能及β-catenin的影响 |
2.7 细胞间线粒体交流影响β-catenin的蛋白表达和HUVEC功能
如图 5B所示,与CytoD处理组相比,未处理组细胞球的β-catenin蛋白荧光强度增强。Western blot结果(图 5C)表明,CytoD处理组β-catenin蛋白的表达水平(0.211±0.002,n=3)较未处理组(1.198±0.028,n=3)显著下降(P<0.05)。
3 讨论血管化是组织再生过程中一个极重要的环节[18],缺乏有效血管再生将导致新生组织无法获得足够营养物质,进而组织缺损修复失败[19]。因此,目前组织修复和再生研究领域多将血管内皮细胞和MSC联合应用,减少细胞因营养缺乏所致的凋亡[20-22]。
以往研究多采用传统二维贴壁共培养模型,不过该模型并不能良好还原细胞在生物体内的生理状态;与之相比,细胞球三维培养模型能提供更符合生物体内原生的微环境[9]。本实验结果表明单独对MSC或HUVEC进行三维培养的效果并不理想;而进行共培养后一种细胞以另一种细胞为刺激中心,发生了更为紧密的细胞间交流,最终团结成细胞球,说明不同细胞间的接触交流影响了细胞行为,这一过程也与胚胎发育过程中的细胞行为相似;在形态发生过程中,复杂的组织结构来源于细胞群,而这些细胞群的生物学行为主要受细胞交流的支配,从而决定细胞的生存、增殖和分化等命运[23]。
本实验结果也表明,相较于贴壁共培养状态,HUVEC在经过与MSC的球形共培养后,其细胞功能得到改善。β-catenin在HUVEC的黏附、增殖和迁移中发挥着重要作用,与血管形成密切相关[24]。降低HUVEC胞内的β-catenin蛋白活性,可使细胞数量减少、增殖速度减慢,血管形成受阻[25]。抑制HUVEC内Src/Akt/β-catenin信号通路将导致血管生成减少[15],而增强β-catenin信号通路转导则可促进HUVEC增殖和血管生成活跃[26]。而在本实验中,与传统二维贴壁培养模型相比,细胞球三维培养模型显著增加了共培养体系中的β-catenin蛋白总量。因此,在立体三维空间中HUVEC和MSC间存在密切的功能交互作用,影响β-catenin蛋白的表达从而影响HUVEC功能。
目前,学者们多关注MSC通过旁分泌[27]和外泌体[28]等间接机制对血管再生的影响,除此之外还存在以TNTs为代表的直接交流通道[17, 29]。TNTs连接仅在二维贴壁培养中得到验证,而对于在细胞球三维条件下不同细胞间的交流通道是否为TNTs这个问题分析有限,限制了细胞球模型在组织再生和修复中的应用。本研究通过鬼笔环肽染色验证了MSC和HUVEC间以F-actin为骨架的TNTs连接的存在,在三维环境下形成立体交流网络,为细胞提供了更多的交流通道,更好地还原了细胞在生物体内的空间位置关系和共生关系,使两种不同的细胞通过这一桥梁紧密联系为一个整体发挥功能,而不仅仅只是简单的单分散细胞聚集成团块。
TNTs作为细胞间的互动交流通道可进行线粒体的转运[8],而线粒体作为细胞能量来源,影响多种细胞活动[30-32]。HUVEC能经TNTs接收来自于MSC的线粒体,从而缓解细胞凋亡,恢复其增殖、迁移和血管形成能力[29]。本研究也观察到线粒体在MSC和HUVEC间的双向交流互动,线粒体膜电位检测结果也表明TNTs能起到维持共培养细胞球线粒体膜电位的作用,而线粒体膜电位改变与细胞程序性死亡密切相关。因此,虽然细胞球内部由于空间致密形成相对低氧环境,但TNTs介导的双向线粒体交流良好维持了细胞的活力,能够防止球体内部的细胞凋亡,从而保护细胞功能。本研究亦证实,当二维贴壁培养时TNTs形成数量减少,此外在CytoD处理的CytoD处理组中也抑制了部分TNTs的形成,而在这两种情况下均存在β-catenin蛋白总量的下降和HUVEC功能的改变。因此,共培养细胞球中TNTs系统的存在可能通过线粒体的双向交流影响β-catenin的蛋白表达,从而影响HUVEC的小管形成功能。
本研究旨在构建一个更接近体内生理状态的MSC/HUVEC共培养细胞球研究模型,在体外实验中尽量还原细胞的原生微环境和立体交流网络,更有利于深入研究细胞间对话机制。同时,血管化是利用干细胞进行组织修复与再生的重要环节之一,本研究证实了TNTs介导的线粒体交流具有促进HUVEC成管功能的潜在能力,为更好地利用共培养细胞球及TNTs交流通道改善细胞功能提供了新的思路,为进一步制定相关治疗策略以实现更有效的血管化组织再生提供了初步理论证据。
本研究也存在一定局限性,尽管体外实验证明TNTs能通过影响细胞间交流调控球内细胞活性和功能,但能否应用于体内实验还有待深究。由于TNTs缺乏特异性的组成成分,因此当使用CytoD作为抑制剂时,在抑制了TNTs的同时也可能会抑制细胞骨架;同时,由于干细胞具有多向分化潜能,共培养细胞球中的MSC是否发生了内皮细胞向分化进而影响成血管效果尚需深入研究。
| [1] |
CASTRECHINI N M, MURTHI P, GUDE N M, et al. Mesenchymal stem cells in human placental chorionic villi reside in a vascular Niche[J]. Placenta, 2010, 31(3): 203-212. |
| [2] |
GRELLIER M, BORDENAVE L, AMÉDÉE J. Cell-to-cell communication between osteogenic and endothelial lineages: implications for tissue engineering[J]. Trends Biotechnol, 2009, 27(10): 562-571. |
| [3] |
GRANT P K, SZEP G, PATANGE O, et al. Interpretation of morphogen gradients by a synthetic bistable circuit[J]. Nat Commun, 2020, 11(1): 5545. |
| [4] |
LJUBOJEVIC N, HENDERSON J M, ZURZOLO C. The ways of actin: why tunneling nanotubes are unique cell protrusions[J]. Trends Cell Biol, 2021, 31(2): 130-142. |
| [5] |
TALBOT J, BRION R, LAMORA A, et al. Connexin43 intercellular communication drives the early differentiation of human bone marrow stromal cells into osteoblasts[J]. J Cell Physiol, 2018, 233(2): 946-957. |
| [6] |
JIANG D, CHEN F X, ZHOU H, et al. Bioenergetic crosstalk between mesenchymal stem cells and various ocular cells through the intercellular trafficking of mitochondria[J]. Theranostics, 2020, 10(16): 7260-7272. |
| [7] |
SISAKHTNEZHAD S, KHOSRAVI L. Emerging physiological and pathological implications of tunneling nanotubes formation between cells[J]. Eur J Cell Biol, 2015, 94(10): 429-443. |
| [8] |
MITTAL R, KARHU E, WANG J S, et al. Cell communication by tunneling nanotubes: Implications in disease and thera-peutic applications[J]. J Cell Physiol, 2019, 234(2): 1130-1146. |
| [9] |
MURPHY K C, HOCH A I, HARVESTINE J N, et al. Mesenchymal stem cell spheroids retain osteogenic phenotype through α2β1 signaling[J]. Stem Cells Transl Med, 2016, 5(9): 1229-1237. |
| [10] |
SEO B J, YOON S H, DO J T. Mitochondrial dynamics in stem cells and differentiation[J]. Int J Mol Sci, 2018, 19(12): E3893. |
| [11] |
WANG J C, LIU X, QIU Y, et al. Cell adhesion-mediated mitochondria transfer contributes to mesenchymal stem cell-induced chemoresistance on T cell acute lymphoblastic leukemia cells[J]. J Hematol Oncol, 2018, 11(1): 11. |
| [12] |
BURT R, DEY A, AREF S, et al. Activated stromal cells transfer mitochondria to rescue acute lymphoblastic leukemia cells from oxidative stress[J]. Blood, 2019, 134(17): 1415-1429. |
| [13] |
SINCLAIR K A, YERKOVICH S T, HOPKINS P M, et al. Characterization of intercellular communication and mitochondrial donation by mesenchymal stromal cells derived from the human lung[J]. Stem Cell Res Ther, 2016, 7(1): 91. |
| [14] |
JIANG L, YIN M, XU J, et al. The transcription factor Bach1 suppresses the developmental angiogenesis of zebrafish[J]. Oxid Med Cell Longev, 2017, 2017: 2143875. |
| [15] |
FOURNIER P, VIALLARD C, DEJDA A, et al. The protein tyrosine phosphatase PTPRJ/DEP-1 contributes to the regulation of the Notch-signaling pathway and sprouting angiogenesis[J]. Angiogenesis, 2020, 23(2): 145-157. |
| [16] |
YI C, WU W, ZHENG D, et al. Targeted inhibition of endothelial calpain delays wound healing by reducing inflammation and angiogenesis[J]. Cell Death Dis, 2020, 11(7): 533. |
| [17] |
ZHANG J L, WHITEHEAD J, LIU Y, et al. Direct observation of tunneling nanotubes within human mesenchymal stem cell spheroids[J]. J Phys Chem B, 2018, 122(43): 9920-9926. |
| [18] |
NAJDANOVIĆ J G, CVETKOVIĆ V J, STOJANOVIĆ S T, et al. Vascularization and osteogenesis in ectopically implanted bone tissue-engineered constructs with endothelial and osteogenic differentiated adipose-derived stem cells[J]. World J Stem Cells, 2021, 13(1): 91-114. |
| [19] |
WANG L, ZHU L X, WANG Z, et al. Development of a centrally vascularized tissue engineering bone graft with the unique core-shell composite structure for large femoral bone defect treatment[J]. Biomaterials, 2018, 175: 44-60. |
| [20] |
HEO D N, HOSPODIUK M, OZBOLAT I T. Synergistic interplay between human MSCs and HUVECs in 3D spheroids laden in collagen/fibrin hydrogels for bone tissue engineering[J]. Acta Biomater, 2019, 95: 348-356. |
| [21] |
ZHANG J, NEOH K G, KANG E T. Electrical stimulation of adipose-derived mesenchymal stem cells and endothelial cells co-cultured in a conductive scaffold for potential orthopaedic applications[J]. J Tissue Eng Regen Med, 2018, 12(4): 878-889. |
| [22] |
MAHON O R, BROWE D C, GONZALEZ-FERNANDEZ T, et al. Nano-particle mediated M2 macrophage polarization enhances bone formation and MSC osteogenesis in an IL-10 dependent manner[J]. Biomaterials, 2020, 239: 119833. |
| [23] |
TODA S, FRANKEL N W, LIM W A. Engineering cell-cell communication networks: programming multicellular behaviors[J]. Curr Opin Chem Biol, 2019, 52: 31-38. |
| [24] |
SONG Z Y, WANG F, CUI S X, et al. Knockdown of CXCR4 inhibits CXCL12-induced angiogenesis in HUVECs through downregulation of the MAPK/ERK and PI3K/AKT and the wnt/β-catenin pathways[J]. Cancer Invest, 2018, 36(1): 10-18. |
| [25] |
SHEN M, BAI D, LIU B, et al. Dysregulated Txnip-ROS-Wnt axis contributes to the impaired ischemic heart repair in diabetic mice[J]. Biochim Biophys Acta Mol Basis Dis, 2018, 1864(12): 3735-3745. |
| [26] |
QIU J J, SUN S G, TANG X Y, et al. Extracellular vesicular Wnt7b mediates HPV E6-induced cervical cancer angiogenesis by activating the β-catenin signaling pathway[J]. J Exp Clin Cancer Res, 2020, 39(1): 260. |
| [27] |
RATUSHNYY A, EZDAKOVA M, BURAVKOVA L. Secretome of senescent adipose-derived mesenchymal stem cells negatively regulates angiogenesis[J]. Int J Mol Sci, 2020, 21(5): 1802. |
| [28] |
YU M Y, LIU W, LI J X, et al. Exosomes derived from atorvastatin-pretreated MSC accelerate diabetic wound repair by enhancing angiogenesis via AKT/ENOS pathway[J]. Stem Cell Res Ther, 2020, 11(1): 350. |
| [29] |
FENG Y H, ZHU R J, SHEN J, et al. Human bone marrow mesenchymal stem cells rescue endothelial cells experiencing chemotherapy stress by mitochondrial transfer via tunneling nanotubes[J]. Stem Cells Dev, 2019, 28(10): 674-682. |
| [30] |
ISLAM M N, DAS S R, EMIN M T, et al. Mitochondrial transfer from bone-marrow-derived stromal cells to pulmonary alveoli protects against acute lung injury[J]. Nat Med, 2012, 18(5): 759-765. |
| [31] |
ACQUISTAPACE A, BRU T, LESAULT P F, et al. Human mesenchymal stem cells reprogram adult cardiomyocytes toward a progenitor-like state through partial cell fusion and mitochondria transfer[J]. Stem Cells, 2011, 29(5): 812-824. |
| [32] |
GUO Y S, CHI X P, WANG Y F, et al. Mitochondria transfer enhances proliferation, migration, and osteogenic differentiation of bone marrow mesenchymal stem cell and promotes bone defect healing[J]. Stem Cell Res Ther, 2020, 11(1): 245. |




