异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo HSCT) 作为大部分血液系统恶性肿瘤的唯一治愈性治疗方法,在过去很长一段时间内是许多病患赖以生存的希望。1981年,北京大学人民医院血液研究所完成了中国首例同种异体造血干细胞移植治疗。而在之后的30年中,中国血液内科领域同行们共同努力,走出了一条造血干细胞移植的“中国特色”之路。据2020年中国血液和骨髓移植登记处统计,我国2020年造血干细胞移植例数达到13 415例,基本赶上了欧美发达国家水平。至2021年,全国已有170家医疗中心获得造血干细胞移植资质。随着中国单倍体移植“北京方案”的不断推广,逐步建立并完善了中国单倍体移植及移植并发症管理体系,为解决供者缺乏及并发症管理难题提出了中国经验[1]。Meta分析结果显示,在有经验的大移植中心,单倍型移植长期生存已经与无关供者全相合造血干细胞移植相当[2]。需要指出的是,移植后的复发及并发症问题仍然是困扰着患者的主要难题,如何进一步提高移植疗效并减少并发症是需要重点攻关的课题。
近几年来,靶向药物不断涌现,各类关键通路抑制剂、单克隆抗体及细胞疗法的研发及临床应用,为血液病恶性肿瘤提供了新的解决方案[3-4]。但是,随着观察时间的延长,靶点逃逸的问题也逐渐显露——药物的迭代总是赶不上肿瘤复发的速度。如何通过延续靶向药物的疗效来延长患者的缓解时间?各种药物及治疗方法间如何相辅相成?另外,随着接受异基因造血干细胞移植患者人数不断增加,如何有效管理各类移植并发症这一影响患者预后及生存质量的重要因素,也需要进一步研究。
本文主要聚焦新药在移植全程(移植前、中、后)的运用,对现有新技术亮点进行总结,并结合笔者的临床经验对异基因造血干细胞移植技术今后的发展做出预测。
1 移植前桥接治疗在移植前达到完全缓解对患者预后有重大意义。但是对于化疗耐药的白血病患者而言,试图在移植前通过化疗将肿瘤细胞清除至细胞学缓解难上加难[5]。针对这类病患,我们在治疗方案中引入了新药。对于难治复发B细胞白血病患者,以嵌合抗原受体T细胞(chimeric antigen receptor T cell,CAR-T)治疗为代表的肿瘤相关抗原表位靶向新药取得了高达80%的完全缓解率的成果。但是,CAR-T治疗后长期随访数据表明,即使达到完全缓解,白血病复发率最高仍可达50%。可见,强势疗法也需要增强后续巩固治疗,不然难以使患者获得长期的生存获益[6]。虽然没有头对头的随机对照临床试验,但是在前期的回顾性或者小样本研究中,可以观察到桥接异基因造血干细胞移植显著提高了患者的生存获益[7]。类似的利用T细胞细胞免疫作用的双特异性T细胞接合抗体(Bispecific T cell Engager)疗法也能使难治复发的CD19阳性急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)达到近60%的首次缓解率[8]。随着免疫细胞治疗药物的陆续上市,大多数通过靶向药物达到缓解的白血病患者都会选择桥接异基因造血干细胞移植作为维持疗效的后续治疗方案。此外,在高危急性髓系白血病(acute myeloid leukemia, AML)和骨髓增生异常综合征(myelodysplastic syndrome, MDS)治疗中去甲基化药物的使用不仅能提高患者诱导化疗的缓解率,同时也能显著降低患者移植后的死亡率,在多项回顾性研究中,去甲基化药物桥接都使患者取得了长期获益[9]。其中,在苏州大学附属第一医院血液科的一项回顾性研究中,桥接地西他滨组患者移植前骨髓完全缓解率为64.0%(16/25),明显高于对照组的15.1%(5/33),显著改善了患者预后[10]。可见针对不同疾病,靶向药物不论是单药还是联合治疗都能显著提高移植患者的预后,这样的生存获益在原本预后不良的二次移植患者中也能被观察到[11]。靶向药物目前在移植前维持治疗及桥接治疗中已占有一席之地。但是目前除了免疫调节药物及少数单抗,大多靶向药物尤其是细胞治疗还没能进入一线。不过,靶向药物在这些领域的未来是可期的。笔者也十分期待所谓一线无化疗或低剂量化疗时代的到来。
2 移植预处理异基因造血干细胞移植主要依靠清髓化疗的作用及移植物抗肿瘤(graft versus leukemia,GVL)效应来达到清除肿瘤细胞的目的[12]。因此,有力但适度的预处理方案设计是移植成败的关键因素。在常规的BU/CY和CY/TBI方案的基础上追求更高效低毒的预处理方案也就成为了临床追求的目标。目前,中国医学科学院血液学研究所牵头的单臂移植预处理阶段添加地西他滨治疗高危及极高危MDS的临床研究使48例患者的2年总体生存率达到86%,且严重急性和慢性移植物抗宿主病(graft-versus-host disease, GVHD)降到23%及15%[13]。陆军军医大学第二附属医院血液病医学中心针对高复发风险及难治、复发急性髓系白血病等病例,在预处理方案中加用地西他滨,AML微小残留病(minimal residual disease,MRD)阳性患者达到严格的完全缓解,进而改善患者长期生存[14-15]。而其他靶点药物,如西达苯胺等代谢相关药物联合化疗作为预处理方案,也显著改善了难治、复发AML患者,尤其是移植前残留病阳性患者的预后。此外,由于清髓化疗有较大副作用,尤其是对基础情况差的老年人,清髓化疗可能无法使患者获益,甚至会增加移植相关死亡风险。这就需要采用非清髓(nonmyeloablative)化疗,即利用部分骨髓毒性相对较低的化疗预处理方案减少毒副作用[16]。但是与之而来的复发导致长期生存预后逊于清髓化疗。不过,随着靶向药如西罗莫司的早期运用,后期GVHD的发病率也被成功降低了[17]。此外,还有一种更加安全的“微移植”方案,即利用短时间的混合嵌合状态成功治疗老年白血病及高危MDS;再加上地西他滨的运用,就能起到抗肿瘤与调节免疫的双重作用。这一方案在相关研究中也显著提高了老年患者的疗效和生存[18]。由此可见,在移植预处理中,靶向药物(尤其是关键通路抑制剂)目前已经被大量运用。而其他新的方法,比如CAR-T细胞及免疫检查点药物也作为预处理方案的一部分被临床创新应用。例如,小样本病例的结果提示预处理中加入CAR-T细胞可以提高单纯化疗预处理的抗肿瘤效应;而即使在免疫抑制剂使用的情况下,也看到了CAR-T细胞在体内的作用和扩增。这些成果无疑给临床提供了一种新的选择[19]。除此之外,新药的加入也降低了移植患者的风险,提高了患者的风险受益比。北大人民医院血液病研究所通过联合抗人胸腺淋巴细胞球蛋白(anti-human thymocyte globulin,ATG)预处理降低T淋巴细胞数量以预防后期GVHD发生。263名患者使用ATG后中重度急性GVHD的发生率从27%降低至13.7%,2年慢性GVHD的累计发生率从52.5%降低至27.9%,显著改善患者移植后生存质量[20]。由此可见,新药的应用使异基因造血干细胞移植预处理更加有效并兼顾了安全性提升。
3 移植后并发症防控异基因造血干细胞移植后供者免疫效应的把控是影响移植患者预后的关键。过强的宿主免疫反应将导致GVHD,而过度抑制则可能导致白血病的复发及各种感染机会的出现[21]。在靶向药物出现之前,供者免疫反应强度主要通过免疫抑制剂用量调节。但是免疫抑制剂是一把“双刃剑”:除了本身的药效,长期使用会导致重症感染和系列并发症。新型靶向药物的出现为分离GVL和GVHD带来了希望。目前许多新型药物都显示出在预防复发的同时抑制GVHD发生的作用。在苏州大学第一附属医院血液科牵头的随机对照研究中,22例异基因造血干细胞移植后AML患者在使用地西他滨维持治疗的移植后3年复发率仅为5.9%,而对照组则高达45.3%[22]。陆军军医大学第二附属医院血液病中心为了减少高危AML患者复发率,采用了重组粒细胞集落刺激因子联合地西他滨的维持治疗,在随机对照研究中,相比对照组,联合用药组的102例患者2年累积复发率从38.3%降至15.0%[23]。南方医科大学南方医院血液科运用索拉非尼用于维持治疗移植后171例FLT3-ITD突变阳性的AML患者,相比对照组1年累积复发率从24.5%降至7%[24]。此外,酪氨酸激酶抑制剂(TKI)对于费城染色体阳性患者(PH+)ALL移植后复发的防治也有积极意义,单臂研究中发现171例2年无病生存率达54%[25]。目前,当MRD转阳时,患者很可能在短期内复发,此时干扰素α能有效清除残留白血病细胞。一项随机对照表明,抢先使用干扰素α使2年复发率从11.5%降到4.3%。此外,细胞治疗也是移植后常用的治疗手段。对于MRD阳性患者,供者淋巴细胞输注(DLI)作为抢先治疗,使完全复发率降低至32.4%。对于异基因造血干细胞移植后复发,尤其是早期复发的白血病曾经被认为是不治之症。但是目前CAR-T细胞,尤其是供者来源的CAR-T细胞疗法已被证明能使79.07%(34/43)的移植后患者达到完全缓解[26]。但是目前对于移植后复发达到再次缓解的患者如何维持治疗或者是否应该进行二次移植仍然存在争论,这也需要后期的临床研究来回答。间充质干细胞作为一种多能干细胞具有显著的免疫调节能力,但是并不会导致免疫的过度抑制。陆军军医大学第二附属医院血液病医学中心牵头的随机对照研究结果显示,在第100天使用脐带来源的MSC能显著使试验组56例患者2年慢性GVHD累计发病率从49.0%降至27.4%, 且没有影响患者的无病生存率[27]。
4 展望随着新技术发展,年龄已经不再是造血干细胞移植的绝对禁忌。为了让更多患者能从造血干细胞移植中获益并有尊严、有质量地生存,靶向新药、细胞新药的参与必不可少(图 1)。古方中的砒霜第一次让世界认识到中国血液人的智慧;而在面对没有合适供者的难题的时候,“北京方案”引领了世界单倍体移植的趋势。在靶向治疗时代,中国新药研发尤其是免疫细胞治疗已经走在了前列,而系列临床研究中也不乏涉及造血干细胞移植与新药结合的思路。靶向药物研发的突飞猛进是患者的机遇,但如何将每个药发挥到最佳疗效并组合出最佳治疗方案却是对血液科医生的挑战。其中,表观遗传学药物联合化疗在AML患者的治疗中已经崭露头角,除了从基础研究入手进一步挖掘其机制以提高疗效外,应当进一步尝试其与现有化疗药物的立体联合,并明确表观遗传药物用药时机与剂量。对于其他靶向药物,如何进一步提高靶点亲和力、减少耐药并尽量避免由于靶点错配导致的毒副作用是亟须解决的重要课题。最后,目前中国免疫细胞疗法相关的临床研究取得了很多成果,在相关研究报道中,细胞免疫治疗的首次缓解率相比传统治疗提高显著且在各个阶段都能与异基因造血干细胞移植紧密结合,但是“定制化”的特点导致细胞治疗无法量产且成本高昂。这极大地限制了细胞治疗的推广运用。为了解决这一问题,“通用型”细胞疗法的技术突破至关重要。目前CAR-NK细胞疗法是一个相较有希望的可行途径,但是其较CAR-T细胞更加容易耗竭且扩增能力差等问题还需要系统工程化改造来解决。
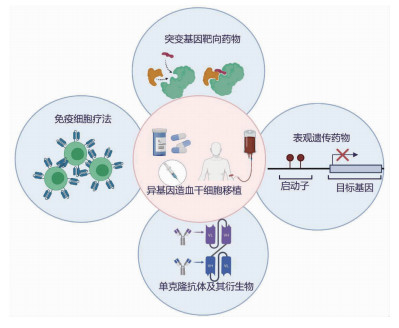
|
| 图 1 目前用于提升接受异基因造血干细胞移植患者预后的新药 |
总的来说,在新药时代,异基因造血干细胞移植后复发及相关并发症如GVHD等一系列难题有了可行的解决路径。可以预测,靶向药物等新药与造血干细胞移植更加紧密地联合是进一步提高移植疗效、增加安全性的有效方法,也是达成使患者获益最终目标的必经之路。
| [1] |
SUGITA J. HLA-haploidentical stem cell transplantation using posttransplant cyclophosphamide[J]. Int J Hematol, 2019, 110(1): 30-38. |
| [2] |
GAGELMANN N, BACIGALUPO A, RAMBALDI A, et al. Haploidentical stem cell transplantation with posttransplant cyclophosphamide therapy vs other donor transplantations in adults with hematologic cancers: a systematic review and meta-analysis[J]. JAMA Oncol, 2019, 5(12): 1739-1748. |
| [3] |
HUANG R, LI X, HE Y, et al. Recent advances in CAR-T cell engineering[J]. J Hematol Oncol, 2020, 13(1): 86. |
| [4] |
CORTES J, KANTARJIAN H. Chronic myeloid leukemia: sequencing of TKI therapies[J]. Hematology, 2016, 2016(1): 164-169. |
| [5] |
CZYZ A, NAGLER A. The role of measurable residual disease (MRD) in hematopoietic stem cell transplantation for hematological malignancies focusing on acute leukemia[J]. Int J Mol Sci, 2019, 20(21): 5362. |
| [6] |
PARK J H, RIVIÈRE I, GONEN M, et al. Long-term follow-up of CD19 CAR therapy in acute lymphoblastic leukemia[J]. N Engl J Med, 2018, 378(5): 449-459. |
| [7] |
WEN S, NIU Z, XING L, et al. CAR-T bridging to allo-HSCT as a treatment strategy for relapsed adult acute B-lymphoblastic leukemia: a case report[J]. BMC Cancer, 2018, 18(1): 1143. |
| [8] |
GOEBELER M E, BARGOU R C. T cell-engaging therapies-BiTEs and beyond[J]. Nat Rev Clin Oncol, 2020, 17(7): 418-434. |
| [9] |
FLOTHO C, SOMMER S, LVBBERT M. DNA-hypomethylating agents as epigenetic therapy before and after allogeneic hematopoietic stem cell transplantation in myelodysplastic syndromes and juvenile myelomonocytic leukemia[J]. Semin Cancer Biol, 2018, 51: 68-79. |
| [10] |
郑慧菲, 王婧, 周进, 等. 地西他滨桥接异基因造血干细胞移植治疗骨髓增生异常综合征的疗效分析[J]. 中华血液学杂志, 2015, 36(2): 121-124. ZHENG H F, WANG J, ZHOU J, et al. Retrospective efficacy analysis of decitabine bridging allogeneic hematopoietic stem cell transplantation on the treatment of myelodysplastic syndrome[J]. Chin J Hematol, 2015, 36(2): 121-124. |
| [11] |
HUI Y, LI Y, TONG X W, et al. Reinduction chemotherapy regimen involved decitabine and cladribine improves the prognosis of patients with relapsed or refractory acute myeloid leukemia: a preliminary study[J]. Int J Cancer, 2021, ijc.33595. |
| [12] |
SPIERINGS E, KIM Y H, HENDRIKS M, et al. Multicenter analyses demonstrate significant clinical effects of minor histocompatibility antigens on GvHD and GvL after HLA-matched related and unrelated hematopoietic stem cell transplantation[J]. Biol Blood Marrow Transplant, 2013, 19(8): 1244-1253. |
| [13] |
CAO Y G, HE Y, ZHANG S D, et al. Conditioning regimen of 5-day decitabine administration for allogeneic stem cell transplantation in patients with myelodysplastic syndrome and myeloproliferative neoplasms[J]. Biol Blood Marrow Transplant, 2020, 26(2): 285-291. |
| [14] |
TANG X W, VALDEZ B C, MA Y J, et al. Low-dose decitabine as part of a modified Bu-Cy conditioning regimen improves survival in AML patients with active disease undergoing allogeneic hematopoietic stem cell transplantation[J]. Bone Marrow Transplant, 2021, 56(7): 1674-1682. |
| [15] |
ZHANG C, CHEN X H, LIU J, et al. Decitabine as a conditioning regimen in haploidentical stem cell transplantation for refractory acute myeloid leukaemia[J]. J Clin Pharm Ther, 2015, 40(3): 336-338. |
| [16] |
SERVAIS S, BARON F, BEGUIN Y. Allogeneic hematopoietic stem cell transplantation (HSCT) after reduced intensity conditioning[J]. Transfus Apher Sci, 2011, 44(2): 205-210. |
| [17] |
SANDMAIER B M, KORNBLIT B, STORER B E, et al. Addition of sirolimus to standard cyclosporine plus mycophenolate mofetil-based graft-versus-host disease prophylaxis for patients after unrelated non-myeloablative haemopoietic stem cell transplantation: a multicentre, randomised, phase 3 trial[J]. Lancet Haematol, 2019, 6(8): e409-e418. |
| [18] |
LI M M, LI C, GENG S X, et al. Decitabine with or without micro-transplantation for the treatment of intermediate or high-risk myelodysplastic syndrome: a Chinese single-center retrospective study of 22 patients[J]. Front Oncol, 2021, 11: 628127. |
| [19] |
ZHANG C, KONG P Y, LI S Q, et al. Donor-derived CAR-T cells serve as a reduced-intensity conditioning regimen for haploidentical stem cell transplantation in treatment of relapsed/refractory acute lymphoblastic leukemia: case report and review of the literature[J]. J Immunother, 2018, 41(6): 306-311. |
| [20] |
CHANG Y J, WU D P, LAI Y R, et al. Antithymocyte globulin for matched sibling donor transplantation in patients with hematologic malignancies: a multicenter, open-label, randomized controlled study[J]. J Clin Oncol, 2020, 38(29): 3367-3376. |
| [21] |
MO X D, XU L P, ZHANG X H, et al. Chronic GVHD induced GVL effect after unmanipulated haploidentical hematopoietic SCT for AML and myelodysplastic syndrome[J]. Bone Marrow Transplant, 2015, 50(1): 127-133. |
| [22] |
MA Y J, QU C J, DAI H P, et al. Maintenance therapy with decitabine after allogeneic hematopoietic stem cell transplantation to prevent relapse of high-risk acute myeloid leukemia[J]. Bone Marrow Transplant, 2020, 55(6): 1206-1208. |
| [23] |
GAO L, ZHANG Y Q, WANG S B, et al. Effect of rhG-CSF combined with decitabine prophylaxis on relapse of patients with high-risk MRD-negative AML after HSCT: an open-label, multicenter, randomized controlled trial[J]. J Clin Oncol, 2020, 38(36): 4249-4259. |
| [24] |
XUAN L, WANG Y, HUANG F, et al. Sorafenib maintenance in patients with FLT3-ITD acute myeloid leukaemia undergoing allogeneic haematopoietic stem-cell transplantation: an open-label, multicentre, randomised phase 3 trial[J]. Lancet Oncol, 2020, 21(9): 1201-1212. |
| [25] |
SAINI N, MARIN D, LEDESMA C, et al. Impact of TKIs post-allogeneic hematopoietic cell transplantation in Philadelphia chromosome-positive ALL[J]. Blood, 2020, 136(15): 1786-1789. |
| [26] |
ZHANG C, WANG X Q, ZHANG R L, et al. Donor-derived CD19 CAR-T cell therapy of relapse of CD19-positive B-ALL post allotransplant[J]. Leukemia, 2021, 35(6): 1563-1570. |
| [27] |
GAO L, ZHANG Y Q, HU B Y, et al. Phase Ⅱ multicenter, randomized, double-blind controlled study of efficacy and safety of umbilical cord-derived mesenchymal stromal cells in the prophylaxis of chronic graft-versus-host disease after HLA-haploidentical stem-cell transplantation[J]. J Clin Oncol, 2016, 34(24): 2843-2850. |




