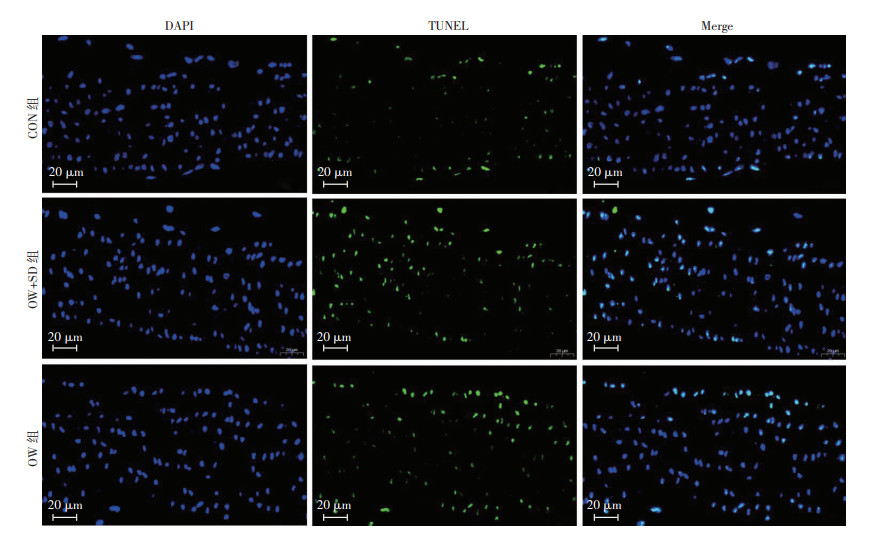
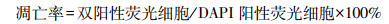2. 730000,兰州,兰州大学第一医院麻醉科
2. Department of Anesthesiology, the First Hospital of Lanzhou University, Lanzhou, Gansu Province, 730000, China
近年国内外各行业中因工作时间过长而猝死的报道越来越多,过劳已成为一个重大社会问题。日本中央大学教授齐藤良夫把过劳定义为“由于活动产生的疲劳不能因休息(包括睡眠)而得到恢复的状态”[1]。目前过劳及过劳死在社会和法律学方面的研究已有一定的成就,但在病理生理方面的研究还很欠缺。以往认为,过劳能使高血压和动脉粥样硬化等疾病逐步恶化,导致心脑血管不良事件的发生,造成永久不能工作甚至死亡的结果[2]。新近研究认为,过劳本身就是一种直接致病或致死的危险因素,会引发特定疾病如高血压、心脏病、糖尿病、高脂血症和抑郁症等[3-4]。其中,心脑血管疾病(如脑出血、脑梗、心梗等)被认为是过劳相关猝死的主要病因之一[5]。在我国一项对云南省猝死病例的研究中发现,猝死的前十大原因中,与血管相关的就占到了一半,包括冠状动脉性心脏病、脑出血、主动脉夹层破裂、动脉瘤破裂、肺栓塞[6]。但对于无心血管相关症状而突发猝死的人来说,现有的研究结果无法解释其病因。
血管平滑肌细胞(vascular smooth muscle cells,VSMC)位于血管中膜且为其主要结构细胞,是血管壁病理变化的物质基础。在动脉粥样硬化、动脉瘤、高血压、血管再狭窄等血管疾病过程中,VSMC均起到关键作用[7]。VSMC的增殖、凋亡及表型决定着血管壁的功能状态,当VSMC凋亡与增殖的平衡状态被打破,血管壁的结构及功能会被破坏,进而引发血管功能障碍甚至破裂[8]。过劳是否能够直接损伤血管,成为心脑血管病变的基础,目前国内外少见研究报道。本实验拟建立大鼠过劳动物模型,检测过劳及睡眠不足对大鼠腹主动脉中膜病理形态、VSMC凋亡及增殖相关指标的影响,探究过劳引起血管病变的可能机制。
1 材料与方法 1.1 主要实验试剂与仪器HE染色试剂盒(博士德生物公司),兔抗Caspase-3抗体(武汉三鹰生物技术有限公司),FITC Tunel试剂盒、qPCR引物、山羊抗兔二抗(武汉赛维尔生物科技有限公司),全景切片扫描仪(3DHISTECH),台式高速冷冻型微量离心机(Dragon Lab),荧光定量PCR仪(Thermo)。
1.2 实验动物及分组健康清洁级雄性SD大鼠18只,初始体质量180~220 g,由兰州大学实验动物中心提供。将18只大鼠分为3组:对照组(CON组)、过劳组(OW组)和过劳+睡眠不足组(OW+SD组)(n=6)。每只大鼠分笼饲养,喂食标准饲料,自由饮水。饲养环境为室温(25±2)℃、湿度(50±10)%,通风流畅,无噪音。本研究经兰州大学实验动物福利和伦理管理委员会批准。
1.3 过劳模型的建立每天固定时间将OW组和OW+SD组的大鼠单独放入水桶中游泳至力竭[水桶高65 cm、直径45 cm,水深(40±2)cm,水温(24±1)℃],上午和下午各1次,连续15 d。力竭标准为大鼠游泳时出现明显的动作失调,或观察到大鼠完全潜入水中(鼻尖低于水平面),超过10 s以上才浮出水面或不能自行浮出水面,这种情况连续发生3次,捞出后翻正反射消失,即认为大鼠完成了1次力竭游泳[9]。游泳结束后将大鼠放回笼中,自由活动及饮食。OW+SD组于每天2次游泳之间被放入水中平台装置中(时长为6 h),以对其睡眠时间予以限制。水中平台装置为一35 cm×40 cm×60 cm的水槽,其内有数个高约12 cm、直径约4 cm的圆柱形平台,水深约10 cm;大鼠被放置在圆柱形平台上,当大鼠在入睡后会因为睡眠期间肌肉张力丧失掉入水中而苏醒。CON组正常饲养,不做特殊处理。
1.4 标本获取造模完成后,大鼠过量麻醉后打开胸腔,暴露心脏,找到主动脉弓,沿主动脉下行,分离腹主动脉。切取腹主动脉2.5 cm,用无菌PBS缓冲液清洗,剥离血管外周结缔组织。取其中0.5 cm腹主动脉置于2.5%戊二醛溶液固定,4 ℃保存;1 cm腹主动脉置于多聚甲醛溶液中固定,常温保存;余1 cm剥除血管外膜与内膜后置于-80 ℃保存备用。
1.5 HE染色法行病理形态学观察取出多聚甲醛溶液固定的腹主动脉,沿管腔剪开,PBS冲洗多聚甲醛固定液,乙醇脱水,石蜡包埋。将石蜡组织块以2 μm厚度连续切片并置于载玻片上,37 ℃培养箱过夜,然后65 ℃保持2 h,石蜡切片用水脱蜡。将切片置于苏木精溶液中数分钟,乙酸及氨水分色各数秒,流水冲洗1 h后入蒸馏水数秒,70%~90%乙醇溶液由低到高浓度依次脱水各10 min,再入乙醇伊红染色液染色2~3 min,无水乙醇脱水,经二甲苯使切片透明。最后,切片用中性树胶包裹覆盖。光学显微镜下观察,采集图形进行分析,使用Image J软件测量血管壁中膜厚度。
1.6 透射电镜观察细胞内超微结构取出固定于10%戊二醛中的血管组织,PBS漂洗3次,每次15 min;PBS配制的1%锇酸避光室温固定2 h,PBS漂洗3次,每次15 min;组织依次入30%→50%→70%→80%→95%→100%→100%酒精上行脱水,每次20 min,100%丙酮2次,每次15 min;丙酮∶812包埋剂=1 ∶1,37 ℃ 2~4 h,丙酮∶812包埋剂=1 ∶2,37 ℃渗透过夜,纯812包埋剂37 ℃ 5~8 h;将纯812包埋剂倒入包埋板,将样品插入包埋板后37 ℃烤箱过夜;包埋板放于60 ℃烤箱聚合48 h;取出树脂块于超薄切片机60~80 nm超薄切片,150目方华膜铜网捞片;铜网于2%醋酸铀饱和酒精溶液避光染色8 min;70%酒精清洗3次;超纯水清洗3次;2.6%枸橼酸铅溶液避二氧化碳染色8 min;超纯水清洗3次,滤纸稍吸干;铜网切片放入铜网盒内室温干燥过夜。透射电子显微镜下观察,采集图像分析。
1.7 TUNEL法检测血管平滑肌细胞的凋亡率按照TUNEL试剂盒的说明书将准备好的石蜡切片在室温下脱蜡至水,PBS润洗,蛋白酶K修复,破膜通透,孵育TUNEL反应液,DAPI染核,抗荧光素淬灭剂封片,最后3D全景扫描拍照,使用Image J软件分析中膜VSMC凋亡率。
1.8 RT-qPCR检测mRNA表达根据试剂盒说明书要求,取出保存于-80 ℃的腹主动脉标本,提取各组大鼠血管组织中总RNA,对浓度过高的RNA进行适当比例的稀释,使其终浓度为200 ng/μL;配置反转录体系对RNA进行反转录,获得cDNA;而后配制RT-PCR反应体系, 并在实时定量PCR仪上进行PCR反应;ΔΔCt法对结果进行分析处理。引物序列见表 1。
| 基因 | 引物序列(5′→3′) | 片段大小/bp |
| Caspase-3 | CTGGACTGCGGTATTGAGACA CGGGTGCGGTAGAGTAAGC |
103 |
| Bax | TGAACTGGACAACAACATGGAG AGCAAAGTAGAAAAGGGCAACC |
148 |
| Bcl-2 | TTGTGGCCTTCTTTGAGTTCG GCATCCCAGCCTCCGTTAT |
151 |
| Ki67 | CCATTAACAAGAGTGAGGGAGTG TGAGTGGAGTATTAGGAGGCAAG |
108 |
1.9 免疫组化染色
制备好的石蜡切片脱蜡水化,柠檬酸抗原修复缓冲液进行抗原修复,PBS洗涤后放入3%双氧水溶液中孵育以阻断内源性过氧化物酶,PBS洗涤后血清封闭,加入一抗(兔抗Caspase-3抗体)孵育过夜,PBS洗涤脱色,加入二抗(兔抗,HRP标记)孵育50 min,PBS洗涤后DAB显色,苏木精复染细胞核,脱水封片,中性树胶封片。显微镜镜检,采集图像分析。
1.10 统计学分析选用SPSS 25.0统计软件对实验数据进行分析,所得实验数据满足正态分布和方差齐性,计量资料数据以x±s表示,组间比较采用单因素方差分析,进一步两两比较采用LSD法,检验水准α=0.05。
2 结果 2.1 HE染色结果对各组大鼠腹主动脉血管壁行HE染色,如图 1。可见CON组血管壁中膜的平滑肌细胞排列整齐,OW组和OW+SD组平滑肌细胞排列较紊乱,部分VSMC细胞内可见胞质空泡化现象。血管壁中膜厚度测量结果显示:与CON组相比,OW组和OW+SD组的血管中膜明显增厚(P < 0.05),OW组和OW+SD组间无明显差异(P=0.083,表 2)。
|
|
in示管腔侧,虚线示中膜厚度,箭头示“空泡”样细胞 A:CON组;B:OW+SD组;C:OW组 图 1 3组大鼠动脉血管壁病理学变化(HE×400) |
| 组别 | 血管中膜厚度/μm |
| CON组 | 78.80±7.94 |
| OW组 | 111.90±22.06a |
| OW+SD组 | 114.61±27.67a |
| a:P < 0.05,与CON组比较 | |
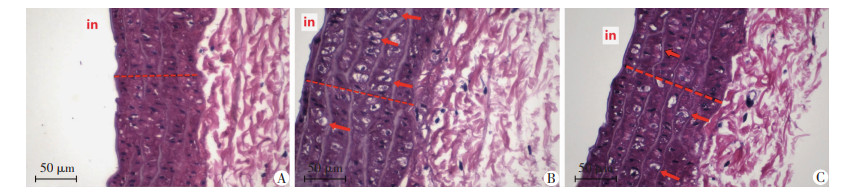
2.2 透射电镜结果
电镜下观察各组大鼠血管中膜细胞超微结构,如图 2。与CON组相比,OW组和OW+SD组大鼠的VSMC胞质内细胞器数量较多,大量聚集,肿胀;线粒体数量丰富,大多明显肿胀,线粒体膜内基质变淡,嵴断裂、减少,少量严重者膜破损、基质外溢;粗面内质网明显扩张,脱颗粒,空泡变;形成具有膜结构的包裹着胞浆内容物和核物质的凋亡小体。
|
| N:细胞核;M:线粒体;RER:粗面内质网;AB:凋亡小体 图 2 透射电镜观察各组大鼠VSMC超微结构变化 |
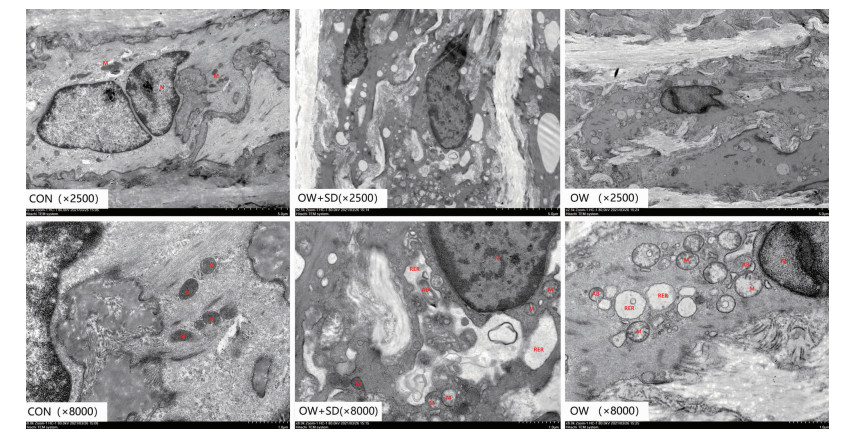
2.3 各组大鼠腹主动脉中层VSMC凋亡率测定
用TUNEL法对各组大鼠腹主动脉中膜VSMC的凋亡率进行分析,如图 3:DAPI染出来的细胞核在紫外线的激发下为蓝色,FITC荧光素标记的阳性凋亡细胞核为绿色。结果显示:OW组和OW+SD组大鼠VSMC凋亡率明显高于CON组(P < 0.05),OW组和OW+SD组间差异无统计学意义(P=0.396,表 3)。
|
| 图 3 3组大鼠动脉中层VSMC凋亡率对比(TUNEL ×400) |
| 组别 | VSCMC凋亡率/% |
| CON组 | 27.08±2.23 |
| OW+SD组 | 39.16±2.75a |
| OW组 | 35.72±1.69a |
| a:P < 0.05,与CON组比较 | |
2.4 Caspase-3、Bax、Bcl-2和Ki67基因表达水平
RT-qPCR法检测各组大鼠腹主动脉中膜的Caspase-3、Bax、Bcl-2和Ki67的mRNA表达水平,结果见表 4:与CON组相比,OW组和OW+SD组大鼠血管中膜的Bax表达明显增加(P < 0.05),OW组和OW+SD组无显著差异(P=0.977);OW组和OW+SD组血管中膜Ki67表达较CON组有明显增加(P < 0.05),OW组和OW+SD组差异无统计学意义(P=0.257);3组大鼠血管中膜Caspase-3和Bcl-2表达差异无统计学意义(P=0.948和P=0.636,>0.05)。
| 组别 | Caspase-3 | Bcl-2 | Bax | Ki67 |
| CON组 | 1.00±0.103 | 1.09±0.49 | 1.00±0.07 | 1.00±0.055 |
| OW+SD组 | 1.02±0.059 | 1.25±0.55 | 1.15±0.09a | 1.28±0.155a |
| OW组 | 1.01±0.134 | 1.38±0.40 | 1.15±0.12a | 1.21±0.06a |
| a:P < 0.05,与CON组比较 | ||||
2.5 大鼠腹主动脉中层Caspase-3蛋白含量测定
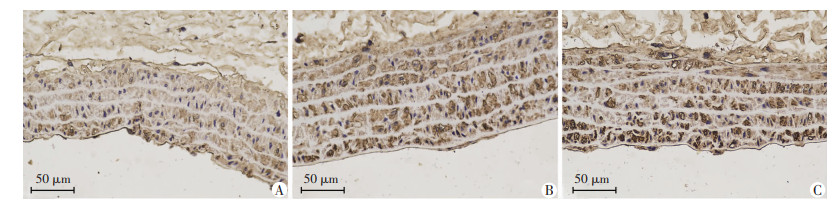
对3组大鼠腹主动脉血管壁进行免疫组化染色,使用Image J软件对图像进行测量分析,用平均光密度值MOD表示Caspase-3蛋白含量,结果显示:OW组(0.234±0.003)和OW+SD组(0.244±0.005)大鼠VSMC的Caspase-3蛋白含量明显高于CON组(0.191± 0.005)(P < 0.05),OW组与OW+SD组差异无统计学意义(P=0.095,图 4)。
|
| A:CON组;B:OW+SD组;C:OW组 图 4 三组大鼠血管VSMC中Caspase-3蛋白含量(S-P ×400) |
3 讨论
过劳是一种社会医学疾病,其特点为超长的工作时间伴随巨大的心理压力,这使得过劳动物模型难以模拟。本实验参考既往关于过劳对心肌损伤的研究[10],选用大鼠力竭游泳模型结合使用水中平台的方法,使动物在强迫“劳动”基础上,实现睡眠时间限制,构建了比较符合人类过劳情景的动物模型。
本实验结果显示:①过劳可以使大鼠腹主动脉血管壁中层的VSMC发生“空泡”样改变,从细胞层面证明过劳会刺激VSMC并使其产生应激反应;②过劳使大鼠腹主动脉VSMC凋亡率增加,且Bax的基因表达水平、Caspase-3的蛋白含量明显高于正常大鼠,结合电镜下细胞内凋亡小体的形成,说明过劳可激活血管壁VSMC的凋亡程序并促进了VSMC的凋亡;③过劳大鼠腹主动脉VSMC中Ki67的表达增加、血管壁中膜增厚,说明过劳促进VSMC凋亡的同时诱发了VSMC的异常增殖与修复。
在光镜下观察血管组织切片时,看到过劳大鼠血管壁中层出现了大量的空泡样细胞,具体表现为细胞状似空泡,胞质不能被染色。这种细胞的空泡化现象,与细胞应激反应密切相关[11],多发生于细胞受到有害物质刺激时(如病原体侵袭、化学物质及生物活性物质刺激等),为细胞适应环境而发生的一种形态学改变,是一种比较常见的现象。因此,细胞空泡化现象的出现,提示过劳使VSMC发生了应激反应。
凋亡是一种细胞程序化死亡的形式,可通过内源性或外源性两种途径实现。同型半胱氨酸蛋白酶家族(Caspase)和Bcl-2家族是凋亡的主要调控因子,不论内源性或是外源性凋亡途径的激活均可由Caspase家族介导,且Caspase-3为大多数凋亡途径的执行蛋白;Bcl-2家族成员包括促凋亡基因(Bax、Bak、Bok等)和抗凋亡基因(Bcl-2、Bcl-xl、Bcl-w等),其中Bcl-2、Bax位于线粒体上游, 是线粒体膜的通透性改变的重要调控因素[12],并直接参与凋亡的调节。诱导细胞凋亡后,它们从细胞质转位到线粒体,破坏线粒体外膜的完整性,控制细胞色素C向细胞质的释放[13]。然后细胞色素C与Caspase-9及凋亡相关因子1形成凋亡小体,导致下游凋亡执行蛋白Caspase-3和Caspase-7的激活[14-15]。本实验检测了Caspase-3的蛋白水平及Bax和Bcl-2的基因表达。结果显示过劳的大鼠血管中层Bax基因表达上调,Caspase-3的蛋白含量增多,VSMC凋亡率增高,结合电镜下观察到细胞内超微结构的改变,表明过劳促进了大鼠Caspase-3依赖性的凋亡。
关于本研究中检测到Caspase-3的mRNA和蛋白表达水平不一致,其原因可能是真核细胞基因表达的转录和翻译具有时空差异所致,在转录后,还有转录后加工、翻译、翻译后加工及修饰等多个环节,每个环节都受多种因素影响;并且mRNA的降解速率和蛋白质的降解速率也存在差异[16-17],所以转录水平和翻译水平并不完全一致。
过劳引起的生理变化复杂,既往研究表明过劳状态下人体内的儿茶酚胺类物质[18]、皮质醇及自由基(特别是活性氧)[19]等均可升高;其中氧化应激反应产物如活性氧等被证明可诱发血管平滑肌细胞的凋亡[20],而儿茶酚胺类物质如肾上腺素被证明可促进血管平滑肌细胞的增殖[21],但不论是凋亡还是增殖均会影响VSMC的表型,进而影响血管的正常功能。Ki67是一种细胞增殖相关的抗原,其功能主要与细胞有丝分裂相关,在除G0期外的各细胞周期中高度表达[22],是细胞增殖能力的评判指标。本实验结果显示过劳大鼠Ki67表达水平明显增加,血管壁中膜明显增厚,提示过劳在促进VSMC凋亡的同时还可能诱使VSMC发生异常增殖。
在正常的血管壁中,VSMC的凋亡与增殖维持在一个相对稳定的平衡状态,当VSMC的增殖与凋亡能力失去平衡,会诱使血管壁发生血管重构。血管重构是血管结构功能发生改变的主动过程,涉及内皮细胞、VSMC等细胞的增殖、迁移、分化、自噬、凋亡、ECM重塑、降解及重新排列,既是维持血管稳态的适应性生理过程又是诸多重要血管疾病共同的关键病理环节[23]。在血管发生紊乱的初期,机体能够启动内源性的代偿机制,引起血管发生适应性的变化与修复,从而维持血管稳态及正常的生理功能[24];然而,修复不当或过度修复会引起血管稳态的失衡,进一步引发心脑血管疾病,例如高血压、肺动脉高压以及动脉粥样硬化等。
本实验还研究了睡眠时间对过劳造成的血管损伤的影响。既往有研究证明,睡眠不足不仅会使血管壁的顺应性变差[25],还会导致血管壁组织受损[26]。这可能与睡眠不足引发氧化应激和脂质过氧化有关[27],氧化应激反应产物如活性氧等被证明可诱发血管平滑肌细胞的凋亡[20]。另有研究表明,相对较长的睡眠时间可明显保护心血管器官,并降低心血管疾病的发病风险[28]。本实验结果显示,睡眠限制的过劳大鼠各项检测指标与非睡眠限制的大鼠相比差异无统计学意义,说明在实验时间内,睡眠未能改善过劳对血管平滑肌细胞的损伤。
综上,过劳可通过激活Caspase-3依赖的凋亡途径,加剧大鼠腹主动脉中层VSMC的凋亡,并可诱发VSMC的修复增殖。这可能是过劳后心、脑等生命脏器动脉血管发生病理性改变,最终引发恶性心血管事件的基础原因。
| [1] |
YAMAUCHI T, YOSHIKAWA T, TAKAMOTO M, et al. Overwork-related disorders in Japan: recent trends and development of a national policy to promote preventive measures[J]. Ind Heal, 2017, 55(3): 293-302. |
| [2] |
杨博帆, 史婧卓, 李倩璟, 等. 过劳死的概念、现状及法医病理学思考[J]. 法医学杂志, 2019, 35(4): 455-458. YANG B F, SHI J Z, LI Q J, et al. The concept, status quo and forensic pathology of karoshi[J]. J Forens Med, 2019, 35(4): 455-458. |
| [3] |
MURATSUBAKI T, HATTORI T, LI J, et al. Relationship between job stress and hypo-high-density lipoproteinemia of Chinese workers in Shanghai: the rosai karoshi study[J]. Chin Med J (Engl), 2016, 129(20): 2409-2415. |
| [4] |
TAYAMA J, LI J, MUNAKATA M. Working long hours is associated with higher prevalence of diabetes in urban male Chinese workers: the rosai karoshi study[J]. Stress Health, 2016, 32(1): 84-87. |
| [5] |
MIAO Q, LI J, PAN Y P, et al. Three cases of karoshi without the typical pathomorphological features of cardiovascular/cerebrovascular disease[J]. Am J Forensic Med Pathol, 2020, 41(4): 305-308. |
| [6] |
孙仲春, 杨启琨, 贾彭林, 等. 云南363例猝死案例的法医病理学分析[J]. 法医学杂志, 2018, 34(4): 384. SUN Z C, YANG Q K, JIA P L, et al. Forensic pathology analysis of 363 sudden death cases in Yunnan Province[J]. J Forens Med, 2018, 34(4): 384. |
| [7] |
QI Y, DAI F, GU J, et al. Biomarkers in VSMC phenotypic modulation and vascular remodeling[J]. Pharmazie, 2019, 74(12): 711-714. |
| [8] |
FRISMANTIENE A, PHILIPPOVA M, ERNE P, et al. Smooth muscle cell-driven vascular diseases and molecular mechanisms of VSMC plasticity[J]. Cell Signal, 2018, 52: 48-64. |
| [9] |
代朋乙, 黄昌林. 运动性疲劳研究进展[J]. 解放军医学杂志, 2016, 41(11): 955-964. DAI P Y, HUANG C L. Research progress of exercise-induced fatigue[J]. Med J Chin PLA, 2016, 41(11): 955-964. |
| [10] |
杨博帆, 史婧卓, 李晶, 等. 大鼠过劳模型心脏Cx43和Cx45的表达[J]. 法医学杂志, 2019, 35(5): 567-571. YANG B F, SHI J Z, LI J, et al. Expression of Cx43 and Cx45 in cardiomyocytes of an overworked rat model[J]. J Forens Med, 2019, 35(5): 567-571. |
| [11] |
刘丹骐, 雷俊, 黄凯, 等. 自噬在草酸诱导人肾小管上皮细胞损伤中的作用[J]. 中南大学学报(医学版), 2021, 46(3): 221-226. LIU D Q, LEI J, HUANG K, et al. Effect of autophagy on oxalate-induced toxicity of human proximal renal tubular epithelial cell[J]. J Central South Univ (Med Sci), 2021, 46(3): 221-226. |
| [12] |
LIN H H, CHEN J H, HUANG C C, et al. Apoptotic effect of 3, 4-dihydroxybenzoic acid on human gastric carcinoma cells involving JNK/p38 MAPK signaling activation[J]. Int J Cancer, 2007, 120(11): 2306-2316. |
| [13] |
POPGEORGIEV N, JABBOUR L, GILLET G. Subcellular localization and dynamics of the Bcl-2 family of proteins[J]. Front Cell Dev Biol, 2018, 6: 13. |
| [14] |
KOLB J P, OGUIN T H, OBERST A, et al. Programmed cell death and inflammation: winter is coming[J]. Trends Immunol, 2017, 38(10): 705-718. |
| [15] |
SINGH R, LETAI A, SAROSIEK K. Regulation of apoptosis in health and disease: the balancing act of BCL-2 family proteins[J]. Nat Rev Mol Cell Biol, 2019, 20(3): 175-193. |
| [16] |
CHEN C A, SHYU A B. Emerging themes in regulation of global mRNA turnover in Cis[J]. Trends Biochem Sci, 2017, 42(1): 16-27. |
| [17] |
DAVIS P R, MILLER S G, VERHOEVEN N A, et al. Increased AMP deaminase activity decreases ATP content and slows protein degradation in cultured skeletal muscle[J]. Metabolism, 2020, 108: 154257. |
| [18] |
SHAN H P, YANG X H, ZHAN X L, et al. Overwork is a silent killer of Chinese doctors: a review of Karoshi in China 2013-2015[J]. Public Health, 2017, 147: 98-100. |
| [19] |
BIGANEH J, ASHTARINEZHAD A, BEHZADIPOUR D, et al. Investigating the relationship between job stress, workload and oxidative stress in nurses[J]. Int J Occup Saf Ergo, 2021, 1-7. |
| [20] |
POPOWICH D A, VAVRA A K, WALSH C P, et al. Regulation of reactive oxygen species by p53: implications for nitric oxide-mediated apoptosis[J]. Am J Physiol Heart Circ Physiol, 2010, 298(6): H2192-H2200. |
| [21] |
SHIN E, KO K S, RHEE B D, et al. Different effects of prolonged β-adrenergic stimulation on heart and cerebral artery[J]. Integr Med Res, 2014, 3(4): 204-210. |
| [22] |
MILLER I, MIN M, YANG C, et al. Ki67 is a graded rather than a binary marker of proliferation versus quiescence[J]. Cell Rep, 2018, 24(5): 1105-1112. e5. |
| [23] |
ZHANG Z, CHEN L, ZHONG J, et al. ACE2/Ang-(1-7) signaling and vascular remodeling[J]. Sci China Life Sci, 2014, 57(8): 802-808. |
| [24] |
QI D, WEI M, JIAO S Y, et al. Hypoxia inducible factor 1α in vascular smooth muscle cells promotes angiotensin Ⅱ-induced vascular remodeling via activation of CCL7-mediated macrophage recruitment[J]. Cell Death Dis, 2019, 10(8): 1-15. |
| [25] |
LIU X, YAN G, BULLOCK L, et al. Sleep moderates the association between arterial stiffness and 24-hour blood pressure variability[J]. Sleep Med, 2021, 83: 222-229. |
| [26] |
SCHEI J L, RECTOR D M. Evoked electrical and cerebral vascular responses during sleep and following sleep deprivation[J]. Prog Brain Res, 2011, 193: 233-244. |
| [27] |
NAWI A, EU K L, FARIS A N A, et al. Lipid peroxidation in the descending thoracic aorta of rats deprived of REM sleep using the inverted flowerpot technique[J]. Exp Physiol, 2020, 105(8): 1223-1231. |
| [28] |
ALCÁNTARA C, GIORGIO COSENZO L, LEIGH A K K, et al. Longer sleep duration and endothelial cell health among a multiethnic sample of adolescents[J]. Psychosom Med, 2019, 81(9): 778-781. |