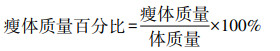2. 100084 北京,北京体育大学:运动人体科学学院;
3. 100084 北京,北京体育大学:运动与体质健康教育部重点实验室
2. School of Sport Science, Beijing Sport University, Beijing, 100084, China;
3. Key Laboratory of Physical Fitness and Exercise of Ministry of Education, Beijing Sport University, Beijing, 100084, China
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)和阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea-hypopnea syndrome,OSAHS)等缺氧性疾病常见于中老年和肥胖等人群,是以持续气流受限为特征的慢性疾病。可进一步发展为肺心病和呼吸衰竭,严重危害患者的生命健康,或将成为世界第三大死亡原因[1]。该类疾病患者机体处于慢性间歇缺氧的状态[2],会导致明显的肺外效应,骨骼肌萎缩是常见的并发症之一,表现为骨骼肌质量的丢失和功能的减弱[3],这将进一步加重缺氧性疾病患者的病情[4]。此外,慢性间歇性低氧暴露是竞技体育的高原训练中常采用的训练模式,如低住高练(living low-training high,LoHi)或高住低练(living high-training low,HiLo)训练法,一般持续3~4周[5]。而该类运动员也常面临肌萎缩的威胁,严重影响运动员的训练效果和比赛成绩[6]。故有必要对慢性间歇性低氧诱导的肌萎缩现象进行深入的研究。
不同肌纤维类型的肌肉对低氧的敏感性不同,低氧诱导的肌萎缩也可能具有肌纤维选择性。研究发现,急性低氧暴露(10%氧浓度暴露1 d)可导致快肌纤维受损;慢性低氧(12.4%氧浓度持续暴露4周)导致快肌萎缩的程度高于慢肌[7]。但关于慢性间歇性低氧对不同类型肌肉的影响还没有定论,有研究发现,COPD患者下肢肌肉中存在肌纤维类型向慢肌转变的趋势,而OSAHS模型动物的上呼吸道肌肉中则会出现慢肌向快肌转化的现象[8]。因此,有关慢性间歇性低氧对不同肌纤维类型肌肉的影响及其机制有待进一步研究。本研究拟采用4周慢性间歇性低氧暴露干预大鼠,观察以慢肌纤维为主的比目鱼肌(soleus muscle,SOL)和以快肌纤维为主的胫骨前肌(musculi tibialis anterior,TA)质量和形态的改变,用RNA测序法探究该过程的作用机制,为探明慢性间歇性低氧对不同类型肌肉影响的机制提供分子水平的参考。
1 材料与方法 1.1 材料与仪器SD大鼠购于北京维通利华实验动物技术有限公司;低氧制备装置:制氮机(北京创文气体有限公司)、冻干机(杭州超滤)和空气压缩机(美国英格索兰);双能X射线(dualenergy X-ray absorptiometry,DEXA)身体成分分析仪购于美国Norland公司;大鼠抓力仪购于北京智鼠多宝公司;RNA保存液购于北京天根生化科技有限公司;多聚甲醛购于上海化学试剂公司;嘌呤霉素(puromycin,Puro)(MABE343)购于美国Sigma公司;Puro抗体(A1113802)购于美国Thermo Fisher公司;泛素(ubiqunitin,Ub)抗体(sc-8017)购于美国Santa公司;α-tubulin抗体(T6074)购于美国Sigma公司。
1.2 方法 1.2.1 实验对象和分组雄性SD大鼠16只,初始体质量为(334.63±7.25)g,分为:常氧对照组(C组,n=8),生活在常氧环境中;慢性间歇性低氧组(H组,n=8),置于低氧房(制氮机、冻干机和空气压缩机通过共同作用将空气中的氮气通入密闭房间内达到设定氧浓度),干预方案为8 h/d(每日8:00-16:00),氧浓度为12.4%(相对于海拔4 000 m的高度),共4周[9-10]。记录各组大鼠体质量和摄食量。饲养与低氧暴露均在北京体育大学动物实验室(许可证号:SYXK(京)2016-0033)内进行。本实验经过北京体育大学运动科学伦理审查委员会的批准(2015040)。
1.2.2 DEXA法测量瘦体质量干预结束后,大鼠禁食24 h,腹腔注射2%戊巴比妥钠(40 mg/kg)麻醉,DEXA法(根据不同能量的X射线通过动物组织时的衰减和吸收状况,测定骨骼无机盐、体脂和瘦体质量含量的方法)测量瘦体质量(去脂体质量),计算瘦体质量百分比(%)。
1.2.3 抓力仪测试抓力大鼠抓住抓力仪抓杆后,测试者向后拉住大鼠尾巴,逐渐增大拉力,直至超过大鼠最大抓力,大鼠松开抓杆时,仪器自动记录并显示最大抓力值,测量3次,取最大值,并计算相对抓力(最大抓力/体质量)。
1.2.4 取材干预4周后,大鼠在取材前30 min腹腔注射Puro(40 nmol/g)。麻醉后腹主动脉取血处死,取同侧SOL和TA,称量湿质量,分成两份,一份置于RNA保存液中,另一份置于液氮冷冻后,转移至-80 ℃保存。另一侧肌肉置于4%多聚甲醛中固定。
1.2.5 HE染色观察肌纤维形态固定24 h后,进行浸蜡、包埋、对肌腹处肌肉切片后,进行脱蜡、透明、梯度乙醇浸泡、Harris苏木素和0.5%伊红染色(hematoxylin-eosin,HE)、梯度乙醇浸泡、封片处理,10× 10倍镜下观察并拍照。Image-Pro Plus(IPP)6.0计算肌纤维横截面积(fiber cross sectional area,FCSA)。以FCSA小于对照组10%为肌萎缩判断标准。
1.2.6 Western blot检测蛋白质表达提取SOL和TA蛋白质,BCA法测定蛋白浓度,调整上样量为20 μg。梯度胶电泳分离蛋白,转膜至NC膜上,根据Marker条带及目的蛋白的分子量裁膜,封闭,孵育Puro和Ub一抗,4 ℃过夜,室温孵育二抗,TBS洗涤,使用Image Studio Ver 5.2软件曝光,对条带的信号值进行相对定量分析,以α-tubulin为内参。
1.2.7 骨骼肌RNA测序提取SOL和TA总RNA,并进行浓度和纯度的检测,纯化总RNA中的mRNA,对RNA进行片段化处理,然后进行cDNA的合成,PCR富集文库片段,荧光定量检测文库总浓度,采用第二代测序技术,基于Illumina平台进行上机测序。对测序数据进行过滤、质量评估和比对结果评估,然后进行表达量计算,分析差异表达基因,并对差异基因进行富集分析(GO分析和KEGG Pathway分析)。
1.3 统计学分析采用SPSS 22.0统计软件,实验数据以x±s表示,体质量和摄食量的测试采用重复测量方差分析;两组间比较采用独立样本t检验,P < 0.05表示差异有统计学意义;采用DESeq对基因表达进行差异分析,筛选差异表达基因条件为:表达差异倍数Fold change>2,显著性P < 0.05;显著富集标准为P < 0.05。
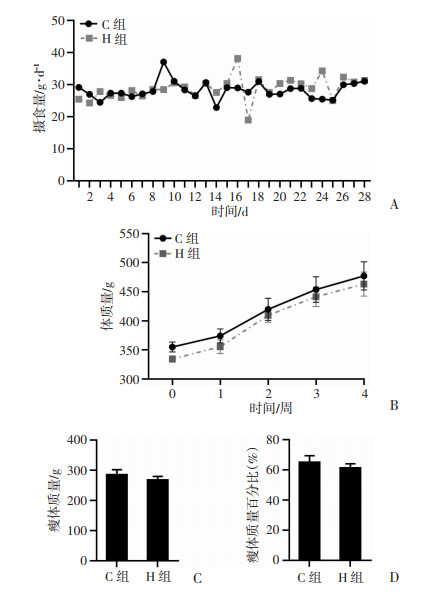
2 结果 2.1 摄食量、体质量和瘦体质量干预期间,各组摄食量在干预期间差异均无统计学意义,见图 1A。C组和H组体质量整体保持增长趋势(干预后较干预前增长率分别为42.44%和38.56%),以每周为一个时间点,H组体质量在各时间点均低于C组,但差异无统计学意义,见图 1B。干预后测试各组大鼠瘦体质量,H组大鼠瘦体质量和瘦体质量百分比较C组有下降趋势,但差异无统计学意义,见图 1C、D。
|
| A:日摄食量;B:每周体质量;C、D:分别为瘦体质量和瘦体质量百分比 图 1 干预期间两组大鼠摄食量、体质量和干预后瘦体质量(n=8,x±s) |
2.2 抓力
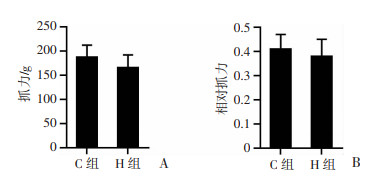
干预末次测试大鼠抓力,H组抓力和相对抓力较C组均有下降趋势,但差异无统计学意义,见图 2。
|
| A:抓力;B:相对抓力(抓力/体质量) 图 2 干预后两组大鼠抓力比较(n=8,x±s) |
2.3 肌肉湿质量和FCSA
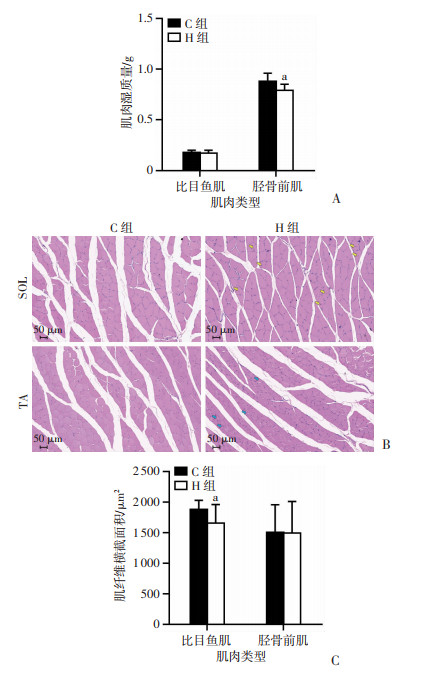
干预后测试大鼠两种肌肉湿质量,结果显示,H组SOL湿质量低于C组,但差异无统计学意义,H组TA湿质量显著低于C组(P < 0.05,图 3A);HE染色观察肌纤维形态发现,低氧干预后两种肌肉的形态均发生改变,SOL中主要表现为肌纤维横截面积缩小,肌细胞的细胞核内移(黄色箭头示),TA中主要表现为肌纤维呈现不规则的多边形(蓝色箭头示),见图 3B;统计FCSA发现,H组SOL的FCSA显著低于C组(P < 0.05),TA中两组差异无统计学意义,见图 3C。
|
| A:SOL和TA湿质量比较(n=8,x±s);B:HE染色观察两组SOL和TA形态 黄色箭头示肌细胞核内移,蓝色箭头示肌纤维呈现不规则状;C:SOL和TA肌纤维横截面积比较(n=3,x±s) a:P < 0.05,与C组比较 图 3 干预后两组大鼠肌肉湿质量、肌纤维形态和肌纤维横截面积 |
2.4 Puro和Ub含量及比值
Puro结合多肽量表示蛋白质的总合成量,H组SOL中Puro结合多肽量显著高于C组(P < 0.05),TA中H组与C组差异无统计学意义;Ub含量表示蛋白质被泛素化标记分解的总量,H组SOL中Ub标记蛋白质量显著高于C组(P < 0.05),TA中H组与C组差异无统计学意义,见图 4A、B;用Puro/Ub比值来反映蛋白质累积量,H组SOL中两者比值显著降低(P < 0.05),而TA中两者比值显著增加(P < 0.01),见图 4C。
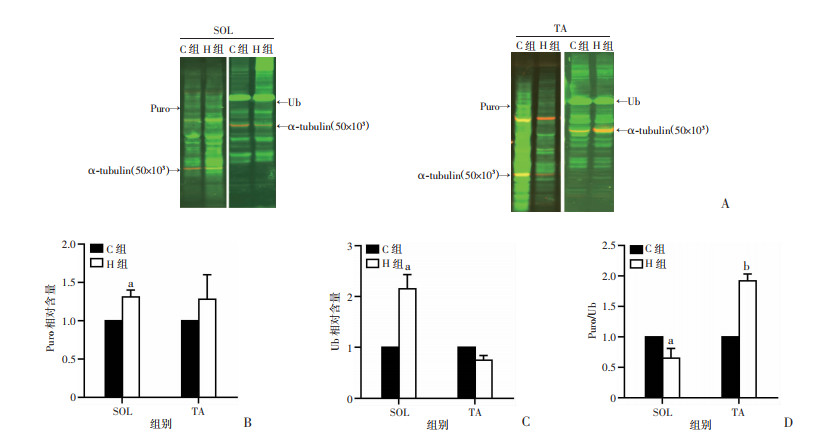
|
| A:Western blot检测结果;B:SOL和TA中Puro相对含量;C:SOL和TA中Ub相对含量;D:SOL和TA中嘌呤霉素/泛素比值; a:P < 0.05,b: P < 0.01与C组比较 图 4 干预后两组大鼠肌肉中Puro和Ub相对含量及比值(n=6,x±s) |
2.5 干预后大鼠骨骼肌测序结果 2.5.1 差异表达基因
SOL中,H、C两组(SOL-H/C)差异基因共有665个,其中上调基因528个,下调基因137个;TA中,H、C两组(TA-H/C)差异基因共有228个,其中上调基因128个,下调基因100个,见图 5A;在SOL-H/C组和TA-H/C组中均上调的基因有58个,均下调的基因有35个;在SOL-H/C组中上调而在TA-H/C组中下调的基因有5个;在SOL-H/C组中下调而在TA-H/C组中上调的基因有3个,见图 5B。
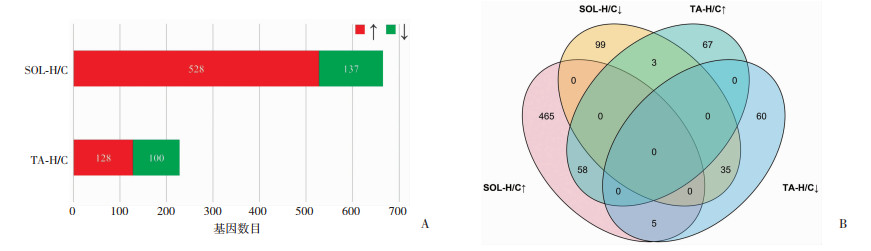
|
| A:SOL和TA中上/下调差异基因数目 红色表示上调基因数目,绿色表示下调基数目;↑:上调基因,↓:下调基因;B:SOL和TA中上/下调差异基因韦恩图 图 5 SOL和TA中两组上/下调差异基因数目及韦恩图 |
2.5.2 GO分析差异基因所富集的生物过程
SOL中,两组上调差异基因所富集的生物过程(biological process,BP)主要为:炎症反应、细胞对白细胞介素-1(interleukin-1,IL-1)的反应、低氧应答、对细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)的正向调控等,见图 6A;下调差异基因与骨骼肌功能关联度低,见图 6B;TA中,两组上调差异基因BP主要为:谷胱甘肽代谢、低氧应答、胰岛素应答、葡萄糖稳态、对糖皮质激素的反应、葡萄糖代谢过程等,见图 6C;下调差异基因BP主要为:快肌和慢肌之间的转化、调节骨骼肌收缩、对过度缺氧的反应、对低氧的反应、对过氧化氢的反应,见图 6D。
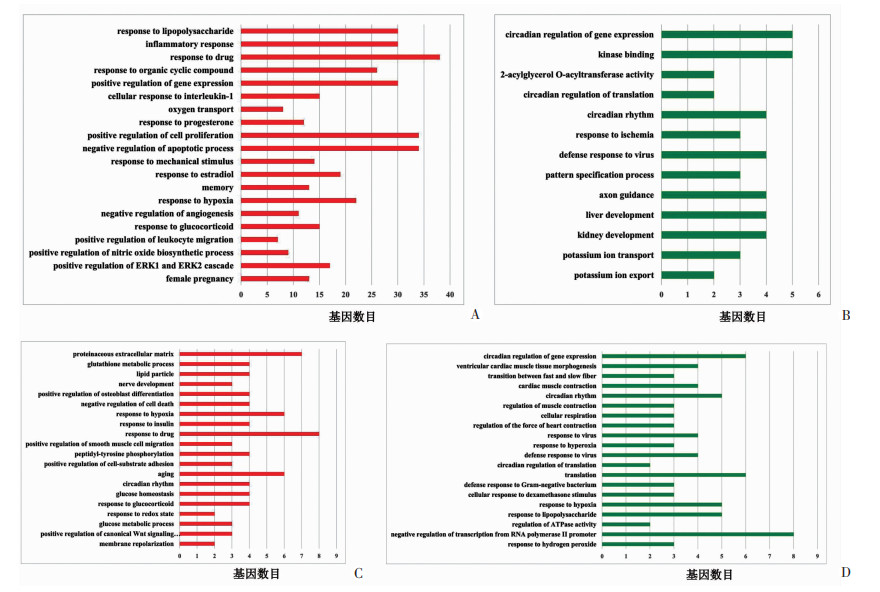
|
| A:SOL中上调差异基因所富集的GO分析;B:SOL中下调差异基因所富集的GO分析;C:TA中上调差异基因所富集的GO分析;D:TA中下调差异基因所富集的GO分析;根据P值大小排序(从上至下P值依次增加) 图 6 SOL和TA中两组上/下调差异基因所富集的BP |
2.5.3 KEGG分析差异基因所富集的通路
SOL中,H、C两组上调差异基因所富集的通路主要为:肿瘤坏死因子(tumor necrosis factor,TNF)信号通路、Jak(janus kinase)-信号转导子和转录激活子(signal transducer and activator of transcription,STAT)信号通路等,见图 7A;TA中,H、C两组上调差异基因所富集的通路主要为:过氧化物酶体增殖物激活受体(peroxisome proliferator activated receptor,PPAR)信号通路和谷胱甘肽代谢(glutathione metabolism)等,见图 7C;SOL和TA中,下调差异基因所富集的通路与骨骼肌功能关联度低,见图 7B、D。
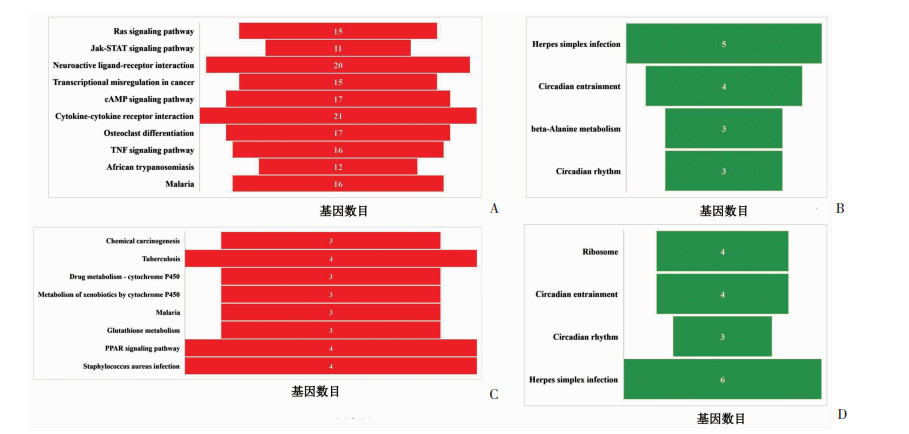
|
| A:SOL中上调差异基因所富集的通路;B:SOL中下调差异基因所富集的通路;C:TA中上调差异基因所富集的通路;D:TA中下调差异基因所富集的通路;根据P值大小排序(从上至下P值依次增加) 图 7 SOL和TA中H、C两组上/下调差异基因所富集的通路 |
3 讨论
骨骼肌由具有不同代谢和收缩特性的纤维类型组成。慢肌纤维为主的肌肉特点是线粒体、肌红蛋白含量高,毛细血管密度高;快肌纤维为主的肌肉氧化能力较低,毛细血管密度低。病理性缺氧和环境缺氧都会造成骨骼肌代谢改变和质量损失[11],但不同纤维类型的肌肉对慢性间歇性低氧的敏感性还不清楚,其作用机制也有待进一步研究。
本研究结果显示,4周的慢性间歇性低氧暴露可导致大鼠体质量的降低。虽然大鼠的瘦体质量、抓力没有显著改变,但慢性间歇性低氧暴露显著降低了大鼠TA的湿质量和SOL的FCSA,且两种肌肉的肌萎缩结构都有明显的损伤,SOL表现为肌细胞核内移,而TA肌纤维呈现不规则状[12]。为了探究两种肌肉蛋白代谢水平,本研究采用测试蛋白质累积量的方式反映骨骼肌蛋白质的合成和分解程度,氨酰基-tRNA类似物Puro可与氨基酸结合,进入新生肽链中,终止蛋白质合成过程,检测其含量可以表示新生多肽量,用于直观反映蛋白质合成量[13]。Ub可标记要降解的蛋白质,通过蛋白酶被降解,该过程构成的泛素蛋白酶系统(Ub-proteasome system,UPS)是蛋白质分解的主要途径[14]。结果发现,低氧干预后,SOL的蛋白质合成和分解程度均增加,但蛋白质累积量降低,即SOL蛋白质以分解代谢为主,而TA蛋白质累积量增加。综上所述,慢性间歇性低氧对以慢肌为主的SOL影响程度高于以快肌为主的TA,SOL表现出更严重的肌萎缩水平。
为了进一步探究该过程的机制,本研究采用骨骼肌RNA测序的方式筛选SOL和TA的差异表达基因,并分析这些基因所富集的生物过程和通路。结果显示,SOL对慢性间歇性低氧更为敏感,表现为差异表达基因数目远高于TA(665 vs 228)。低氧干预后,SOL中上调基因的功能主要为炎症反应、细胞对IL-1的反应、对ERK1/2的正向调控等,且TNF和Jak-STAT信号通路参与该过程。研究发现,采用缺血再灌注(ischemia-reperfusion,IR)的方式模拟慢性间歇性低氧干预,可见小鼠骨骼肌收缩力降低,形态受损,并伴随着巨噬细胞浸润和TNF介导的炎症水平增加[15]。TNF-α和IL-1β介导的炎症水平增加是促进肌萎缩的重要因素。老年小鼠骨骼肌中TNF-α水平升高,与肌肉萎缩、卫星细胞和慢肌纤维数量减少有关,并伴随着UPS中E3泛素连接酶表达增加[16-17];此外,Jak/STAT3信号通路也可通过调节UPS等蛋白分解途径介导骨骼肌萎缩的发生[18]。低氧干预后,SOL中除了蛋白质分解作用增加,合成途径也增加,而ERK1/2是骨骼肌蛋白质合成的关键蛋白,在维持肌肉质量中发挥着重要作用,测序结果也显示对ERK1/2的正向调控相关基因表达增加。虽然蛋白质合成和分解均增加,但合成程度不敌分解,SOL在慢性间歇性低氧干预下最终表现为肌纤维受损和肌肉质量的丢失。
低氧干预后,TA中上调基因的功能所富集的BP主要为糖代谢(胰岛素应答、葡萄糖稳态和葡萄糖代谢过程)、对糖皮质激素的反应和抗氧化过程(谷胱甘肽代谢)。研究发现,慢性间歇性低氧可导致胰腺β细胞功能紊乱,并导致胰岛素靶器官肝脏、骨骼肌和脂肪组织的胰岛素抵抗[19],而葡萄糖利用障碍可降低骨骼肌质量和功能。此外,骨骼肌是糖皮质激素的主要靶点,适量的糖皮质激素有助于发挥抗炎和免疫抑制的作用,而过量则会打破骨骼肌的蛋白质代谢平衡,诱发骨骼肌萎缩,促进肌少症的发生[20]。本研究中虽然TA湿质量降低,肌纤维形态有一定的损伤,但其FCSA没有明显的变化,且Puro/Ub比值增加,说明TA对慢性间歇性低氧已产生适应,肌萎缩程度已开始缓解。分析其差异基因功能可知,抗氧化物质谷胱甘肽及其代谢通路、PPAR信号通路相关基因的表达增加,可能是TA发挥抵抗低氧诱导肌萎缩的关键因素。谷胱甘肽可维持骨骼肌的氧化还原稳态,谷胱甘肽缺失可导致肌萎缩的发生,并伴随有骨骼肌葡萄糖利用障碍[21]。而增加PPARα的表达可以抑制核因子-κB(nuclear factor-kappa B,NF-κB)活化,抑制炎症反应,减轻肌肉萎缩[22]。提示TA可能通过增加PPAR通路和抗氧化作用以逐步适应慢性间歇性低氧刺激,缓解肌萎缩症状。
综上所述,本研究显示,慢性间歇性低氧诱导肌萎缩具有纤维选择性,以慢肌纤维为主的比目鱼肌较以快肌为主的胫骨前肌更易发生萎缩。其中,比目鱼肌萎缩可能与炎症反应增强有关,胫骨前肌则有可能通过提高抗氧化能力来抵抗肌萎缩。
| [1] |
AUSÍN P, MARTÍNEZ-LLORENS J, SABATÉ-BRESCO M, et al. Sex differences in function and structure of the quadriceps muscle in chronic obstructive pulmonary disease patients[J]. Chron Respir Dis, 2017, 14(2): 127-139. |
| [2] |
PAN L L, KE J Q, ZHAO C C, et al. Electrical stimulation improves rat muscle dysfunction caused by chronic intermittent hypoxia-hypercapnia via regulation of miRNA-related signaling pathways[J]. PLoS One, 2016, 11(3): e0152525. |
| [3] |
付鹏宇, 胡扬, 龚丽景. 低氧暴露诱导肌萎缩发生的机制探讨[J]. 生理科学进展, 2019, 50(3): 205-210. FU P Y, HU Y, GONG L J. Mechanism of myoatrophy induced by hypoxic exposure[J]. Prog Physiol Sci, 2019, 50(3): 205-210. |
| [4] |
杨亚辉, 李健, 李培君, 等. 氧化应激在慢性阻塞性肺疾病骨骼肌功能障碍的作用及运动干预的影响[J]. 中国康复医学杂志, 2021, 36(5): 620-625. YANG Y H, LI J, LI P J, et al. Effect of oxidative stress on skeletal muscle dysfunction in chronic obstructive pulmonary disease and effect of exercise intervention[J]. Chin J Rehabilit Med, 2021, 36(5): 620-625. |
| [5] |
胡扬. 高原训练的多元化发展: 从HiHi到HiLo再到HiHi+ HiHiLo[J]. 体育科学, 2010, 30(11): 74-78. HU Y. Diversified development of altitude training—from HiHi to HiLo as well as HiHi+HiLo[J]. China Sport Sci, 2010, 30(11): 74-78. |
| [6] |
BIGARD A X, BRUNET A, GUEZENNEC C Y, et al. Skeletal muscle changes after endurance training at high altitude[J]. J Appl Physiol, 1991, 71(6): 2114-2121. |
| [7] |
付鹏宇, 于加倍, 朱镕鑫, 等. 4周抗阻训练缓解低氧诱导大鼠肌萎缩中不同肌纤维类型的敏感性差异[J]. 环境与职业医学, 2021, 38(8): 901-909. FU P Y, YU J B, ZHU R X, et al. Differential sensitivity of muscle fiber types to hypoxia-induced muscle atrophy in rats relieved by 4-week resistance training[J]. J Environ Occup Med, 2021, 38(8): 901-909. |
| [8] |
CHAILLOU T. Skeletal muscle fiber type in hypoxia: adaptation to high-altitude exposure and under conditions of pathological hypoxia[J]. Front Physiol, 2018, 9: 1450. |
| [9] |
于加倍, 胡扬, 李燕春, 等. 4周爬梯抗阻训练对低氧诱导大鼠骨骼肌萎缩的影响[J]. 中国实验动物学报, 2018, 26(4): 448-453. YU J B, HU Y, LI Y C, et al. Effects of 4-week resistance training on hypoxia-induced skeletal muscle atrophy in rats[J]. Acta Lab Animalis Sci Sin, 2018, 26(4): 448-453. |
| [10] |
龚丽景, 付鹏宇, 朱镕鑫, 等. 低氧对肥胖小鼠棕色脂肪组织相关基因表达的影响及其机制[J]. 中国应用生理学杂志, 2018, 34(1): 88-92, 100. GONG L J, FU P Y, ZHU R X, et al. Effects and mechanism of hypoxia exposure on related genes in brown fat tissue of obese mice based on mRNA expression profile microarray[J]. Chin J Appl Physiol, 2018, 34(1): 88-92, 100. |
| [11] |
CHAILLOU T, KOULMANN N, MEUNIER A, et al. Effect of hypoxia exposure on the recovery of skeletal muscle phenotype during regeneration[J]. Mol Cell Biochem, 2014, 390(1/2): 31-40. |
| [12] |
CHAUDHARY P, SHARMA Y K, SHARMA S, et al. High altitude mediated skeletal muscle atrophy: Protective role of curcumin[J]. Biochimie, 2019, 156(1): 138-147. |
| [13] |
UOZUMI N, MATSUMOTO H, SAITOH H. Detection of O-propargyl-puromycin with SUMO and ubiquitin by click chemistry at PML-nuclear bodies during abortive proteasome activities[J]. Biochem Biophys Res Commun, 2016, 474(2): 247-251. |
| [14] |
SANDRI M, SANDRI C, GILBERT A, et al. Foxo transcription factors induce the atrophy-related ubiquitin ligase atrogin-1 and cause skeletal muscle atrophy[J]. Cell, 2004, 117(3): 399-412. |
| [15] |
CHENG W J, LIU X, ZHANG L, et al. Chronic intermittent hypobaric hypoxia attenuates skeletal muscle ischemia-reperfusion injury in mice[J]. Life Sci, 2019, 231(8): 116533. |
| [16] |
LI J, YI X, YAO Z, et al. TNF receptor-associated factor 6 mediates TNFα-induced skeletal muscle atrophy in mice during aging[J]. J Bone Mine Res, 2020, 35(8): 1535-1548. |
| [17] |
PASSMORE L A, BARFORD D. Getting into position: the catalytic mechanisms of protein ubiquitylation[J]. Biochem J, 2004, 379(pt 3): 513-525. |
| [18] |
桑亚洲, 张艳, 陈玉龙, 等. JAK/STAT3介导肿瘤恶病质肌肉萎缩及药物干预研究进展[J]. 中国比较医学杂志, 2021, 31(7): 118-124. SANG Y Z, ZHANG Y, CHEN Y L, et al. JAK/STAT3 mediated muscle atrophy in cancer Cachexia and drug intervention[J]. Chin J Comp Med, 2021, 31(7): 118-124. |
| [19] |
RYAN S. Adipose tissue inflammation by intermittent hypoxia: mechanistic link between obstructive sleep apnoea and metabolic dysfunction[J]. J Physiol, 2017, 595(8): 2423-2430. |
| [20] |
黄蓓, 刘隆福, 蒋铁建. 糖皮质激素与肌少症[J]. 中华骨质疏松和骨矿盐疾病杂志, 2020, 13(5): 486-492. HUANG B, LIU L F, JIANG T J. Glucocorticoid and sarcopenia[J]. Chin J Osteoporos Bone Miner Res, 2020, 13(5): 486-492. |
| [21] |
YANG Y, LIAO Z, XIAO Q. Metformin ameliorates skeletal muscle atrophy in Grx1 KO mice by regulating intramuscular lipid accumulation and glucose utilization[J]. Biochem Biophys Res Commun, 2020, 533(4): 1226-1232. |
| [22] |
DAI J X, XIANG Y X, FU D, et al. Ficus carica L. attenuates denervated skeletal muscle atrophy via PPARα/NF-κB pathway[J]. Front Physiol, 2020, 11: 580223. |