异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)是治愈血液系统恶性肿瘤的成熟方法。但是,移植后复发是急性白血病患者的主要死亡原因[1]。移植后复发患者的治疗措施主要包括免疫抑制剂的撤减、供者淋巴细胞输注(donor lymphocyte infusion,DLI)、干扰素α、靶向药物、化疗、嵌合抗原受体T细胞(chimeric antigen receptor-T cell,CAR-T)以及二次移植等,但是移植后复发患者的预后并不理想[2-3]。其中,二次移植是复发患者可能获得长期生存的重要手段。在不论二次移植供者类型的情况下,二次移植的2年总体生存率(overall survival,OS)为16%~49%,2年无白血病生存率(leukemia-free survival,LFS)为20%~31%,2年累积复发率为21.8%~57%[4-7]。目前二次移植供者的选择仍待明确。既往的二次移植研究多以亲缘全合供者和非血缘供者为主,单倍体供者在二次移植中的应用并不多见。另一方面,基于二次移植后较高的复发率以及患者的高危复发特征,二次移植后对原发病复发的早期干预尤为重要。本中心以往的研究证实早期进行预防性供者淋巴细胞输注可有效预防高危急性白血病患者移植后的复发,其3年的累积复发率为29.7%[8]。二次移植后应用DLI治疗初次allo-HSCT后复发患者的疗效有待评估。因此,本研究回顾性分析本中心收治的近8年来血液系统恶性肿瘤allo-HSCT后复发患者接受新单倍体不合的半相合二次移植联合或不联合DLI治疗方案的临床资料,旨在为二次移植的供者选择以及复发患者的治疗方法提供思路。
1 资料与方法 1.1 病例资料本研究收集2013年10月至2021年6月在浙江大学医学院附属第一医院接受二次造血干细胞移植的急性白血病或骨髓增生异常综合征患者共22例。纳入标准:①初次移植为异基因移植。②初次移植后因原发病复发接受二次移植。③二次移植为新单倍体不合的供者。④二次移植前原发病缓解。本研究共纳入新单体不合二次移植患者11例。所有患者签署知情同意书,并由本院科研伦理审查委员会审核通过[(2021)IIT快审第(635)号]。本研究随访至2021年7月31日。
1.2 移植预处理新单倍体不合二次移植中10例接受清髓性预处理方案(myeloablative conditioning,MAC),1例接受减剂量预处理方案(reduced-intensity conditioning,RIC)。二次移植清髓性方案包括阿糖胞苷(cytarabine,Ara-C;4 g·m-2·d-1静注,-10~-9 d),白消安(busulfan,Bu; 3.2 mg·kg-1·d-2静注,-8~-6 d),环磷酰胺(cyclophosphamide,CY; 1.8 g·m-2·d-1静注,-5~-4 d),司莫司汀(250 mg·m-2口服,-3 d)和抗胸腺淋巴细胞球蛋白(ATG-F,总剂量10 mg·kg-1静注;Fresenius,Bad Homburg,Germany或ATG,总剂量6 mg·kg-1静注; Genzyme,Cambridge,MA)。减剂量方案包括氟达拉滨(fludarabine,Flu; 30 mg·m-2·d-1静注,-10~-5 d),白消安(Bu; 3.2 mg·kg-1·d-1静注,-7~-5 d)和ATG-F(总剂量20 mg·kg-1静注)。
1.3 干细胞采集和回输供者从-4 d开始接受重组粒细胞集落刺激因子(rh granulocyte colony -stimulating factor,rh G-CSF; 5~7.5 μg·d-1)的动员。采集后未经处理的干细胞一部分予以移植回输,一部分冻存用于移植后的供者淋巴细胞输注。患者二次移植后处于疾病缓解状态且微小残留病灶(minimal residual disease,MRD)阴性,同时无移植物抗宿主病(graft-versus-host disease,GVHD)征象,按计划于移植后90 d给予预防性供者淋巴细胞输注(prophylactic donor lymphocyte infusion,pro-DLI)[9]。若二次移植后缓解的患者出现MRD阳性,则给予抢先供者淋巴细胞输注(preemptive donor lymphocyte infusion,pre-DLI)[10]。DLI输注前不予化疗,输注后予以小剂量环孢菌素(1~2 mg·kg-1·d-1)口服预防GVHD。
1.4 移植物抗宿主病预防移植物抗宿主病预防方案为环孢菌素(cyclosporin A,CsA)、甲氨蝶呤(methotrexate,MTX)和小剂量的霉酚酸酯(mycophenolate mofetil,MMF)。CsA在移植前-7 d开始静脉应用(2.5 mg·kg-1·d-1),造血恢复后改为口服应用,保持血药谷浓度为150~250 ng·mL-1。依据患者移植后的原发病和移植物抗宿主病的情况调整用药。在移植后6~9个月撤停免疫抑制剂。MMF在移植前-9 d开始服用(500 mg·d-1)直至移植后+100 d。MTX(10 mg·m-2)在移植后+1、+3、+6、+9 d静脉使用。
1.5 研究终点及定义新单倍体不合二次移植指亲缘全相合或非血缘初次移植的患者更换半相合供者,首次半相合移植患者更换不同的单倍体相合供者[11]。粒系植入时间定义为连续3 d外周血中中性粒细胞计数>0.5×109 /L,血小板植入时间定义为脱离血制品输注时连续7 d外周血中血小板计数>20×109 /L。观察单倍体二次移植患者急性移植物抗宿主病(acute graft-versus-host disease,aGVHD)和慢性移植物抗宿主病(chronic graft-versus-host disease,cGVHD)的发生情况。aGVHD的诊断和分级依据2016年建立的Harri标准,cGVHD的诊断和分级依据2014年美国国立卫生院的标准[12-13]。复发定义为骨髓中原始细胞>5%,或血液中出现白血病细胞,或髓外出现白血病浸润。总体生存定义为单倍体二次移植干细胞回输时间至各种原因死亡或随访截止时间。无白血病生存定义为单倍体二次移植干细胞回输时间至白血病复发或者各种原因死亡时间。
1.6 统计学分析采用SPSS 26.0统计软件(Chicago,IL,USA)和R语言编程软件(http://www.r-project.org)进行分析。患者、供者和移植相关的基本特征采用中位数描述。OS、LFS使用Kaplan-Meier模型分析;累计复发率、GVHD发生率使用竞争风险模型分析。
2 结果 2.1 研究对象基本信息特征11例新单倍体不合二次移植患者的中位随访时间为9.4(2.9~94.9)个月。其中6例女性患者,5例男性患者。7例急性淋巴细胞性白血病(acute lymphocytic leukemia,ALL),其中1例为慢性粒细胞白血病(chronic myeloid leukemia,CML)进展为急性淋巴细胞白血病;3例急性髓系白血病(acute myeloid leukemia,AML)和1例骨髓增生异常综合征(myelodysplastic syndrome,MDS)。初次allo-HSCT中,4例非亲缘供者(unrelated donor,URD),4例亲缘全相合供者(matched sibling donor,MSD),3例亲缘单倍体相合供者(haploidentical related donor,HRD)。初次移植至原发疾病复发的中位时间为38.1(9.3~182.6)个月,其中2例在初次移植1年内复发。复发至二次移植的中位时间为10.5(3.2~40.9)个月。6例在二次移植后接受pro-DLI或者pre-DLI,中位CD3细胞量为1.53(0.65~5.0)×107 /kg。至随访时间,5例患者未行DLI:1例二次移植后尚未随访至预防性DLI时间,1例二次移植后1.5个月复发,1例使用普纳替尼靶向预防治疗,1例患者初次移植后存在中重度cGVHD,1例患者拒绝DLI。初次移植和二次移植相关信息具体见表 1。
| 序号 | 疾病 | 患者性别 | 初次移植 | 二次移植 | |||||||||||||
| 患者年龄(岁)/血型 | 供者年龄(岁)/性别/血型 | 供者类型 | 预处理 | 移植到复发时间(月) | 复发到二次移植时间(月) | HLA-LOSS | 患者年龄(岁)/血型 | 供者年龄(岁)/性别/血型/关系 | 预处理 | CD34+(×106/kg) /MNC(×108/kg) | ANC/PLT植入(d) | DLI(CD3+, ×107/kg) | 移植预后OS(月) | ||||
| 1 | AML | 女 | 22/A | 37/男/O | URD | MAC | 106.7 | 12.6 | / | 32/O | 28/女/A/胞妹 | MAC | 6.4/11.8 | 11/16 | Pro-DLI(2.3) | 20.1(死亡) | |
| 2 | ALL | 女 | 41/O | 18/男/B | HRD(儿子) | MAC | 84.8 | 20.1 | 阴性 | 50/B | 46/女/O/胞妹 | MAC | 8.5/12.9 | 12/11 | / | 5.9(生存) | |
| 3 | ALL | 女 | 22/O | 24/男/B | URD | MAC | 8.3 | 7.0 | / | 23/B | 46/女/B/母亲 | MAC | 4.3/9.3 | 15/15 | Pro-DLI(5.0) | 94.9(生存) | |
| 4 | AML | 女 | 39/B | 40/女/A | MSD(胞姐) | MAC | 53.8 | 5.0 | / | 44/A | 18/女/B/女儿 | MAC | 5.9/15.1 | 30/15 | Pro-DLI(1.2) | 29.9(复发,死亡) | |
| 5 | ALL | 男 | 17/A | 25/女/A | MSD(胞姐) | MAC | 14.9 | 10.5 | / | 19/A | 46/男/A/父亲 | MAC | 3.7/19.3 | 13/13 | / | 2.9(复发,死亡) | |
| 6 | AML | 男 | 19/AB | 44/男/AB | HRD(父亲) | MAC | 33.4 | 40.9 | 阴性 | 25/AB | 51/女/B/母亲 | RIC | 2.2/14.6 | 17/21 | / | 4.7(生存) | |
| 7 | ALL | 女 | 28/O | 37/男/O | URD | MAC | 4.9 | 4.4 | / | 29/O | 53/女/O/母亲 | MAC | 8.7/22.6 | 14/17 | Pre-DLI(0.65) | 7.6(复发,死亡) | |
| 8 | ALL | 男 | 21/O | 46/男/A | HRD(父亲) | MAC | 38.1 | 10.8 | 阴性 | 25/A | 49/女/A/母亲 | MAC | 5.3/17.1 | 23/25 | Pre-DLI(1.0) | 11.9(生存) | |
| 9 | MDS | 女 | 47/B | 51/女/A | MSD(胞姐) | RIC | 17.7 | 23.8 | / | 50/A | 25/男/O/儿子 | MAC | 9.7/11.6 | 13/14 | Pre-DLI(1.86) | 9.4(生存) | |
| 10 | ALL | 男 | 16/AB | 50/女/B | URD | MAC | 38.8 | 4.7 | / | 20/B | 47/女/A/母亲 | MAC | 6.8/23.0 | 18/25 | / | 25.0(生存) | |
| 11 | CML急淋变 | 男 | 41/O | 39/女/O | MSD(胞妹) | RIC | 179.4 | 3.2 | / | 56/O | 31/男/A/儿子 | MAC | 6.5/5.8 | 18/20 | / | 3.2(生存) | |
| AML:急性髓系白血病;ALL:急性淋巴细胞白血病;MDS:骨髓增生异常综合征;CML:慢性粒细胞白血病;URD:非血缘供者;HRD:单倍体供者;MSD:亲缘全相合供者;MAC:清髓性预处理方案;RIC:减剂量预处理方案;ANC:中性粒细胞;PLT:血小板;pre-DLI:抢先性供者淋巴细胞输注;pro-DLI:预防性供者淋巴细胞输注 | |||||||||||||||||
2.2 植入
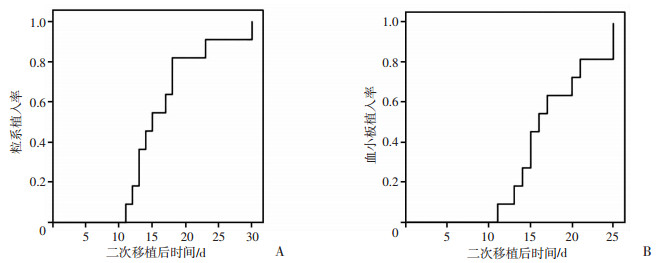
二次移植后,患者的粒系中位植入时间为15(11~30)d;28 d中性粒细胞植入率为91%;血小板中位植入时间为16(11~25)d,28 d血小板植入率为100%(图 1)。
|
| A:二次移植粒系植入率;B:二次移植血小板植入率 图 1 新单倍体不合二次移植的植入情况 |
2.3 GVHD发生率
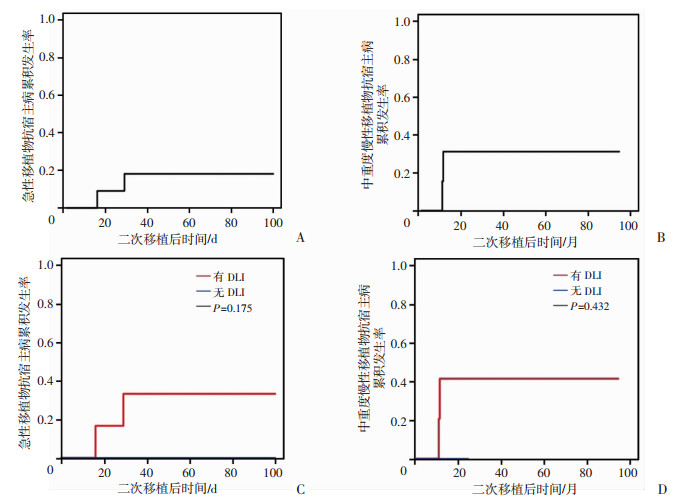
初次移植后,5例患者发生aGVHD(Ⅰ度4例,Ⅱ度1例);1例中度cGVHD。二次移植后100 d内,共2例发生aGVHD (Ⅰ度和Ⅱ度各1例),移植后100 d累积aGVHD发生率为18.2%(图 2A)。11例二次移植患者中,共4例发生cGVHD,其中2例为中重度cGVHD。2年总cGVHD发生率为58.4%,2年中重度cGVHD累积发生率为31.2%(图 2B)。无患者因GVHD而死亡。接受DLI的患者中2例发生DLI相关的aGVHD(Ⅱ度和Ⅲ度各1例),aGVHD累积发生率为33.5%;2例发生中重度cGVHD,2年中重度cGVHD累积发生率为41.7%;5例未接受DLI的患者无aGVHD和中重度cGVHD发生(图 2C、D)。
|
| A、B:分别为患者急性移植物抗宿主病和中重度慢性移植物抗宿主病的总体累积发生率;C、D:分别为有无供者淋巴细胞输注患者急性移植物抗宿主病和中重度慢性移植物抗宿主病的累积发生率 图 2 新单倍体不合二次移植后移植物抗宿主病的发生情况 |
2.4 新单倍体不合二次移植后的复发和非复发死亡
二次移植后,11例患者中共3例复发,中位复发时间7.6(2.9~29.9)个月。1年累积复发率为22.1%,3年累积复发率为51.3%。6例接受DLI的患者,中位随访时间为16(7.6~94.9)个月,2例复发;5例未接受DLI的患者,中位随访时间为4.7(2.9~25.0)个月,1例复发。至随访截止时间,3例复发患者均死亡。1例复发后化疗联合DLI无效死亡、2例并发肺部感染死亡。11例患者移植期间均未并发肝肾功能及心功能损害,其中1例患者在二次移植后因重度肺部感染而死亡,2年非复发死亡率为9.1%。
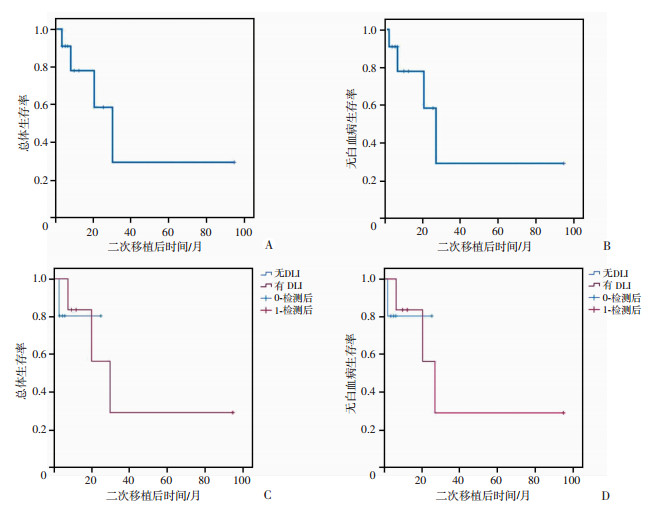
2.5 新单倍体不合二次移植后的生存至随访截止时间,7例患者二次移植后持续缓解。新单倍体不合二次移植的1年LFS为77.9%(95%CI: 54.6%~99.9%)、2年LFS为58.4%(95%CI: 30.0%~99.9%);1年OS为77.9%(95%CI: 54.6%~99.9%)、2年OS为58.4%(95%CI: 30.0%~99.9%,图 3A、B)。二次移植联合DLI的1年OS为83.3%(95%CI: 58.3%~ 99.9%)、LFS为83.3%(95%CI:58.3%~99.9%);未接受DLI的患者1年OS为80.0%(95%CI: 51.6%~99.9%)、LFS为80.0%(95%CI:51.6%~99.9%,图 3C、D)。依据疾病类型,分为AML/MDS和ALL组,两组患者的OS及LFS差异均无统计学意义(P=0.632)。
|
| A、B:分别为患者总体生存率和无白血病生存率;C、D:分别为有无供者淋巴细胞输注患者总体生存率和无白血病生存率 图 3 新单倍体不合二次移植的总体生存率和无白血病生存率 |
3 讨论
得益于预处理方案的进展、GVHD预防方案的优化、供者选择的完善,allo-HSCT作为治愈血液系统恶性肿瘤的重要手段,其治疗效果进一步提高。本研究是allo-HSCT后复发行单倍体二次移植治疗的一次积极探索,旨在探讨新单倍体不合二次移植治疗血液系统恶性肿瘤allo-HSCT后复发患者的可行性和临床效果。本研究发现新单倍体不合二次移植的临床预后良好,二次移植的1年总体OS为77.9%、LFS为77.9%、累积复发率为22.1%;新单倍体不合二次移植联合DLI后1年OS为83.3%。故推测,新单倍体不合二次移植可以作为allo-HSCT后复发患者的有效治疗方法。
二次移植是移植后复发患者可能获得长期生存的重要手段[14]。二次移植的供者选择仍是一个值得探讨的问题。CHRISTOPEIT等[4]研究发现,初次亲缘全相合移植患者,新亲缘全合供者较同一供者二次移植的生存更高(2年OS 37% vs 16%,P=0.048);初次非亲缘移植患者,更换供者较相同供者二次移植的预后更好(2年OS 20% vs 11%,P=0.037)。近来研究表明二次移植的供者类型并不影响二次移植的临床预后[5-7]。但KHARFAN-DABAJA团队[6-7]的一项165例ALL患者的研究显示半相合二次移植较非亲缘二次移植趋于更高的OS和更低的复发率;另一项455例AML患者的研究发现半相合二次移植较非亲缘二次移植的cGVHD发生风险更低(21% vs 32%,P=0.045)。目前,单倍体移植因供受者间的HLA差异产生相对更强的移植物抗白血病(graft-versus-leukemia,GVL)效应而被应用于更多的相对高危复发的患者[15-17]。本中心既往研究发现高危白血病患者接受单倍体移植后的5年累积复发率显著降低,为15.4%[18]。既往的一些小样本半相合二次移植研究中,1年OS、复发率和NRM分别为32%~52%、33%~36%和29%~36%;2年OS、复发率和NRM分别为23.3%~43%、44.2%~45.6% 和29%~40%[19-21]。相比既往研究,本研究1年LFS达77.9%,二次移植初显成效,但是有待长期随访以明确患者二次移植的长期预后。本研究二次移植时均选择新单倍体不合的半相合替代供者。一方面,移植后复发包括宿主来源的复发和供者来源(约占2%)的复发;对于供者来源复发患者,二次移植时需要更换供者[22]。本研究中1例患者初次移植后存在供者来源的复发。另一方面,移植后复发机制包括HLA-LOSS、HLA Ⅱ类分子的下调和T细胞抑制性配体上调等[23]。研究表明约33%不全相合allo-HSCT后复发患者是由于HLA-LOSS的发生[24]。对于存在HLA-LOSS的患者,原供者DLI或原供者二次移植均属于无效治疗,此时二次移植需优选新单倍体不合供者以克服HLA-LOSS的复发[25]。本中心的一项回顾性研究发现半相合造血干细胞移植后复发患者中HLA-LOSS复发占53.3%[26]。本研究移植结果显示新单倍体不合二次移植模式具有可行性,1年OS和LFS均达77.9%。既往的一项相似的研究由IMUS团队[11]开展,提出新单倍体不合的供者可能改善患者二次移植的总体生存和无白血病生存。由此可见,新单倍不合供者或可成为二次移植较好的替代供者。受限于研究样本量的不足,新单倍体不合的供者在二次移植中的效果有待更大样本量的随机对照研究来验证。
Allo-HSCT后LFS≥1年的患者面临的主要问题仍是原发病复发[27-28]。KUROSAWA团队[29]的一项包含93例患者的研究发现,移植后复发患者接受二次移植的1年OS优于接受化疗的患者(58% vs 14%,P<0.001),但是两组患者的2年OS差异无统计学意义。本研究显示二次移植患者的主要不良事件及死因仍为复发。因此,移植后复发的防治是提高患者生存的关键。DLI因其GVL效应可有效降低高危复发患者移植后的复发率[30-31]。本中心的一项高危复发白血病患者接受移植后pro-DLI的配对研究发现,pro-DLI可显著降低移植后的复发率(5年累积复发率:14.7% vs 49.3%,P=0.01),显著改善移植后生存(5年LFS:64.6% vs 33.9%,P<0.01)[9]。另一研究表明,pre-DLI可使移植后迟发性微小残留病灶(LMRD)阳性患者获得低复发率和长生存(1年DFS 78.4%,1年复发率20.0%)[10]。本研究中6例患者在二次移植后接受DLI,其1年LFS达83.3%,显示出良好的临床预后。二次移植后联合DLI的疗效有待更大样本量的研究分析。
初次移植后的复发时间和二次移植时的疾病状态是影响二次移植预后的主要因素[32-33]。二次移植时原发病处于完全缓解状态显著优于非缓解状态下的临床预后[34]。初次移植后晚于1年复发患者的二次移植预后显著优于初次移植后1年内复发的患者[35]。本研究中11例患者在二次移植时均处于缓解状态,且9例在初次移植1年后复发。患者的这些特征一定程度上提高新单倍体不合二次移植的成功率。因而,初次移植后晚期复发以及再次诱导缓解的患者行二次移植可能具有相对更高的获益度。本研究发现,二次移植后是否联合DLI和疾病类型(AML/MDS vs ALL)均不影响预后。本研究结果需在更大样本量的临床研究中进行深入探讨并加以检验。
目前,随着技术的发展以及新药的问世,移植后复发的治疗方案呈现多样化。近期的一项研究表明应用地西他滨联合DLI治疗8例移植后复发MDS/AML患者,均达完全缓解进而延长生存[36]。张曦团队的前瞻性多中心随机对照研究发现,对高危AML患者移植后应用粒细胞集落刺激因子联合小剂量地西他滨(5 mg·m-2·d-1×5 d)维持治疗,显著降低2年复发率(15.0% vs 38.3%)[34]。CAR-T、过继免疫治疗、免疫检查点抑制剂治疗以及化疗等均在移植后复发患者中具有一定的疗效[34, 37-38]。复发患者的预后在多种治疗策略下将不断改善。
综上,新单倍体不合二次移植治疗移植后复发患者具有可行性;且不显著增加治疗相关的死亡,具有一定的安全性,但有待更大样本的研究验证。
| [1] |
STYCZYŃSKI J, TRIDELLO G, KOSTER L, et al. Death after hematopoietic stem cell transplantation: changes over calendar year time, infections and associated factors[J]. Bone Marrow Transplant, 2020, 55(1): 126-136. |
| [2] |
CRUZ C R, MICKLETHWAITE K P, SAVOLDO B, et al. Infusion of donor-derived CD19-redirected virus-specific T cells for B-cell malignancies relapsed after allogeneic stem cell transplant: a phase 1 study[J]. Blood, 2013, 122(17): 2965-2973. |
| [3] |
KOCHENDERFER J N, DUDLEY M E, CARPENTER R O, et al. Donor-derived CD19-targeted T cells cause regression of malignancy persisting after allogeneic hematopoietic stem cell transplantation[J]. Blood, 2013, 122(25): 4129-4139. |
| [4] |
CHRISTOPEIT M, KUSS O, FINKE J, et al. Second allograft for hematologic relapse of acute leukemia after first allogeneic stem-cell transplantation from related and unrelated donors: the role of donor change[J]. J Clin Oncol, 2013, 31(26): 3259-3271. |
| [5] |
SHIMONI A, LABOPIN M, FINKE J, et al. Donor selection for a second allogeneic stem cell transplantation in AML patients relapsing after a first transplant: a study of the Acute Leukemia Working Party of EBMT[J]. Blood Cancer J, 2019, 9(12): 88. |
| [6] |
KHARFAN-DABAJA M A, LABOPIN M, BAZARBACHI A, et al. Comparing outcomes of a second allogeneic hematopoietic cell transplant using HLA-matched unrelated versus T-cell replete haploidentical donors in relapsed acute lymphoblastic leukemia: a study of the Acute Leukemia Working Party of EBMT[J]. Bone Marrow Transplant, 2021, 56(9): 2194-2202. |
| [7] |
KHARFAN-DABAJA M A, LABOPIN M, BRISSOT E, et al. Second allogeneic haematopoietic cell transplantation using HLA-matched unrelated versus T-cell replete haploidentical donor and survival in relapsed acute myeloid leukaemia[J]. Br J Haematol, 2021, 193(3): 592-601. |
| [8] |
杨露欣, 谭亚敏, 施继敏, 等. 高危急性白血病异基因造血干细胞移植后行预防性改良供者淋巴细胞输注的疗效及安全性分析[J]. 第三军医大学学报, 2019, 41(23): 2267-2271. YANG L X, TAN Y M, SHI J M, et al. Efficacy and safety of prophylactic modified donor lymphocyte infusion following allogeneic hematopoietic stem cell transplantation for high-risk acute leukemia[J]. J Third Mil Med Univ, 2019, 41(23): 2267-2271. |
| [9] |
YANG L X, TAN Y M, SHI J M, et al. Prophylactic modified donor lymphocyte infusion after low-dose ATG-F-based haploidentical HSCT with myeloablative conditioning in high-risk acute leukemia: a matched-pair analysis[J]. Bone Marrow Transplant, 2021, 56(3): 664-672. |
| [10] |
YUAN X L, TAN Y M, SHI J M, et al. Preemptive low-dose interleukin-2 or DLI for late-onset minimal residual disease in acute leukemia or myelodysplastic syndrome after allogeneic hematopoietic stem cell transplantation[J]. Ann Hematol, 2021, 100(2): 517-527. |
| [11] |
IMUS P H, BLACKFORD A L, BETTINOTTI M, et al. Major histocompatibility mismatch and donor choice for second allogeneic bone marrow transplantation[J]. Biol Blood Marrow Transplant, 2017, 23(11): 1887-1894. |
| [12] |
HARRIS A C, YOUNG R, DEVINE S, et al. International, multicenter standardization of acute graft-versus-host disease clinical data collection: a report from the mount Sinai acute GVHD international consortium[J]. Biol Blood Marrow Transplant, 2016, 22(1): 4-10. |
| [13] |
JAGASIA M H, GRENINIX H T, ARORA M, et al. National institutes of health consensus development project on criteria for clinical trials in chronic graft-versus-host disease: Ⅰ. the 2014 diagnosis and staging working group report[J]. Biol Blood Marrow Transplant, 2015, 21(3): 389-401. |
| [14] |
YANADA M, KONUMA T, YAMASAKI S, et al. Relapse of acute myeloid leukemia after allogeneic hematopoietic cell transplantation: clinical features and outcomes[J]. Bone Marrow Transplant, 2021, 56(5): 1126-1133. |
| [15] |
APPERLEY J, NIEDERWIESER D, HUANG X J, et al. Haploidentical hematopoietic stem cell transplantation: a global overview comparing Asia, the European union, and the United States[J]. Biol Blood Marrow Transplant, 2016, 22(1): 23-26. |
| [16] |
CICERI F, BACIGALUPO A, LANKESTER A, et al. Haploidentical HSCT [M]//CARRERAS E, DUFOUR C, MOHTY M, et al. The EBMT handbook: hematopoietic stem cell transplantation and cellular therapies. 7th ed. Cham: Springer, 2019: 479-486.
|
| [17] |
DOPPELHAMMER M, FRACCAROLI A, PREVALSEK D, et al. Comparable outcome after haploidentical and HLA-matched allogeneic stem cell transplantation for high-risk acute myeloid leukemia following sequential conditioning-a matched pair analysis[J]. Ann Hematol, 2019, 98(3): 753-762. |
| [18] |
LUO Y, XIAO H W, LAI X Y, et al. T-cell-replete haploidentical HSCT with low-dose anti-T-lymphocyte globulin compared with matched sibling HSCT and unrelated HSCT[J]. Blood, 2014, 124(17): 2735-2743. |
| [19] |
GORGEIS J, ZHANG X, CONNOR K, et al. T cell-replete HLA haploidentical donor transplantation with post-transplant cyclophosphamide is an effective salvage for patients relapsing after an HLA-matched related or matched unrelated donor transplantation[J]. Biol Blood Marrow Transplant, 2016, 22(10): 1861-1866. |
| [20] |
HAEN S P, GROH C, SCHUMM M, et al. Haploidentical hematopoietic cell transplantation using in vitro T cell depleted grafts as salvage therapy in patients with disease relapse after prior allogeneic transplantation[J]. Ann Hematol, 2017, 96(5): 817-827. |
| [21] |
SROUR S A, KONGTIM P, RONDON G, et al. Haploidentical transplants for patients with relapse after the first allograft[J]. Am J Hematol, 2020, 95(10): 1187-1192. |
| [22] |
WILLIAMS L, DOUCETTE K, KARP J E, et al. Genetics of donor cell leukemia in acute myelogenous leukemia and myelodysplastic syndrome[J]. Bone Marrow Transplant, 2021, 56(7): 1535-1549. |
| [23] |
ROVATTI P E, GAMBACORTA V, LORENTINO F, et al. Mechanisms of leukemia immune evasion and their role in relapse after haploidentical hematopoietic cell transplantation[J]. Front Immunol, 2020, 11: 147. |
| [24] |
CRUCITTI L, CROCCHIOLO R, TOFFALORI C, et al. Incidence, risk factors and clinical outcome of leukemia relapses with loss of the mismatched HLA after partially incompatible hematopoietic stem cell transplantation[J]. Leukemia, 2015, 29(5): 1143-1152. |
| [25] |
VILLALOBOS I B, TAKAHASHI Y, AKATSUKA Y, et al. Relapse of leukemia with loss of mismatched HLA resulting from uniparental disomy after haploidentical hematopoietic stem cell transplantation[J]. Blood, 2010, 115(15): 3158-3161. |
| [26] |
赵妍敏, 吴恒薇, 施继敏, 等. 亲缘单倍体造血干细胞移植后患者特异性HLA基因组丢失复发的危险因素、预后分析[C/OL]. 徐州: 中华医学会第十二次全国造血干细胞移植学术会议. [2021-08-10]. https://hsct21.sciconf.cn/cn/minisite/abstract-assembly-content/1461?abstract_id=1519912. ZHAO Y M, WU H W, SHI J M, et al. Risk factors and prognosis of specific HLA genome loss and recurrence in patients after relative haploid hematopoietic stem cell transplantation[C/OL]. Xuzhou: the 12th National Conference on Hematopoietic Stem Cell Transplantation of Chinese Medical Association. [2021-08-10]. https://hsct21.sciconf.cn/cn/minisite/abstract-assembly-content/1461?abstract_id=1519912. |
| [27] |
GUIÈZE R, DAMAJ G, PEREIRA B, et al. Management of myelodysplastic syndrome relapsing after allogeneic hematopoietic stem cell transplantation: a study by the French society of bone marrow transplantation and cell therapies[J]. Biol Blood Marrow Transplant, 2016, 22(2): 240-247. |
| [28] |
DUNCAN C N, MAJHAIL N S, BRAZAUSKAS R, et al. Long-term survival and late effects among one-year survivors of second allogeneic hematopoietic cell transplantation for relapsed acute leukemia and myelodysplastic syndromes[J]. Biol Blood Marrow Transplant, 2015, 21(1): 151-158. |
| [29] |
KUROSAWA S, FUKUDA T, TAJIMA K, et al. Outcome of 93 patients with relapse or progression following allogeneic hematopoietic cell transplantation[J]. Am J Hematol, 2009, 84(12): 815-820. |
| [30] |
YAN C H, LIU Q F, WU D P, et al. Prophylactic donor lymphocyte infusion(DLI) followed by minimal residual disease and graft-versus-host disease-guided multiple DLIs could improve outcomes after allogeneic hematopoietic stem cell transplantation in patients with refractory/relapsed acute leukemia[J]. Biol Blood Marrow Transplant, 2017, 23(8): 1311-1319. |
| [31] |
WANG Y, LIU Q F, WU D P, et al. Impact of prophylactic/preemptive donor lymphocyte infusion and intensified conditioning for relapsed/refractory leukemia: a real-world study[J]. Sci China Life Sci, 2020, 63(10): 1552-1564. |
| [32] |
SCHNEIDAWIND C, HAGMAIER V, FAUL C, et al. Second allogeneic hematopoietic cell transplantation enables long-term disease-free survival in relapsed acute leukemia[J]. Ann Hematol, 2018, 97(12): 2491-2500. |
| [33] |
FAN Y, ARTZ A S, VAN BESIEN K, et al. Outcomes following second allogeneic stem cell transplant for disease relapse after T cell depleted transplant correlate with remission status and remission duration after the first transplant[J]. Exp Hematol Oncol, 2019, 8: 1. |
| [34] |
GAO L, ZHANG Y Q, WANG S B, et al. Effect of rhG-CSF combined with decitabine prophylaxis on relapse of patients with high-risk MRD-negative AML after HSCT: an open-label, multicenter, randomized controlled trial[J]. J Clin Oncol, 2020, 38(36): 4249-4259. |
| [35] |
PARK J H, RIVIÈRE I, GONEN M, et al. Long-term follow-up of CD19 CAR therapy in acute lymphoblastic leukemia[J]. N Engl J Med, 2018, 378(5): 449-459. |
| [36] |
王清云, 梁赜隐, 董玉君, 等. 地西他滨治疗移植后复发MDS/AML及高危AML患者的临床疗效分析[J]. 中国实验血液学杂志, 2020, 28(1): 248-254. WANG Q Y, LIANG Z Y, DONG Y J, et al. Analysis of decitabine therapeutic effeicacy for patients with relapsed MDS/AML and high-risk AML patients after HSCT[J]. J Exp Hematol, 2020, 28(1): 248-254. |
| [37] |
DAVIDS M S, KIM H T, COSTELLO C, et al. A multicenter phase 1 study of nivolumab for relapsed hematologic malignancies after allogeneic transplantation[J]. Blood, 2020, 135(24): 2182-2191. |
| [38] |
CHOI I, YOON S R, PARK S Y, et al. Donor-derived natural killer cells infused after human leukocyte antigen-haploidentical hematopoietic cell transplantation: a dose-escalation study[J]. Biol Blood Marrow Transplant, 2014, 20(5): 696-704. |




