2. 563099 贵州 遵义,遵义医科大学第二附属医院检验科
2. Department of Clinical Laboratory, the Second Affiliated Hospital of Zunyi Medical University, Zunyi, Guizhou Province, 563099, China
异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantiation,allo-HSCT)是治疗血液系统恶性和非恶性疾病的有效手段,慢性移植物抗宿主病发生率占30%~70%,其中激素难治性慢性移植物抗宿主病大大降低了患者的生存质量,是患者非复发死亡(non-relapse mortality,NRM)的主要原因。现有的二线治疗药物种类繁多,疗效报道不一致[1],亟须探讨比较各个方案的优劣性以指导临床治疗。伊马替尼和西罗莫司是常用的二线治疗药物,研究报道在治疗激素难治性慢性移植物抗宿主病(steroid-refractory chronic graft-versus-host-disease,SR-cGVHD)方面具有一定的疗效且各有利弊[2-3],在二线治疗的作用上尚未进行比较。因此,本研究对2017年9月至2020年12月于我中心确诊为激素难治性cGVHD的33例患者进行回顾性分析,对比西罗莫司和伊马替尼作为二线药物,治疗异基因干细胞移植后合并SR-cGVHD的效果和预后。
1 资料与方法 1.1 临床资料回顾性分析2017年9月至2020年12月于我中心确诊为SR-cGVHD的33例患者的临床资料,其中伊马替尼治疗组(伊马替尼组)16例,西罗莫司治疗组(西罗莫司组)17例,患者一般临床资料见表 1。
| 一般资料 | 伊马替尼组(n=16) | 西罗莫司组(n=17) | P值 |
| 性别 | 0.728 | ||
| 男 | 9(56.2) | 11(64.7) | |
| 女 | 7(43.7) | 6(35.2) | |
| 移植时年龄/岁 | 33(7~52) | 26(9~52) | 0.200 |
| 原发病 | 0.656 | ||
| 急性白血病 | 13(81.3) | 15(88.2) | |
| 其他病种a | 3(18.7) | 2(11.8) | |
| 疾病分期b | 0.394 | ||
| 低/中危 | 5(31.3) | 2(12.5) | |
| 高危 | 11(68.7) | 14(87.5) | |
| cGVHD分度 | 0.601 | ||
| 中度 | 15(93.7) | 14(82.3) | |
| 重度 | 1(6.2) | 3(17.6) | |
| a:其他病种中伊马替尼治疗组中慢性髓系白血病3例,西罗莫司治疗组中阵发性睡眠性血红蛋白尿症1例,骨髓增生异常综合征1例;b:西罗莫司治疗组阵发性睡眠性血红蛋白尿症1例未纳入疾病分期计算 | |||
纳入标准:①确诊为血液系统恶性或非恶性疾病且接受异基因造血干细胞移植治疗;②抗排异一线方案治疗[激素±钙调磷酸酶抑制剂(calcineurin inhibitors,CNI)]失败且确诊为SR-cGVHD;③仅使用伊马替尼或西罗莫司作为二线抗排异方案。排除标准:①启动二线治疗前有病理学证据证实患者本病复发或因其他因素临床医师判断不宜继续接受抗排异治疗;②异基因造血干细胞移植后使用二线抗排异方案前接受嵌合抗原受体T细胞(chimeric antigen receptor-T cell,CAR-T)治疗;③使用除伊马替尼或西罗莫司以外的其他二线药物治疗SR-cGVHD。
1.2 SR-cGVHD诊断及分度标准根据美国国立卫生研究院关于慢性移植物抗宿主病共识,具有以下特征之一可以考虑诊断为SR-cGVHD:①患者接受泼尼松≥1.0 mg/(kg·d)至少1周疾病进展或无缓解;②患者接受泼尼松≥0.5 mg/(kg·d)或1.0 mg/kg隔天治疗至少4周后疾病无改善;③2次不成功的激素减量尝试后仍需要使用泼尼松>0.25 mg/(kg·d) 控制疾病进展[4]。
cGVHD临床分度参考美国国立卫生研究院慢性移植物抗宿主病诊断标准(2015版)[5]。①轻度:1~2个受累器官的器官评分为1分,且肺的器官评分为0分;②中度:≥3个受累器官的器官评分为1分,或≥1个受累器官(肺除外)的器官评分为2分,或肺的器官评分为1分;③重度:≥1个受累器官(肺除外)的器官评分为3分,或肺的器官评分为2分及以上。
1.3 治疗方法患者一线治疗方案为激素±钙调磷酸酶抑制剂,其中钙调磷酸酶抑制剂包括环孢素或他克莫司。在维持原有一线药物治疗基础上(激素±钙调磷酸酶抑制剂),加用伊马替尼或西罗莫司作为二线抗排异方案。伊马替尼初始剂量为100~200 mg/d,西罗莫司初始剂量为2~4 mg/d,根据cGVHD病情变化和药物耐受情况调整用药剂量。疗程中西罗莫司最大剂量为4 mg/d,伊马替尼最大剂量为400 mg/d。临床医师评定cGVHD症状改善后逐渐减量,总体原则是先减激素,再减其他免疫抑制,激素减停后其他免疫抑制剂缓慢减量直至停药。
1.4 治疗反应评估治疗反应评估参考美国国立卫生研究院慢性移植物抗宿主病治疗反应评估标准(2015版)。①完全缓解(complete response,CR):每个器官或部位的所有症状达到完全缓解。②部分缓解(partial response,PR):至少一个器官或部位的症状改善,且无其他器官或部位症状加重,以及无新的器官或部位受累[6]。③整体反应率(overall response rate,ORR)定义为患者达到完全缓解或部分缓解的比例。
1.5 生存分析与不良事件评估① 总生存期(overall survival,OS):从接受二线治疗开始到因任何原因死亡的时间。②无病生存期(disease free survival,DFS):从接受二线治疗开始到本病复发或非复发因素造成死亡的时间。③无失败生存期(failure free survival,FFS):从接受二线治疗开始到治疗失败的时间,治疗失败包括血液系统疾病复发、药物相关毒性不耐受、疾病控制不佳使用新的抗排异药物和任何原因造成的死亡。药物相关毒副作用评估参考常见不良反应事件评价标准4.0版本(CTCAE4.0 NIH Publication No.03-5410)。
1.6 随访采用门诊、电话和查阅病历系统等方式进行随访。末次随访时间为2021年7月20日。中位随访时间为83(12~195)周。
1.7 统计学分析使用SPSS 23.0和GraphPad Prism 8软件进行统计分析和作图。采用Mann-Whitney U检验和t检验对计量资料进行比较;采用Fisher确切概率法对分类资料进行比较;采用Kaplan-Meier曲线法对OS、DFS和FFS进行分析,采用Log-Rank进行组间比较;采用双侧检验,检验水准α=0.05。
2 结果 2.1 患者特征 2.1.1 移植特征33例患者均接受过CNI+MMF+MTX±间充质干细胞方案预防移植物抗宿主病,伊马替尼组采用CNI+MMF+MTX方案13例,CNI+MMF+MTX+间充质干细胞方案3例,西罗莫司组采用CNI+MMF+MTX方案12例,CNI+MMF+MTX+间充质干细胞方案5例。33例患者中有15例患者发生过aGHVD,其中伊马替尼组9例,西罗莫司组6例。33例患者在接受二线药物前,均使用激素±CNI治疗cGVHD。伊马替尼组从cGVHD确诊到启动二线治疗的中位时间是31(8~248)d,西罗莫司组对应的中位时间是41(9~435)d。患者移植特征见表 2。
| 移植特征 | 伊马替尼组(n=16) | 西罗莫司组(n=17) | P值 |
| 造血干细胞来源 | 0.491 | ||
| PB | 10(62.5) | 8(47.1) | |
| BM±PB | 6(37.5) | 9(52.9) | |
| HLA配型 | 0.303 | ||
| 全相合 | 9(56.3) | 6(35.3) | |
| 部分相合 | 7(43.7) | 11(64.7) | |
| 性别错配 | 0.736 | ||
| 无 | 9(56.2) | 9(59.2) | |
| 男供女 | 4(25.0) | 3(17.6) | |
| 女供男 | 3(18.7) | 5(29.4) | |
| 预防方案 | 0.688 | ||
| CNI+MMF+MTX | 13(81.3) | 12(70.5) | |
| CNI+MMF+MTX+MSC | 3(18.8) | 5(29.4) | |
| aGVHD病史 | 0.303 | ||
| 有 | 9(56.2) | 6(35.2) | |
| 无 | 7(43.7) | 11(64.7) | |
| 一线治疗 | 0.732 | ||
| 激素 | 7(43.8) | 9(52.9) | |
| 激素+CNI | 9(56.3) | 8(47.1) | |
| 中位时间/d | 31(8~248) | 41(9~435) | 0.471 |
| CNI:钙调磷酸酶抑制剂;MSC:间充质干细胞 | |||
2.1.2 不良事件基线情况
启动二线药物治疗前,两组患者均接受激素±CNI作为一线药物治疗cGVHD。接受一线治疗期间两组患者在血细胞减少、代谢异常、感染3个方面差异无统计学意义(P>0.05)。二线治疗前不良事件发生率见表 3。
| 不良事件 | 治疗前 | P值 | 治疗后 | P值 | ||
| 伊马替尼组(n=16) | 西罗莫司组(n=17) | 伊马替尼组(n=16) | 西罗莫司组(n=17) | |||
| 贫血 | 6(37.5) | 2(11.8) | 0.118 | |||
| Ⅰ~Ⅱ级 | 2(12.5) | 1(5.9) | 0.601 | 5(31.3) | 2(11.8) | 0.225 |
| Ⅲ~Ⅵ级 | 1(6.3) | 0(0.0) | 0.485 | |||
| 中性粒细胞减少症 | 1(6.3) | 3(17.6) | 0.601 | 4(25.0) | 5(29.4) | 1.000 |
| Ⅰ~Ⅱ级 | 1(6.3) | 2(11.8) | 1.000 | 3(18.8) | 4(23.5) | 1.000 |
| Ⅲ~Ⅵ级 | 0(0.0) | 1(5.9) | 1.000 | 1(6.3) | 1(5.9) | 1.000 |
| 血小板减少症 | 2(12.5) | 2(11.8) | 1.000 | 7(43.8) | 3(17.6) | 0.147 |
| Ⅰ~Ⅱ级 | 2(12.5) | 1(5.9) | 0.601 | 7(43.8) | 3(17.6) | 0.147 |
| Ⅲ~Ⅵ级 | 0(0.0) | 1(5.9) | 1.000 | 0(0.0) | 0(0.0) | 1.000 |
| 高糖血症 | 3(18.8) | 3(17.6) | 1.000 | 1(6.3) | 4(23.5) | 0.335 |
| Ⅰ~Ⅱ级 | 1(6.3) | 2(11.8) | 1.000 | 0(0.0) | 2(11.8) | 0.485 |
| Ⅲ~Ⅵ级 | 2(12.5) | 1(5.9) | 0.601 | 1(6.3) | 2(11.8) | 1.000 |
| 高脂血症 | 2(12.5) | 2(11.8) | 1.000 | 2(12.5) | 5(29.4) | 0.398 |
| Ⅰ~Ⅱ级 | 2(12.5) | 1(5.9) | 0.601 | 1(6.3) | 5(29.4) | 0.175 |
| Ⅲ~Ⅵ级 | 0(0.0) | 1(5.9) | 1.000 | 1(6.3) | 0(0.0) | 0.485 |
| EBV血症 | 5(31.3) | 3(17.6) | 0.438 | 6(37.5) | 4(23.5) | 0.465 |
| CMV血症 | 2(12.5) | 2(11.8) | 1.000 | 1(6.3) | 2(11.8) | 1.000 |
| 其他感染 | 2(12.5) | 3(17.6) | 1.000 | 3(18.8) | 2(11.8) | 0.656 |
| 复发 | 0(0.0) | 2(11.8) | 0.408 | |||
| 治疗前不良事件:启动二线药物前,即接受一线治疗期间所发生的不良事件;治疗后不良事件:启动二线药物后,即同时接受一线和二线药物期间所发生的不良事件;其他感染(治疗前):伊马替尼治疗组尿道感染和肺部感染各1例,西罗莫司治疗组3例均为肺部感染 | ||||||
2.2 疗效与预后 2.2.1 整体治疗反应
治疗后6个月和1年对药物疗效进行评判。①整体反应率:伊马替尼组6个月ORR(62.5%)和1年ORR(73.3%)高于西罗莫司组(6个月ORR: 41.2%,1年ORR:43.8%),但差异无统计学意义(P=0.303,P=0.149)。②完全缓解率:西罗莫司组6个月CR率(23.5%)和1年CR率(31.3%)高于伊马替尼组(6个月CR率:12.5%,1年CR率:20.0%),差异也无统计学意义(P=0.656,P=0.685)。
2.2.2 各器官受累者治疗反应二线治疗开始前,伊马替尼组cGVHD受累器官皮肤9例,肝脏9例,口腔8例;西罗莫司组cGVHD受累器官皮肤12例、肝脏7例、口腔10例。两组器官受累情况差异无统计学意义(表 4)。由于涉及其他器官数量较少和病例数限制,治疗后仅对皮肤、肝脏、口腔的ORR进行比较。①皮肤:伊马替尼组6个月和1年ORR分别为66.7%和77.8%,高于西罗莫司组(P=1.000,P=0.374)。②肝脏:不同于西罗莫司,伊马替尼治疗组随着治疗时间延长,ORR由6个月的33.3%增长至1年的66.7%(P=0.179)。③口腔:伊马替尼6个月和1年ORR分别为62.5%和85.7%,相较于西罗莫司差异无统计学意义(P=1.000,P=1.000)。二线治疗后6个月和1年各器官受累者的ORR结果见图 1。
| 受累器官 | 伊马替尼组(n=16) | 西罗莫司组(n=17) | P值 |
| 皮肤 | 9(56.3) | 12(70.6) | 0.481 |
| 肝脏 | 9(56.3) | 7(41.2) | 0.494 |
| 口腔 | 8(50.0) | 10(58.8) | 0.732 |
| 其余器官 | 10(62.5) | 8(47.1) | 0.491 |
| 其余器官包括眼、肺、外生殖器及肌肉关节 | |||
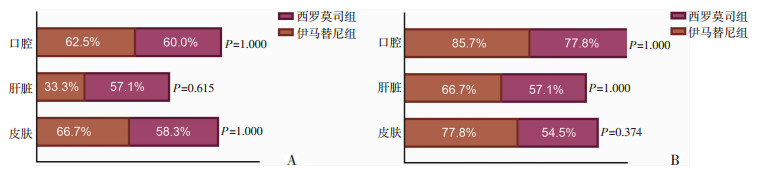
|
| A:治疗后6个月;B:治疗后1年 图 1 伊马替尼和西罗莫司治疗组患者各器官受累者的ORR结果 |
2.3 生存分析
33例激素难治性cGVHD患者中位随访时间为83(12~195)周。至随访结束,共4例患者死亡。①2年OS:在启动二线药物后2年内,未观察到伊马替尼组患者死亡,西罗莫司组4例患者死亡,其中2例GVHD进展死亡,2例本病复发死亡。2年OS伊马替尼优于西罗莫司(P=0.041,图 2A)。②2年DFS:在启动二线药物后2年内,未观察到伊马替尼组患者复发或死亡,西罗莫司组2例本病复发,2例GVHD进展死亡。2年DFS伊马替尼优于西罗莫司(P=0.043,图 2B)。③1年FFS:在启动二线药物后1年内,伊马替尼组2例患者治疗失败,1例cGVHD控制不佳更换药物,1例发生真菌感染停药。西罗莫司组6例患者治疗失败,3例cGVHD控制不佳更换药物,2例本病复发停药,1例血糖控制不佳换药。两组1年FFS差异无统计学意义(P=0.111,图 2C)。④疗效对2年OS的影响:33例患者中,启动二线药物治疗6个月后,有效与无效患者2年OS差异无统计学意义(P=0.421,图 3A);启动二线药物治疗1年后,有效患者2年OS优于治疗无效患者(P=0.009,图 3B)。
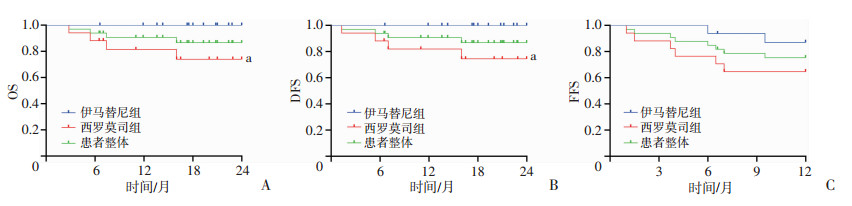
|
|
a:P<0.05,与伊马替尼组比较 A:2年OS曲线分析;B:2年DFS曲线分析;C:1年FFS曲线分析 图 2 伊马替尼、西罗莫司和患者整体二线治疗后2年OS、DFS曲线分析和1年FFS曲线分析 |
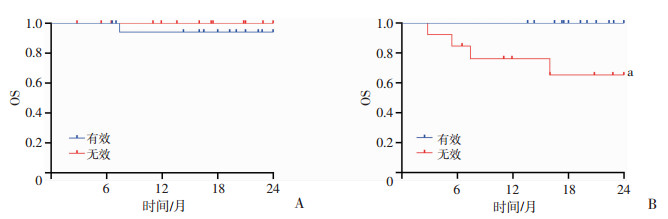
|
|
a:P<0.01,与有效比较 A:治疗后6个月;B:治疗后1年 图 3 二线治疗后不同时间有效和无效患者2年OS曲线分析 |
2.4 不良事件 2.4.1 血细胞减少
① 贫血:伊马替尼组6例患者出现贫血,其中Ⅲ~Ⅵ级1例;西罗莫司组2例患者贫血,均为Ⅰ~Ⅱ级(P=0.118)。②中性粒细胞减少症:伊马替尼组4例患者中性粒细胞计数降低,其中1例为Ⅲ~Ⅵ级;西罗莫司组5例患者中性粒细胞计数降低,其中1例为Ⅲ~Ⅵ级(P=1.000)。③血小板减少症:伊马替尼组发现血小板计数降低7例,西罗莫司组3例,两组均为Ⅰ~Ⅱ级(P=0.141)。
2.4.2 代谢异常① 高糖血症:伊马替尼组1例患者出现Ⅲ~Ⅵ级高糖血症;西罗莫司组4例患者出现高糖血症,其中2例为Ⅲ~Ⅵ级,1例因血糖控制不佳停用西罗莫司,两组比较差异无统计学意义(P=0.335)。②高脂血症:伊马替尼组2例患者出现高脂血症,其中1例为Ⅲ~Ⅵ级;西罗莫司组5例患者出现高脂血症,均为Ⅰ~Ⅱ级,两组比较差异无统计学意义(P=0.398)。
2.4.3 感染① 伊马替尼组EBV血症6例,CMV血症1例;西罗莫司组EBV血症4例,CMV血症2例,两组比较差异无统计学意义(P=0.465,P=1.000)。②伊马替尼组带状疱疹1例,细菌性肺部感染和真菌性肺部感染各1例,其中1例因感染停用伊马替尼;西罗莫司组2例患者发现真菌性肺部感染,两组比较差异无统计学意义(P=0.656)。
2.4.4 复发伊马替尼组在随访期内未观察到患者复发,西罗莫司组2例患者复发,两组比较差异无统计学意义(P=0.408)。二线治疗后不良事件发生率见表 3。
3 讨论造血干细胞移植在血液系统恶性和非恶性疾病治疗中应用广泛且疗效优异[7-11]。移植后发生cGVHD是患者NRM首要因素之一。目前激素±CNI仍是cGVHD首选治疗方案[12],但其有效性仅有50%左右。随着异基因造血干细胞移植的数量逐年递增,SR-cGVHD愈发成为我们迫切希望解决的难题。挽救性治疗疗效与SR-cGVHD患者生存成正相关[13],选择最佳的二线治疗方案使患者GVHD达到缓解的同时提高患者长期生存是首要任务。目前针对SR-cGVHD的挽救性治疗的药物选择较多,但最佳二线治疗方案尚未达成共识[14]。伊马替尼和西罗莫司都是常用的挽救性治疗药物[15],两种药物在缓解率和长期生存方面缺乏头对头的临床研究。因此,本研究纳入33例SR-cGVHD患者,其中接受伊马替尼治疗16例,西罗莫司治疗17例,两组患者在原发病、疾病分期、移植类型等方面差异无统计学意义且具有一定可比性,采用回顾性研究方式对比西罗莫司和伊马替尼作为二线药物治疗SR-cGVHD的疗效和预后,初步回答了在缓解率、短期生存、药物相关毒性等方面何种药物更具有优势性的问题。
伊马替尼是一种临床耐受性良好的小分子抑制剂,体外试验证实伊马替尼选择性双重阻断转化生长因子β(TGF-β)和血小板衍生生长因子(PDGF)通路,降低细胞外基质蛋白的合成,有效发挥抗纤维化作用[16]。活化T细胞引发组织炎症反应和组织纤维化,导致cGVHD患者组织器官损伤,是GVHD重要发病机制之一[17]。有研究者尝试使用伊马替尼治疗SR-cGVHD,初步证明其安全性和有效性[18-19]。国外一项多中心前瞻性临床试验结果显示[20]:伊马替尼挽救性治疗SR-cGVHD 6个月的ORR为51.3%(20/39)。本研究伊马替尼治疗组患者6个月ORR为62.5%,相较于大规模临床试验数据(n=39)略高,或许是因为患者启动挽救性治疗之前接受过的抗排异药物方案种类和数量不同;本组16例患者伊马替尼治疗前仅接受过激素±CNI治疗,而该研究39例患者入组前均接受≥2种抗排异方案且治疗失败。mTOR抑制剂在治疗GVHD方面应用广泛[21]。西罗莫司与他克莫司结合蛋白(FKBP)以及哺乳类西罗莫司靶分子(mTOR)结合形成复合物,该复合物阻断白介素-2(IL-2)信号通路进而抑制T细胞增殖[22]。既往研究证实西罗莫司有抗肿瘤效应[23]。将西罗莫司作为GVHD的防治方案取得了不错的疗效[2, 24]。本研究西罗莫司治疗组患者6个月和1年ORR分别为41.2%和43.8%。本课题组前瞻性临床研究发现西罗莫司联合钙调磷酸酶抑制剂治疗激素耐药/依赖广泛性慢性移植物抗宿主病疗效显著,6个月和1年ORR分别为55.6%(15/27)和59.3%(16/27)[25]。其ORR较本研究西罗莫司治疗组高,可能原因是两组患者治疗方案不完全一致,该研究27例患者均使用西罗莫司+CNI治疗,本研究中17例患者有9例(52.9%)未使用CNI,说明西罗莫司联合钙调磷酸酶抑制剂在诱导GVHD缓解方面较单用西罗莫司更具有优势性。本研究中伊马替尼和西罗莫司6个月ORR分别是62.5%和41.2%,1年ORR分别是73.3%和43.8%,6个月CR率分别是12.5%和23.5%,1年CR率分别是20%和31.3%,似乎伊马替尼在6个月和1年ORR方面优于西罗莫司(P=0.303,P=0.149),但西罗莫司相较于伊马替尼具有更高的CR率(P=0.656,P=0.685)。此外,通过对比不同受累器官6个月和1年ORR发现:在肝排异治疗上,长期服用伊马替尼相较于短期服用疗效更佳(P=0.179);伊马替尼在诱导皮肤症状缓解方面似乎优于西罗莫司,但二者1年ORR差异无统计学意义(P=0.374)。
本研究发现伊马替尼治疗后2年OS和2年DFS均优于西罗莫司,差异有统计学意义(P=0.041,P=0.043)。启动二线治疗后2年内伊马替尼治疗组无死亡,西罗莫司治疗组4例死亡,包括2例本病复发和2例GVHD进展死亡(2例GVHD进展后三线方案治疗无效死亡)。启动二线治疗后2年内未观察到伊马替尼治疗组患者复发,这与国外多中心前瞻性临床试验结果相似。该研究的中位随访时间为40个月,39例患者中仅1例复发[20],推测伊马替尼在移植物抗肿瘤效应方面较优(P=0.043)。虽然两组患者ORR差异无统计学意义(P=0.303,P=0.149),但伊马替尼治疗组仅1例GVHD控制不理想换药,西罗莫司治疗组GVHD疗效不理想3例换药,其中2例治疗无效死亡。可以推测伊马替尼在疾病控制方面疗效更佳。西罗莫司可以更多的探索一下联合用药来提高GVHD缓解率,从而降低非复发死亡。后期课题组将启动大样本前瞻性临床研究来进一步验证。此外,二线药物治疗1年后达到缓解(CR/PR)的患者,2年OS优于未达到缓解的患者(P=0.009),可见二线药物治疗1年后能否诱导缓解可以在一定程度上预测患者短期生存情况。
在药物相关毒性方面,伊马替尼与西罗莫司各有利弊。两组患者启动二线治疗前均接受一线治疗(激素±CNI),一线药物治疗期间不良事件差异无统计学意义(P>0.05),两治疗组间具有一定的可比性。启动二线药物后,血细胞减少方面,贫血和血小板减少症发生率伊马替尼较西罗莫司稍高(P=0.118,P=0.147),在治疗过程中应监测血象及时对症处理。代谢异常方面,西罗莫司治疗患者糖代谢和脂代谢异常发生率较高(P=0.335,P=0.398),与本课题组前瞻性临床试验结果相似[25]。临床工作者使用西罗莫司治疗时应定时检测血糖血脂并对症处理。感染发生率和病原体种类方面两治疗组无差别(P=0.465,P=1.000,P=0.656),因此患者在接受伊马替尼或西罗莫司二线治疗过程中,都应该加强感染方面的监测,及时采取抗感染治疗,动态调整药物剂量。
综上,伊马替尼作为二线抗排异方案治疗异基因造血干细胞移植后发生的SR-cGVHD,在短期生存和无病生存方面优于西罗莫司,但由于本研究病例数较少且随访时间较短,在缓解率、长期生存和药物相关毒性等方面,哪种药物更具优势性尚未明确,后期需要进行大样本随机对照试验来证实。
| [1] |
FERRARA J L M, LEVINE J E, REDDY P, et al. Graft-versus-host disease[J]. Lancet, 2009, 373(9674): 1550-1561. |
| [2] |
JURADO M, VALLEJO C, PÉREZ-SIMÓN J A, et al. Sirolimus as part of immunosuppressive therapy for refractory chronic graft-versus-host disease[J]. Biol Blood Marrow Transplant, 2007, 13(6): 701-706. |
| [3] |
PARRA SALINAS I, BERMUDEZ A, LÓPEZ CORRAL L, et al. Treatment of steroid-refractory chronic graft-versus-host disease with imatinib: Real-life experience of the spanish group of hematopoietic transplantation (GETH)[J]. Clin Transplant, 2021, 35(5): e14255. |
| [4] |
MARTIN P J, LEE S J, PRZEPIORKA D, et al. National institutes of health consensus development project on criteria for clinical trials in chronic graft-versus-host disease: Ⅵ. the 2014 clinical trial design working group report[J]. Biol Blood Marrow Transplant, 2015, 21(8): 1343-1359. |
| [5] |
JAGASIA M H, GREINIX H T, ARORA M, et al. National institutes of health consensus development project on criteria for clinical trials in chronic graft-versus-host disease: Ⅰ. the 2014 diagnosis and staging working group report[J]. Biol Blood Marrow Transplant, 2015, 21(3): 389-401. |
| [6] |
LEE S J, WOLFF D, KITKO C, et al. Measuring therapeutic response in chronic graft-versus-host disease. National institutes of health consensus development project on criteria for clinical trials in chronic graft-versus-host disease: Ⅳ. The 2014 response criteria working group report[J]. Biol Blood Marrow Transplant, 2015, 21(6): 984-999. |
| [7] |
ZENG Y J, WANG S B, WANG J S, et al. Optimal donor for severe aplastic anemia patient requiring allogeneic hematopoietic stem cell transplantation: a large-sample study from China[J]. Sci Rep, 2018, 8(1): 2479. |
| [8] |
GAO L, ZHANG C, GAO L, et al. Favorable outcome of haploidentical hematopoietic stem cell transplantation in Philadelphia chromosome-positive acute lymphoblastic leukemia: a multicenter study in Southwest China[J]. J Hematol Oncol, 2015, 8: 90. |
| [9] |
肖函, 王欣, 罗小华, 等. 非高危急性髓系白血病患者首次完全缓解后行自体与异基因外周血造血干细胞移植的疗效对比[J]. 第三军医大学学报, 2020, 42(17): 1717-1723. XIAO H, WANG X, LUO X H, et al. Efficacy of autologous versus allogeneic peripheral blood hematopoietic stem cell transplantation in non-high-risk acute myeloid leukemia patients in first complete remission[J]. J Third Mil Med Univ, 2020, 42(17): 1717-1723. |
| [10] |
蔺诗佳, 刘雨青, 姚浛, 等. EVI1基因阳性的急性髓系白血病患者临床特点及其造血干细胞移植的疗效观察[J]. 第三军医大学学报, 2020, 42(17): 1699-1705. LIN S J, LIU Y Q, YAO H, et al. Clinical characteristics of EVI1+ AML and clinical observation of hematopoietic stem cell transplantation on these patients[J]. J Third Mil Med Univ, 2020, 42(17): 1699-1705. |
| [11] |
蔺诗佳, 赵伟, 陈婷, 等. 二次移植治疗异基因造血干细胞移植后复发急性髓系白血病5例临床观察[J]. 第三军医大学学报, 2019, 41(23): 2301-2306. LIN S J, ZHAO W, CHEN T, et al. Second allogeneic hematopoietic stem cell transplantation in treatment of relapsed acute myeloid leukemia: clinical report of 5 cases[J]. J Third Mil Med Univ, 2019, 41(23): 2301-2306. |
| [12] |
PARK H, GARRIDO-LAGUNA I, NAING A, et al. Phase I dose-escalation study of the mTOR inhibitor sirolimus and the HDAC inhibitor vorinostat in patients with advanced malignancy[J]. Oncotarget, 2016, 7(41): 67521-67531. |
| [13] |
赵菲, 王佳丽, 施圆圆, 等. 芦可替尼挽救性治疗激素难治性移植物抗宿主病: 一项单中心回顾性分析[J]. 临床血液学杂志, 2020, 33(1): 18-24. ZHAO F, WANG J L, SHI Y Y, et al. The utility of ruxolitinib in patients with steroid-refractory graft-versus-host disease: retrospective analysis of a single center[J]. J Clin Hematol, 2020, 33(1): 18-24. |
| [14] |
中华医学会血液学分会造血干细胞应用学组, 中国抗癌协会血液病转化委员会. 慢性移植物抗宿主病(cGVHD)诊断与治疗中国专家共识(2021年版)[J]. 中华血液学杂志, 2021, 42(4): 265-275. Applied Hematopoietic Stem Cell Group of Hematology Branch of Chinese Medical Association, Hematological Disease Transformation Committee of Chinese Anti-Cancer Association. Chinese consensus on the diagnosis and management of chronic graft-versus-host disease (2021)[J]. Chin J Hematol, 2021, 42(4): 265-275. |
| [15] |
YALNIZ F F, MURAD M H, LEE S J, et al. Steroid refractory chronic graft-versus-host disease: cost-effectiveness analysis[J]. Biol Blood Marrow Transplant, 2018, 24(9): 1920-1927. |
| [16] |
DISTLER J H, JVNGEL A, HUBER L C, et al. Imatinib mesylate reduces production of extracellular matrix and prevents development of experimental dermal fibrosis[J]. Arthritis Rheum, 2007, 56(1): 311-322. |
| [17] |
PÉREZ-SIMÓN J A, SÁNCHEZ-ABARCA I, DÍEZ-CAMPELO M, et al. Chronic graft-versus-host disease: Pathogenesis and clinical management[J]. Drugs, 2006, 66(8): 1041-1057. |
| [18] |
CHEN G L, ARAI S, FLOWERS M E, et al. A phase 1 study of imatinib for corticosteroid-dependent/refractory chronic graft-versus-host disease: response does not correlate with anti-PDGFRA antibodies[J]. Blood, 2011, 118(15): 4070-4078. |
| [19] |
OLIVIERI A, LOCATELLI F, ZECCA M, et al. Imatinib for refractory chronic graft-versus-host disease with fibrotic features[J]. Blood, 2009, 114(3): 709-718. |
| [20] |
OLIVIERI A, CIMMINIELLO M, CORRADINI P, et al. Long-term outcome and prospective validation of NIH response criteria in 39 patients receiving imatinib for steroid-refractory chronic GVHD[J]. Blood, 2013, 122(25): 4111-4118. |
| [21] |
FENG Y M, CHEN X L, CASSADY K, et al. The role of mTOR inhibitors in hematologic disease: from bench to bedside[J]. Front Oncol, 2020, 10: 611690. |
| [22] |
KIRKEN R A, WANG Y L. Molecular actions of sirolimus: sirolimus and mTor[J]. Transplant Proc, 2003, 35(3 Suppl): 227S-230S. |
| [23] |
PANWALKAR A, VERSTOVSEK S, GILES F J. Mammalian target of rapamycin inhibition as therapy for hematologic malignancies[J]. Cancer, 2004, 100(4): 657-666. |
| [24] |
ALYEA E P, LI S L, KIM H T, et al. Sirolimus, tacrolimus, and low-dose methotrexate as graft-versus-host disease prophylaxis in related and unrelated donor reduced-intensity conditioning allogeneic peripheral blood stem cell transplantation[J]. Biol Blood Marrow Transplant, 2008, 14(8): 920-926. |
| [25] |
朱雯, 冯一梅, 陈婷, 等. 西罗莫司联合钙调磷酸酶抑制剂治疗糖皮质激素耐药/依赖广泛型慢性移植物抗宿主病临床观察[J]. 中华血液学杂志, 2020, 41(9): 716-722. ZHU W, FENG Y M, CHEN T, et al. The clinical observation of sirolimus combined with calcineurin inhibitors for steroid-resistant/steroid-dependent extensive cGVHD[J]. Chin J Hematol, 2020, 41(9): 716-722. |




