2. 563099 贵州 遵义,遵义医科大学第二附属医院检验科;
3. 400038 重庆,陆军军医大学(第三军医大学)基础医学院细胞生物学教研室
2. Department of Clinical Laboratory, the Second Affiliated Hospital of Zunyi Medical University, Zunyi, Guizhou Province, 563099;
3. Department of Cell Biology, College of Basic Medical Sciences, Army Medical University (Third Military Medical University), Chongqing, 400038, China
异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)是治疗血液系统恶性疾病、骨髓衰竭性疾病等的有效手段。急性移植物抗宿主病(acute graft-versus-host disease,aGVHD)是造成移植失败和移植相关死亡的主要因素[1-4],移植物中供者T细胞活化后错误识别受者组织抗原并发起免疫攻击是其主要发病机制,可造成包括肝、胃肠道、皮肤黏膜等的受累,临床发生率为30%~50%[5-6],需采取措施降低其发生。糖皮质激素联合环孢素等免疫抑制剂类药物是aGVHD的一线治疗方案,然而该方案仅在约半数患者中有效,激素治疗失败和耐药的患者预后不容乐观[7-8]。
间充质干细胞(mesenchymal stem cells,MSCs)是一种具有多向分化潜能和自我更新特性的多能干细胞,在特定条件下能够定向分化成骨、软骨、脂肪等多种细胞。因独特的低免疫原性和免疫负调节活性,MSCs具有防治aGVHD的潜在能力[9]。2004年LE BLANC等[10]在儿童患者中首次发现MSCs具有治疗aGVHD的作用,随后越来越多报道证实了MSCs临床治疗的有效性[11-12],一项最新的临床研究也表明HUCMSCs显著延长难治性aGVHD患者的长期生存率[13],但这些结果并不稳定。关于MSCs预防aGVHD的临床应用方面,既往报道显示MSCs混合移植物输注能降低aGVHD总体发生率,尤其对于Ⅳ级aGVHD预防效果显著[14-15]。近年来随着对MSCs生物特性理解的深入,其已成为防治aGVHD的新兴手段并被纳入我国aGVHD治疗专家共识[16]。
MSCs具有多种组织来源,包括脐带、骨髓、真皮、脂肪、羊膜等,人脐带间充质干细胞(human umbilical cord mesenchymal stem cells, HUCMSCs)相比其他来源的MSCs具有增殖能力强、生物性能稳定、取材不受限制、污染机会少等优点,临床应用潜力更佳[16]。有研究者在动物模型中验证了HUCMSCs对小鼠aGVHD的缓解作用[17],本课题组在前期基础研究中也已证明其优势[18]。本实验进一步观察HUCMSCs预防小鼠aGVHD的效果,并探讨其可能的作用机制,为临床MSCs预防aGVHD的开展奠定实验基础。
1 材料与方法 1.1 实验动物从陆军军医大学实验动物中心购买8~12周龄的雄性BALB/c小鼠(H-2Kd)和雄性C57BL/6小鼠(H-2Kb),并饲养于SPF级隔离室。于移植实验前1周起给予BALB/c受鼠抗生素饮食至实验全程。动物实验获得陆军军医大学实验动物福利伦理审查委员会批准(AMUWEC2020549)。
1.2 主要试剂无菌1×磷酸盐缓冲液(PBS)购自美国HyClone公司;RPMI1640细胞培养基、胎牛血清(FBS)购自美国Gibco公司;胶原酶Ⅷ、DNaseⅠ购自美国Sigma公司;Percoll细胞分离液购自美国GE公司;流式抗体(抗鼠H-2Kb-BV421、抗鼠TCR-APC-Cy7、抗鼠CD4-FITC、抗鼠CD8-PE)、人源间充质干细胞表型鉴定试剂盒、细胞凋亡流式检测试剂盒均购自美国BD公司;ELISA试剂盒购自美国R&D公司;人脐带间充质干细胞完全培养基、干细胞诱导分化培养基购自广州赛业(Cyagen)公司。
1.3 骨髓细胞和脾脏细胞悬液制备C57BL/6小鼠引颈脱臼处死,75%酒精喷洒周身消毒,于超净工作台中取股骨、胫骨和脾脏,注射器插入骨髓腔用含2%FBS的PBS吹出骨髓,于200目细胞筛上研磨制备单细胞悬液;脾脏细胞悬液如上研磨制备。计数有核细胞的数量,调整为1×107/mL。
1.4 人脐带间充质干细胞分离培养及鉴定健康足月剖宫产新生儿脐带组织,产妇无传染病及其他合并症。于陆军军医大学第二附属医院产科手术室收取长约5 cm脐带组织,将新鲜标本置于含青链霉素的无菌生理盐水管中,带回实验室。标本取材经陆军军医大学第二附属医院伦理委员会批准(SQ2017ZY050182),供者及家属知情同意。
在超净工作台内用含1%青链霉素的PBS清洗脐带组织3次。用组织剪沿脐带静脉剪开脐带,用组织镊分离脐带内膜,PBS洗涤2~3次后用组织剪剪成1.0 mm×1.0 mm左右大小,均匀铺于T25培养瓶中。翻转培养瓶,使其铺有组织块的底面朝上,加入2 mL人脐带间充质干细胞完全培养基后放入细胞培养箱。24 h后翻转培养瓶,使培养基浸泡到组织块。每天观察培养瓶内组织块周围是否有细胞爬出,爬出的细胞为P0代。扩增传代后冻存备用。所有移植实验使用P4代细胞。根据国际细胞治疗学会(International Society for Cellular Therapy,ISCT)发布的最低评价标准,MSCs在体外的特征是:①培养贴壁性;②高表达CD73、CD90、CD105,低表达造血和内皮标记物,包括CD11b、CD14、CD19、CD34、CD45、CD79a、HLA-DR等;③分化成脂肪细胞、软骨细胞和成骨细胞的能力[19]。P4代HUCMSCs体外培养后光学显微镜观察其生长情况,并行流式细胞术检测表面抗原(CD105、CD90、CD73、CD34、CD11b、CD19、CD45、HLA-DR)表达情况;P0-1代细胞接种于6孔板中,加入干细胞诱导分化培养基培养,每3天换液1次,诱导分化培养21 d后茜素红染色观察成骨情况,阿利新蓝染色观察成软骨情况,油红O染色观察成脂情况。
1.5 aGVHD模型构建流程受者BALB/c小鼠于移植前7 d起给予抗生素饮食,根据不同部分实验需要按完全随机设计分为BM组、aGVHD组、aGVHD+MSCs组。各组设置不同批次小鼠,一批用于小鼠生存观察及临床aGVHD评估(各组10只),另一批用于移植后14 d取材(各组5只)。实验流程见图 1。①aGVHD建模,BM组和aGVHD组于移植当天接受剂量为7.5 Gy的60Co源γ射线全身辐照(total body irradiation,TBI),6 h后,BM组尾静脉注射500 μL供者C57BL/6小鼠骨髓细胞(5×106/只) 悬液;aGVHD组尾静脉注射500 μL骨髓细胞(5×106/只) 和脾脏细胞(5×106/只)混悬液。②HUCMSCs预防小鼠aGVHD,aGVHD组处理同前,aGVHD+MSCs组经尾静脉注射500 μL骨髓细胞(5×106/只)、脾脏细胞(5×106/只)和HUCMSCs(5×105/只)混悬液,并于移植后7 d输注第2剂HUCMSCs。
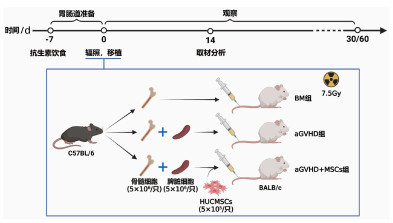
|
| 图 1 小鼠aGVHD模型构建及HUCMSCs预防aGVHD实验流程 |
1.6 小鼠生存观察及临床aGVHD评估
移植后每天观察记录小鼠生存情况,称取小鼠体质量,计算相对于原始体质量的百分比(体质量百分比),每周1~4次进行aGVHD严重程度临床评分,包含5项评分内容[20],见表 1。小鼠aGVHD临床评分由5项得分相加获得(积分范围0~10)。
| 指标 | 0 | 1 | 2 |
| 体质量减轻 | <10% | 10%~25% | >25% |
| 姿态 | 正常 | 休息时偶尔弓背 | 明显弓背活动受限 |
| 活动度 | 正常 | 轻到中度减低 | 刺激后才活动 |
| 毛发卷曲 | 正常 | 轻到中度卷曲 | 严重卷曲无序 |
| 皮肤完整性 | 正常 | 掌指皮肤脱屑 | 掉毛皮肤非常明显 |
1.7 淋巴细胞分离及流式细胞术
移植后14 d各组小鼠引颈脱臼处死后,小动物外科手术操作取下脾脏、肝脏、肺脏、小肠置于预冷的含2% FBS的PBS中。脾脏于200目细胞筛上加PBS研磨制备单细胞悬液,转移液体至15 mL离心管中,1 500 r/min、4 ℃离心5 min,弃上清,加入15 mL PBS重悬沉淀,计数有核细胞数量,收集1×106个细胞进行流式细胞术实验。肝脏如上操作获得细胞沉淀后,使用Percoll细胞分离液重悬沉淀,转移至新15 mL离心管中,1 300×g、室温离心30 min,收集中间白膜层即为淋巴细胞。肺脏置于培养皿中加入含1%胶原酶Ⅷ、0.2% DNaseⅠ、10% FBS的1640培养基5 mL,于37 ℃孵箱内消化30 min后如上制备单细胞悬液并用Percoll细胞分离液离心法获得淋巴细胞。小肠剪碎至1 cm左右,转移至新50 mL离心管中,加入含1%胶原酶Ⅷ、0.2% DNaseⅠ、10% FBS的1640培养基15 mL,于摇床中250 r/min振荡消化15 min后如上制备单细胞悬液。
凋亡检测染色方法参照BD试剂盒说明书进行;人脐带间充质干细胞流式表面抗原鉴定染色方法参照人间充质干细胞分析试剂盒(美国BD公司)说明书进行。
1.8 嵌合分析取移植后14 d小鼠(BM组和aGVHD组各3只)和健康对照BALB/c小鼠(n=3)的骨髓细胞制备单细胞悬液,加入抗鼠H-2Kb-BV421抗体,染色完成后上机检测。
1.9 ELISA检测取移植后14 d各组小鼠的外周血,分离、收集血清。使用ELISA试剂盒检测IFN-γ、TNF-α血清浓度。
1.10 HE染色与病理评分取移植后14 d各组小鼠的肝脏、小肠、结肠、肺脏。将组织多聚甲醛固定,然后石蜡包埋,切片,并用HE染色。用光学显微镜(Olympus)拍摄图像,参照BRUCE等[21]创建的病理评分标准进行评分。
1.11 统计学分析实验均重复3次,实验结果用x±s表示,两组之间比较采用学生t检验,3组之间比较采用单因素方差分析。各组之间生存率比较采用Log-rank检验。采用GraphPad Prism 9.0软件统计分析,检验水准α=0.05。
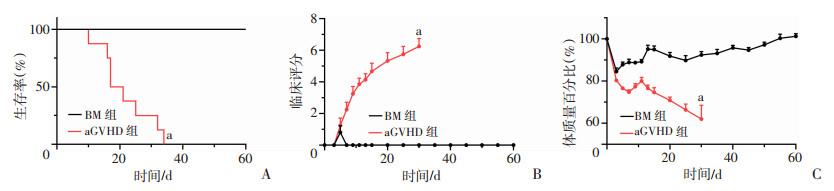
2 结果 2.1 小鼠aGVHD模型构建如流程模式图(图 1)所示构建小鼠骨髓单移植和aGVHD模型后,可观察到生存方面,aGVHD组小鼠存活率显著低于BM组,表现为从移植后10 d起陆续死亡,至移植后33 d无存活,而BM组小鼠在移植后观察期内能健康存活(P<0.001,图 2A)。所有aGVHD组小鼠表现出相似的临床表现:从移植后5~7 d开始,逐渐出现弓背、耸毛、活跃度下降、腹泻等症状;而BM组小鼠无上述表现;aGVHD组小鼠临床评分明显高于BM组(P<0.001,图 2B)。两组小鼠在移植后7 d内有急剧的体质量下降,但随后BM组小鼠体质量渐渐上升恢复至约初始水平,而aGVHD组小鼠体质量持续下降不能恢复,呈显著差异(P<0.001,图 2C)。
|
| A:生存率;B:aGVHD临床评分;C:体质量百分比 a:P<0.001,与BM组比较 图 2 移植后aGVHD组小鼠和BM组小鼠的生存、临床评分和体质量百分比的变化 |
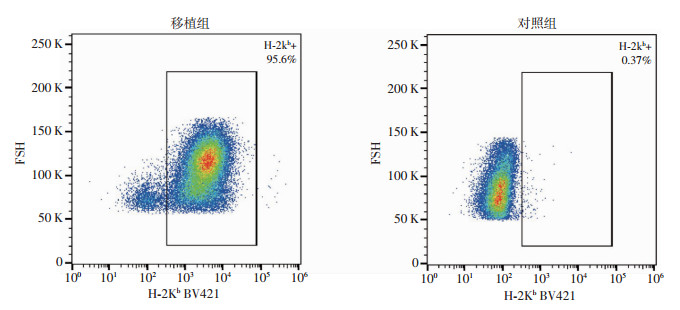
为了进一步明确移植后供者小鼠细胞在受者体内的嵌合情况,在移植后14 d取移植小鼠与健康对照BALB/c小鼠的骨髓细胞进行流式染色分析,结果显示对照小鼠骨髓细胞中未检测到H-2Kb表达,移植小鼠则高表达H-2Kb,两组表达率差异有统计学意义(图 3)。说明供者细胞完全植入,达完全嵌合。
|
| 图 3 流式细胞术检测移植后小鼠的嵌合度 |
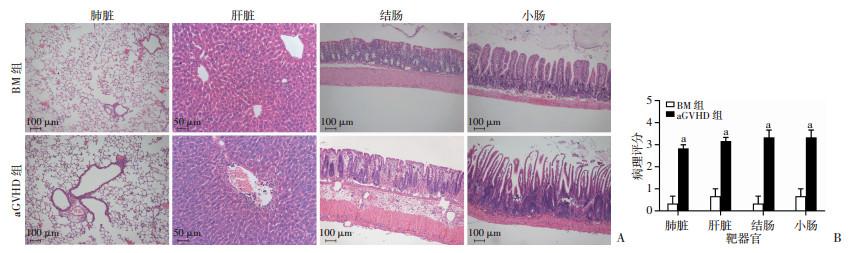
HE染色观察移植小鼠靶器官的病理学改变情况,可见aGVHD组小鼠靶器官有相较于BM组严重的组织破坏(图 4A),肺、肝脏组织内可见50%及以上的血管扩张充血,四周间隙变宽,局部炎症细胞浸润;结肠、小肠大量杯状细胞丢失,绒毛结构破坏,50%以上的隐窝有坏死细胞,固有层炎症细胞浸润及水肿导致明显的黏膜移位。经严格的病理评分,aGVHD组小鼠各组织评分均显著高于BM组(P<0.01,图 4B)。
|
| A:HE染色靶器官病理变化;B: 病理评分统计学结果 a:P<0.01,与BM组比较 图 4 移植后14 d BM组和aGVHD组小鼠各靶器官病理学变化 |
以上数据说明成功构建小鼠aGVHD模型。异基因造血干细胞移植后骨髓单移植组小鼠恢复情况良好,而混有供者淋巴细胞的实验组则成功诱导出小鼠aGVHD。
2.2 HUCMSCs鉴定基于ISCT的标准[19]进行形态学、表面标志物、多向分化潜能的鉴定实验。复苏冻存于液氮中的HUCMSCs,培养于T25细胞培养瓶,24 h后可在光学显微镜下观察到几乎所有HUCMSCs在培养瓶底部贴壁生长,细胞中央有卵圆形核,胞质向外伸出长短不等的突起,形为梭状,呈均质、涡旋状排列(图 5A)。使用流式细胞术对比相应同型对照抗体的方法检测所培养的HUCMSCs的CD73、CD90、CD105表达率,结果显示其表达均在95%以上,而CD34、CD11b、CD19、CD45、HLA-DR表达则低于2%(图 5B)。使用茜素红、阿利新蓝、油红O分别进行成软骨细胞染色、成骨细胞染色、成脂细胞染色,良好显色情况可证实经体外诱导培养的HUCMSCs成功分化为成骨细胞、成软骨细胞、成脂细胞(图 5C),具有多向分化潜能。
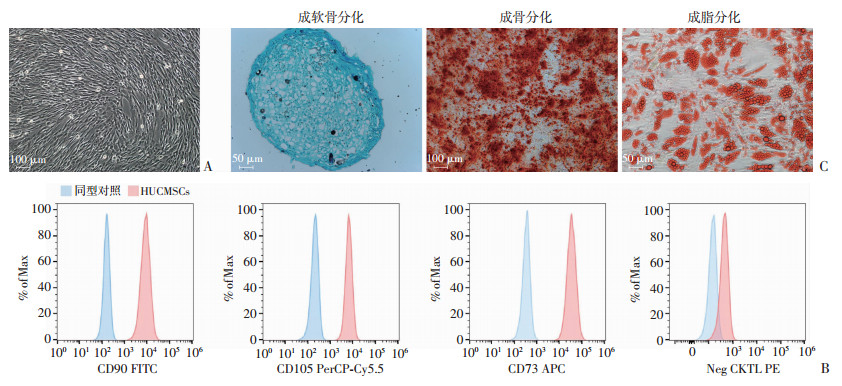
|
| A:HUCMSCs在T25细胞培养瓶中贴壁生长情况;B:P4代HUCMSCs表面特征性抗原荧光强度流式结果;C:HUCMSCs体外诱导分化培养效果观察 图 5 P4代HUCMSCs特性鉴定结果 |
2.3 HUCMSCs预防aGVHD发展
为明确HUCMSCs是否能预防小鼠aGVHD,在移植当天对受者小鼠注射供鼠骨髓细胞、脾脏细胞混悬液的同时注射HUCMSCs,并于移植后7 d输注第2剂(图 1)。各组小鼠在移植后30 d内的生存曲线见图 6A。截至观察期末,aGVHD+MSCs组小鼠生存率明显高于aGVHD组(P<0.05),HUCMSCs显著延长aGVHD小鼠的生存时间。移植后5~7 d起,aGVHD组小鼠表现出逐渐加重的弓背、腹泻、耸毛、活动度降低等典型表现;aGVHD+MSCs组小鼠虽然在移植后也有上述表现,但出现较晚且较轻微,后期并无进一步恶化,其临床评分显著低于aGVHD组(P<0.01,图 6B)。移植后所有小鼠体质量出现急剧下降,约13 d开始,aGVHD+MSCs组体质量略高于aGVHD组,但差异无统计学意义(图 6C)。表明HUCMSCs能预防小鼠allo-HSCT后aGVHD的发生、发展,显著减轻其严重程度,虽然体质量下降差异不明显,但在延缓生存和降低临床评分上作用可观。
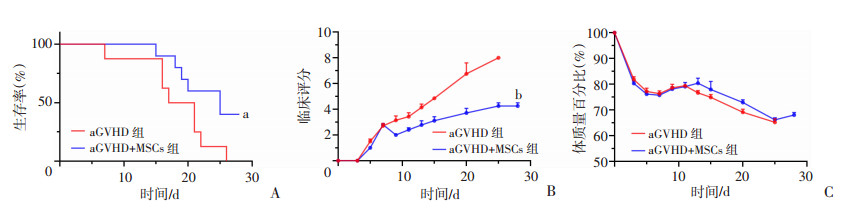
|
| A:生存率;B:aGVHD临床评分;C:体质量百分比 a:P<0.05,b:P<0.01,与aGVHD组比较 图 6 移植后aGVHD+MSCs组小鼠和aGVHD组小鼠生存,临床评分和体质量百分比的变化 |
2.4 HUCMSCs降低aGVHD小鼠体内炎症
取移植后14 d各组小鼠的靶器官切片后HE染色结果见图 7A,可见aGVHD+MSCs组小鼠的各个靶器官破坏程度较aGVHD组轻微,肺、肝组织的血管扩张充血和炎症细胞浸润明显缓解,结肠、小肠隐窝的坏死细胞也较aGVHD组减少,aGVHD+MSCs组小鼠各组织评分均显著低于aGVHD组(P<0.01,图 7B)。ELISA法检测各组小鼠移植后14 d血清中主要炎症细胞因子的浓度,结果显示aGVHD+MSCs组小鼠血清IFN-γ、TNF-α浓度较aGVHD组小鼠均显著下降(P<0.01,图 7C)。
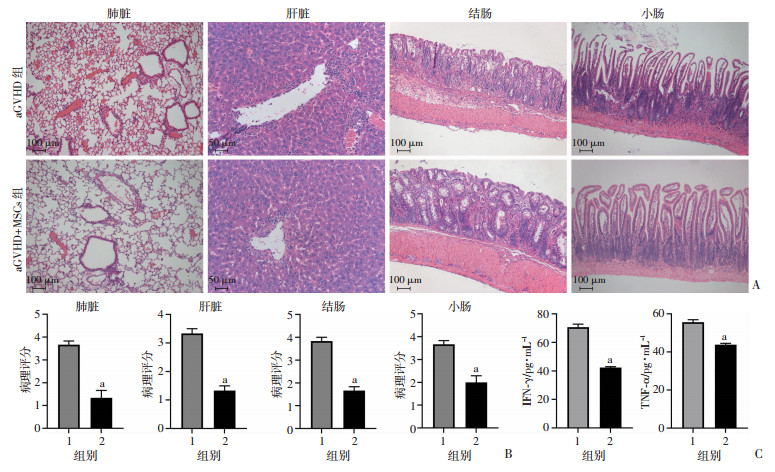
|
|
1:aGVHD组;2:aGVHD+MSCs组;a:P<0.01,与aGVHD组比较 A:HE染色观察靶器官病理学变化;B: 各靶器官病理评分;C:ELISA检测小鼠血清炎症因子浓度 图 7 HUCMSCs处理后小鼠靶器官病理损伤和血清炎症因子的变化 |
取各组小鼠移植后14 d的脾、肺、肝、小肠组织行流式细胞术检测CD4+ T淋巴细胞浸润水平,并计算淋巴细胞绝对数,可见aGVHD+MSCs组小鼠各组织中CD4+ T淋巴细胞绝对数均低于aGVHD组(P<0.05,图 8A)。进一步检测淋巴细胞凋亡水平,发现HUCMSCs处理增加了aGVHD组小鼠体内淋巴细胞凋亡,其Annexin Ⅴ的表达量在肝脏、小肠组织中显著提高(P<0.05),在脾脏、肺脏中无明显差异(图 8B、C),可能与aGVHD靶器官差异有关。同时,也解释了aGVHD+MSCs组淋巴细胞绝对数明显低于aGVHD组。
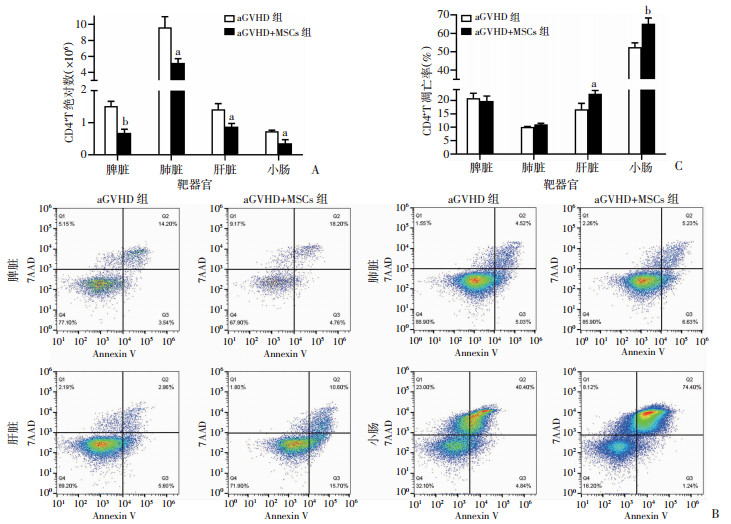
|
| A:流式细胞术检测CD4+ T淋巴细胞在小鼠脾、肺、肝、小肠组织中浸润水平;B、C:流式细胞术检测CD4+ T淋巴细胞在小鼠脾、肺、肝、小肠组织中凋亡水平及统计分析a:P<0.05,b:P<0.01,与aGVHD组比较 图 8 HUCMSCs处理后小鼠靶器官CD4+T淋巴细胞绝对计数和凋亡的变化 |
以上结果显示,HUCMSCs可能通过增加淋巴细胞凋亡,减少其扩增和浸润,从而整体上降低aGVHD小鼠的炎症,预防和缓解aGVHD。
3 讨论aGVHD一直是限制造血干细胞移植患者术后长期健康生存的主要难题。传统的防治aGVHD的药物有效缓解排异症状的同时不可避免地削弱了机体正常免疫功能,导致部分患者严重感染和白血病复发率增高。近年来,作为一种新兴手段,aGVHD的细胞疗法在动物模型以及临床研究上已有卓有成效的探索与实践,多种细胞表现出在调控aGVHD病理方面更具选择性、相较传统药物疗法更具安全性的优势[22-26]。
近年来,MSCs的免疫抑制能力被人们广泛关注,并在动物模型和临床试验中被用于防治各类炎症性疾病、自身免疫性疾病和aGVHD。本中心一直致力于MSCs的基础研究及临床应用探索,由于MSCs来源广泛,前期课题组对比了不同来源(骨髓、真皮、脐带、脂肪)MSCs,发现HUCMSCs减轻aGVHD的能力优于其他来源MSCs,主要原因在于其可通过趋化因子受体配体的结合而优势趋化髓源抑制性细胞(myeloid-derived suppressor cells, MDSCs)到靶器官发挥作用[18];另外本中心牵头的Ⅱ期临床研究证实HUCMSCs能够有效降低移植后慢性移植物抗宿主病(cGVHD)发生率,且肺部cGVHD零发生[11],提示HUCMSCs可以用于预防。本实验成功构建小鼠aGVHD模型,证实HUCMSCs对小鼠aGVHD具有预防作用,在提高生存率、降低aGVHD临床评分上较对照组有显著优势。由此可见,HUCMSCs无疑是一种很有前景的aGVHD细胞治疗手段,本实验结果为临床使用HUCMSCs防治aGVHD提供了新实验依据。
有关MSCs发挥免疫调控的机制涉及很多方面。既往报道细胞因子如前列腺素E2、吲哚胺-2, 3-双加氧酶(IDO)、一氧化氮、半乳凝素、HLA-G5等是MSCs发挥免疫抑制效应的机制之一[27-29]。此外,MSCs通过调节T细胞氨基酸代谢、细胞与细胞接触、Fas-L途径等抑制其增殖[30-32],同时MSCs增加调节性T、B细胞的比例,降低炎症因子,从而缓解GVHD[33]。还有报道指出MSCs通过被单核巨噬细胞等吞噬导致其表达抑制性分子[34]。另外,MSCs分化为构成骨髓微环境的细胞,以促进植入和造血重建的恢复[35]。本实验通过HE染色、ELISA、流式细胞术等发现HUCMSCs处理后aGVHD炎症显著降低,在aGVHD中发挥主要作用的CD4+ T细胞在靶器官中的浸润明显减少,HUCMSCs增加淋巴细胞的凋亡可能是减少炎症和浸润的机制之一,而HUCMSCs如何介导T细胞凋亡的具体信号通路则需进一步研究。同时,CD8+ T细胞的绝对数在本实验中未发现差异有统计学意义,其凋亡水平亦未发现显著差异(结果未展示),故HUCMSCs是否对CD4+和CD8+ T细胞的作用存在靶向性以及在不同CD4+ T细胞亚群(T helper、Treg等)的影响也是下一步应探索的内容。基于此,本课题组开展了HUCMSCs的单细胞转录组测序,拟从中发现HUCMSCs特异表达的与T细胞活化增殖相关的分子,这是否是HUCMSCs发挥免疫调控作用的机制之一也在进一步验证中。
MSCs的临床应用也存在诸多争议。有报道称因MSCs强大的免疫抑制功能或会导致肿瘤复发[36]。除外作用机制的复杂与安全性悖论,MSCs的高异质性同样是临床研究的关键问题。MSCs组织来源的多样性以及同一组织来源的MSCs亚群多样性均可导致其生物学功能的不同[37],临床上MSCs产品明显的差异性或许是导致治疗效果参差不齐的重要原因。在此背景下,精确筛选出针对aGVHD靶向发挥免疫抑制功能的优势MSCs亚群意义重大。随着单细胞测序技术的发展,下一步研究有望为我们挖掘到解决这一问题的新出路。
| [1] |
HOU Y C, ZHANG Q W, PANG W J, et al. YTHDC1-mediated augmentation of miR-30d in repressing pancreatic tumorigenesis via attenuation of RUNX1-induced transcriptional activation of Warburg effect[J]. Cell Death Differ, 2021. |
| [2] |
SUNG A D, CHAO N J. Concise review: acute graft-versus-host disease: immunobiology, prevention, and treatment[J]. Stem Cells Transl Med, 2013, 2(1): 25-32. |
| [3] |
中华医学会血液学分会干细胞应用学组. 中国异基因造血干细胞移植治疗血液系统疾病专家共识(Ⅲ)——急性移植物抗宿主病(2020年版)[J]. 中华血液学杂志, 2020, 41(7): 529-536. Applied Stem Cell Group of Hematology Branch of Chinese Medical Association. Chinese consensus of allogeneic hematopoietic stem cell transplantation for hematological disease(Ⅲ)—acute graft-versus-host disease (2020)[J]. Chin J Hematol, 2020, 41(7): 529-536. |
| [4] |
陈婷, 李小平, 高强国, 等. 不同方法检测急性移植物抗宿主病患者的血清标志物[J]. 第三军医大学学报, 2019, 41(23): 2280-2284. CHEN T, LI X P, GAO Q G, et al. Different methods for detecting serum markers in patients with acute graft versus host disease[J]. J Third Mil Med Univ, 2019, 41(23): 2280-2284. |
| [5] |
RAMACHANDRAN V, KOLLI S S, STROWD L C. Review of graft-versus-host disease[J]. Dermatol Clin, 2019, 37(4): 569-582. |
| [6] |
ALADAǦ E, KELKITLI E, GÖKER H. Acute graft-versus-host disease: a brief review[J]. Turk J Haematol, 2020, 37(1): 1-4. |
| [7] |
ZAHID M F, LAZARUS H M, RINGDÉN O, et al. Can we prevent or treat graft-versus-host disease with cellular-therapy?[J]. Blood Rev, 2020, 43: 100669. |
| [8] |
FERRARA J L, LEVINE J E, REDDY P, et al. Graft-versus-host disease[J]. Lancet, 2009, 373(9674): 1550-1561. |
| [9] |
MUNNEKE J M, SPRUIT M J, CORNELISSEN A S, et al. The potential of mesenchymal stromal cells as treatment for severe steroid-refractory acute graft-versus-host disease: a critical review of the literature[J]. Transplantation, 2016, 100(11): 2309-2314. |
| [10] |
LE BLANC K, RASMUSSON I, SUNDBERG B, et al. Treatment of severe acute graft-versus-host disease with third party haploidentical mesenchymal stem cells[J]. Lancet, 2004, 363(9419): 1439-1441. |
| [11] |
GAO L, ZHANG Y, HU B, et al. Phase Ⅱ multicenter, randomized, double-blind controlled study of efficacy and safety of umbilical cord-derived mesenchymal stromal cells in the prophylaxis of chronic graft-versus-host disease after HLA-haploidentical stem-cell transplantation[J]. J Clin Oncol, 2016, 34(24): 2843-2850. |
| [12] |
GODOY J A P, PAIVA R M A, SOUZA A M, et al. Clinical translation of mesenchymal stromal cell therapy for graft versus host disease[J]. Front Cell Dev Biol, 2019, 7: 255. |
| [13] |
许慧敏, 张素平, 曹伟杰, 等. 人脐带间充质干细胞治疗难治性急性移植物抗宿主病的单臂临床研究[J]. 中国组织工程研究, 2021, 25(31): 4921-4927. XU H M, ZHANG S P, CAO W J, et al. Human umbilical cord blood-derived mesenchymal stem cells in the treatment of refractory acute graft-versus-host disease: a single-arm clinical study[J]. Chin J Tissue Eng Res, 2021, 25(31): 4921-4927. |
| [14] |
MORATA-TARIFA C, MACÍAS-SÁNCHEZ M D M, GUTIÉRREZ-PIZARRAYA A, et al. Mesenchymal stromal cells for the prophylaxis and treatment of graft-versus-host disease-a meta-analysis[J]. Stem Cell Res Ther, 2020, 11(1): 64. |
| [15] |
NING H, YANG F, JIANG M, et al. The correlation between cotransplantation of mesenchymal stem cells and higher recurrence rate in hematologic malignancy patients: outcome of a pilot clinical study[J]. Leukemia, 2008, 22(3): 593-599. |
| [16] |
YIP H K, FANG W F, LI Y C, et al. Human umbilical cord-derived mesenchymal stem cells for acute respiratory distress syndrome[J]. Crit Care Med, 2020, 48(5): e391-e399. |
| [17] |
LI H, LIU Q, GAO X F, et al. IFN-γ gene loaded human umbilical mesenchymal stromal cells targeting therapy for graft-versus-host disease[J]. Int J Pharm, 2021, 592: 120058. |
| [18] |
WANG R, WANG X Q, YANG S J, et al. Umbilical cord-derived mesenchymal stem cells promote myeloid-derived suppressor cell enrichment by secreting CXCL1 to prevent graft-versus-host disease after hematopoietic stem cell transplantation[J]. Cytotherapy, 2021, S1465-S3249(21): 00744-1. |
| [19] |
DOMINICI M, LE BLANC K, MUELLER I, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement[J]. Cytotherapy, 2006, 8(4): 315-317. |
| [20] |
COOKE K R, KOBZIK L, MARTIN T R, et al. An experimental model of idiopathic pneumonia syndrome after bone marrow transplantation: Ⅰ. the roles of minor H antigens and endotoxin[J]. Blood, 1996, 88(8): 3230-3239. |
| [21] |
BLAZAR B R, TAYLOR P A, MCELMURRY R, et al. Engraftment of severe combined immune deficient mice receiving allogeneic bone marrow via in utero or postnatal transfer[J]. Blood, 1998, 92(10): 3949-3959. |
| [22] |
TAYLOR P A, LEES C J, BLAZAR B R. The infusion of ex vivo activated and expanded CD4(+)CD25(+) immune regulatory cells inhibits graft-versus-host disease lethality[J]. Blood, 2002, 99(10): 3493-3499. |
| [23] |
MARTELLI M F, DI IANNI M, RUGGERI L, et al. HLA-haploidentical transplantation with regulatory and conventional T-cell adoptive immunotherapy prevents acute leukemia relapse[J]. Blood, 2014, 124(4): 638-644. |
| [24] |
DU J, PAZ K, THANGAVELU G, et al. Invariant natural killer T cells ameliorate murine chronic GVHD by expanding donor regulatory T cells[J]. Blood, 2017, 129(23): 3121-3125. |
| [25] |
SIMONETTA F, ALVAREZ M, NEGRIN R S. Natural killer cells in graft-versus-host-disease after allogeneic hematopoietic cell transplantation[J]. Front Immunol, 2017, 8: 465. |
| [26] |
LV M, ZHAO X S, HU Y, et al. Monocytic and promyelocytic myeloid-derived suppressor cells may contribute to G-CSF-induced immune tolerance in haplo-identical allogeneic hematopoietic stem cell transplantation[J]. Am J Hematol, 2015, 90(1): E9-E16. |
| [27] |
ZHOU X Y, JIN N, WANG F, et al. Mesenchymal stem cells: a promising way in therapies of graft-versus-host disease[J]. Cancer Cell Int, 2020, 20: 114. |
| [28] |
MENDT M, DAHER M, BASAR R, et al. Metabolic reprogramming of GMP grade cord tissue derived mesenchymal stem cells enhances their suppressive potential in GVHD[J]. Front Immunol, 2021, 12: 631353. |
| [29] |
MEISEL R, ZIBERT A, LARYEA M, et al. Human bone marrow stromal cells inhibit allogeneic T-cell responses by indoleamine 2, 3-dioxygenase-mediated tryptophan degradation[J]. Blood, 2004, 103(12): 4619-4621. |
| [30] |
VAN DER MAREL A P, SAMSOM J N, GREUTER M, et al. Blockade of IDO inhibits nasal tolerance induction[J]. J Immunol, 2007, 179(2): 894-900. |
| [31] |
KRAMPERA M, COSMI L, ANGELI R, et al. Role for interferon-gamma in the immunomodulatory activity of human bone marrow mesenchymal stem cells[J]. Stem Cells, 2006, 24(2): 386-398. |
| [32] |
AKIYAMA K, CHEN C, WANG D D, et al. Mesenchymal-stem-cell-induced immunoregulation involves FAS-ligand-/FAS-mediated T cell apoptosis[J]. Cell Stem Cell, 2012, 10(5): 544-555. |
| [33] |
PENG Y, CHEN X, LIU Q, et al. Mesenchymal stromal cells infusions improve refractory chronic graft versus host disease through an increase of CD5+ regulatory B cells producing interleukin 10[J]. Leukemia, 2015, 29(3): 636-646. |
| [34] |
DE WITTE S F H, LUK F, SIERRA PARRAGA J M, et al. Immunomodulation by therapeutic mesenchymal stromal cells (MSC) is triggered through phagocytosis of MSC by monocytic cells[J]. Stem Cells, 2018, 36(4): 602-615. |
| [35] |
KAIPE H, ERKERS T, SADEGHI B, et al. Stromal cells-are they really useful for GVHD?[J]. Bone Marrow Transplant, 2014, 49(6): 737-743. |
| [36] |
GALIÈ M, KONSTANTINIDOU G, PERONI D, et al. Mesenchymal stem cells share molecular signature with mesenchymal tumor cells and favor early tumor growth in syngeneic mice[J]. Oncogene, 2008, 27(18): 2542-2551. |
| [37] |
DU W J, CHI Y, YANG Z X, et al. Heterogeneity of proangiogenic features in mesenchymal stem cells derived from bone marrow, adipose tissue, umbilical cord, and placenta[J]. Stem Cell Res Ther, 2016, 7(1): 163. |




