2. 400037 重庆,陆军军医大学(第三军医大学)第二附属医院血液病医学中心,全军血液病中心,创伤、烧伤与复合伤国家重点实验室
2. State Key Laboratory of Trauma, Burns and Combined Injury, Medical Center of Hematology, PLA Center for Hematology, Second Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400037, China
异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)是现阶段治疗恶性血液系统疾病的重要手段,但移植物抗宿主病(graft-versus-host disease,GVHD)作为造血干细胞移植术后主要的并发症,其极大地降低了allo-HSCT患者的生存质量并影响患者长期生存[1]。按发病时间不同GVHD可分为急性移植物抗宿主病(acute GVHD,aGVHD) 和慢性移植物抗宿主病(chronic GVHD,cGVHD),其中cGVHD通常指移植100 d后发生的远期并发症,但目前临床发现很少一部分患者在移植后早期(100 d内)发生的cGVHD临床表现与aGVHD的临床表现同时存在,这种类型称为重叠综合征。慢性移植物抗宿主病是一种具有类似于自身免疫和其他免疫障碍临床表现的综合征,发生率30%~70%,是严重影响allo-HSCT患者生存质量和长期生存的关键因素之一。
根据cGVHD的病理生理特征可分为3个阶段:组织损伤引起炎症(第1阶段),胸腺损伤及细胞体液免疫失调(第2阶段),组织纤维化(第3阶段)。研究证实cGVHD的发生与Th1、Th2及调节性T细胞等细胞亚群介导的促炎与抗炎调控机制有关[2],对免疫细胞发育过程的监测可能是诊疗和随访的一种重要手段。因此本研究收集cGVHD患者的外周血样本,通过对其外周血样本的检测明确特定患者免疫细胞分布的特异性。从免疫失调的角度分析,利用免疫细胞发育时分布水平的特异性变化的这一现象或将有利于辅助传统诊断方法,为cGVHD的发生阶段的预防、精准干预、预后提供新的参考。本研究通过对入组患者随诊时留取的外周血标本进行流式细胞术检测,明确产生cGVHD患者的免疫细胞是否存在分布差异性,进一步解释不同免疫细胞亚群在疾病发展中发挥的作用。
1 资料与方法 1.1 临床资料收集2020年10月至2021年7月陆军军医大学第二附属医院血液病医学中心接受造血干细胞移植后的患者资料,募集的患者接受造血干细胞移植的时间在2017年11月至2021年5月期间,其中发生cGVHD的中位时间为178.5(47~1 328)d,每例患者于随访过程中发生cGVHD时或病程中随访当日留取外周血标本。本研究经陆军军医大学第二附属医院伦理委员会审批批准(2017YFA02)。募集的58例患者中有43例发生cGVHD,纳入cGVHD组;15例未发生cGVHD的患者作为对照组。
cGVHD组纳入标准:按标准诊断为cGVHD的患者,无活动或进展;排除标准:出现疾病进展或复发,出现活动性感染者。对照组纳入标准:移植后100 d内基础疾病稳定,无活动性感染,没有出现临床或活检证实的cGVHD表现者。具体诊断标准参照2014年NIH提出的专家共识[3]。
1.2 方法患者留取外周血标本,采用流式细胞仪(Navios流式细胞仪,贝克曼公司,美国)进行免疫亚群检测。以CD45+/SSC+设门,获50×104个细胞,获取目标群体为淋巴细胞。各个细胞亚群表面标志见表 1。标记亚群的流式检测抗体均购于美国贝克曼公司,根据不同的配色方案,按照说明书进行细胞表面分子及胞内染色,抗体包括:CD45RA-FITC、CD3-ECD、CD45RO-PC-5.5、CD62L-PerCP-Cy7、CD4-AR700、CD45-A750,CD19-BV510、CD127-FITC、CD196-PE、CD4-PC-5.5、CD25PerCP-Cy7、CD183-APC、IgM-FITC、IgD-PE、CD19-ECD、CD24-PC-5.5、CD38-APC、CD27-BV510,流式FCS文件由Kaluza Analysis 2.1进行分析。
| 细胞亚群名称 | 表面标志 |
| T淋巴细胞 | CD45bri+SSClow/+CD3+CD19- |
| 辅助T淋巴细胞 | CD45+CD3+CD4+CD8- |
| CD4+效应T细胞 | CD3+CD4+CD45RA+CD45RO-CD62L- |
| Th1样细胞 | CD45+CD3+CD4+CD183+CD196- |
| Th2样细胞 | CD45+CD3+CD4+CD183-CD196- |
| Th17样细胞 | CD45+CD3+CD4+CD183-CD196+ |
| CD4+调节性T细胞 | CD45+CD3+CD4+CD127low/-CD25+ |
| B淋巴细胞 | CD45+CD19+ |
| 初始B淋巴细胞Naive B | CD19+CD27+IgD+CD38+CD24- |
| 过渡型B淋巴细胞(Transitional B) | CD19+CD27-CD38+/-CD24+ |
1.3 统计学分析
采用SPSS 26.0软件进行数据分析。符合正态分布的计量资料以x±s表示,两组间比较采用单因素方差分析;不符合正态分布的计量资料以M(P25,P75)表示,多组间两两比较采用Kruskal-Wallis单因素方差分析;计数资料以例数或百分率表示,组间比较采用χ2检验。检验水准α=0.05。
2 结果 2.1 临床资料共纳入患者58例,其中cGVHD组43例,男性31例,中位年龄29.0(2~54)岁,轻度15例,中度19例,重度9例;对照组15例,男性8例,中位年龄23.9 (4~50)岁。两组患者的基线情况差异无统计学意义(表 2)。
| 临床特征 | cGVHD组(n=43) | 对照组(n=15) | P值 |
| 疾病类型 | 0.156 | ||
| ALL | 14(24.14) | 3(5.17) | |
| AML | 19(32.76) | 7(12.07) | |
| CML | 2(3.45) | 1(1.72) | |
| MDS | 6(10.34) | 0(0.00) | |
| SAA | 1(1.72) | 2(3.45) | |
| 重型β型地中海贫血 | 1(1.72) | 2(3.45) | |
| 供受者类型 | 0.794 | ||
| 有血缘关系 | 13(30.2) | 4(26.70) | |
| 其他 | 30(69.7) | 11(37.30) | |
| 是否使用ATG体外去T细胞 | 0.445 | ||
| 使用ATG | 30(51.70) | 12(20.70) | |
| 未使用ATG | 13(22.40) | 3(5.20) | |
| 预防性治疗方案 | 0.305 | ||
| CSA+MMF+MTX | 26(45.60) | 7(12.30) | |
| FK506+MMF+MTX | 16(28.10) | 8(14.00) | |
| 发生cGVHD的严重程度 | / | ||
| 轻度 | 15(44.10) | 0(0.00) | |
| 中度 | 19(59.10) | 0(0.00) | |
| 重度 | 9(26.50) | 0(0.00) | |
| 靶器官损伤a | / | ||
| 肝脏损伤 | 14(32.56) | 0(0.00) | |
| 皮肤损伤 | 22(51.16) | 0(0.00) | |
| 肝脏合并皮肤损伤 | 3(6.98) | 0(0.00) | |
| 其他(黏膜、眼睛) | 4(9.30) | ||
| AML:急性髓系白血病;CML:慢性髓系白血病;ALL:急性淋巴细胞白血病;MDS:骨髓增生异常综合征;AA:再生障碍性贫血;SAA:重型再生障碍性贫血;ATG:抗胸腺细胞球蛋白;CSA:环孢素;MMF:吗替麦考酚脂;MTX:甲氨蝶呤;FK506:他克莫司;a: 靶器官损伤中,肝脏损伤患者排除包括皮肤排异表现的患者,皮肤损伤患者排除包括肝脏排异表现的患者,其他患者同时排除包括皮肤及肝脏表现的患者 | |||
2.2 cGVHD组与对照组中免疫细胞亚群的分布情况
检测结果显示,与对照组(阴性患者)相比,cGVHD组患者外周血中调节性T细胞(regulatory T cells,Tregs)和过渡型B淋巴细胞(transitional B)亚群的比例明显降低;CD19+B细胞亚群的比例较对照组明显升高(P<0.01,图 1A、C、D);CD4+/CD8+的细胞亚群比例差异无统计学意义(P>0.05,图 1B)。

|
|
a:P<0.01,与对照组比较 A:调节性T淋巴细胞;B:CD4+/CD8+比值;C:CD19+B淋巴细胞;D:过渡型B淋巴细胞 图 1 cGVHD组与对照组外周血中细胞亚群的分布差异 |
2.3 不同程度的cGVHD组患者免疫细胞亚群的检测情况
不同程度的cGVHD患者中,调节性T细胞比例相比对照组有显著性降低(P<0.05,图 2A),中度cGVHD患者Th17样细胞亚群高于轻度及重度患者(P<0.05,图 2B),但与对照组患者外周血中的亚群分布无显著差异;轻度和中度cGVHD患者CD19+B淋巴细胞较对照组差异有统计学意义(P<0.05,图 2C),重度患者比明显升高,但差异无统计学意义。对照组患者过渡型B淋巴细胞占比水平显著高于cGVHD组患者,其中轻度和中度患者差异有统计学意义(P<0.05,图 2D)。
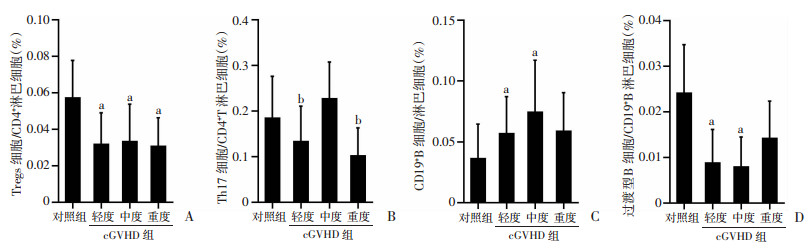
|
|
a:P<0.05,与对照组比较;b:P<0.05,与中度比较 A:调节性T细胞;B:Th17样细胞;C:CD19+B淋巴细胞;D:过渡型B淋巴细胞 图 2 不同严重程度的cGVHD组患者与对照组患者的免疫细胞亚群的分布 |
2.4 不同靶器官损伤的cGVHD组患者免疫细胞亚群检测情况
统计cGVHD组患者常累及的靶器官结果显示,仅皮肤排异14例,仅肝脏损伤22例,同时表现出皮肤及肝脏排异的患者3例,排异表现包括眼睛、黏膜及消化道但不包括皮肤及肝脏的患者4例。分析后发现,仅表现肝脏排异或皮肤排异表现的患者Tregs及过渡型B淋巴细胞亚群无显著差异,对照组中Tregs及过渡型B淋巴细胞显著高于cGVHD组(P<0.05,图 3A、C)。皮肤合并肝脏排异的cGVHD患者辅助滤泡T细胞水平显著高于cGVHD累及其他靶器官的患者(P<0.05,图 3B);过渡型B淋巴细胞亚群水平则显著低于对照组患者(P<0.05,图 3C)。
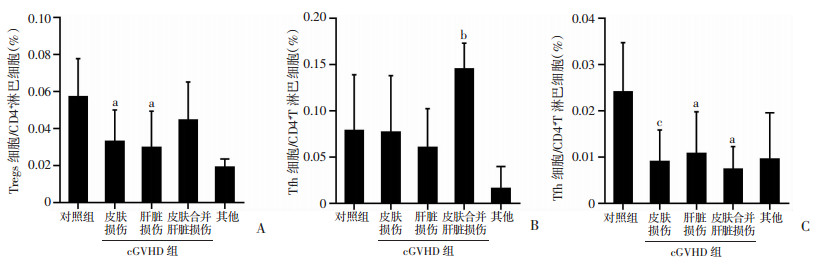
|
|
a:P<0.05,与对照组比较;b:P<0.05,与其他比较 A:调节性T细胞;B:滤泡辅助T细胞;C:过渡型B细胞 图 3 不同靶器官损伤的cGVHD组患者与对照组患者的免疫细胞亚群的分布 |
3 讨论
GVHD显著影响allo-HSCT的成功率,同时也是非复发性死亡的常见原因[4]。急性GVHD发病的病理生理学机制与慢性GVHD有明显区别,前者有典型炎性表现包括T细胞浸润与破坏;而后者主要是纤维增生,为典型的自身免疫性疾病的表现,包括皮肤硬化、肝脏损伤和纤维闭塞性支气管炎等。免疫细胞亚群的变化和失衡贯穿整个GVHD的发病过程,研究表明在造血干细胞移植过程中使用初始T细胞(Naïve T细胞)耗尽的移植物会使cGVHD发生率更低。同时所接受的移植物当中记忆T细胞(Memory T细胞)的作用更多地体现在有助于患者移植后的免疫重建[5]。cGVHD的发生机制已在小鼠模型上证实由供体反应性T细胞诱导产生[6],而在小鼠模型上通过干预Th2细胞极化将使cGVHD表现加重。在自身免疫性疾病中发现系统性硬化症中纤维化的表现与硬皮病cGVHD非常相似,均由浸润皮肤的Th17细胞介导[4]。通过对免疫细胞表面特异标志物分选后得到的免疫细胞亚群,可以体现出特定免疫细胞亚群在免疫细胞发育过程中的变化。以上提及的细胞亚群在cGVHD发生、发展过程中参与的环节,与本研究中观察的免疫细胞亚群结果相互印证,提示免疫细胞亚群可作为疾病的生物标志物参与疾病诊断及病情发展判断。
本研究通过分析对照组和cGVHD组患者外周血免疫细胞亚群,结果显示cGVHD组Tregs细胞水平显著降低。Tregs作为免疫抑制的关键亚群能够抑制效应T细胞活化,因胸腺受损及T终末分化效应记忆细胞(TEMRA)的发育分化致使Tregs数量的减少[7]。这一现象或提示移植后的患者因胸腺损伤出现GVHD的可能性[8]。CD19+B淋巴细胞作为参与特异性免疫反应的主体亚群细胞,在cGVHD组中的占比明显升高。细胞过渡型B细胞表达CD19+CD24hiCD38hi等表面标记,被定义为众多“调节性B细胞(regulatory B cells,Bregs)”的一类。其同样可以通过保留Tregs细胞以及限制辅助性Th1细胞和辅助性Th17细胞的分化来发挥免疫抑制作用[8],在cGVHD组患者外周血的分布降低可能影响其作为抑制供体反应性T细胞而发挥作用[9]。本研究入组的病例数不多,后续研究将进一步扩大样本量,探讨上述细胞亚群作为预测移植后cGVHD发生的意义。从上述细胞亚群监测结果来看,目前针对Tregs细胞的监测已经作为临床上判断机体免疫抑制的常用指标,在免疫功能的检查中作为机体免疫抑制状态的评估指标。
本研究对比不同严重程度cGVHD组和对照组患者的免疫细胞亚群分布。Th17细胞亚群是介导cGVHD炎症反应的重要环节,并且分泌的细胞因子IL-17已被验证可反映疾病的严重程度且呈正相关[10-11]。重度cGVHD组中Th17样细胞水平降低现象可能与长期服用免疫抑制剂相关。过渡型B淋巴细胞亚群在对照组和cGVHD组中也体现出显著差异。既往研究表明cGVHD患者的Bregs被CD40激活后生成的IL-10影响[12],而过渡型B淋巴细胞中部分有功能的Bregs会受到其影响出现过渡型B淋巴细胞亚群数量降低。同时在cGVHD患者常表现为淋巴细胞减少,可解释轻中度患者过渡型B淋巴细胞降低表现。而针对重度患者该亚群表现为分布水平高于轻中度患者,可继续扩大样本量并结合血常规表现进一步分析。
滤泡辅助T细胞(Tfh细胞)作为参与cGVHD发生的关键亚群,因其可激活供体来源的B细胞分化为成熟的B细胞,进一步分泌相关细胞因子IL-21等或趋化因子CXCR5等参与cGVHD,如闭塞性细支气管综合征(bronchiolitis obliterans syndrome, BOS)的发生则依赖于生发中心B细胞的发育而导致病变组织中的抗原沉积[13-14]。这与本研究结果可互相印证,在涉及较多靶器官损伤且较为复杂的cGVHD中,如同时发生肝脏及皮肤排异患者外周血中Tfh细胞的分布水平要显著高于仅累计黏膜、眼睛等器官的患者。因纳入患者的原因,本研究未涉及胃肠道或肺脏排异患者。研究表明肺脏排异的患者主要的病理表现由上述机制产生损伤,结合目前严重程度评分标准,肺部病变的患者通常为中度或重度cGVHD,可为Tfh作为cGVHD严重程度评定指标的生物标志物提供思路[15]。
cGVHD发病机制复杂,参与的细胞亚群及其分泌相关细胞因子众多,本研究发现一些具有临床意义的特异性免疫细胞亚群并初步分析了其参与cGVHD发病的初步机制。考虑本研究持续时间有限,同时纳入研究的病例数较少,不同原发疾病的患者数量分布以及相关治疗个体化差异等影响导致病例异质性较大,为了保证相关实验结果的可信性,后期应扩大样本量后优化检测流程,精细筛选出与cGVHD相关的特异性细胞亚群,进一步为指导临床诊疗提供参考。
作者贡献声明 本文由杜雨軒、王平参与本研究的研究方案设计、样本收集、数据处理、文章撰写及修改,作者张曦、王筱淇、黄瑞昊参与本文的数据处理及修改,洪涛、王蔚浩、何云地、邓小娟、刘帅妹参与本文的修改,共同通信作者葛晓军、杨世杰参与本研究的研究方案设计及文章修改
| [1] |
ZHAO L, CHEN S Q, YANG P X, et al. The role of mesenchymal stem cells in hematopoietic stem cell transplantation: prevention and treatment of graft-versus-host disease[J]. Stem Cell Res Ther, 2019, 10(1): 182. |
| [2] |
陈婷, 李小平, 张诚, 等. 慢性移植物抗宿主病患者血清特异性生物标志物的临床研究[J]. 中华血液学杂志, 2019, 40(11): 948-952. CHEN T, LI X P, ZHANG C, et al. The clinical observation of serum specific biomarkers in patients with chronic graft-versus-host disease[J]. Chin J Hematol, 2019, 40(11): 948-952. |
| [3] |
JAGASIA M H, GREINIX H T, ARORA M, et al. National institutes of health consensus development project on criteria for clinical trials in chronic Graft-versus-Host Disease: I the 2014 diagnosis and staging working group report[J]. Biol Blood Marrow Transplant, 2015, 21(3): 389-401. |
| [4] |
MACDONALD K P, HILL G R, BLAZAR B R. Chronic graft-versus-host disease: biological insights from preclinical and clinical studies[J]. Blood, 2017, 129(1): 13-21. |
| [5] |
DEKKER L, DE KONING C, LINDEMANS C, et al. Reconstitution of T cell subsets following allogeneic hematopoietic cell transplantation[J]. Cancers, 2020, 12(7): 1974. |
| [6] |
LIN A E, REYES S, AN X Y, et al. Experimental modeling of acute- and chronic-GVHD by xenotransplanting human donor PBMCs or cord blood CD34+ cells (HSC) into NSG mice[J]. Blood, 2018, 132(Supplement 1): 5684. |
| [7] |
SOARES M V D, AZEVEDO R I, FERREIRA I A, et al. TREG and tcon dynamics after allo-HSCT: cGVHD is associated to decreased NaïVe and stem cell memory subsets with a concomitant increase in terminally differentiated T cell subsets[J]. Blood, 2016, 128(22): 2229. |
| [8] |
KINSELLA S, DUDAKOV J A. When the damage is done: injury and repair in thymus function[J]. Front Immunol, 2020, 11: 1745. |
| [8] |
LI X P, GAO Q G, FENG Y M, et al. Developing role of B cells in the pathogenesis and treatment of chronic GVHD[J]. Br J Haematol, 2019, 184(3): 323-336. |
| [9] |
SARVARIA A, BASAR R, MEHTA R S, et al. IL-10+ regulatory B cells are enriched in cord blood and may protect against cGVHD after cord blood transplantation[J]. Blood, 2016, 128(10): 1346-1361. |
| [10] |
CHEN X, LAI P, WANG Y, et al. Emerging role of C5a/C5aR IL-17A axis in cGVHD[J]. Am J Transl Res, 2018, 10(7): 2148-2157. |
| [11] |
FORCADE E, PAZ K, FLYNN R, et al. An activated Th17-prone T cell subset involved in chronic graft-versus-host disease sensitive to pharmacological inhibition[J]. JCI Insight, 2017, 2(12): e92111. |
| [12] |
MARAVILLAS-MONTERO J L, ACEVEDO-OCHOA E. Human B regulatory cells: the new players in autoimmune disease[J]. Rev Invest Clin, 2017, 69(5): 243-246. |
| [13] |
VERGHESE D A, CHUN N, PAZ K, et al. C5aR1 regulates T follicular helper differentiation and chronic graft-versus-host disease bronchiolitis obliterans[J]. JCI Insight, 2018, 3(24): e124646. |
| [14] |
BEURIER P, RICARD L, ESHAGH D, et al. TFH cells in systemic sclerosis[J]. J Transl Med, 2021, 19(1): 375. |
| [15] |
SAIDU N E B, BONINI C, DICKINSON A, et al. New approaches for the treatment of chronic graft-versus-host disease: current status and future directions[J]. Front Immunol, 2020, 11: 578314. |




