异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation, allo-HSCT)目前仍然是治愈某些血液病的重要手段,其疗效受很多因素影响,尤其是一些移植相关并发症[1-2]。出血性膀胱炎(hemorrhagic cystitis, HC)是allo-HSCT中常见的并发症之一,近年国内外报道的发生率为5.6%~40%[3-9]。其临床症状包括血尿、尿频、尿急、尿痛、排尿困难、排尿时灼烧感和尿失禁、腹部或耻骨上疼痛、尿梗阻、肾或膀胱损害[10],严重者致使患者生活质量显著下降,甚至危及患者生命。HC的治疗尚无标准程序,主要以水化、碱化尿液为基础,部分患者可行抗病毒治疗,严重者需要行膀胱持续冲洗,甚至外科干预。
HC的发病原因尚不明确,近年研究表明,早发型HC可能与血小板减少、预处理中烷化剂的使用以及全身照射放疗等相关,而迟发性HC(late-onset HC,LOHC)与HLA相合程度、移植后的病毒感染、急性移植物抗宿主病(acute graft-versus-host disease, aGVHD) 的发生等多种因素相关[3-4, 11-13],由于各中心诊断标准以及移植过程差异,危险因素分析结果各异,尚有许多存在争议的危险因素有待进一步验证。本研究对本院2016-2020年接受allo-HSCT治疗的患者资料进行了回顾性分析,主要关注LOHC的发生情况,旨在分析可能影响LOHC发生的因素,以期找到新的危险因素,为临床治疗提供依据,从而提高allo-HSCT的治疗质量。
1 资料与方法 1.1 临床资料回顾性分析2016-2020年于重庆医科大学附属第一医院血液内科接受allo-HSCT治疗的227例患者的临床资料。其中男性120例,女性107例,移植时的中位年龄31(12~65)岁。基础疾病包括:急性白血病(acute leukemia, AL)162例,其中急性髓系白血病(acute myeloid leukemia, AML)103例,急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)55例,急性混合细胞白血病4例;骨髓增生异常综合征(myelodysplastic syndrome, MDS)16例,慢性髓系白血病(chronic myeloid leukemia, CML)6例,重型再生障碍性贫血(severe aplastic anemia, SAA)27例,多发性骨髓瘤(multiple myeloma,MM)7例,淋巴瘤7例,嗜血细胞综合征和阵发性睡眠性血红蛋白尿各1例。移植类型包括:单倍体移植153例,亲缘全相合移植61例,无关供者移植13例(HLA全相合5例,9/10相合8例)。本研究获得本院临床科研伦理委员会批准审批(2021-397)。
1.2 预处理及GVHD的预防血液肿瘤疾病的预处理以BUCY(白消安+环磷酰胺)为主,部分患者联合FA[氟达拉滨(fludarabine, FLU)+阿糖胞苷]/CA(克拉屈滨+阿糖胞苷)、地西他滨(decitabine,DEC)、去甲氧柔红霉素(idarubicin,IDA)、依托泊苷(etoposide,VP-16)或司莫司汀。部分MM患者采用改良FC[FLU+环磷酰胺(cyclophosphamide,CY)]+马法兰(melphalan,MEL)进行预处理。SAA的预处理方案为改良FC,联合兔抗人胸腺细胞球蛋白(anti-human thymocyte globulin,ATG)/抗人T细胞兔免疫球蛋白(aTG-Fresenius, ATG-F)和/或后置CY。
GVHD的预防以环孢素A(cyclosporin A, CsA)/他克莫司(tacrolimus, FK506)+短程甲氨蝶呤(methotrexate, MTX)+吗替麦考酚酯(mycophenolate mofetil,MMF)为基础。HLA不全相合者,联合ATG/ATG-F或者后置CY;HLA全相合者,不使用或者加用减低剂量的ATG/ATG-F。
1.3 病毒感染的预防及监测常规予以更昔洛韦,序惯膦甲酸钠预防病毒感染,造血重建稳定后调整为阿昔洛韦;移植后1个月内,每周输注丙球0.4 g/kg,之后根据病情间断输注。移植后每周监测EBV、CMV DNA定量;出现血尿或者尿路刺激症状时,即时监测CMV-DNA,同时筛查BK病毒、腺病毒和JC病毒。
1.4 HC的防治和疗效判断预防:预处理开始即予以补液水化、碱化尿液;使用CY的0、4、8、12 h予以美司钠解救(每日总量为CY日剂量的1~1.5倍)。治疗:加强水化、碱化尿液,利尿、解痉、止痛治疗;部分患者加强抗病毒治疗;Ⅲ、Ⅳ度HC,可行膀胱持续冲洗,部分患者予以地塞米松膀胱灌注等治疗,合并aGVHD者同时接受抗排异治疗。尿路刺激症状消失且无肉眼、镜下血尿者,为完全缓解(complete remission,CR)。
1.5 定义移植后粒系、巨核系及造血重建的定义参照文献[14]。原发性植入失败的定义参照文献[2, 15]。HC参照文献[14, 16]定义为持续血尿,伴下尿路刺激症状,排除泌尿系结石、感染、肿瘤,血管内溶血及妇科疾病等。根据血尿的严重程度分度[14, 17-18]:镜下血尿为Ⅰ度,肉眼血尿为Ⅱ度,肉眼血尿伴血凝块为Ⅲ度,肉眼血尿伴血凝块致尿路梗阻则为Ⅳ度。LOHC是指预处理结束1周后发生的HC[17-18]。参照文献[19]诊断aGVHD并分级。CMV-DNA或EBV-DNA阳性定义为DNA定量>103copies/mL。
总生存期(overall survival,OS)定义为移植后至因任何原因导致的死亡或末次随访日。无进展生存期(progress free survival,PFS)定义为移植后至疾病进展、复发或末次随访日。
1.6 统计学分析采用SPSS 25.0统计软件。计量资料以中位数(范围)表示,计数资料以例(%)表示。计量资料组间比较采用t检验,计数资料采用χ2检验或者Fisher精确检验。二分类变量的相关性分析采用Spearman检验。χ2检验用于单因素分析,采用Logistics回归模型进行多因素分析。主要终点事件为OS和PFS,采用Kaplan-Meier曲线分析,选用Log-Rank检验,生存曲线交叉时选用Tarone-Ware检验。检验水准α=0.05。
2 结果 2.1 造血重建227例患者输注的干细胞采集物中CD34+细胞的中位数为6.71(1.01~33.86)×106/kg,其中215例造血重建,粒系重建的中位时间为13(7~30)d,巨核系重建的中位时间为14(8~40)d。余下12例患者因植入失败或植入不良早期死亡或行二次移植,未纳入因素分析。
2.2 LOHC 2.2.1 LOHC的发生及临床特征227例患者中,有72例(31.7%)在移植后中位31(8~80)d发生LOHC,中位持续时间为24(3~100)d,其中Ⅰ级6例(8.3%),Ⅱ级22例(30.6%),Ⅲ级36例(50.0%),Ⅳ级8例(11.1%)。在72例HC患者中,有17例(23.6%)发生aGVHD,有27例(37.5%)CMV-DNA阳性,31(43.1%)例EBV-DNA阳性,49例送检BK病毒有8例(16.3%)阳性,18例送检JC病毒有1例(5.6%)阳性。70例患者经治疗后获得CR,余下2例在未缓解的情况下分别死于重症肺炎和颅内出血。
2.2.2 危险因素分析不管是移植后35 d内LOHC的发生(r=-0.037,P=0.584),还是整体LOHC的发生情况(r=-0.008,P=0.902)都与患者造血重建无显著相关。对造血重建的215例患者进行LOHC的危险因素分析。根据是否发生LOHC分为LOHC组(n=68)和non-LOHC组(n=147),结合文献报道及本研究的临床资料,选择19个因素进行单因素和多因素分析(表 1)。BK病毒、JC病毒等未定期监测,故未纳入分析。结果显示供受性别、预处理方案包含FA/CA、CMV-DNA阳性以及aGVHD的发生与HC的发生相关(P值分别为0.047、0.001、0.016和0.008,表 1)。同时,对应用ATG/ATG-F且造血重建的162例患者进一步分析显示,使用ATG还是ATG-F以及是否减量使用(ATG<7.5 mg/kg或ATG-F<15 mg/kg)对LOHC的发生无影响(P值分别为0.707和0.353)。
| 临床特征 | LOHC组(n=68) | non-LOHC组(n=147) | P值 |
| 性别 | 0.700 | ||
| 男 | 38(55.9) | 78(53.1) | |
| 女 | 30(44.1) | 69(46.9) | |
| 年龄/岁 | 0.289 | ||
| ≤18 | 11(16.2) | 21(14.3) | |
| >18~45 | 44(64.7) | 83(56.5) | |
| >45 | 13(19.1) | 43(29.3) | |
| 疾病 | 0.730 | ||
| AL | 51(75.0) | 106(72.1) | |
| MDS | 3(4.4) | 12(8.2) | |
| SAA/PNH | 7(10.3) | 17(11.6) | |
| 其他 | 7(10.3) | 12(8.2) | |
| 移植类型 | 0.219 | ||
| 单倍体 | 49(72.1) | 92(62.6) | |
| 同胞全相合 | 14(20.6) | 47(32.0) | |
| 无关供者 | 5(7.4) | 8(5.4) | |
| 供受性别 | 0.047 | ||
| 男供女 | 24(35.3) | 46(31.3) | |
| 女供女 | 6(8.8) | 23(15.6) | |
| 女供男 | 16(23.5) | 16(10.9) | |
| 男供男 | 22(32.4) | 62(42.2) | |
| 血型相合 | 0.877 | ||
| 是 | 41(60.3) | 87(59.2) | |
| 否 | 27(39.7) | 60(40.8) | |
| 预处理方案 | |||
| BU | 0.419 | ||
| 有 | 61(89.7) | 126(85.7) | |
| 无 | 7(10.3) | 21(14.3) | |
| FA/CA | 0.001 | ||
| 有 | 36(52.9) | 43(29.3) | |
| 无 | 32(47.1) | 104(70.7) | |
| VP-16 | 1.000 | ||
| 有 | 3(4.4) | 7(4.8) | |
| 无 | 65(95.6) | 140(95.2) | |
| DEC | 0.620 | ||
| 有 | 15(22.1) | 37(25.2) | |
| 无 | 53(77.9) | 110(74.8) | |
| 预防GVHD | |||
| CsA | 39(57.4) | 84(57.1) | 0.977 |
| FK506 | 29(42.6) | 63(42.9) | |
| ATG/ATG-F | 0.549 | ||
| 有 | 53(77.9) | 109(74.1) | |
| 无 | 15(22.1) | 38(25.9) | |
| 后置CTX | 0.288 | ||
| 有 | 12(14.0) | 18(12.2) | |
| 无 | 56(82.4) | 129(87.8) | |
| 移植物CD34+细胞/×106·kg-1 | 6.72(1.56~18.70) | 6.75(1.01~33.86) | 0.163 |
| 重建时间/d | |||
| 粒系 | 14(9~24) | 13(7~30) | 0.675 |
| 巨核系 | 14(9~40) | 14(8~40) | 0.561 |
| CMV-DNA | 0.016 | ||
| 阳性 | 26(38.2) | 33(22.4) | |
| 阴性 | 42(61.8) | 114(77.6) | |
| EBV-DNA | 0.154 | ||
| 阳性 | 30(44.1) | 50(34.0) | |
| 阴性 | 38(55.9) | 97(66.0) | |
| aGVHD | 0.008 | ||
| 有 | 17(15.0) | 16(10.9) | |
| 无 | 51(75.0) | 131(89.1) |
进一步多因素分析结果显示,预处理方案包含FA/CA、CMV-DNA阳性以及aGVHD的发生是LOHC发生的危险因素(P值分别为<0.001、0.021和0.028);供受性别对LOHC的发生也有显著影响(P=0.025),其中女供男相对于男供男而言,显著增加了LOHC的发生风险(OR=3.902,95%CI:1.524~9.987,P=0.005,表 2)。
| 临床特征 | 回归系数 | 标准误 | Wald | OR | 95%CI | P值 |
| 供受性别 | 9.367 | 0.025 | ||||
| 男供女 | 0.486 | 0.380 | 1.631 | 1.626 | 0.771~3.427 | 0.202 |
| 女供女 | -0.160 | 0.556 | 0.083 | 0.852 | 0.286~2.535 | 0.773 |
| 女供男 | 1.361 | 0.480 | 8.060 | 3.902 | 1.524~9.987 | 0.005 |
| 男供男a | ||||||
| FLU/CLA+Ara-C | 1.293 | 0.340 | 14.515 | 3.645 | 1.874~7.091 | <0.001 |
| CMV-DNA | 0.789 | 0.341 | 5.357 | 2.202 | 1.129~4.296 | 0.021 |
| aGVHD | 0.919 | 0.417 | 4.841 | 2.506 | 1.106~5.679 | 0.028 |
| a:作为参照 | ||||||
2.3 生存分析
215例患者造血重建后中位随访20.4(1.1~67.2)个月,26例(12.1%)出现疾病进展或复发,32例(14.9%)死亡,其中4例因疾病进展死亡,18例死于感染,8例死于出血,余下2例的死亡原因分别为Ⅳ度肠道aGVHD和肝衰竭。5年PFS率为84.2%(95%CI:81.1%~87.3%),5年OS率为81.7%(95%CI:78.6%~84.8%,图 1A)。LOHC组和non-LOHC组的5年PFS率分别为85.7%(95%CI:80.9%~90.5%)和83.7%(95%CI:79.9%~87.5%),5年的OS率为74.2%(95%CI:68.3%~80.1%)和85.1%(95%CI:81.5%~88.7%),两组的PFS差异无统计学意义(P=0.778),但LOHC组的OS率显著低于non-HC组(P=0.035,图 1B)。不管是单纯发生aGVHD或LOHC,还是aGVHD合并LOHC的患者,PFS差异均无统计学意义(P>0.05,图 1C),但aGVHD合并LOHC患者的OS要比没有aGVHD和LOHC的差(P=0.005,图 1D)。

|
| A:总体PFS和OS;B:LOHC和non-LOHC组患者的PFS和OS;C、D:根据患者aGVHD及LOHC发生情况行PFS(C)和OS(D)分析 图 1 215例造血重建患者的生存分析 |
2.4 LOHC亚组分析
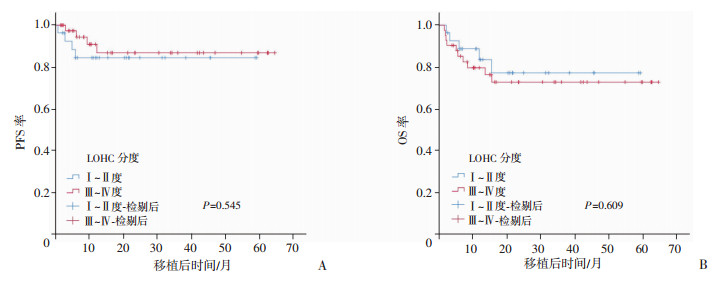
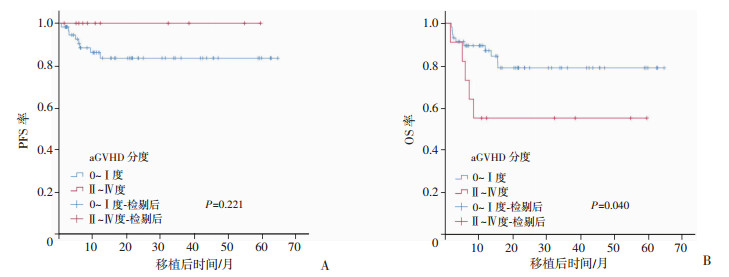
在68例造血重建的LOHC患者中,Ⅰ~Ⅱ度有27例(39.7%),Ⅲ~Ⅳ度有41例(60.3%),LOHC的严重程度对其PFS和OS无影响(P值分别为0.545和0.609,图 2)。共有17例(25.0%)发生aGVHD,Ⅰ度以上aGVHD(10例)的发生对LOHC患者的PFS无显著影响(P=0.221),但会显著降低LOHC患者的OS(P=0.040,图 3)。
|
| 图 2 不同程度LOHC患者的PFS(A)和OS(B)分析 |
|
| 图 3 aGVHD程度对68例造血重建的LOHC患者的PFS(A)和OS(B)的影响 |
2.5 SAA亚组分析
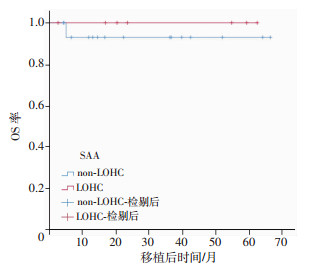
23例SAA患者移植后造血重建,中位随访22.5(2.8~66.5)个月,有7例(30.4%)发生LOHC,无患者复发。移植类型为单倍体或同胞全相合、外周造血干细胞移植或联合骨髓移植对LOHC的发生均无显著影响(P值分别为1.000和0.667)。是否发生LOHC对移植后造血重建的SAA患者的OS差异无统计学意义(P=0.513,图 4)。
|
| 图 4 23例造血重建的SAA患者的OS分析 |
2.6 AL亚组分析
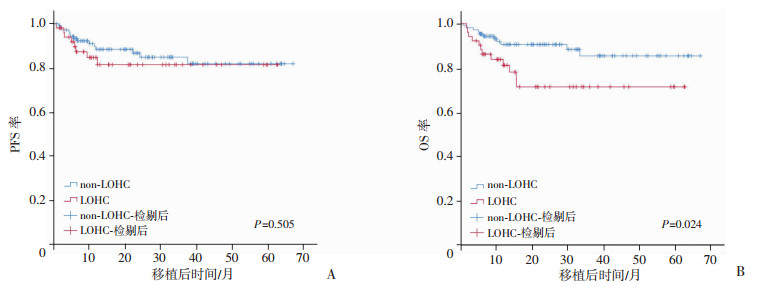
157例AL患者造血重建,中位随访19.9(1.1~67.2)个月,有51例(32.5%)发生LOHC。移植前的中位化疗疗程为3(1~18)周,移植前疾病处于CR1的AL患者LOHC发生率较低(OR=2.964,95%CI:1.255~ 7.003,P=0.013)。LOHC的发生对移植后造血重建的AL患者的PFS差异无统计学意义(P=0.505),但OS显著低于non-LOHC组(P=0.024,图 5)。
|
| 图 5 157例造血重建的AL患者的PFS(A)和OS(B)分析 |
3 讨论
随着HSCT在血液病治疗中的广泛应用,如何防治移植并发症成为临床关注重点,作为移植后常见并发症之一的HC也逐渐被重视。不同研究中心报道的LOHC发生率有差异,多在20.0%~40.0%之间[3-4, 7-9, 11, 20-21],本研究LOHC的发生率为31.7%,与文献报道相似。LOHC的发生与多种因素相关,目前已明确LOHC与CMV、BK病毒等感染以及aGVHD相关,但仍有一些因素存在争议。
3.1 性别、年龄和LOHC的关系国内外研究发现在儿童allo-HSCT患者中,LOHC的发生与性别、年龄是否<6岁等因素显著相关[9, 21-22]。而成人患者中,年龄、性别是否对LOHC的发生有显著影响,仍然存在争议。ARAI等[23]回顾性分析了249例接受allo-HSCT患者的临床资料,发现年龄>45岁会显著增加LOHC风险(P=0.02)。LUNDE等[17]对1321例allo-HSCT患者的回顾性分析的单因素显示,患者为男性、年龄≤20岁与LOHC的发生相关(P值均<0.01),多因素分析在未纳入预处理强度、年龄的情况下仍然提示男性是HC发生的高危因素(P=0.01)。国内多数研究表明患者年龄、性别以及供受性别是否相合与LOHC的发生无关[8, 11, 13]。本研究未发现年龄及患者性别与LOHC的发生相关,但对于男性患者,女性供者会增加其LOHC的发生风险(OR=3.902,95%CI:1.524~9.987,P=0.005)。研究表明,女性供者可能增加GVHD的风险,降低移植患者预后,这与其采集的移植物中含有针对H-Y抗原的抗体有关系,但具体机制不明[24]。本研究女供男较男供男LOHC发生率高,考虑也是与性别差异之间的免疫因素影响有关。
3.2 疾病与LOHC的关系患者原发疾病是否对移植后LOHC的发生有显著影响,目前仍无定论。有研究表明,非恶性疾病或者高危恶性疾病是移植后LOHC发生的高危因素(P<0.01)[17]。邓兰兰等[9]对276例行allo-HSCT的患儿的分回顾性分析结果显示,单因素分析显示基础疾病是影响LOHC发生的危险因(P<0.05),但经多因素分析,并无相关意义。郑凤美等[13]对移植前的疾病状态进行再分层研究,但并未发现高危和标危组间的LOHC发生率有显著差异。本研究在针对所有疾病的多因素及单因素分析中,均未见疾病差异与LOHC的发生显著相关。但在AL的亚组分析中,发现移植前疾病处于CR1的AL患者LOHC发生率较低(OR=2.964,95%CI:1.255~7.003,P=0.013)。基础疾病以及移植前疾病状态,可能影响后续预处理方案的选择,再加上移植、感染等相关因素的相互影响,可能削弱了其对LOHC作用,相关结果还需进一步扩大样本量研究。
3.3 预处理药物与LOHC的关系CY、BU是目前清髓性预处理方案的主要组成药物,前者的代谢产物可与膀胱黏膜结合,引起膀胱黏膜内层形成溃疡,基底膜及周围血管损伤,导致HC[25];后者可直接损伤膀胱黏膜;两者联合预处理时,体内的谷胱甘肽和细胞色素P450显著减少,使两种药物代谢变缓,进一步加重对膀胱黏膜的损伤[9]。除此之外,许多化疗药物,比如异环磷酰胺、VP-16等的代谢产物均可导致尿道黏膜上皮细胞损伤。这些预处理相关化疗药物的使用,不仅与早发型HC相关,还可能与早期发生的LOHC相关[26]。本研究多数患者预处理以BUCY为基础,故结果并未提示BU或CY的应用会增加LOHC的发生风险,但包含FA/CA的强化预处理方案会显著增加LOHC的风险(OR=3.621,95%CI:1.862~7.043,P<0.001),可能与强化预处理方案的毒性、严重的骨髓抑制及免疫等因素相关,具体机制有待进一步研究。
3.4 病毒感染、aGVHD与LOHC的关系绝大多数研究表明CMV、BK病毒感染以及aGVHD是LOHC发生的独立危险因素[3, 9, 11-12, 23, 27]。早期研究表明,CMV感染是LOHC发生的危险因素,其可能机制为病毒复制导致病毒尿、移植后宿主对尿上皮细胞的异源免疫导致血尿[23]。国外研究针对病毒相关LOHC研究多聚焦于BK病毒,allo-HSCT的患者约有50%尿中可检出BK病毒[4, 28],载量超过1×107 copies/mL是BK相关HC的诊断标准之一,其敏感性为86%,特异性为60%[18]。BIELORAI等[29]的研究结果认为,CMV感染并不直接引起HC,而是通过促进BK病毒的扩增,导致HC的发生,GVHD或CMV血症的存在可能有助于低拷贝数的BK病毒感染相关HC的发生。本研究单因素及多因素结果均显示CMV-DNA阳性和aGVHD的发生是LOHC的独立危险因素,与国内外报道相符。由于本研究尚未规律监测BK病毒载量,故未将其纳入因素分析,但是随着病毒感染的重视,后期拟将BK病毒DNA定量监测作为移植后常规监测项目。
除此之外,有些研究表明LOHC可能还与移植类型、HLA相合程度及ATG的使用相关[8, 30]。本研究并未发现移植类型、ATG/ATG-F的使用或者相关药物的剂量与LOHC相关,后续有待扩大样本量及进一步分层研究来验证。
3.5 LOHC对生存的影响LOHC的发生是否对患者的生存有显著影响,仍存在争议[3, 8, 17]。本研究生存分析结果显示LOHC的发生对患者的PFS虽无显著影响(P=0.778),但可显著降低其OS(P=0.035)。Ⅰ度以上aGVHD的发生会显著降低LOHC患者的OS(P=0.040),且aGVHD合并LOHC患者的OS比没有aGVHD和LOHC的更差(P=0.005)。提示为了提高患者的OS,需要高度重视LOHC以及aGVHD。移植前疾病处于CR1的AL患者,造血重建后的LOHC发生率较低(OR=2.964,95%CI: 1.255~7.003,P=0.013),而LOHC的发生显著降低了AL患者的OS(P=0.024)。提示计划allo-HSCT的AL患者,最好在CR1的状态下行allo-HSCT,并且为了提高移植质量,治疗期间应当更加注重LOHC的监测和防治。
综上,本研究发现供受性别不合、强化预处理方案(包含FA/CA)、CMV-DNA阳性以及aGVHD的发生是LOHC发生的危险因素;LOHC的发生会降低患者的OS率;与无aGVHD或LOHC的患者相比,aGVHD合并LOHC的患者OS更差。提示为了减少LOHC的发生,延长患者OS,需注意以下几方面:①当患者为男性时,选择男性供者对预防HC发生是有利因素,当然还需兼顾其他因素;②对于拟行allo-HSCT的AL患者,应尽量在CR1状态时进行移植;③移植中注意选择适当的预处理方案,对于强化预处理的患者,尤其警惕LOHC的发生,加强防治;④积极预防及监测CMV感染和aGVHD的发生。
| [1] |
OTTAVIANO G, CHIESA R, FEUCHTINGER T, et al. Adoptive T cell therapy strategies for viral infections in patients receiving haematopoietic stem cell transplantation[J]. Cells, 2019, 8(1): E47. |
| [2] |
XIONG Y Y, FAN Q, HUANG F, et al. Mesenchymal stem cells versus mesenchymal stem cells combined with cord blood for engraftment failure after autologous hematopoietic stem cell transplantation: a pilot prospective, open-label, randomized trial[J]. Biol Blood Marrow Transplant, 2014, 20(2): 236-242. |
| [3] |
李莹, 杨隽, 许晓倩, 等. 异基因造血干细胞移植后出血性膀胱炎发生危险因素分析[J]. 内科理论与实践, 2020, 15(5): 52-57. LI Y, YANG J, XU X Q, et al. Analysis of the risk factors for hemorrhagic cystitis after allogeneic hematopoietic stem cell transplantation[J]. J Intern Med Concepts Pract, 2020, 15(5): 52-57. |
| [4] |
ATILLA E, CAN A, USLU A, et al. Prospective analysis of hemorrhagic cystitis and BK viremia in allogeneic hematopoietic stem cell transplantation[J]. Turk J Haematol, 2020, 37(3): 186-192. |
| [5] |
ARANGO M, CARDONA D. Hemorrhagic cystitis after haploidentical transplantation with post-transplantation cyclophosphamide: protective effect of MESNA continuous infusion[J]. Biol Blood Marrow Transplant, 2020, 26(8): 1492-1496. |
| [6] |
YANG W B, DU Y Q, QU Z, et al. Multivariate analysis of factors for failed continuous bladder irrigation in hemorrhagic cystitis patients after hematopoietic stem cell transplantation[J]. BMC Urol, 2020, 20(1): 184. |
| [7] |
MO X D, ZHANG X H, XU L P, et al. Treatment of late-onset hemorrhagic cystitis after allogeneic hematopoietic stem cell transplantation: the role of corticosteroids[J]. Ann Hematol, 2018, 97(7): 1209-1217. |
| [8] |
JIANG H M, GENG L Q, WAN X, et al. Incidence and risk factors of late-onset hemorrhagic cystitis after single umbilical cord blood transplantation with myeloablative conditioning regimen[J]. Int J Hematol, 2021, 114(3): 381-389. |
| [9] |
邓兰兰, 邱坤银, 廖雄宇, 等. 儿童异基因造血干细胞移植术后迟发性出血性膀胱炎的病因学研究[J]. 中国实验血液学杂志, 2018, 26(4): 1167-1173. DENG L L, QIU Y K, LIAO X Y, et al. Etiological study of late onset hemorrhagic cystitis after allogeneic hematopoietic stem cell transplantation in children[J]. J Exp Hematol, 2018, 26(4): 1167-1173. |
| [10] |
IMLAY H, XIE H, LEISENRING W M, et al. Presentation of BK polyomavirus-associated hemorrhagic cystitis after allogeneic hematopoietic cell transplantation[J]. Blood Adv, 2020, 4(4): 617-628. |
| [11] |
武倩, 周芳, 宋宁霞, 等. 异基因造血干细胞移植后出血性膀胱炎的临床特征及高危因素分析[J]. 中华血液学杂志, 2019, 40(3): 187-190. WU Q, ZHOU F, SONG N X, et al. Clinical features and risk factors of hemorrhagic cystitis after allogeneic hematopoietic stem cell transplantation[J]. Chin J Hematol, 2019, 40(3): 187-190. |
| [12] |
张兵, 扈臣媛, 于迪, 等. 影响异基因造血干细胞移植后出血性膀胱炎恢复的多因素分析[J]. 中国实验血液学杂志, 2019, 27(3): 976-982. ZHANG B, HU C Y, YU D, et al. Multivariate analysis of factors influencing recovery from hemorrhagic cystitis after allo-HSCT[J]. J Exp Hematol, 2019, 27(3): 976-982. |
| [13] |
郑凤美, 陈育红, 陈欢, 等. 亲属单倍型与同胞全合异基因造血干细胞移植后患者出血性膀胱炎的临床特征比较[J]. 中华血液学杂志, 2017, 38(8): 656-661. ZHENG F M, CHEN Y H, CHEN H, et al. Comparison of clinical features of hemorrhagic cystitis after haploidentical and matched sibling donor allogeneic hematopoietic stem cell transplantation[J]. Chin J Hematol, 2017, 38(8): 656-661. |
| [14] |
EL-ZIMAITY M, SALIBA R, CHAN K, et al. Hemorrhagic cystitis after allogeneic hematopoietic stem cell transplantation: donor type matters[J]. Blood, 2004, 103(12): 4674-4680. |
| [15] |
POTTINGER B, WALKER M, CAMPBELL M, et al. The storage and re-infusion of autologous blood and BM as back-up following failed primary hematopoietic stem-cell transplantation: a survey of European practice[J]. Cytotherapy, 2002, 4(2): 127-135. |
| [16] |
GORCZYNSKA E, TURKIEWICZ D, RYBKA K, et al. Incidence, clinical outcome, and management of virus-induced hemorrhagic cystitis in children and adolescents after allogeneic hematopoietic cell transplantation[J]. Biol Blood Marrow Transplant, 2005, 11(10): 797-804. |
| [17] |
LUNDE L E, DASARAJU S, CAO Q, et al. Hemorrhagic cystitis after allogeneic hematopoietic cell transplantation: risk factors, graft source and survival[J]. Bone Marrow Transplant, 2015, 50(11): 1432-1437. |
| [18] |
CESARO S, DALIANIS T, HANSSEN RINALDO C, et al. ECIL guidelines for the prevention, diagnosis and treatment of BK Polyomavirus-associated haemorrhagic cystitis in haematopoietic stem cell transplant recipients[J]. J Antimicrob Chemother, 2018, 73(1): 12-21. |
| [19] |
PRZEPIORKA D, WEISDORF D, MARTIN P, et al. 1994 consensus conference on acute GVHD grading[J]. Bone Marrow Transplant, 1995, 15(6): 825-828. |
| [20] |
BEJANYAN N, BRUNSTEIN C G, CAO Q, et al. Delayed immune reconstitution after allogeneic transplantation increases the risks of mortality and chronic GVHD[J]. Blood Adv, 2018, 2(8): 909-922. |
| [21] |
谢云霞, 王昱, 黄晓军, 等. 儿童及青少年血液病患者单倍型造血干细胞移植后合并出血性膀胱炎临床分析[J]. 中华血液学杂志, 2018, 39(10): 833-838. XIE Y X, WANG Y, HUANG X J, et al. Clinical analysis of hemorrhagic cystitis in children and adolescents with hematological diseases post haplo-hematopoietic stem cell transplantation[J]. Chin J Hematol, 2018, 39(10): 833-838. |
| [22] |
RIACHY E, KRAUEL L, RICH B S, et al. Risk factors and predictors of severity score and complications of pediatric hemorrhagic cystitis[J]. J Urol, 2014, 191(1): 186-192. |
| [23] |
ARAI Y, MAEDA T, SUGIURA H, et al. Risk factors for and prognosis of hemorrhagic cystitis after allogeneic stem cell transplantation: retrospective analysis in a single institution[J]. Hematology, 2012, 17(4): 207-214. |
| [24] |
于文静, 王昱, 许兰平, 等. 供受者性别组合对急性白血病单倍体相合造血干细胞移植预后的影响[J]. 中华血液学杂志, 2018, 39(5): 398-403. YU W J, WANG Y, XU L P, et al. Influence of donor-recipient sex matching on outcomes of haploidentical hematopoietic stem cell transplantation for acute leukemia[J]. Chin J Hematol, 2018, 39(5): 398-403. |
| [25] |
郭道远, 刘林. 造血干细胞移植术后出血性膀胱炎的诊治[J]. 现代医药卫生, 2016, 32(16): 2510-2512. GUO D Y, LIU L. Diagnosis and treatment of hemorrhagic cystitis after hematopoietic stem cell transplantation[J]. J Mod Med Health, 2016, 32(16): 2510-2512. |
| [26] |
邓兰兰, 周敦华. 造血干细胞移植术后出血性膀胱炎的研究进展[J]. 国际输血及血液学杂志, 2015, 38(6): 522-525. DENG L L, ZHOU D H. Research progress of hemorrhagic cystitis after hematopoietic stem cell transplantation[J]. Int J Blood Transfus Hematol, 2015, 38(6): 522-525. |
| [27] |
孙春红, 王晓宁, 罗敏娜, 等. 异基因造血干细胞移植后并发出血性膀胱炎的危险因素分析[J]. 中国实验血液学杂志, 2021, 29(2): 610-614. SUN C H, WANG X N, LUO M N, et al. Analysis of the risk factors for hemorrhagic cystitis after hematopoietic stem cell transplantation[J]. J Exp Hematol, 2021, 29(2): 610-614. |
| [28] |
SEBER A, SHU X O, DEFOR T, et al. Risk factors for severe hemorrhagic cystitis following BMT[J]. Bone Marrow Transplant, 1999, 23(1): 35-40. |
| [29] |
BIELORAI B, SHULMAN L M, RECHAVI G, et al. CMV reactivation induced BK virus-associated late onset hemorrhagic cystitis after peripheral blood stem cell transplantation[J]. Bone Marrow Transplant, 2001, 28(6): 613-614. |
| [30] |
COPELAN O R, SANIKOMMU S R, TRIVEDI J S, et al. Higher incidence of hemorrhagic cystitis following haploidentical related donor transplantation compared with matched related donor transplantation[J]. Biol Blood Marrow Transplant, 2019, 25(4): 785-790. |




