2. 400038 重庆,陆军军医大学(第三军医大学)第一附属医院: 全军临床病理学研究所,西南癌症中心
2. PLA Institute of Pathology, Southwest Cancer Center, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038, China
胃癌是常见的消化道恶性肿瘤,其发病率位居恶性肿瘤的第5位,是第3大癌症致死病因[1-2]。目前,胃癌的治疗方式主要包括手术、化疗和靶向治疗等。在过去几十年里,随着诊疗水平的提高,胃癌的发病率逐步下降,但对于进展期胃癌而言,预后仍不乐观,其中位生存期尚不足1年[3]。因此,寻找胃癌全新的诊疗靶标具有十分重要的临床意义。C型尼曼-匹克蛋白2(niemann-pick protein C2,NPC2)是一种在进化上十分保守的蛋白,其在各类组织和器官中均有分布,主要定位于晚期内体和溶酶体,并在胆固醇转运中发挥作用[4-5]。随着研究的深入,人们发现,NPC2与肿瘤的发生进展密切,其在肿瘤细胞分化、增殖和肿瘤微环境调控中均发挥重要作用[6-9]。The Human Protein Atlas显示,NPC2的表达水平与胃癌患者预后相关(P<0.001),NPC2高表达者生存期更短。为了研究NPC2与胃癌的关系,我们通过分析数据库基因表达信息和胃癌组织芯片免疫组化染色结果,探讨了NPC2在胃癌组织中的表达情况、其表达水平与胃癌患者临床病理参数及预后的关系。在胃癌细胞系SGC7901中干预NPC2表达后,通过Transwell试验检测迁移能力的改变。
1 资料与方法 1.1 胃癌相关数据集、临床样本和胃癌细胞系TCGA数据集和GEO数据集均下载自官网。在本研究中,应用了TCGA胃癌数据集的406例胃癌组织基因表达矩阵及临床信息、GSE15459数据集的192例胃癌组织基因表达矩阵及临床信息、GSE33335数据集的25例胃癌组织和50例正常胃组织基因表达矩阵、GSE63089数据集的45例胃癌及其癌旁组织基因表达矩阵、GSE54129数据集的111例胃癌组织基因表达矩阵、GSE62254数据集的300例胃癌组织基因表达矩阵、GSE84437数据集的433例胃癌组织基因表达矩阵。胃癌组织芯片购自上海芯超生物科技有限公司,其中包含98例胃癌组织(其中82例胃癌组织样本含配对的癌旁组织)及临床病理预后信息。胃癌细胞系SGC7901购自中国科学院上海细胞库。
1.2 数据集分析提取GSE33335数据集和GSE63089数据集中胃癌组织和正常胃组织/癌旁组织的NPC2 mRNA表达量,统计分析其表达差异。提取GSE15459数据集中NPC2 mRNA表达量和临床信息,通过绘制受试者工作曲线(Receiver operating characteristic curve,ROC曲线),以约登指数最大时所对应的表达量为临界值,将样本分为高、低表达两组,绘制生存曲线,进行生存分析,利用临床信息和NPC2表达分组进行列联表分析。提取TCGA胃癌数据集中NPC2 mRNA表达量和临床信息,通过绘制ROC曲线,以约登指数最大时所对应的表达量为临界值,将样本分为高、低表达两组,绘制生存曲线,进行生存分析,利用临床信息和NPC2表达分组进行单因素和多因素回归分析。以NPC2 mRNA表达量中位数为临界值,以NOM P≤0.05、FDR≤0.25为富集标准,在GSE54129数据集、GSE62254数据集和GSE84437数据集中进行基因集富集分析(gene set enrichment analysis,GSEA),并绘制韦恩图求交集,得到NPC2高表达胃癌组织中的主要富集通路。
1.3 免疫组织化学染色、结果判定及分析将胃癌组织芯片置于65 ℃恒温孵箱中烤片30 min,二甲苯、梯度酒精标准脱蜡处理;使用枸橼酸抗原修复工作液进行抗原修复,PBS缓冲液震荡清洗3次,每次5 min;滴加3% 过氧化氢溶液,避光处理30 min,用以阻断内源性过氧化物酶;使用山羊封闭血清封闭30 min;以1 ∶2000的浓度滴加NPC2抗体(Abcam公司,美国),置于湿盒内4 ℃孵育过夜;使用PBS缓冲液震荡清洗3次,每次5 min,滴加鼠兔通用二抗工作液(DAKO),室温孵育30 min;使用PBS缓冲液震荡清洗3次,每次5 min,DAB显色,苏木精复染;梯度酒精脱水后,使用二甲苯透明,中性树胶封片。使用光学显微镜采集芯片中全部180点的镜下图像,使用Image Pro Plus软件分别测定各点的积分光密度(IOD值),作为NPC2的表达强度,用于后续分析。提取胃癌组织及相应癌旁组织的IOD值进行统计分析,比较NPC2表达水平差异。提取胃癌组织IOD值及临床信息,通过绘制ROC曲线,以约登指数最大时所对应的表达量为临界值,将样本分为高、低表达两组,绘制生存曲线,进行生存分析。利用临床信息和NPC2表达分组进行列联表分析、单因素和多因素回归分析。
1.4 胃癌细胞系SGC7901的培养和NPC2表达干预使用含10%胎牛血清(Giboco)的RPMI1640培养基(HyClone)在37 ℃、5% CO2恒温孵箱中培养胃癌细胞系SGC7901。在胃癌细胞系SGC7901中干预NPC2表达前,将细胞种于6孔板中,待细胞生长约50%时开始转染。si-NPC2 RNA购自广州锐博生物技术有限公司(siNPC2-1:CTACCTGAATAAACTACCA,siNPC2-2:AGTGGCAACTTCAGGATGA)。每孔所需体系:将4 μL (10 μmol/L)的si-NPC2 RNA和4 μL转染试剂RNA iMax(Thermo)分别置于100 μL Opti-MEM(Giboco)中混匀,静置5 min后将两者混匀,室温孵育15 min后转染,60 h后收取细胞行后续检测。
1.5 Western blot检测在收取的细胞沉淀中添加适量M-PERTM Mammalian Protein Extraction Reagent(Thermo)和蛋白酶抑制剂,混匀后置于冰上裂解30 min,以4 ℃、15 000 r/min离心10 min后留取上清液,使用BCA试剂盒测定蛋白浓度。加入适量蛋白上样缓冲液(5×),将样品置于100 ℃水浴锅中变性15 min。配制电泳凝胶,每孔加样量为5 μL,使用80 V电泳30 min后,改为120 V继续电泳90 min。使用PVDF膜进行转膜,转膜条件为100 V、120 min。使用5%脱脂牛奶室温封闭60 min后,4 ℃过夜孵育NPC2抗体(Abcam,1 ∶1 000)和GAPDH抗体(CST,1 ∶2 000)。室温孵育兔二抗(中杉金桥,1 ∶4 000)60 min。使用SuperSignalingTM West Femto Substrate(Thermo)和自动化凝胶成像仪曝光显影。
1.6 Transwell试验实验前,将转染的细胞在无血清培养基中培养24 h,进行细胞周期同步化。按照4×104个/孔将细胞种于Transwell上室中,并加入200 μL无血清培养基,下室中加入600 μL含20% 胎牛血清的RPMI1640培养基。将小室置于37 ℃、5% CO2恒温孵箱中培养。培养48 h后,使用预冷的PBS缓冲液轻柔漂洗小室,并使用4 %多聚甲醛固定30 min。固定结束后,将小室置于室温风干,并使用结晶紫染液染色30 min。将小室置于光镜下采图,计数并分析。
1.7 统计学分析采用SPSS 20.0软件和GraphPad Prism 6.01处理实验数据。计量资料以x±s表示。独立样本采用独立样本t检验,配对样本采用配对样本t检验。计数资料列联表分析采用卡方检验。Kaplan-Meier生存分析采用Log-rank检验。单因素回归分析采用Kaplan-Meier法Log-rank检验。多因素回归分析采用Cox比例风险回归模型。检验水准α=0.05。
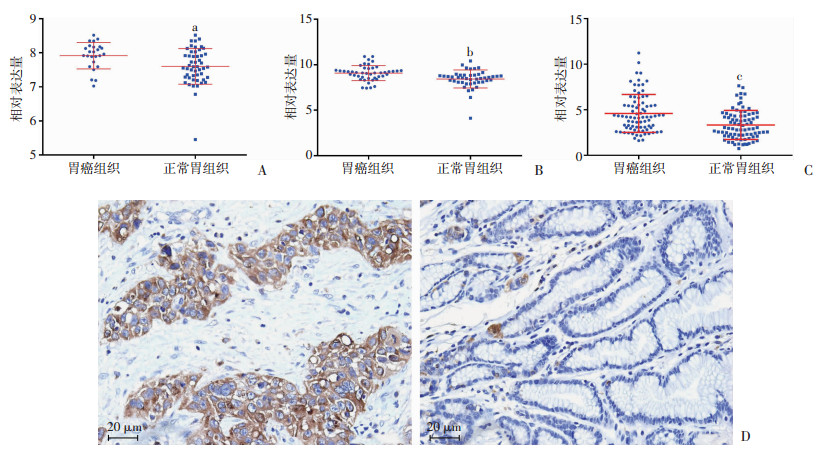
2 结果 2.1 NPC2在胃癌组织中高表达GSE33335数据集分析结果显示:与正常胃组织[(7.601±0.074),n=50]相比,胃癌组织[(7.917±0.077),n=25]的NPC2 mRNA表达水平显著升高(独立样本t检验,双侧检验,P=0.0096,图 1A)。GSE63089数据集分析结果也显示:与癌旁组织[(8.435±0.148),n=45]相比,胃癌组织[(9.083±0.123),n=45]的NPC2 mRNA表达水平显著升高(配对样本t检验,双侧检验,P=0.0001,图 1B)。对胃癌组织芯片进行免疫组化染色,并利用IPP软件对表达情况进行量化分析,计算IOD值,分析结果显示:与癌旁组织[(3.336±0.176),n=82]相比,胃癌组织[(4.596±0.230),n=82]的NPC2表达水平显著升高(配对样本t检验,双侧检验,P<0.0001,图 1C、D)。上述研究结果均表明,NPC2在胃癌组织中的表达水平显著升高。
|
| A: GSE33335数据集中胃癌(n=25)和正常胃组织(n=50)的NPC2表达 a:P=0.0096;B:GSE63089数据集中胃癌(n=45)和癌旁组织(n=45)的NPC2表达 b:P=0.0001;C:组织芯片中胃癌(n=82)和癌旁组织(n=82)的NPC2表达 c:P<0.0001;D:胃癌组织芯片中胃癌(左)与癌旁组织(右)的NPC2表达(典型图片) 图 1 NPC2在胃癌组织和正常胃组织/癌旁组织中的表达差异 |
2.2 NPC2表达与胃癌患者临床病理参数相关
GSE15459数据集分析结果显示:NPC2的mRNA表达水平与胃癌的美国癌症联合委员会(American Joint Committee on Cancer,AJCC)临床分期相关(P=0.009,表 1)。利用胃癌组织芯片进行免疫组化染色,分析结果显示:NPC2的表达水平与胃癌患者的区域淋巴结转移(pN)(P=0.04)、AJCC临床分期(P=0.04)密切相关(表 2)。
| 临床病理参数 | NPC2表达水平 | 卡方检验 | |
| 高表达 | 低表达 | ||
| 性别 | |||
| 男 | 41 | 84 | P=0.527 |
| 女 | 19 | 48 | |
| 年龄 | |||
| ≥66岁 | 28 | 68 | P=0.533 |
| <66岁 | 32 | 64 | |
| AJCC分期 | |||
| Ⅰ~Ⅱ | 11 | 49 | P=0.009 |
| Ⅲ~Ⅳ | 49 | 83 | |
| 临床病理参数 | NPC2表达水平 | 卡方检验 | |
| 高表达 | 低表达 | ||
| 性别 | |||
| 男 | 35 | 27 | P=0.14 |
| 女 | 25 | 11 | |
| 年龄 | |||
| <65岁 | 27 | 20 | P=0.46 |
| ≥65岁 | 33 | 18 | |
| pT | |||
| T1~T2 | 11 | 7 | P=0.99 |
| T3~T4 | 49 | 31 | |
| pN | |||
| N0 | 12 | 15 | P=0.04 |
| N1~N3 | 48 | 23 | |
| pM | |||
| M0 | 53 | 36 | P=0.48 |
| M1 | 7 | 2 | |
| AJCC分期 | |||
| Ⅰ~Ⅱ | 19 | 20 | P=0.04 |
| Ⅲ~Ⅳ | 41 | 18 | |
2.3 NPC2高表达的胃癌患者预后不良
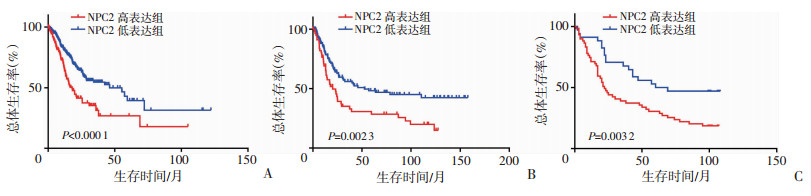
TCGA胃癌数据集分析结果显示:较之于NPC2 mRNA低表达的胃癌患者,NPC2 mRNA高表达者预后不良(中位生存时间:NPC2低表达 vs. NPC2高表达= 46.22月vs 18.13月,Log-rank检验,P<0.000 1,图 2A)。GSE15459数据集分析结果也显示:NPC2 mRNA高表达的胃癌患者预后不良(中位生存时间:NPC2低表达 vs NPC2高表达=52.63月vs 20.27月,Log-rank检验,P=0.002 3,图 2B)。同样,胃癌组织芯片分析结果也显示:NPC2高表达胃癌患者的预后不良(中位生存时间:NPC2低表达组 vs NPC2高表达组=64.50月vs 22.00月,Log-rank检验,P=0.003 2,图 2C)。结果显示,NPC2高表达的胃癌患者生存期显著缩短。
|
| A:TCGA胃癌数据集中NPC2表达水平和预后的关系(P<0.000 1);B:GSE15459数据集中NPC2表达水平和预后的关系(P=0.002 3);C:胃癌组织芯片中NPC2表达水平和预后的关系(P=0.003 2) 图 2 胃癌组织中NPC2表达水平和预后的关系 |
2.4 NPC2表达水平是胃癌患者的独立预后预测因素
利用TCGA胃癌数据集进行单因素和多因素回归分析,结果显示:NPC2 mRNA表达水平与胃癌患者预后密切相关(P<0.000 1),且NPC2 mRNA表达水平是胃癌患者的独立预后预测因素(风险比为2.140,95%置信区间为1.523~3.006,P<0.000 1,表 3)。同样,胃癌组织芯片分析结果也表明:NPC2表达水平与胃癌患者预后密切相关(P=0.003),且NPC2表达水平是胃癌患者的独立预后预测因素(风险比为1.926,95%置信区间为1.108~3.348,P=0.02,表 4)。
| 临床病理参数 | 例数 | 单因素分析 | 多因素分析 | |||
| 生存时间 | P | HR(95%CI) | P | |||
| 性别 | ||||||
| 女性 | 134 | 65.3 | 0.142 | |||
| 男性 | 228 | 49.9 | ||||
| pT | ||||||
| T1~T2 | 93 | 66.8 | 0.003 | 1 | 0.060 | |
| T3~T4 | 296 | 51.7 | 1.583(0.981~2.554) | |||
| pN | ||||||
| N0 | 114 | 58.7 | 0.001 | 1 | 0.276 | |
| N1-N2 | 248 | 52.2 | 1.356(0.784~2.346) | |||
| pM | ||||||
| M0 | 336 | 55.4 | 0.003 | 1 | 0.138 | |
| M1 | 26 | 27.3 | 1.546(0.869~2.750) | |||
| AJCC分期 | ||||||
| Ⅰ~Ⅱ | 164 | 64.3 | 9.3×10-5 | 1 | 0.198 | |
| Ⅲ~Ⅳ | 198 | 47.2 | 1.393(0.841~2.308) | |||
| NPC2表达 | ||||||
| 低表达 | 240 | 61.7 | 2.4×10-5 | 1 | 1.1×10-5 | |
| 高表达 | 122 | 36.7 | 2.140(1.523~3.006) | |||
| 临床病理参数 | 例数 | 单因素分析 | 多因素分析 | |||
| 生存时间 | P | HR(95%CI) | P | |||
| 性别 | ||||||
| 男性 | 62 | 53.3 | 0.415 | |||
| 女性 | 36 | 47.5 | ||||
| 年龄 | ||||||
| <65岁 | 47 | 58.7 | 0.054 | |||
| ≥65岁 | 51 | 44.6 | ||||
| pT | ||||||
| T1-T2 | 18 | 69.3 | 0.045 | 1 | 0.408 | |
| T3-T4 | 80 | 46.7 | 1.393(0.635~3.054) | |||
| pN | ||||||
| N0 | 27 | 66.8 | 0.071 | |||
| N1-N2 | 71 | 45.7 | ||||
| pM | ||||||
| M0 | 89 | 54.7 | 0.001 | 1 | 0.010 | |
| M1 | 9 | 14.3 | 2.835(1.288~6.242) | |||
| AJCC分期 | ||||||
| Ⅰ~Ⅱ | 39 | 68.3 | 0.002 | 1 | 0.028 | |
| Ⅲ~Ⅳ | 59 | 39.6 | 1.837(1.067~3.164) | |||
| NPC2表达 | ||||||
| 低表达 | 38 | 67.0 | 0.003 | 1 | 0.020 | |
| 高表达 | 60 | 41.9 | 1.926(1.108~3.348) | |||
2.5 细胞黏附分子基因在NPC2高表达胃癌中显著富集
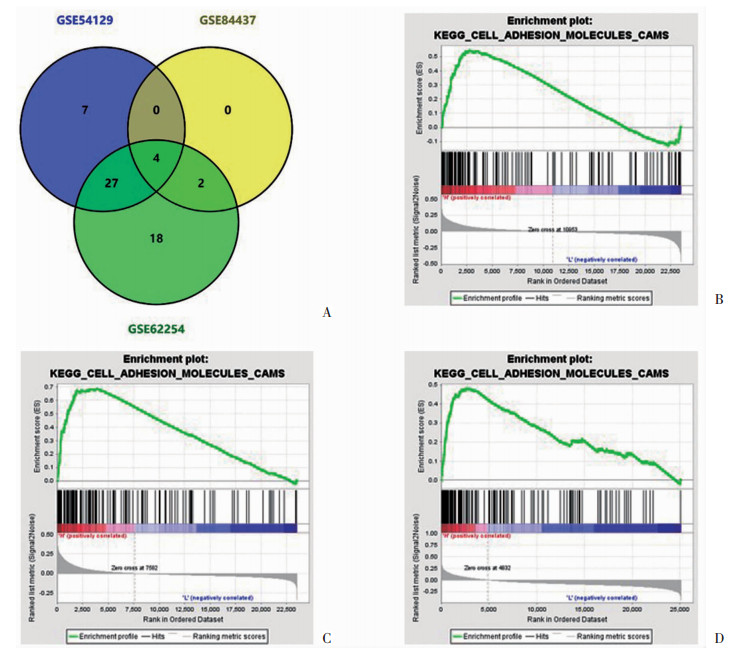
上述研究结果显示,NPC2表达与胃癌关系密切。那么,NPC2究竟影响了胃癌细胞的何种生物学行为呢?在GSE54129数据集、GSE62254数据集和GSE84437数据集中,我们利用GSEA对NPC2高表达胃癌中的富集通路进行了挖掘,在GSE54129数据集中得到38条富集通路,在GSE62254数据集中得到51条富集通路,在GSE84437数据集中得到6条富集通路。通过绘制韦恩图(图 3A)求交集,得到4条富集通路,分别是:KEGG LEISHMANIA INFECTION(利什曼原虫感染)、KEGG LYSOSOME(溶酶体)、KEGG ASTHMA(哮喘)和KEGG CELL ADHESION MOLECULES (细胞黏附分子)。其中,与肿瘤细胞生物学行为关系最为直接的是KEGG CELL ADHESION MOLECULES(CAMS),其在NPC2高表达胃癌中显著富集(GSE54129数据集:富集分数=1.61,NOM P=0.006,FDR=0.074;GSE62254数据集:富集分数=1.85,NOM P<0.001,FDR=0.045;GSE84437数据集:富集分数=1.62,NOM P=0.049,FDR=0.208, 图 3B~D)。上述分析结果表明:NPC2或在调控胃癌细胞迁移中发挥重要作用。
|
| A:GSE54129数据集、GSE62254数据集和GSE84437数据集中NPC2高表达胃癌富集通路韦恩图;B:GSE54129数据集中KEGG_CELL_ADHESION_MOLECULES_CAMS富集情况(富集分数=1.61,NOM P=0.006,FDR=0.074);C:GSE62254数据集中KEGG_CELL_ADHESION_MOLECULES_CAMS富集情况(富集分数=1.85,NOM P<0.001,FDR=0.045);D:GSE84437数据集中KEGG_CELL_ADHESION_MOLECULES_CAMS富集情况(富集分数=1.62,NOM P=0.049,FDR=0.208) 图 3 NPC2高表达胃癌中GSEA结果 |
2.6 下调NPC2表达,胃癌细胞迁移能力显著降低
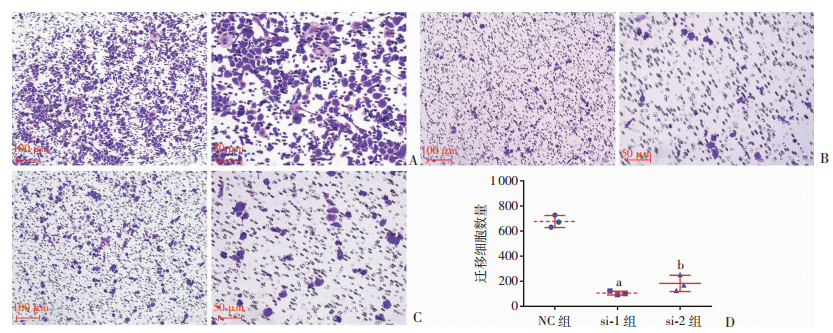
在胃癌细胞系SGC7901中成功敲低NPC2表达(图 4)后,通过Transwell试验检测其迁移能力。结果显示,在胃癌细胞系SGC7901中下调NPC2表达后,其迁移能力显著下降(图 5)。3次独立重复试验[NC组vs si-1组:(676.7±48.2) vs (106.3±15.0),独立样本t检验,双侧检验,P=0.000 04;NC组vs si-2组:(676.7±48.2) vs (183.7±64.6),独立样本t检验,双侧检验,P=0.000 449]。

|
| 图 4 在SGC7901中使用siRNA敲低NPC2表达 |
|
| A:不同倍数观察SGC7901 NC组迁移能力;B:不同倍数观察SGC7901 si-1组迁移能力;C:不同倍数观察SGC7901 si-2组迁移能力;D:3组SGC7901迁移能力的统计分析(a:P=0.000 04,si-1 vs NC;b:P=0.000 449,si-2 vs NC) 图 5 在SGC7901中干预NPC2表达后,其迁移能力改变 |
3 讨论
全球癌症数据显示,全球现有胃癌病例数超100万例,其发病率在恶性肿瘤中居第5位,致死率居第3位,每年因胃癌死亡的人数约占因癌致死病例数的8.2%。现有治疗方法对于进展期胃癌患者而言疗效不佳。因此,寻找新的诊疗靶标,对于改善胃癌患者(特别是进展期胃癌患者)的预后,具有十分重要的意义。NPC2是一种定位于晚期内体和溶酶体的胆固醇转运蛋白,既往研究也多围绕其胆固醇转运功能展开,关于NPC2与肿瘤关系的研究较少。近年来,随着研究深入,人们逐渐发现,除了“转运胆固醇”这一经典功能外,NPC2还可能在肿瘤的发生进展中发挥重要作用。生物信息学分析结果表明,NPC2表达与乳腺癌、肝癌等肿瘤的临床病理参数密切相关,其高表达与结直肠癌、胃癌、肝癌的不良预后相关,其低表达与甲状腺癌的不良预后相关。此外,已有研究结果也显示,NPC2在多种肿瘤中表达水平发生改变,参与调控了肺癌、乳腺癌、肝癌等肿瘤细胞的增殖,通过细胞凋亡途径促进了甲状腺乳头状癌、肺腺癌等肿瘤组织中乳头状结构的形成,并参与调控了肺癌肿瘤微环境中巨噬细胞的招募[6-9]。由此可见,NPC2或在多种肿瘤的发生进展中发挥调控作用,值得深入研究。如前所述,The Human Protein Atlas数据库显示,NPC2的表达水平与胃癌患者预后相关(P<0.001),NPC2高表达者生存期更短。那么,NPC2在胃癌的发生进展中究竟扮演着怎样的角色呢?目前尚无相关研究。
为了回答这一科学问题,本研究首先从生物信息学分析入手,利用数据库分析和胃癌组织芯片免疫组化染色分析,发现与正常胃组织和癌旁组织相比,NPC2在胃癌组织中的表达水平显著升高,其表达水平与胃癌患者的AJCC分期、区域淋巴结转移等临床病理参数密切相关,NPC2高表达的胃癌患者预后不良,其表达水平是胃癌患者的独立预后预测因素。上述生物信息学分析结果初步揭示了NPC2与胃癌的密切关系。当然,这些结果也并非最终论断。受限于操作误差、纳入样本量等因素,不同数据集的分析结果也会存在出入,甚至出现截然相反的情况。例如,在TCGA胃癌数据集和胃癌组织芯片中进行单因素和多因素回归分析时,尽管NPC2的分析结果是一致的,但pT、pN、pM和AJCC分期的分析结果则不完全相同。这表明,生物信息学分析的结果无法得到肯定结论,必须通过体外实验、体内实验加以验证。我们利用GSEA,发现NPC2高表达胃癌组织中,细胞黏附分子相关基因显著富集,大量研究结果均已证实,细胞黏附分子与肿瘤侵袭迁移关系密切[10-11]。基于此结果,我们在胃癌细胞系SGC7901中干预NPC2表达后,发现其迁移能力显著降低。上述研究结果提示我们,NPC2或在胃癌的发生进展中发挥着重要作用,并调控胃癌细胞的迁移能力,NPC2可能是胃癌的潜在全新诊疗靶标。
当然,NPC2在胃癌中的具体作用机制仍不清楚,现有研究表明,NPC2可能通过调控MAPK、mTOR等信号通路发挥作用,但相关研究仍然有限,没有回答其具体作用机制。今后,围绕NPC2和肿瘤的研究,或许可以从其最基础的功能——胆固醇转运来入手。我们知道,信号转导异常是导致肿瘤发生的关键分子生物学事件[12]。稳定的生物膜系统是保证有序细胞信号转导的物质基础,而胆固醇在细胞内的有序分布,对于维持生物膜系统稳定的重要性不言而喻[13]。在细胞膜上,存在着富含胆固醇、鞘脂类和特殊蛋白质的微区,又名“脂筏”,一些重要的信号转导分子也定位于此,稳定的脂筏结构对于其行使信号转导功能十分必要。另有研究结果表明,脂筏与前列腺癌、卵巢癌等多种肿瘤的发生及治疗关系密切[14, 15]。而胆固醇则参与了维持脂筏结构的稳定性,如果去除细胞膜中的胆固醇,脂筏结构将出现形变,甚至解构。那么,作为胆固醇转运分子的NPC2,是否通过改变胆固醇的分布状态和脂筏结构的稳定,进而影响了生物膜上信号分子的正确定位与功能行使,从而影响了肿瘤的发生和进展呢?这值得进一步深入研究,解答上述科学问题,将具有重要的临床意义。
| [1] |
EUSEBI L H, TELESE A, MARASCO G, et al. Gastric cancer prevention strategies: a global perspective[J]. J Gastroenterol Hepatol, 2020, 35(9): 1495-1502. |
| [2] |
THRIFT A P, EL-SERAG H B. Burden of gastric cancer[J]. Clin Gastroenterol Hepatol, 2020, 18(3): p. 534-542. |
| [3] |
SMYTH E C, NILSSON M, GRABSCH H I, et al. Gastric cancer[J]. Lancet, 2020, 396(10251): 635-648. |
| [4] |
XU Y, ZHANG Q, TAN L, et al. The characteristics and biological significance of NPC2: Mutation and disease[J]. Mutat Res Rev Mutat Res, 2019, 782: 108284. |
| [5] |
COLOGNA S M, ROSENHOUSE-DANTSKER A. Insights into the molecular mechanisms of cholesterol binding to the NPC1 and NPC2 proteins[J]. Adv Exp Med Biol, 2019, 1135: 139-160. |
| [6] |
CHEN K J, JIN R M, SHI C C, et al. The prognostic value of Niemann-Pick C1-like protein 1 and Niemann-Pick disease type C2 in hepatocellular carcinoma[J]. J Cancer, 2018, 9(3): 556-563. |
| [7] |
WU C C, LIN J D, CHEN J T, et al. Integrated analysis of fine-needle-aspiration cystic fluid proteome, cancer cell secretome, and public transcriptome datasets for papillary thyroid cancer biomarker discovery[J]. Oncotarget, 2018, 9(15): 12079-12100. |
| [8] |
ADACHI T, MATSUMOTO Y, INAGAKI Y, et al. Niemann-Pick disease type C2 protein induces autophagy and inhibits growth in FM3A breast cancer cells[J]. Drug Discov Ther, 2015, 9(4): 282-288. |
| [9] |
KAMATA T, JIN H, GIBLETT S, et al. The cholesterol-binding protein NPC2 restrains recruitment of stromal macrophage-lineage cells to early-stage lung tumours[J]. EMBO Mol Med, 2015, 7(9): 1119-1137. |
| [10] |
JANISZEWSKA M, PRIMI M C, IZARD T. Cell adhesion in cancer: Beyond the migration of single cells[J]. J Biol Chem, 2020, 295(8): 2495-2505. |
| [11] |
HARJUNPÄÄ H, LLORT ASENS M, GUENTHER C, et al. Cell adhesion molecules and their roles and regulation in the immune and tumor microenvironment[J]. Front Immunol, 2019, 10: 1078. |
| [12] |
HANAHAN D, WEINBERG R A. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144(5): 646-674. |
| [13] |
SUNSHINE H, IRUELA-ARISPE M L. Membrane lipids and cell signaling[J]. Curr Opin Lipidol, 2017, 28(5): 408-413. |
| [14] |
DAMBAL S, ALFAQIH M, SANDERS S, et al. 27-hydroxycholesterol impairs plasma membrane lipid raft signaling as evidenced by inhibition of IL6-JAK-STAT3 signaling in prostate cancer cells[J]. Mol Cancer Res, 2020, 18(5): 671-684. |
| [15] |
LI G, HU X, NIE P, et al. Lipid-raft-targeted molecular self-assembly inactivates YAP to treat ovarian cancer[J]. Nano Lett, 2021, 21(1): 747-755. |




