造血干细胞移植(hematopoietic stem cell transplantation,HSCT)是目前治愈恶性血液疾病的主要方式,移植后并发症的防治影响患者移植疗效和长期生存。自身免疫性血细胞减少(autoimmune cytopenia, AIC)是造血干细胞移植常见的自身免疫并发症,其中最常见的是自身免疫性溶血性贫血(autoimmune hemolytic anemia, AIHA)及免疫性血小板减少(immune thrombocytopenia, ITP)[1]。移植后Evans综合征是一种罕见的并发症,定义为自身免疫性溶血性贫血和免疫性血小板减少同时或相继发生[2]。目前,国际上将糖皮质激素或糖皮质激素联合利妥昔单抗作为温抗体型AIHA的一线治疗方式,二线及其他治疗方式包括:利妥昔单抗、脾切除术、环孢素、免疫球蛋白、吗替麦考酚酯等[3-4]。移植后AIHA尚未有标准的治疗方案,治疗方式与原发性AIHA类似[5]。由于发病率低,尚未有明确针对Evans综合征的治疗方案,治疗方式主要依据独立发生的AIHA或ITP治疗推演而来[2]。移植后纯红细胞再生障碍性贫血(pure red cell aplasia,PRCA)是指移植后大于60 d时仍有贫血,伴外周血网织红细胞计数低(<1%),中性粒细胞恢复,但骨髓中缺乏有核红细胞[6]。移植后PRCA的治疗主要包括促红细胞生成素使用、血浆置换、调整免疫抑制剂、供者淋巴细胞输注及针对CD20阳性B细胞的利妥昔单抗[7-8]。
伊布替尼(ibrutinib)是靶向BCR信号通路中关键激酶BTK的小分子抑制剂,目前尚少有伊布替尼用于异基因造血干细胞移植后PRCA或Evans综合征的报道,本研究将伊布替尼分别应用于1例AML移植后发生PRCA的患者及1例ALL移植后发生Evans综合征的患者,观察其治疗效果,以期对临床决策提供依据。
1 资料与方法 1.1 基本信息收集2016年及2018年在本院行造血干细胞移植的患者2例。研究经本院伦理委员会审批通过,审批号:[2018]伦审字(S449)号。
例1,女性,36岁,急性髓系白血病,行化疗达到完全缓解后于2018年2月27日至3月2日行5/10相合外周血干细胞移植,供者为其女儿,血型不合(A+供O+),予以IDA+BuCy2方案预处理,CsA+MTX+MMF+anti-CD25单抗+ATG方案预防GVHD。同年诊断为移植后PRCA。
例2,女性,19岁,急性淋巴细胞白血病,化疗达完全缓解后于2016年3月27-29日行HLA3/6相合造血干细胞移植,供者为其父,血型相合(A+)。予以TBI+IDA+Cy方案预处理,FK506+MTX+MMF+anti-CD25单抗+ATG方案预防GVHD。2017年诊断为移植后AIHA,2018年诊断为移植后Evans综合征。
1.2 疾病诊断及定义移植后PRCA诊断:①依照2015年版获得性纯红细胞再生障碍诊断与治疗中国专家共识[9],排除原发性或其他原因引起的继发性PRCA。②移植后大于60 d时仍有贫血,外周血网织红细胞计数低(<1%)[6]。
移植后AHIA诊断依照2017年版自身免疫性溶血性贫血诊断与治疗中国专家共识[10],排除原发性或其他原因引起的继发性AIHA。移植后AIHA伴随ITP定义为移植后Evans综合征[2]。
慢性移植物抗宿主病(chronic graft-versus-host disease,cGVHD)诊断及评分依照NIH标准[11]。
1.3 检查指标包括血常规、网织红细胞百分比(reticulocyte,Ret)、肝肾功能、自身抗体、血型抗体、血小板抗体、Coombs试验、Rous试验、Ham试验、CD55/CD59、TCR/IgH重排、骨髓细胞学、骨髓嵌合状态、流式微小残留病变、B19病毒、EBV-DNA、CMV-DNA及HBV-DNA等。
1.4 治疗方法及疗效评估例1患者移植出仓后规范使用免疫抑制剂及糖皮质激素,初期予以糖皮质激素、人免疫球蛋白、EPO及输血支持等治疗PRCA,患者因经济原因拒绝利妥昔单抗及血浆置换治疗。上诉策略对患者血象恢复及高血型抗体滴度的治疗效果欠佳,随后采用伊布替尼治疗。例2患者出仓后维持口服FK506,予以糖皮质激素、人免疫球蛋白、血浆置换、免疫抑制剂及输血支持等治疗,治疗过程中患者出现真菌感染等激素不耐受症状,后期使用伊布替尼治疗。疗效评估依照国内专家共识的疗效评判标准[9-10]。
基于前期研究[12],2017年FDA批准伊布替尼用于慢性移植物抗宿主病(chronic graft-versus-host disease, cGVHD)的治疗,而移植后免疫性血细胞减少可以是cGVHD在血液系统的表现。本组2例患者移植后均口服伏立康唑,考虑药物间的相互作用[13-15],伊布替尼初始剂量调整为每2~4天使用140 mg, 并根据病情调整剂量。
2 结果例1患者+90 d内血红蛋白(Hb)41~71 g/L,予以糖皮质激素、EPO及输血治疗(4~6 U /月)。+75 d Hb 71 g/L,PLT 93 G/L, 骨髓细胞学增生活跃,幼红细胞仅2.5%,巨核细胞50个/片,诊断为移植后PRCA。定期复查骨髓嵌合状态均为完全供者型,且未见白血病复发证据。各项溶血试验、病毒检测持续阴性。+118~396 d,Hb 45~94 g/L,PLT 79~100 G/L, Ret 0.13%~0.3%。2018年7月起出现前臂及背部皮疹伴瘙痒表现的慢性移植物抗宿主病(cGVHD),予以MMF 0.25 g口服,2次/d,治疗过程见图 1。7月19日(+139 d),抗A型抗体1 ∶16,抗B型抗体1 ∶16,予以人免疫球蛋白HIg 5 g/d×2 d治疗,但血型抗体仍不断上升。8月底皮肤cGVHD稍加重,抗心磷脂抗体(+)。于10月12日(+224 d)加用伊布替尼口服140 mg/(2~4)d,FK506 0.5 g/3 d递减,MMF 0.25 g/d并于+235 d停用。+269 d因皮疹加重,抗A抗体1 ∶1 024,抗B抗体1 ∶32,伊布替尼加至140 mg/d,FK506减为0.5 g/15 d。+334 d抗A抗体1 ∶256,抗B抗体1 ∶64,此后抗体滴度继续下降。+422 d后脱离输血依赖,Hb 84~110 g/L, PLT 107~197 G/L, Ret由0.21%升至10%。+493 d抗A抗体未检出,抗B抗体1 ∶4,血型转换为供者型(A+),伊布替尼减为140 mg/2 d。+558 d抗A抗体<1 ∶2,抗B抗体1 ∶8,因经费原因,加用MMF 0.5 g口服,2次/d,伊布替尼减量为140 mg/3 d。在血型抗体滴度逐渐下降和血象逐渐恢复的同时,cGVHD得到控制,未再出现皮肤瘙痒及新发皮疹。截止2020年1月8日(+677 d),Hb 110 g/L, PLT 197 G/L, Ret 9.8%。
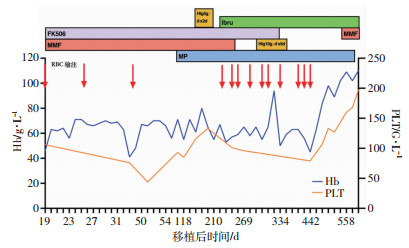
|
| Hb:血红蛋白;PLT:血小板;FK506:他克莫司;Hlg:人免疫球蛋白; MP:甲泼尼龙;RBC:红细胞;MMF:霉芬酸酯;Ibru:伊布替尼 图 1 例1患者伊布替尼治疗前后血红蛋白及血小板变化 |
例2患者移植后恢复良好,白血病持续缓解,完全供者嵌合。移植1年后出现头昏、乏力。2017年3月20日(+356 d) 第1次入院Hb 51 g/L,PLT 163 G/L,Ret 17.04%,DAT试验强阳性(IgG型),抗SS-A抗体弱阳性,抗Ro-52抗体阳性。其他溶血检查均阴性,涂片未见破碎红细胞,骨髓幼红细胞比例偏高(34%),诊断为造血干细胞移植术后自身免疫性溶血性贫血(AIHA)。甲泼尼龙40 mg,q12h×6 d,HIg 10 g/d×14 d,血浆置换4 d及红细胞输注(图 2),他克莫司1 mg/6 d。+377 d和+763 d两次因贫血和血小板减少入院,伴Ret增高,ANA 1 ∶320,抗SSA+, 抗Ro-52+, 加用激素、MMF和人免疫球蛋白后病情改善。+789 d,因水肿、满月脸、体质量增加等激素不耐受表现和肺曲霉菌感染,甲泼尼龙减为28 mg/d。2018年6月5日(+798 d) Hb 78 g/L,PLT 15 G/L,第4次入院,DAT试验阳性,PAIgG表达增高,诊断造血干细胞移植后Evans综合征。2周内甲泼尼龙快减至4 mg/2 d, 经抗真菌、血小板输注、HIg 10 g/d×4 d、FK506 1 mg/3 d,MMF 0.5 g口服,2次/d,治疗后Hb仍降至72 g/L,依赖血小板输注。鉴于激素不耐受,且拒绝血浆置换或CD20单抗治疗,开始口服伊布替尼。考虑伏立康唑对药物代谢的影响,口服伊布替尼140 mg/3 d。伊布替尼治疗第16天(+820 d) PLT回升,治疗第23天(+827 d)Hb回升。第29天Hb 79 g/L,PLT 214 G/L。此后Hb及PLT稳定回升,DAT试验逐步转为弱阳性,PAIgG表达较前降低,其余各项自身抗体逐渐转阴,FK506、MMF、甲泼尼龙逐渐减量,伊布替尼维持140 mg/3 d。截止2021年3月11日,患者Hb 101 g/L,PLT 100 G/L,各项自身抗体指标均阴性,DAT试验转为弱阳性,FK506已经减至1 mg/8 d,MMF 0.5 g/3 d,激素4 mg/7 d,伊布替尼140 mg/5 d维持治疗。治疗过程患者中没有出现明显感染和药物毒副反应及恶性病复发证据。
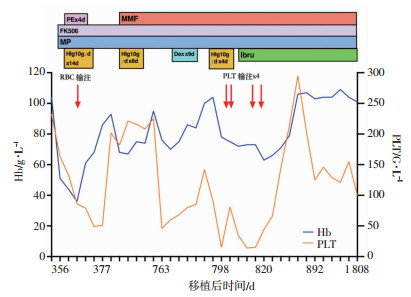
|
| Hb:血红蛋白;PLT:血小板;Hlg:人免疫球蛋白; PE:血浆置换; MP:甲泼尼龙;Dex:地塞米松; RBC:红细胞; MMF:霉芬酸酯; Ibru:伊布替尼 图 2 例2患者伊布替尼值前后血红蛋白及血小板变化 |
3 讨论 3.1 移植后PRCA诊疗现状
受者体内存在抗供者红细胞的血型抗体是移植后PRCA的重要病因,多见于供受者ABO血型不合,尤其是A型供者和O型受者[7-8]。受者体内残余B淋巴细胞或浆细胞产生针对供体红细胞和红系前体细胞上血型抗原的同族血凝素,通过溶血反应及抑制红系造血导致PRCA[8, 16]。血型主要不合及双向血型不合的HSCT,其PRCA发生率为7.5%~26.1%[7, 17-18],主要血型不合的非清髓HSCT后,PRCA发生率可高达29%[19]。移植后发生PRCA的危险因素包括:存在抗A血型的同族血凝素[20],移植前减低强度预处理[19],同胞供者,环孢素A (CsA)用于GVHD的预防及未发生急性移植物抗宿主病(aGVHD)[17]。目前移植后PRCA的治疗尚未达成共识,主要治疗方法如前所述。HELBIG等[17]报道6例血型不相合移植后出现PRCA的患者,5例患者在使用糖皮质激素、供者淋巴细胞输注、利妥昔单抗、EPO或二次移植后获得缓解。
3.2 移植后AIHA和Evans综合征诊疗现状移植后AIHA发生的主要原因是供者的免疫细胞产生了针对供者红细胞的自身抗体[21]。移植后AIHA发生率为2%~6%[5],远高于普通人群的年发病率(0.8/10万)[22]。Evans综合征作为一种罕见疾病,仅出现在0.8%~3.7%的ITP或AIHA患者中[23],而移植后Evans综合征更加罕见。移植后AIHA和Evans综合征主要治疗方法如前所述。意大利一项多中心研究报道了33例异基因HSCT后出现自身免疫性血液病的儿童(15例AIHA,5例Evans综合征,2例PRCA)[24]。14例AIHA和4例Evans综合征患者在应用一线或二线治疗后获得完全缓解(complete response,CR)。1例Evans综合征患者在用了多种免疫抑制疗法(激素、IVIG、利妥昔单抗、长春新碱、环磷酰胺、血浆置换、脾切除术、阿仑妥珠单抗和雷帕霉素)之后仍死于多器官衰竭。2例PRCA患者在接受EPO及激素治疗后其中1例获得CR,1例获得部分缓解(partial response,PR)。MILLER等[25]报道25例异基因移植后出现AIC(7例AIHA,6例Evans综合征)的再障患者,在接受多种免疫抑制治疗后,6例移植后AIHA患者(年龄7~42岁)获得CR,1例获得PR。移植后Evans综合征患者(年龄5~45岁)1例获得CR,3例获得PR,2例未缓解患者中1例死亡。
3.3 BTK抑制剂的免疫调节活性BTK是BCR信号通路中起关键作用的胞质酪氨酸激酶,其与B细胞增殖、激活、趋化因子受体信号传递等过程有关。伊布替尼作为BTK共价不可逆的小分子抑制剂,具有高选择性和高效价的特点,通过靶向阻断BTK信号从而抑制B细胞增殖,促进诱导细胞凋亡,减少异常免疫球蛋白的产生。FDA及EMA批准其用于慢性淋巴细胞白血病(CLL)、华氏巨球蛋白血症(WM)等B淋巴细胞肿瘤[14]。除此之外, 伊布替尼还能不可逆地抑制白介素-2诱导激酶(ITK),ITK是另一种与BTK共有重要序列和功能同源性的Tec激酶家族成员,ITK参与近端TCR信号通路转导,激活PLCγ2启动信号级联反应,导致T细胞的活化、细胞因子及快速增殖,ITK在Th2及Th17的病理生理过程中发挥着重要作用[26]。由于伊布替尼对BTK及ITK的抑制作用,2017年FDA批准其用于cGVHD的二线治疗[14]。BTK抑制剂具有免疫调节作用,已经在其他自身免疫性疾病开展了临床前及临床研究。伊布替尼被证实可抑制小鼠MRL-Fas狼疮模型中自身抗体的产生和肾脏疾病的发展[27]。在胶原诱导关节炎(CIA)、胶原抗体诱导关节炎(CAIA)的动物模型中,伊布替尼呈剂量依赖性地逆转了关节炎炎症,还可预防CAIA模型中的关节炎[28]。一项双盲、随机、二期临床实验将BTK抑制剂evobrutinib应用于复发性多发性硬化的患者,治疗24周后,服用剂量为75 mg/d的患者组织损伤较安慰剂组明显减少[29]。但伊布替尼治疗CLL相关AIHA的免疫调节作用存在争议。伊布替尼治疗CLL过程中出现少数(1.28%)治疗相关AIC已被ROGERS等[30]所报道。SUZUKI等[31]报道1例75岁的CLL女性患者,伊布替尼治疗4周后发生AIHA。而有研究证实伊布替尼治疗CLL继发性AIHA具有良好的疗效,患者获得了完全缓解或部分缓解[32-34]。
3.4 伊布替尼治疗移植后AIC的初步疗效本组例1患者在干细胞移植出仓后足量使用口服免疫抑制剂及糖皮质激素,但60 d后仍出现PRCA。早期给予输血、EPO等治疗,期望通过调整激素及逐渐减停免疫抑制剂诱发GVHD来清除受者体内残存的B细胞,但效果不佳,且在免疫抑制剂减量过程中cGVHD加重,血象未见好转,抗体滴度仍高。为缓解cGVHD的严重程度及保留其清除残余B细胞的功能,我们并未通过传统的加量激素及免疫抑制剂来控制病情,而是利用伊布替尼对B细胞的作用,清除受者体内剩余的B细胞并减少血型抗体的产生,同时抑制供者淋巴细胞活化所致的GVHD效应,使其抗GVHD的治疗和调控PRCA致病机制达到平衡,最终使GVHD得到控制,且血型抗体滴度不断下降,成功转化为供者血型。例2患者在移植后出现Evans综合征,前期治疗效果不佳,考虑其发生机制为供者细胞产生既针对红细胞又针对血小板抗体,血细胞也是GVHD攻击的靶标,移植后AIC实则为cGVHD的一种特殊血液系统的临床表现[11],因此加用被FDA批准为cGVHD二线治疗的伊布替尼。治疗后Hb及PLT逐渐恢复,抗血小板抗体不断减少,抗自身抗体逐步转阴,DAT试验由强阳性转为弱阳性。伊布替尼不仅阻断了移植后AIC对红细胞及血小板的破坏,还减少了激素的使用剂量,降低其毒副反应,成功治疗了Evans综合征。伊布替尼也被报道在治疗原发性AIHA取得良好疗效,国内方力维等[35]采用伊布替尼单药治疗复发/难治性AIHA,2例患者均获得完全缓解。
伊布替尼是一种靶向治疗恶性疾病的药物,如今也在非肿瘤性疾病中展现出巨大的潜能,本研究在一定程度上提供了一种合理的超越说明书治疗范围的选择。在移植后的AIC、ITP、原发性AIHA、Evans综合征等自身免疫性血液病以及风湿自身免疫性疾病中,伊布替尼可能蕴藏着巨大的治疗潜力。
综上,伊布替尼对移植后PRCA或Evans综合征具有一定的治疗效果,其疗效及应用潜力值得进一步探究。
| [1] |
GONZÁLEZ-VICENT M, SANZ J, FUSTER J L, et al. Autoimmune hemolytic Anemia (AIHA) following allogeneic hematopoietic stem cell transplantation (HSCT): a retrospective analysis and a proposal of treatment on behalf of the grupo español de trasplante de medula osea en niños (GETMON) and the grupo español de trasplante hematopoyetico (GETH)[J]. Transfus Med Rev, 2018, 32(3): 179-185. |
| [2] |
AUDIA S, GRIENAY N, MOUNIER M, et al. Evans' syndrome: from diagnosis to treatment[J]. J Clin Med, 2020, 9(12): 3851. |
| [3] |
JÄGER U, BARCELLINI W, BROOME C M, et al. Diagnosis and treatment of autoimmune hemolytic anemia in adults: Recommendations from the First International Consensus Meeting[J]. Blood Rev, 2020, 41: 100648. |
| [4] |
BRODSKY R A. Warm autoimmune hemolytic anemia[J]. N Engl J Med, 2019, 381(7): 647-654. |
| [5] |
WANG M, WANG W J, ABEYWARDANE A, et al. Autoimmune hemolytic anemia after allogeneic hematopoietic stem cell transplantation: analysis of 533 adult patients who underwent transplantation at King's college hospital[J]. Biol Blood Marrow Transplant, 2015, 21(1): 60-66. |
| [6] |
HIROKAWA M, FUKUDA T, OHASHI K, et al. Efficacy and long-term outcome of treatment for pure red cell aplasia after allogeneic stem cell transplantation from major ABO-incompatible donors[J]. Biol Blood Marrow Transplant, 2013, 19(7): 1026-1032. |
| [7] |
ZHU K E, LI J P, ZHANG T, et al. Clinical features and risk factors of pure red cell aplasia following major ABO-incompatible allogeneic hematopoietic stem cell transplantation[J]. Hematology, 2007, 12(2): 117-121. |
| [8] |
WOREL N. ABO-mismatched allogeneic hematopoietic stem cell transplantation[J]. Transfus Med Hemother, 2015, 43(1): 3-12. |
| [9] |
中华医学会血液学分会红细胞疾病(贫血)学组. 获得性纯红细胞再生障碍诊断与治疗中国专家共识(2015年版)[J]. 中华血液学杂志, 2015, 36(5): 363-366. Red Blood Cell Disease (Anemia) Group of Hematology Branch of Chinese Medical Association. Chinese expert consensus on the treatment and diagnosis of acquired pure red cell aplasia (2015)[J]. Chin J Hematol, 2015, 36(5): 363-366. |
| [10] |
中华医学会血液学分会红细胞疾病(贫血)学组. 自身免疫性溶血性贫血诊断与治疗中国专家共识(2017年版)[J]. 中华血液学杂志, 2017, 38(4): 265-267. Red Blood Cell Disease (Anemia) Group of Hematology Branch of Chinese Medical Association. Chinese expert consensus on the diagnosis and treatment of autoimmune hemolytic anemia (2017)[J]. Chin J Hematol, 2017, 38(4): 265-267. |
| [11] |
FILIPOVICH A H, WEISDORF D, PAVLETIC S, et al. National institutes of health consensus development project on criteria for clinical trials in chronic graft-versus-host disease: Ⅰ. diagnosis and staging working group report[J]. Biol Blood Marrow Transplant, 2005, 11(12): 945-956. |
| [12] |
MIKLOS D, CUTLER C S, ARORA M, et al. Ibrutinib for chronic graft-versus-host disease after failure of prior therapy[J]. Blood, 2017, 130(21): 2243-2250. |
| [13] |
DE JONG J, HELLEMANS P, DE WILDE S, et al. A drug-drug interaction study of ibrutinib with moderate/strong CYP3A inhibitors in patients with B-cell malignancies[J]. Leuk Lymphoma, 2018, 59(12): 2888-2895. |
| [14] |
CHARALAMBOUS A, SCHWARZBICH M A, WITZENS-HARIG M. Ibrutinib[M]//Small molecules in hematology. Cham: Springer International Publishing, 2018: 133-168. DOI: 10.1007/978-3-319-91439-8_7.
|
| [15] |
NYGA R, SIMON L, CHOUAKI T, et al. The pharmacokinetic challenge of voriconazole therapy for cerebral aspergillosis in patients treated with ibrutinib[J]. Crit Care, 2019, 23(1): 1-3. |
| [16] |
MEANS R T Jr. Pure red cell aplasia[J]. Blood, 2016, 128(21): 2504-2509. |
| [17] |
HELBIG G, STELLA-HOLOWIECKA B, WOJNAR J, et al. Pure red-cell aplasia following major and bi-directional ABO-incompatible allogeneic stem-cell transplantation: recovery of donor-derived erythropoiesis after long-term treatment using different therapeutic strategies[J]. Ann Hematol, 2007, 86(9): 677-683. |
| [18] |
AUNG F M, LICHTIGER B, BASSETT R, et al. Incidence and natural history of pure red cell aplasia in major ABO-mismatched haematopoietic cell transplantation[J]. Br J Haematol, 2013, 160(6): 798-805. |
| [19] |
BOLAN C D, LEITMAN S F, GRIFFITH L M, et al. Delayed donor red cell chimerism and pure red cell aplasia following major ABO-incompatible nonmyeloablative hematopoietic stem cell transplantation[J]. Blood, 2001, 98(6): 1687-1694. |
| [20] |
LEE J H, LEE K H, KIM S, et al. Anti-A isoagglutinin as a risk factor for the development of pure red cell aplasia after major ABO-incompatible allogeneic bone marrow transplantation[J]. Bone Marrow Transplant, 2000, 25(2): 179-184. |
| [21] |
PARK J A, LEE H H, KWON H S, et al. Sirolimus for refractory autoimmune hemolytic Anemia after allogeneic hematopoietic stem cell transplantation: a case report and literature review of the treatment of post-transplant autoimmune hemolytic Anemia[J]. Transfus Med Rev, 2016, 30(1): 6-14. |
| [22] |
KLEIN N P, RAY P, CARPENTER D, et al. Rates of autoimmune diseases in kaiser permanente for use in vaccine adverse event safety studies[J]. Vaccine, 2010, 28(4): 1062-1068. |
| [23] |
NORTON A, ROBERTS I. Management of Evans syndrome[J]. Br J Haematol, 2006, 132(2): 125-137. |
| [24] |
FARACI M, ZECCA M, PILLON M, et al. Autoimmune hematological diseases after allogeneic hematopoietic stem cell transplantation in children: an Italian multicenter experience[J]. Biol Blood Marrow Transplant, 2014, 20(2): 272-278. |
| [25] |
MILLER P D E, SNOWDEN J A, DE LATOUR R P, et al. Autoimmune cytopenias (AIC) following allogeneic haematopoietic stem cell transplant for acquired aplastic anaemia: a joint study of the autoimmune diseases and severe aplastic anaemia working parties (ADWP/SAAWP) of the european society for blood and marrow transplantation (EBMT)[J]. Bone Marrow Transplant, 2020, 55(2): 441-451. |
| [26] |
JAGLOWSKI S M, BLAZAR B R. How ibrutinib, a B-cell malignancy drug, became an FDA-approved second-line therapy for steroid-resistant chronic GVHD[J]. Blood Adv, 2018, 2(15): 2012-2019. |
| [27] |
HONIGBERG L A, SMITH A M, SIRISAWAD M, et al. The Bruton tyrosine kinase inhibitor PCI-32765 blocks B-cell activation and is efficacious in models of autoimmune disease and B-cell malignancy[J]. PNAS, 2010, 107(29): 13075-13080. |
| [28] |
CHANG B Y, HUANG M M, FRANCESCO M, et al. The Bruton tyrosine kinase inhibitor PCI-32765 ameliorates autoimmune arthritis by inhibition of multiple effector cells[J]. Arthritis Res Ther, 2011, 13(4): R115. |
| [29] |
MONTALBAN X, ARNOLD D L, WEBER M S, et al. Placebo-controlled trial of an oral BTK inhibitor in multiple sclerosis[J]. N Engl J Med, 2019, 380(25): 2406-2417. |
| [30] |
ROGERS K A, RUPPERT A S, BINGMAN A, et al. Incidence and description of autoimmune cytopenias during treatment with ibrutinib for chronic lymphocytic leukemia[J]. Leukemia, 2016, 30(2): 346-350. |
| [31] |
SUZUKI T, MIYAKOSHI S, NANBA A, et al. A case of chronic lymphocytic leukemia complicated by autoimmune hemolytic Anemia due to ibrutinib treatment[J]. J Clin Exp Hematop, 2018, 58(3): 136-140. |
| [32] |
MANDA S, DUNBAR N, MARX-WOOD C R, et al. Ibrutinib is an effective treatment of autoimmune haemolytic anaemia in chronic lymphocytic leukaemia[J]. Br J Haematol, 2015, 170(5): 734-736. |
| [33] |
ST BERNARD R, HSIA C C. Safe utilization of ibrutinib with or without steroids in chronic lymphocytic leukemia patients with autoimmune hemolytic Anemia[J]. Ann Hematol, 2015, 94(12): 2077-2079. |
| [34] |
CAVAZZINI F, LISTA E, QUAGLIA F M, et al. Response to ibrutinib of refractory life-threatening autoimmune hemolytic Anemia occurring in a relapsed chronic lymphocytic leukemia patient with 17p deletion[J]. Leuk Lymphoma, 2016, 57(11): 2685-2688. |
| [35] |
方力维, 潘虹, 施均. 伊布替尼治疗复发/难治原发性自身免疫性溶血性贫血二例——探索性研究[J]. 中华血液学杂志, 2020, 41(5): 412-416. FANG L W, PAN H, SHI J. Ibrutinib treatment for 2 cases of relapsed/refractory autoimmune hemolytic anemia: a pilot study[J]. Chin J Hematol, 2020, 41(5): 412-416. |




